Similar presentations:
Роль HER2/Neu в канцерогенезе
1.
Роль HER2/Neuканцерогенезе
Human Epidermal Growth Factor Receptor (HER) family
В 1987 г. HER2 был была показана его роль в патогенезе рака
молочной железы человека (Slamon et al., 1987). Это открытие
подтвердило гипотезу об онкогене HER2 для развития некоторых
видов рака у человека.
2.
HER2 и neu являются гомологами рецептора онкогенного фактора роста человека игрызунов, которые были идентифицированы и названы независимо друг от друга в начале
1980-х годов на моделях грызунов и человека, но вскоре оказались гомологами друг друга.
Первоначально онкоген neu был описан как трансформирующий онкоген, обнаруженный в
модели опухоли мозга крысы, индуцированной канцерогеном (Shih et al., 1981). Было
обнаружено, что этот ген гомологичен вирусному онкогену v-erbB (вирус птичьего
эритробластоза) и гену рецептора клеточного эпидермального фактора роста (EGFR). В то
время как ErbB2 используется для обозначения гена как человека, так и грызунов, HER2
используется в отношении человеческого гена и продукта гена, а neu используется в
отношении его аналогов грызунов. Расширение семейства HER в системах млекопитающих
было связано с функциональной дифференциацией, обусловливающей необходимость
взаимозависимости, а не стимулирующей независимые или избыточные функции.
Примером этого служат HER2 и HER3, которые представляют собой функционально
неполные рецепторные молекулы. В отличие от других членов семейства, внеклеточный
домен HER2 не находится между активной и неактивной конформациями, а конститутивно
существует в активированной конформации. В соответствии с его конститутивно активной
конформацией, HER2 не обладает лигандсвязывающей активностью, и его сигнальная
функция задействована его гетеродимерными партнерами, связанными с лигандом.
Данные, подтверждающие трансформирующий потенциал HER2 человека и neu грызунов,
неопровержимы. Онкоген neu грызунов был первоначально идентифицирован при
скрининге онкогенов с использованием модели опухоли, индуцированной канцерогеном
крысы, и было показано, что он трансформирует клетки NIH3T3.
Амплификация генов или дерегуляция транскрипции наблюдается примерно в 25-30%
случаев рака молочной железы и яичников и приводит к худшему биологическому
поведению опухоли.
3.
Общая номенклатура вариантов HER2 у грызунов и человекаНазвание
Описание
Сайт мутации
Где найден
neu, c-neu, wtneu,
neu proto-oncogene
клеточный гомолог HER2
грызунов
-
в клетках крыс и мышей
neuT, neuNT, neu oncogene,
neuV664E
neu крысы, содержащий
мутацию трансмембранного
домена, обладает мощной
трансформирующей
активностью
C
обнаружен на модели
канцерогенеза у крыс,
используется в качестве
сильнодействующего
экспериментального
онкогена
neu8142, neu8342
Neu крыс, содержащий
делеционные мутации во
внеклеточном домене
A
обнаружен в опухолях
трансгенных мышей MMTVc-neu
HER2, ErbB2, c-ErbB2
Кллеточный ген HER2
человека
-
В клетках человека
HER2V659E
сконструированный
трансформирующий мутант
HER2 человека,
аналогичный neuT
C
нет в природе. Генноинженерный конструкт
ΔHER2
Изоформа HER2 человека
без одного экзона
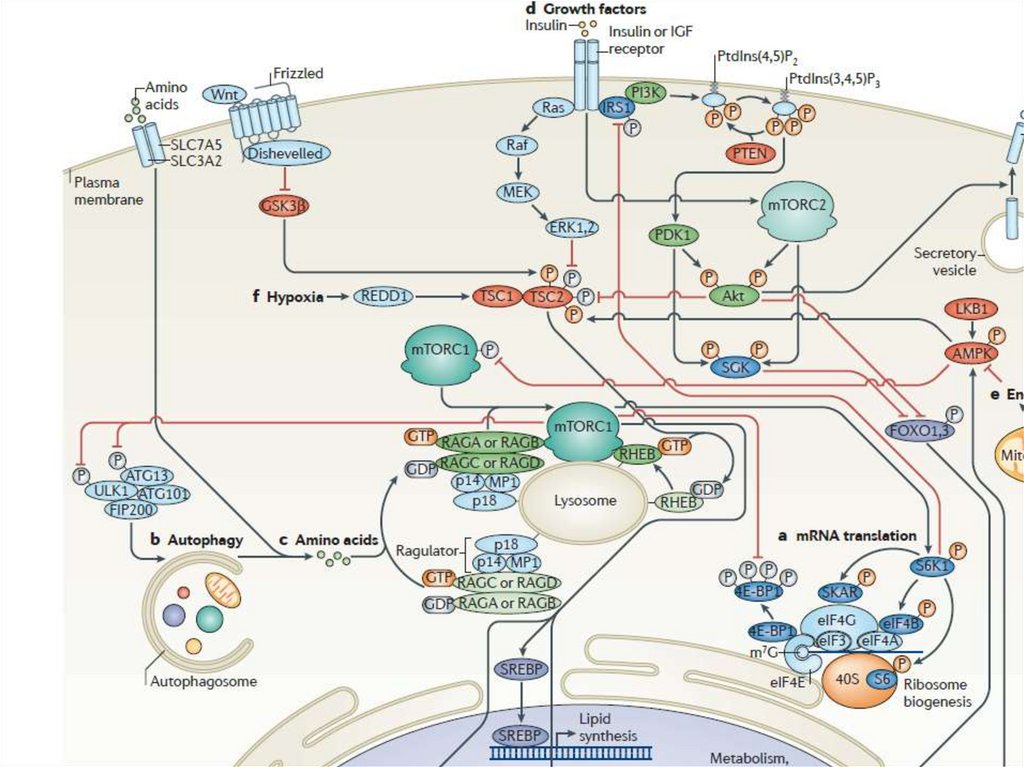
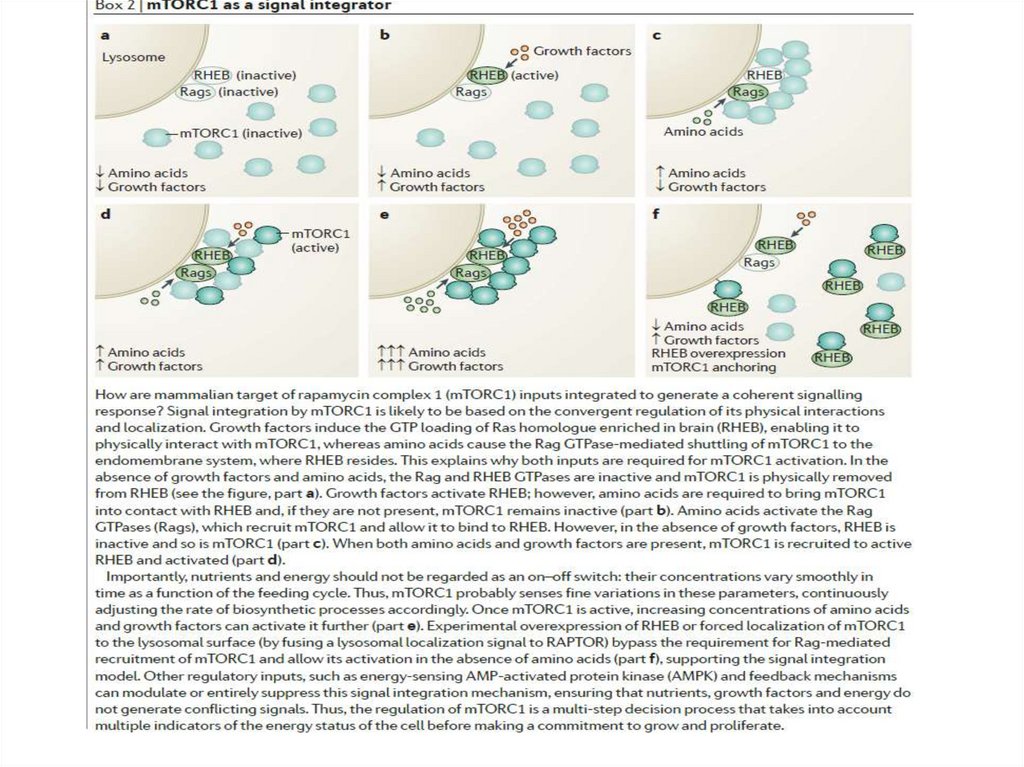
B
обычно встречающаяся
минорная изоформа,
обнаруживаемая везде, где
экспрессируется HER2
HER2YVMA
HER2 с мутацией киназного
домена и повышенной
киназной активностью
D
обнаружен при некоторых
видах рака легкихund
cancers
4.
Структура белков HER2 и Neu. Структура доменапоказана слева и состоит из двух областей
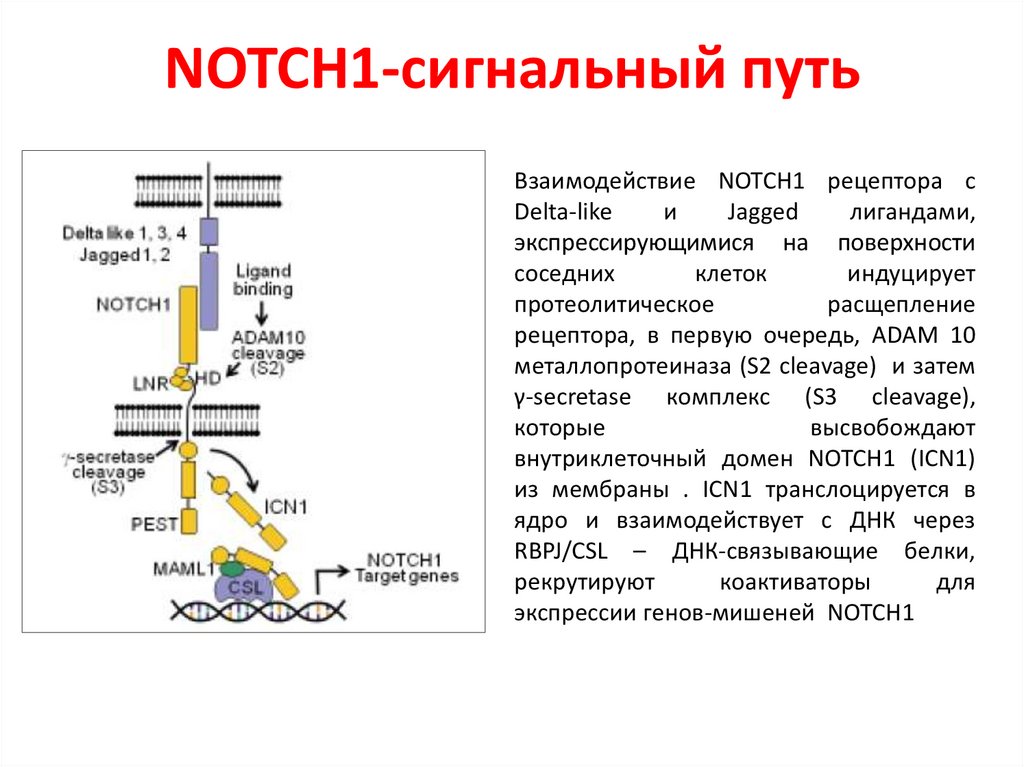
связывания лиганда (LD1 и LD2), двух областей,
богатых цистеином (CR1 и CR2), короткого
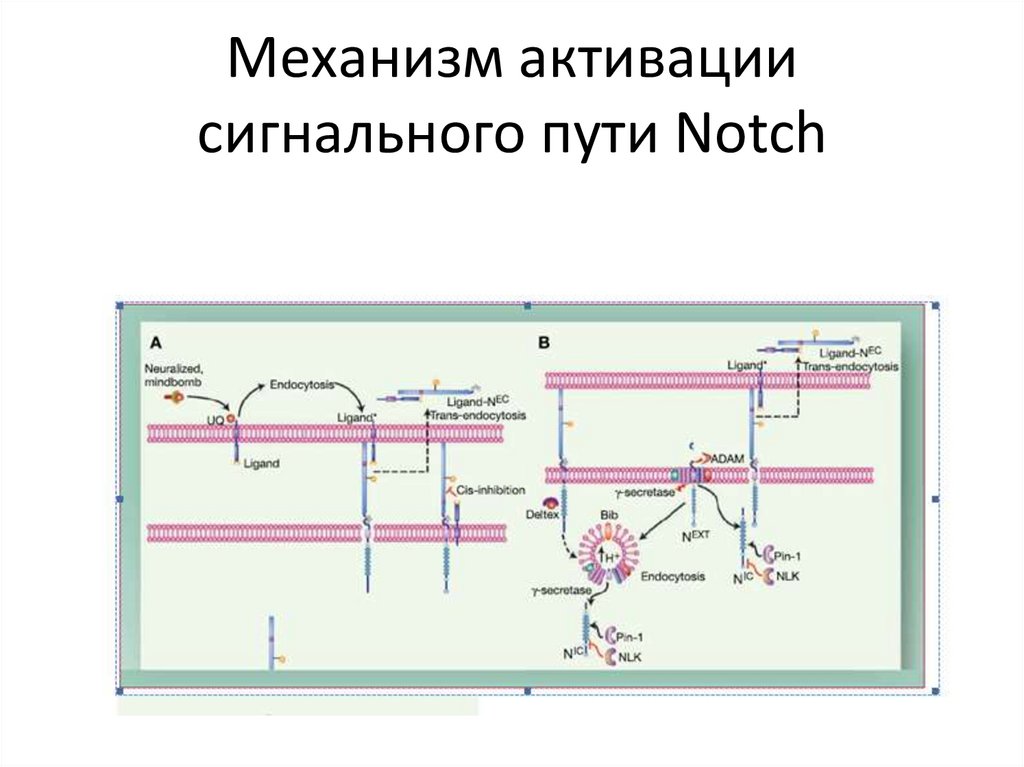
трансмембранного домена (TM), каталитического
тирозинкиназного домена (TK) и карбоксиконцевой
хвост (КТ). Многочисленные сайты
фосфорилирования тирозина в доменах TK и CT
обозначены буквой P в кружке. Буквы справа
указывают на конкретные области, которые
изменены или мутированы при некоторых
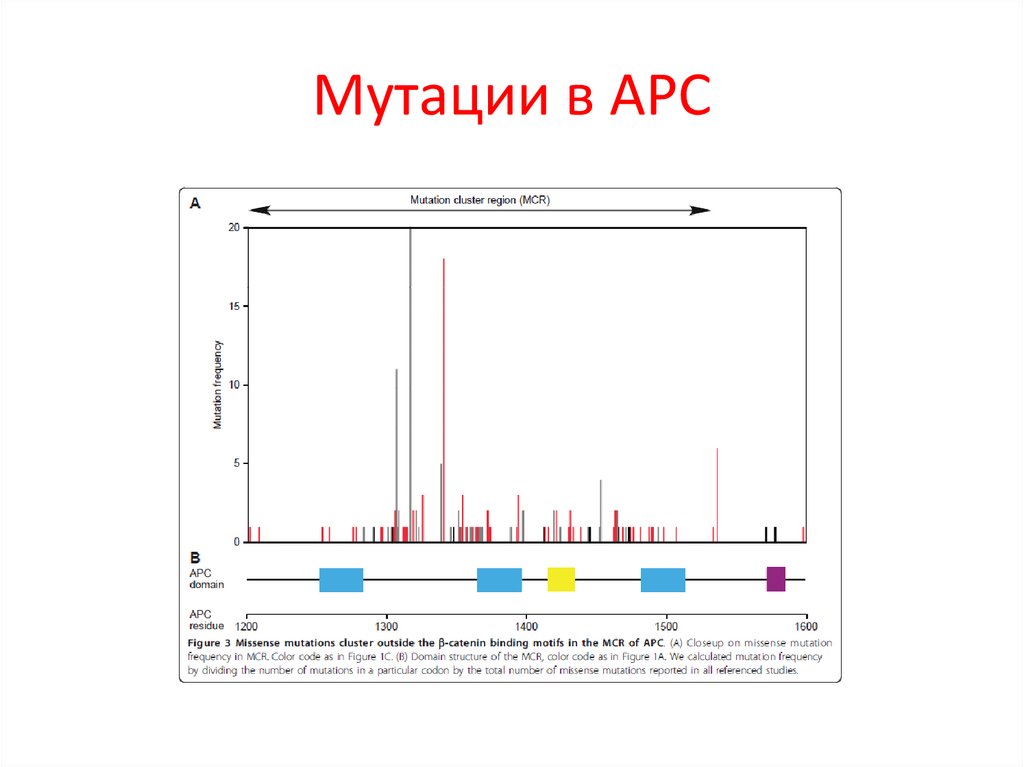
встречающихся в природе или экспериментально
индуцированных раковых заболеваниях,
обсуждаемых в тексте. А) место соматических
мутаций, обнаруженных в опухолях, возникающих
у мышей MMTV-neu. Б) участок делеции 48 п.н. в
природной изоформе ΔHER2 человека. C) сайт
мутации в онкогене neuT, первоначально
обнаруженный в модели опухоли, индуцированной
канцерогеном у крыс, и впоследствии
использованный в многочисленных
экспериментальных моделях in vitro и
трансгенных. D) сайт мутаций, обнаруживаемый в
редких случаях рака легкого человека.
5.
Значительно сложнее система EGFR у млекопитающих, у которых функцииэтого семейства выполняют не менее двенадцати лигандов и четырех
рецепторов.
Схема сигнальных аномалий, возникающих в результате сверхэкспрессии HER2, которые, как считается, способствуют
онкогенезу. Сверхэкспрессия HER2 приводит к увеличению димеров всех видов, содержащих HER2. Увеличение димеров HER2EGFR сопровождается пролиферативной и инвазивной функциями. Увеличение количества гомодимеров HER2 нарушает
клеточную полярность. Увеличенние количества димеров HER2-HER3 способствует пролиферативной, выживающей,
инвазивной и метаболической функций. Повышенная экспрессия HER2 приводит к увеличению количества редкой изоформы
ΔHER2 с более мощными сигнальными характеристиками. В клетках со сверхэкспрессией HER2 индуцируется несколько
факторов транскрипции, что приводит к множеству изменений экспрессии генов.
6.
FISH-анализ амплификации HER2. Образец рака молочной железычеловека, гибридизованный с зондом гена HER2 (зеленый) и
центромерным зондом хромосомы 17 (красный), показывает значительно
увеличенное количество копий гена HER2 по сравнению с контрольным
образцом хромосомы 17.
До 30% - РМЖ HER2+
Структура ампликона HER2 при раке
молочной железы человека. Схема и
табличный список генов, окружающих
локус HER2/ERBB2 в 17q12-q21, которые
часто совместно амплифицируются с
HER2/ERBB2. Определенные виды рака
часто имеют более крупные ампликоны,
включая гены за пределами этой области.
Но исследования картирования
ампликонов идентифицируют указанную
выше минимальную общую область
амплификации.
7.
Для нацеливания на HER2 было разработано несколько стратегий:- внеклеточные антитела, такие как трастузумаб, который нацелен
на домен IV рецептора и
- пертузумаб, который связывается с доменом II и ингибирует
гетеродимеризация HER2 с другими рецепторами ErbB;
- малые ингибиторы тирозинкиназы, такие как лапатиниб,
тукатиниб,или нератиниб, которые ингибируют активность
киназы;
- наконец, конъюгаты антитело-лекарственное средство (ADC),
такие как трастузумабэмтанзин (T-DM1), который, связываясь с
HER2 вводит мощный цитотоксический агент в HER2гиперэкспрессирующие клетки.
8.
Задача для HER2В простейшей механистической модели HER2 индуцирует трансформацию
за счет повышения активности киназы и сверхфосфорилирования самого
себя и клеточных субстратов. В этой модели единственным последствием
сверхэкспрессии является повышение клеточной активности HER2. Но
ограничение этой модели заключается в том, что она не может объяснить,
почему при раке человека активность HER2 всегда повышена за счет
сверхэкспрессии, а мутационная активация HER2, аналогичная neuT
грызунов, никогда не наблюдается при раке молочной железы человека.
Одно из предложенных объяснений заключается в том, что neu можно
активировать посредством мутации с одной парой оснований, тогда как
аналогичная активация HER2 требует мутации с двумя парами оснований,
что значительно снижает вероятность спонтанного возникновения этого в
гене человека. Однако более правдоподобным объяснением было то, что
повышенная экспрессия HER2 является существенным аспектом его
трансформирующей функции. Это представляет собой более сложную
модель трансформации, но есть существенные доказательства в ее
поддержку.
9.
5.2.1.Ассоциированные с
мембраной белки
(на примере RAS и SRC)
10.
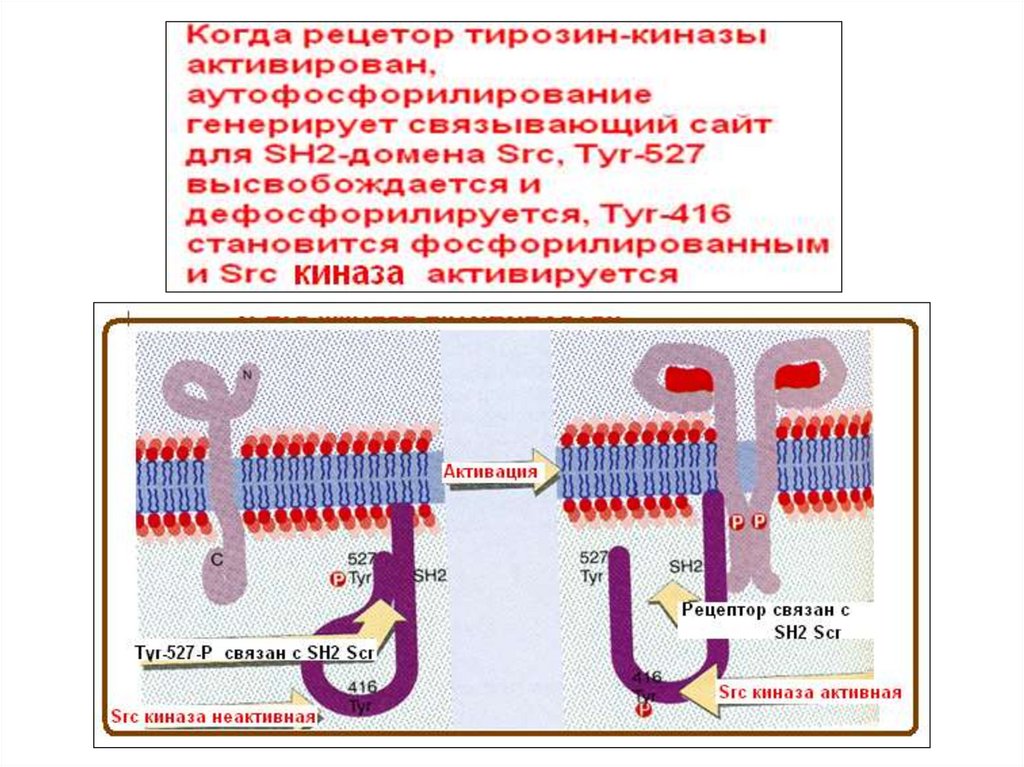
Фосфорилирование рецептора приводит кдвум последствиям:
1. Фосфорилирование усиливает киназную активность рецептора по типу
положительной обратной связи.
2. Фосфорилирование тирозиновых остатков в цитоплазматических доменах
обеспечивает прохождение сигнала к следующему этапу сигнальной трансдукции.
Различают 3 типа белков, с которыми может взаимодействовать активированный
рецептор:
- Белок может быть мишенью для рецептора, если он сам не фосфорилирован.
Мишень может быть также адаптерной молекулой, т.е. сама не обладать
каталитической активностью (например, Grb-2) или быть ферментом, который
активируется связыванием с рецептором (например, PI-3 киназа).
- Белок является субстратом для фермента, который его фосфорилирует. Если
субстрат сам является ферментом, то он активируется фосфорилированием
(например, c-src, PLCγ). Иногда субстрат – это киназа, тогда сигнальная трансдукции
продолжается каскадом киназ.
- Некоторые субстраты могут быть концевыми мишенями, как в случае с
цитоскелетными белками, которые фосфорилируются с изменением их
биохимических свойств, что сопровождается появлением новых клеточных структур.
Этот механизм работает, например, в митозе, когда появляется веретено для
разделения хромосом.
11.
Семейство Src-киназ. ИсторияПрототипом семейства Src-киназ является белок c-Src (pp60c-src), впервые открытый как онкоген. Однако
считается, что оригинальным белком этого семейства был его вирусный аналог, открытый Раусом в ранние 1900ые годы. Раус описал трансформирующий фактор, присутствующий в тканях саркомы цыплят, который индуцировал
опухоль у здоровых цыплят после инъекции тканевого гомогената. Этот фактор позднее стал известен как вирус
саркомы Рауса, содержащий вирусный онкоген Scr. В 1966 году Нобелевская премия наконец была присуждена
Пейтону Раусу.
Клеточное происхождение ретровирусных онкогенов
В 1961 г. было доказано, что RSV содержит РНК-геном, чье постоянное присутствие было необходимо для
поддержания клеточной трансформации. Однако механизм действия вируса с РНК-геномом остался
неопределенным. В 1970 году одновременные исследования Темина и Балтимора привели к открытию обратной
транскриптазы, фермента, катализирующего транскрипцию ретровирусной РНК в ДНК. Через обратную
транскриптазу, РНК вируса превращается в двухцепочечную ДНК, а затем вирусный геном включается в ядерную
ДНК через другой фермент, называемый интегразой. Изначально считалось, что копия src, существует только в
инфицированных клетках. В 1974 г. лаборатория Майкла Бишопа и Гарольда Вармуса обнаружили, что детектор src
может также гибридизоваться с генетическим материалом неинфицированных клеток кур и других видов (две копии
на геном диплоидной клетки). Они также заметили, что чем дальше эволюционное родство с курицей, тем слабее
степень гибридизация. Данные подтверждают идею о том, что последовательности src обнаружены в
неинфицированных клетках, на самом деле являются частью их нормального генома (клеточная версия c-src). В
1975 г. Нобелевская премия была присуждена Темину и Балтимору за открытие обратной транскриптазы.
Т.о. клеточный аналог этого онкогена или протоонкоген впервые был охарактеризован Майклом Бишопом и
Гарольдом Вармусом, за открытие которого в 1989 г. они получили Нобелевскую премию.
Онкоген Src стал прототипом для десятков других трансформирующих генов онкогенных вирусов. Его продукт был
идентифицирован Брюгге и Erikson в 1977 г., как белок с тирозинкиназной активностью.
12.
С 1976 по 1980 годы исследования были сосредоточены на различиях между csrc и v-src, который расположен в пределах RSV геном. Первыйдемонстрировал физиологическое клеточное поведение, в отличие от второго,
который действует как мощный онкоген. Объяснение было простым: ген src
RSV изначально не присутствовал в первичном ретровирусе RSV.
Историческая ретроспектива основных открытий, касающихся онкогена Src.
13.
Схематическое изображение Src-киназыЭто нерецепторные тирозинкиназы (Src family of protein tyrosine kinases - SFKs), которые после
активации внешними стимулами (воздействующими на рецепторы GF, R цитокинов, R стероидных
гормонов, рецепторы, связанные с G-белком, и белки адгезии), запускают сигнальные каскады,
ведущими к широко распространенным эффектам. Семейство состоит из 11 членов,среди которых
Src является ферментом-прототипом: представители основной группы (Src, Yes, Fyn, Fgr, Blk,Hck, Lck
и Lyn) тесно связаны между собой, в то время как Frk, Srm и Brk составляют более отдаленную
родственную группу. Среди них Src, Yes и Fyn повсеместно экспрессируются у млекопитающих, в то
время как паттерн экспрессии других представителей ограничен тканью и/или клеткой.
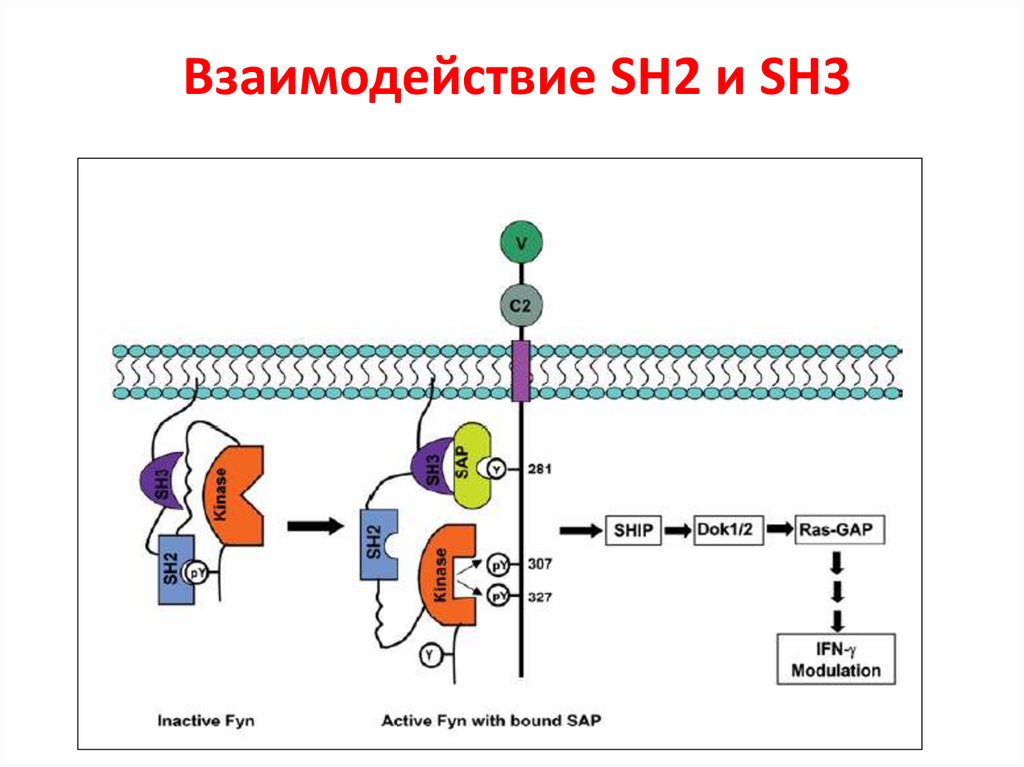
SFK являются структурами с высоким уровнем гомологичности, состоящими из четырех последовательных доменов Src Homology
(SH): SH4 область нацеливания на мембрану на их N-конце, которая может быть миристоилирована и/или пальмитоилирована, что
позволяет локализацию в мембране; внутренне неупорядоченный уникальный домен, который демонстрирует расхождение среди
членов SFK; регуляторные домены SH-2 и SH-3 предшествуют большому каталитическому С-концевой домену (SH1) с отличительной
чертой киназ Src, сайт аутоингибиторного фосфорилирования, который представляет собой остаток Y527 в Src человека. Домен SH3
имеет решающее значение для взаимодействия белок-белок, опосредуя сборку специфического белкового комплекса, как правило,
посредством связывания с богатыми пролином пептидами, несущими мотив «PxxP» в их соответствующих обязательных партнерах.
14.
15.
16.
Взаимодействие SH2 и SH317.
Разнообразные функции SRC18.
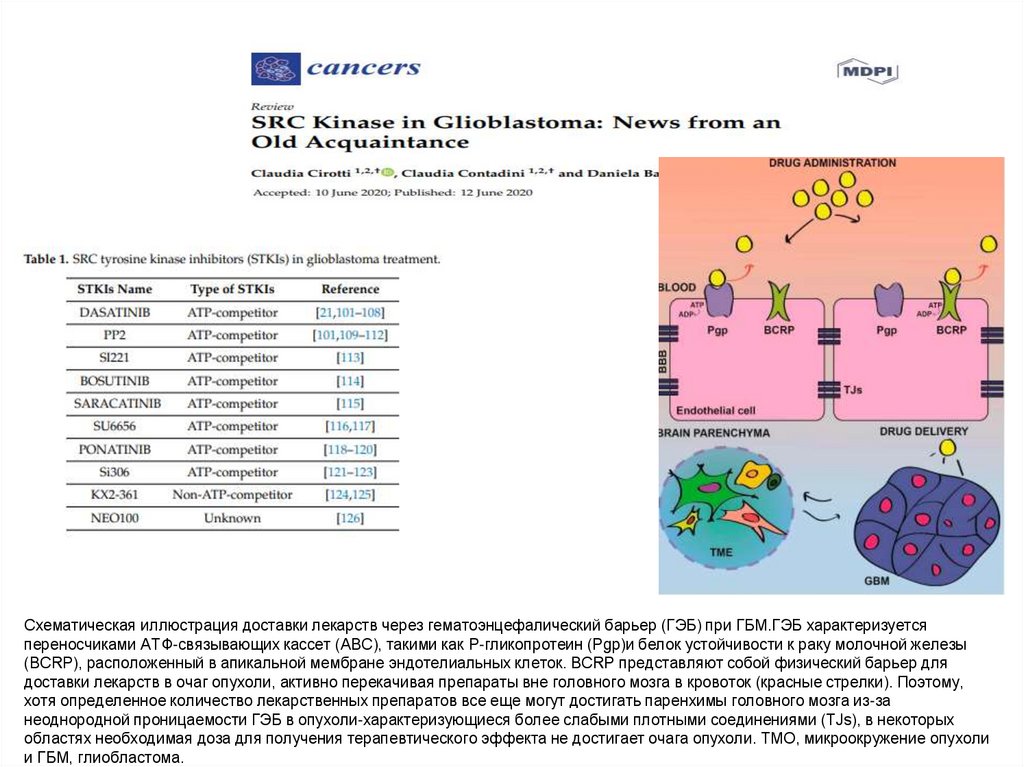
Схематическая иллюстрация доставки лекарств через гематоэнцефалический барьер (ГЭБ) при ГБМ.ГЭБ характеризуетсяпереносчиками АТФ-связывающих кассет (АВС), такими как P-гликопротеин (Pgp)и белок устойчивости к раку молочной железы
(BCRP), расположенный в апикальной мембране эндотелиальных клеток. BCRP представляют собой физический барьер для
доставки лекарств в очаг опухоли, активно перекачивая препараты вне головного мозга в кровоток (красные стрелки). Поэтому,
хотя определенное количество лекарственных препаратов все еще могут достигать паренхимы головного мозга из-за
неоднородной проницаемости ГЭБ в опухоли-характеризующиеся более слабыми плотными соединениями (TJs), в некоторых
областях необходимая доза для получения терапевтического эффекта не достигает очага опухоли. ТМО, микроокружение опухоли
и ГБМ, глиобластома.
19.
Конститутивная активация SRC модулирует воспаление и метаболизм в опухоли, а также поддержание микросреды вГБМ. Конститутивная активация SRC при ГБМ в основном вызвана аберрантной передачей сигналов рецепторными
тирозинкиназами (RTK). Гиперактивация SRC влияет на метаболизм, индуцируя активность гексокиназы (ГК),
отвечающей за образование глюкозо-6-фосфата (G-6-P) промежуточный продукт, питающий как пентозофосфатный
путь (PPP), так и гликолиз. Важно отметить, что аберрантная активность SRC напрямую индуцирует аэробный
гликолиз (эффект Варбурга), вызывая накопление лактата и его секрецию во внеклеточном матриксе. Аберрантная
активность SRC также ответственна за стабилизацию и активацию факторов транскрипции (например, NF-κB, STAT3,
HIF1α,и AP-1), индуцирующие экспрессию провоспалительных цитокинов, хемокинов, факторов роста и матриксные
металлопротеазы (ММП). Массивное производство провоспалительных молекул и ростовых факторов, депривация
глюкозы и накопление лактата во внеклеточном матриксе совпадают с сформированием важного опухолевого
микроокружения, в котором опухолевые и неопухолевые клетки сотрудничают для поддержки друг друга в
положительной обратной связи.
20.
G-белки в сигнальнойтрансдукции
21.
Семейство белков RASСуперсемейство RAS состоит из нескольких семейств белков:
RAS, RHO, RAB, ARF, RAC и RAN. Наиболее изученным из низ
являются белки RAS. Геном млекопитающих содержит 3 гена RAS,
кодирующих небольшие ГТФ-азные белки молекулярной массой
21 kDa, обозначаемые как H-RAS (Harvey-RAS), N-RAS
(neuroblastoma-RAS) и K-RAS (Kristen-RAS), последний имеет две
изоформы K-RAS4A и K-RAS4B, образуемые через
альтернативный сплайсинг. KRAS4A слабо экспрессируется в
клетках человека, в отличие от KRAS4B, который является
доминантной формой. Кроме того, в геноме млекопитающих было
идентифицировано более чем 150 RAS-подобных гена.
Белки этого семейства также регулируют многие
физиологические процессы, пролиферацию, дифференцировку и
выживание клетки.
22.
Механизм активации G белков23.
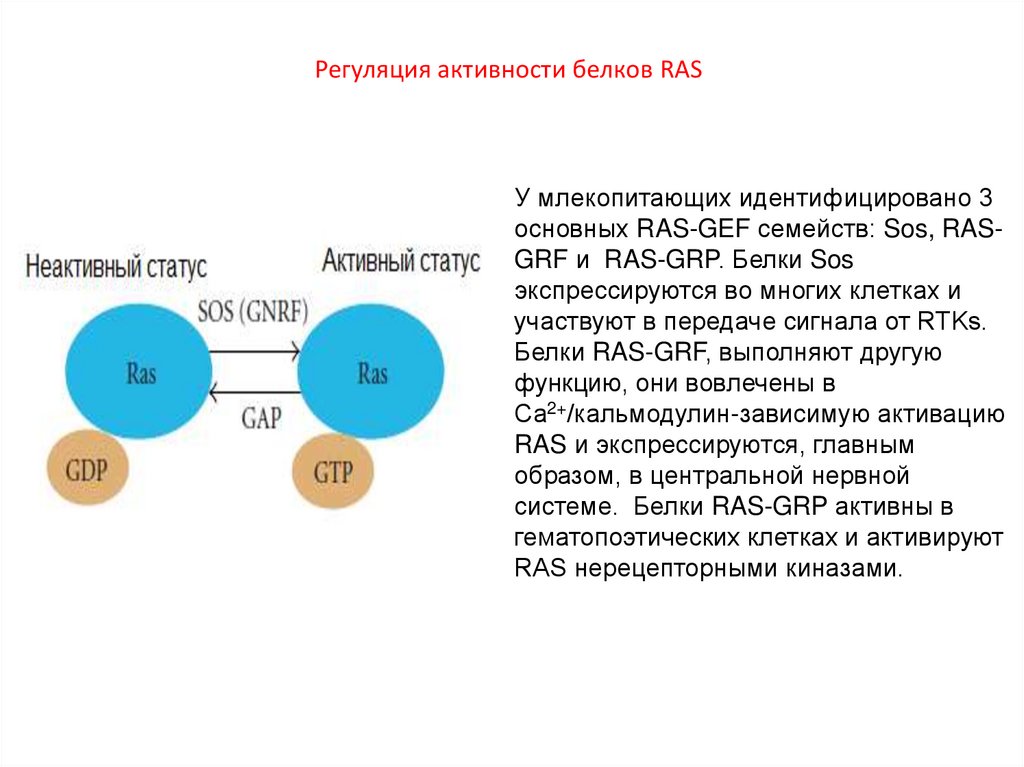
Регуляция активности белков RASУ млекопитающих идентифицировано 3
основных RAS-GEF семейств: Sos, RASGRF и RAS-GRP. Белки Sos
экспрессируются во многих клетках и
участвуют в передаче сигнала от RTKs.
Белки RAS-GRF, выполняют другую
функцию, они вовлечены в
Са2+/кальмодулин-зависимую активацию
RAS и экспрессируются, главным
образом, в центральной нервной
системе. Белки RAS-GRP активны в
гематопоэтических клетках и активируют
RAS нерецепторными киназами.
24.
Семейство белков RAS-GEFмлекопитающих
DH = Dbl гомология; PH =
плекстрин гомология; REM =
RAS обменный мотив; CDC25-H
= CDC25 гомология
(каталитический GEF домен); IQ
= кальмодулин-связывающий
домен; PEST = PEST-подобная
область; HF = гистон
поддерживающий мотив; PR =
пролин-богатый регион
(содержащий SH3-связывающие
домены); EF = Ca2+
связывающий домен; ZF = домен
цинковых пальцев .
25.
Роль белка SOS26.
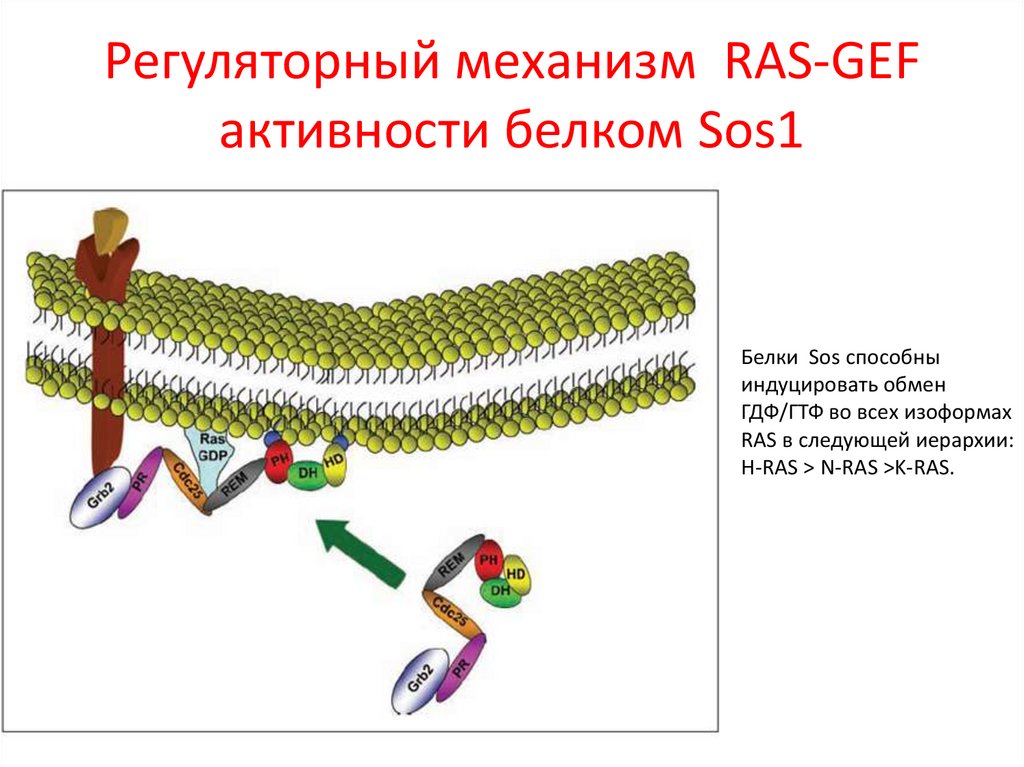
Регуляторный механизм RAS-GEFактивности белком Sos1
Белки Sos способны
индуцировать обмен
ГДФ/ГТФ во всех изоформах
RAS в следующей иерархии:
H-RAS > N-RAS >K-RAS.
27.
Активация RasПролиферация
Выживаемость
Дифференцировка
28.
Модель белка КRASG-домен белка KRAS включает
ГТФ-связывающий карман, где Рпетля (10 – 16 и 56 – 59
аминокислоты) взаимодействует с
b-фосфатом и c-фосфатом ГТФ.
Аминокислотные остатки 116 – 119
и 152 – 165 взаимодействуют с
гуаниновым основанием. Район
между аминокислотными
позициями 32 и 40 – коровый
эффектор, он необходим для
взаимодействия с нижестоящими
эффекторами и GAPs
29.
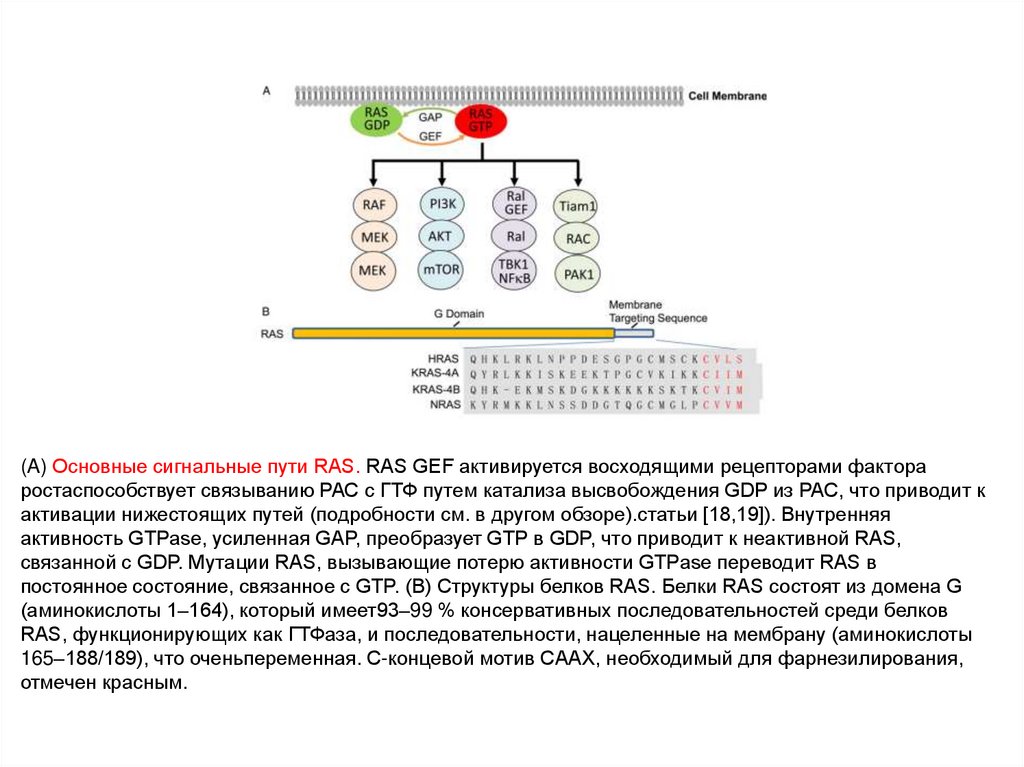
(A) Основные сигнальные пути RAS. RAS GEF активируется восходящими рецепторами фактораростаспособствует связыванию РАС с ГТФ путем катализа высвобождения GDP из РАС, что приводит к
активации нижестоящих путей (подробности см. в другом обзоре).статьи [18,19]). Внутренняя
активность GTPase, усиленная GAP, преобразует GTP в GDP, что приводит к неактивной RAS,
связанной с GDP. Мутации RAS, вызывающие потерю активности GTPase переводит RAS в
постоянное состояние, связанное с GTP. (B) Структуры белков RAS. Белки RAS состоят из домена G
(аминокислоты 1–164), который имеет93–99 % консервативных последовательностей среди белков
RAS, функционирующих как ГТФаза, и последовательности, нацеленные на мембрану (аминокислоты
165–188/189), что оченьпеременная. С-концевой мотив CAAX, необходимый для фарнезилирования,
отмечен красным.
30.
Схематическоеизображение
мевалонатного пути,
разделенного на: (а)
мевалонатный путь,
который продуцирует
мевалонат 5-PP, а затем
изопентенил 5-PP; (b) путь
холестерина, который, в
свою очередь, индуцирует
образование стероидных
гормонов, витамина D и
желчных кислот; и (c)
нехолестериновый путь,
важный для продукции
фарнезил-PP и
геранилгеранил-PP,
который индуцирует
соответственно
фарнезилирование и
геранилгеранилирование
малых GTPase.
Пренилирование - это процесс посттрансляционной модификации, в котором либо фарнезильная группа, как при
фарнезилировании, либо геранил-геранильная группа, как при геранилгеранилировании, добавляется к C-концевому
остатку цистеина целевого белка. Пренилирование может катализироваться фарнезилтрансферазой, протеазой Caax
или геранилгеранилтрансферазой.
30
31.
Химические структуры терапевтическихагентов, модулирующих субклеточные
локализации РАС
32.
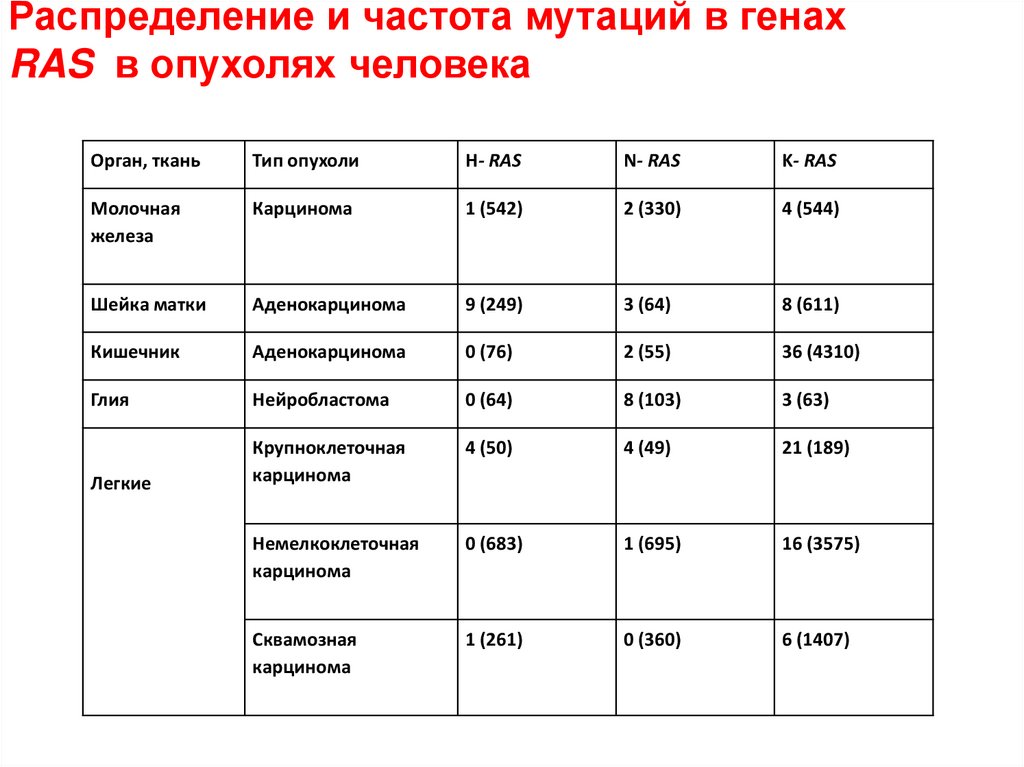
Распределение и частота мутаций в генахRAS в опухолях человека
Орган, ткань
Тип опухоли
H- RAS
N- RAS
K- RAS
Молочная
железа
Карцинома
1 (542)
2 (330)
4 (544)
Шейка матки
Аденокарцинома
9 (249)
3 (64)
8 (611)
Кишечник
Аденокарцинома
0 (76)
2 (55)
36 (4310)
Глия
Нейробластома
0 (64)
8 (103)
3 (63)
4 (50)
4 (49)
21 (189)
Легкие
Крупноклеточная
карцинома
Немелкоклеточная
карцинома
0 (683)
1 (695)
16 (3575)
Сквамозная
карцинома
1 (261)
0 (360)
6 (1407)
33.
Мембранные «якори» RAS белков34.
Изоформы RASRAS-гипервариабельная (HVR) область способна взаимодействовать с различными
районами мембраны. В N-области – высокая консервативность для изоформ белка,
она содержит все сайты, необходимые для связывания в нуклеотидами. C-область
содержит СААХ мотив для фарнезилирования. Второй сигнал представлен
пальмитированный цистеин(ы) или лизиновыми (основными) остатками (красный) для
стабилизация связывания с мембраной и регуляции последовательных клеточных
локализаций.
35.
Регуляция RAS36.
37.
Молекулярная гетерогенность в мутантных аденокарциномах KRAS Статус мутаций KRAS и коммутаций вдругих генах-факторах рака в 230 легкихаденокарциномы (А); 90 аденокарцинома поджелудочной железы
(В); и 220 случаев колоректальной аденокарциномы (C), извлеченных из баз данных The Cancer Genome
Atlas (TCGA) нана сайте http://www.cbioportal.org. Каждая вертикальная линия представляет собой опухоль.
На графике показаны мутации в семи ведущих генах, вызывающих рак, в легких, поджелудочной железе,и
колоректальные аденокарциномы. красный, усиление; синий, гомозиготная делеция; зеленый, миссенсмутация; черный, укороченная мутация; взорванная, внутрифреймовая мутация.Обратите внимание, что
большинство мутантных видов рака KRAS имеют комутации в других драйверных генах рака.
38.
Гены RAS (HRAS, KRAS и NRAS) составляют наиболее часто мутирующее семействоонкогенов при раке человека. Учитывая самые высокие частоты мутаций RAS,
наблюдаемые в трех основных причинах смертности от рака в Соединенных Штатах
(рак легких, колоректальный рак и рак поджелудочной железы), разработка методов
лечения против RAS является основным приоритетом для исследований рака.
Несмотря на более чем тридцатилетие интенсивных усилий, эффективные
ингибиторы RAS еще не дошли до больных раком. С горькими уроками, извлеченными
из прошлых неудач, и с новыми идеями и стратегиями, появилась новая надежда на
то, что не поддающийся лечению RAS может быть наконец побежден. Поскольку
изоформа KRAS мутирует в 84% всех случаев рака с мутациями RAS, мы
сосредоточимся на KRAS. Аденокарцинома протоков поджелудочной железы (PDAC) с
почти 100% частотой мутаций KRAS считается наиболее зависимой от RAS из всех
видов рака. Мы рассматриваем роль KRAS как движущей силы и терапевтической
мишени при PDAC.
39.
(A) Идентичность последовательности белковRAS человека. Идентичность аминокислотной
последовательности определяли методом
множественного выравнивания
последовательностей CLUSTALW. (B) Частота
мутаций RAS. Данные были собраны из
Каталога соматических мутаций при раке
(COSMIC) v80. (C) домены РАН.
Аминоконцевые аминокислоты (1–164)
составляют домен G, участвующий в
связывании и гидролизе гуанозинтрифосфата
(ГТФ), а также во взаимодействии с факторами
обмена гуаниновых нуклеотидов (GEF),
GTPase-активирующими белками (GAP) и
эффекторами. Структура белка RAS
изменяется в областях Switch I (SI;
аминокислоты 30–38) и II (SII; аминокислоты
60–76) во время цикла гуанозиндифосфат
(GDP)–GTP, при этом связанная с GTP форма
имеет более высокое сродство к эффекторам. .
Аминокислоты цистеина, обведенные кружком,
указывают на сайты ковалентной модификации
путем добавления пальмитатной жирной
кислоты. Остаток серина в рамке
фосфорилируется протеинкиназой C.
Подчеркнутые остатки лизина способствуют
нацеливанию на мембрану. Цистеины,
выделенные курсивом в мотиве СААХ,
представляют собой сайты ковалентной
модификации путем добавления
фарнезилизопреноида и
карбоксиметилирования.
40.
SMAD – Receptor of transforming growth factor betaМутации KRAS при раке поджелудочной железы. (A) Частота мутаций в
четырех основных генах при раке поджелудочной железы. (B)
Генетическое прогрессирование рака поджелудочной железы. (C) Замены
аминокислот KRAS при раке поджелудочной железы. (Составлено на
основе данных Jones et al. 2008, Biankin et al. 2012, Sausen et al. 2015,
Waddell et al. 2015 и Witkiewicz et al. 2015.)
41.
Регуляция гуанозиндифосфата (GDP)-гуанозинтрифосфата (GTP) KRAS иэффекторная передача сигналов. RAS-селективные факторы обмена гуаниновых
нуклеотидов (GEF) и GTP-активирующие белки (GAP) регулируют цикл GDP-GTP.
Мутации, связанные с раком, обнаруженные в основном (> 99%) в остатках G12,
G13 или Q61, нарушают цикл GDP-GTP, нарушая внутренний и GAPстимулированный гидролиз GTP и / или ускоряя обмен GDP-GTP. Эффекторы
KRAS характеризуются RAS-связывающим доменом (RBD) или доменом
ассоциации RAS (RA). AKT1 фосфорилирует и инактивирует GSK3β,
предотвращая фосфорилирование MYC при полиубиквитинировании и
деградации, опосредованном T58 и FBW7.
42.
G белки активируют каскады СТ43.
5.2.2. Цитозольные белки(RAF и MAP)
Цитозольные белки принимают сигнал от вышестоящих мембраноассоциированных белков, от рецепторов или адаптеров.
44.
45.
Место Raf в сигнальной трансдукции46.
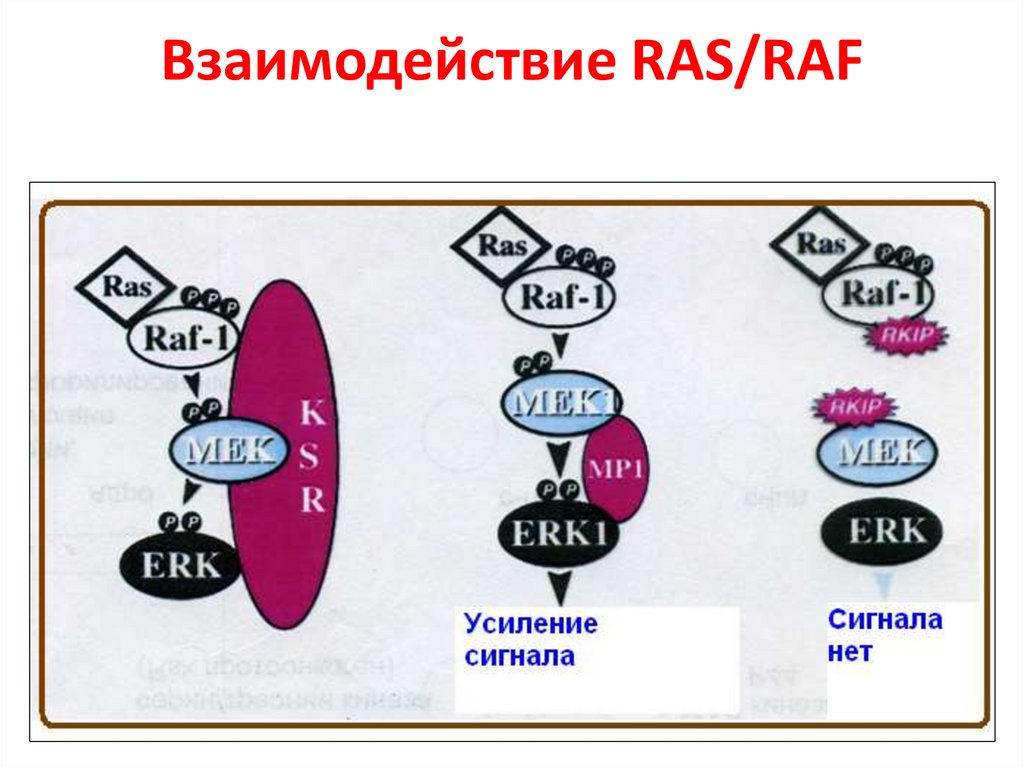
Взаимодействие RAS/RAF47.
Семейство белков Raf• Белки Raf были идентифицированы как прямые активаторы белков
MEK и эффекторы Ras.
• Таким образом, стало ясно, что Raf являются основным связывающим
звеном между Ras- и MEK-ERK-сигнальными участками. Интересно,
что у дрожжей нет Raf-киназы, а филогенетически древняя изоформа
этого белка B-Raf появилась у позвоночных. У млекопитающих
выявлено 3 изоформы Raf: Raf-1, B-Raf и A-Raf, которые имеют общую
консервативную область (CR), но проявляют разные свойства . В свою
очередь, CR область состоит из 3-х участков: CR1, CR2, CR3.
48.
Структура и регуляторные сайтыфосфорилирования Raf-белков
(A) Общая структура белков Raf. (B)
Структура и сайты
фосфорилирования изоформ Raf.
Аминокислотные остатки красного
цвета – активирующее
фосфорилирование, черного –
ингибирующее фосфорилирование,
голубого – оба эффекта.
Основные сайты
аутофосфорилирования показаны
зеленым.
49.
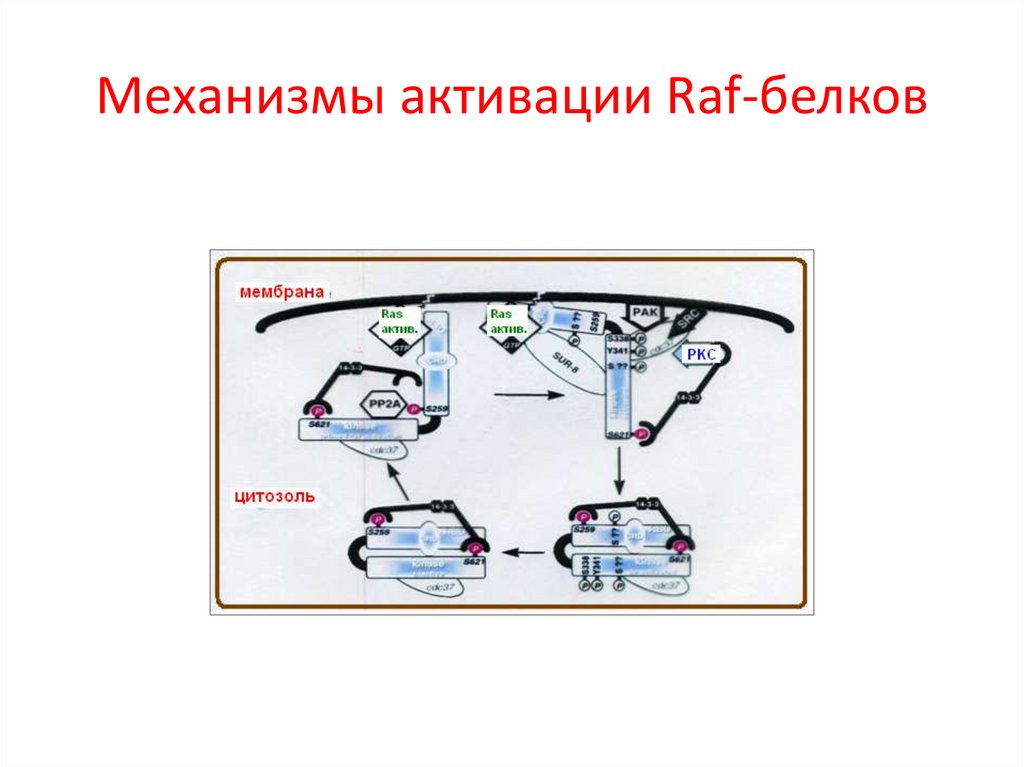
Механизмы активации Raf-белков50.
Механизмы активации Raf-белков51.
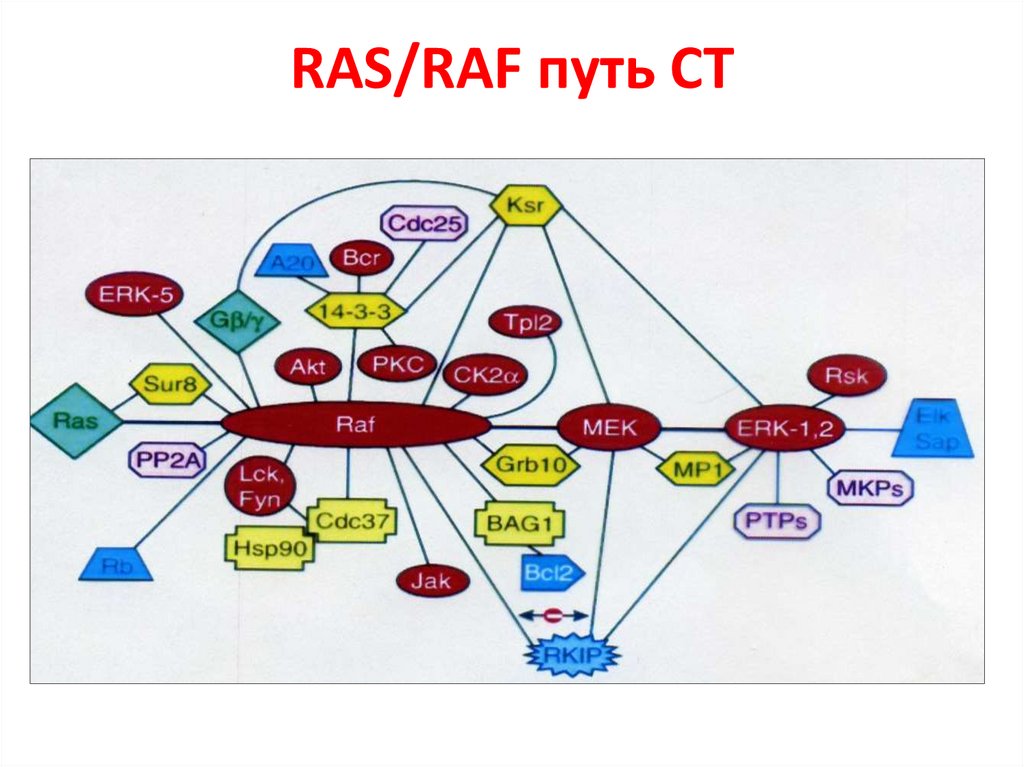
RAS/RAF путь СТ52.
Функции 14-3-3 белка в СТ53.
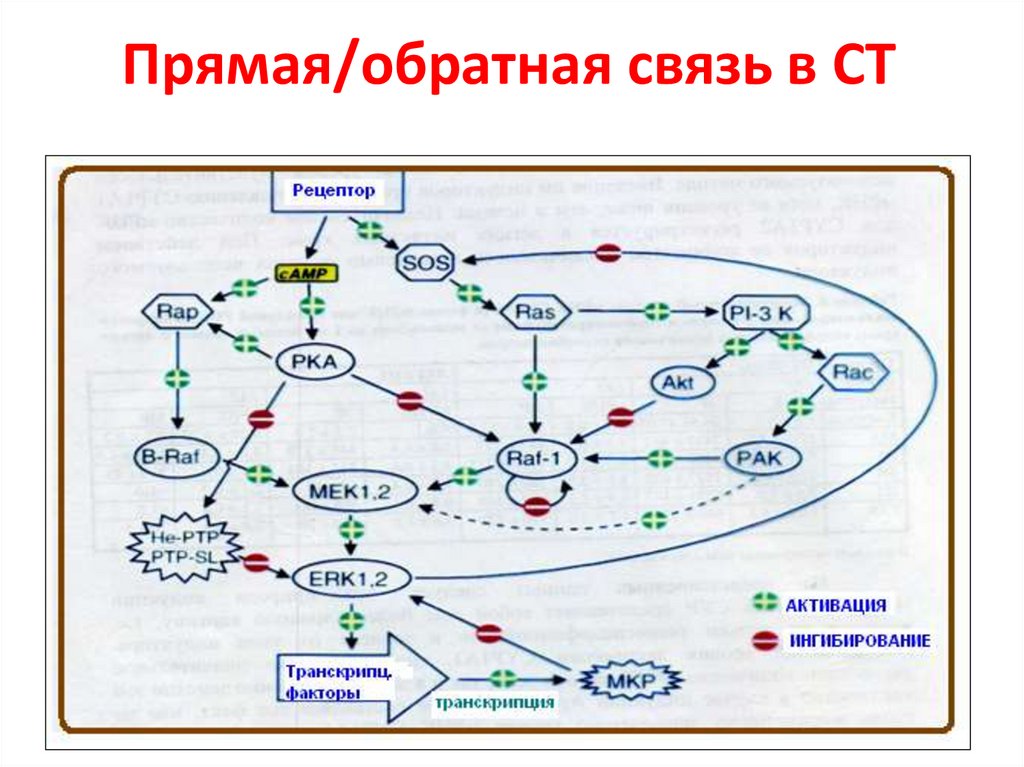
Прямая/обратная связь в СТ54.
BRAF inhibitors: From the laboratory to clinical trialsM.A. Rahman,
A. Salajegheh, R.A. Smith and A.K.-Y. Lam
BRAF
Critical Reviews in Oncology/Hematology
DOI: 10.1016/j.critrevonc.2013.12.008
Copyright © Elsevier Ireland Ltd Terms and Conditions
55.
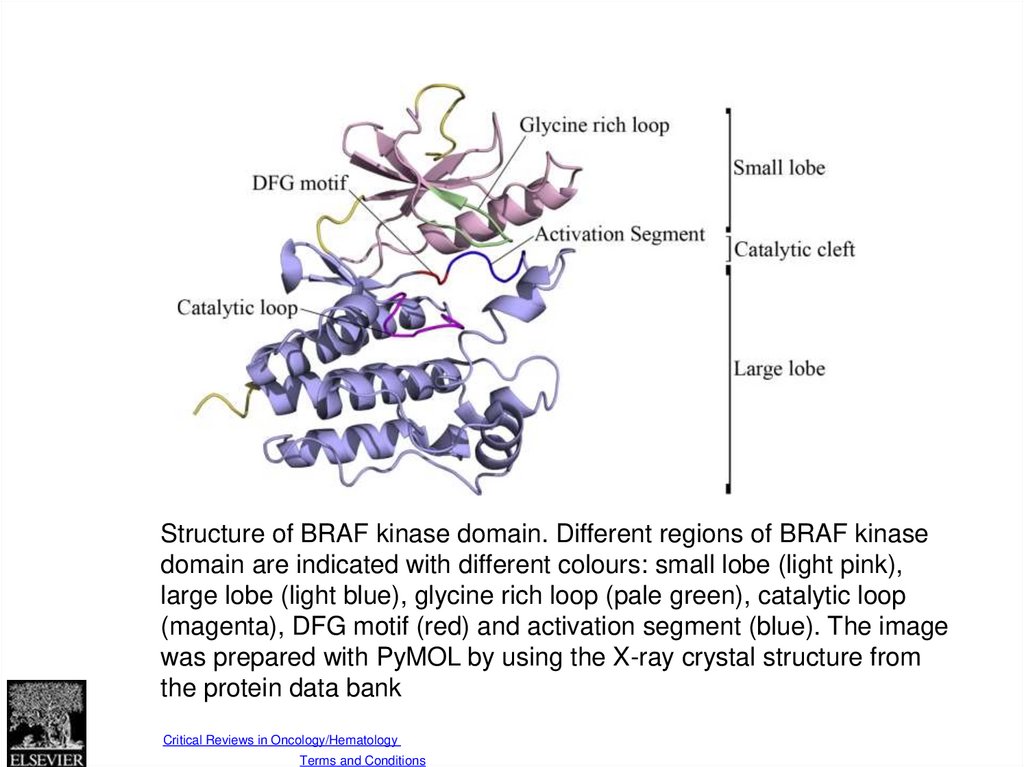
Fig. 1Structure of BRAF kinase domain. Different regions of BRAF kinase
domain are indicated with different colours: small lobe (light pink),
large lobe (light blue), glycine rich loop (pale green), catalytic loop
(magenta), DFG motif (red) and activation segment (blue). The image
was prepared with PyMOL by using the X-ray crystal structure from
the protein data bank
Source: Critical Reviews in Oncology/Hematology (DOI:10.1016/j.critrevonc.2013.12.008 )
Copyright © Elsevier Ireland Ltd Terms and Conditions
56.
Fig. 2Structure of BRAF V600E kinase domain in
complex with BRAF inhibitor PLX4032
(Vemurafenib). Different regions of BRAF
kinase domain are indicated with different
colours: small lobe (light pink), large lobe
(light blue), glycine rich loop (pale green),
catalytic loop (magenta) and DFG motif
(red). (A) Binding position of PLX4032 with
kinase domain of V600E mutant BRAF. (B)
Close view of V600E mutant BRAF and
PLX4032 complex, binding amino acids are
indicated. The images were prepared with
PyMOL by using the X-ray crystal structure
from the protein data bank
Source: Critical Reviews in Oncology/Hematology (DOI:10.1016/j.critrevonc.2013.12.008 )
Copyright © Elsevier Ireland Ltd Terms and Conditions
57.
Fig. 3Structure of BRAF V600E kinase
domain in complex with BRAF inhibitor
BAY 43-9006 (sorafenib). Different
regions of BRAF kinase domain are
indicated with different colours: small
lobe (light pink), large lobe (light blue),
glycine rich loop (pale green), catalytic
loop (magenta), DFG motif (red) and
activation segment (blue). (A) Binding
position of BAY 43-9006 with kinase
domain of V600E mutant BRAF. (B)
Close view of V600E mutant BRAF and
BAY 43-9006 complex, binding amino
acids are indicated. Note: X-ray data
for this interaction is based on 2004
crystallography and amino acid
numbers are incorrect. True amino acid
numbers on the protein will be one
higher (e.g. TRP-530 is TRP-531). The
images were prepared with PyMOL by
using X-ray crystal structure data from
the protein data ban
Source: Critical Reviews in Oncology/Hematology (DOI:10.1016/j.critrevonc.2013.12.008 )
Copyright © Elsevier Ireland Ltd Terms and Conditions
58.
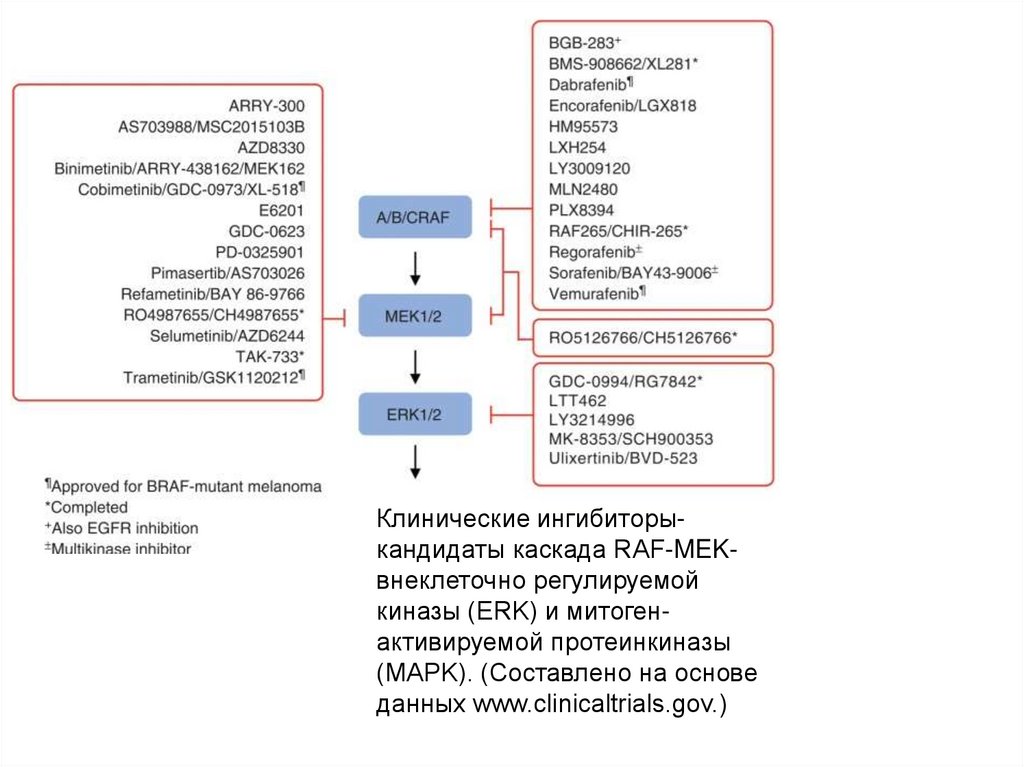
Клинические ингибиторыкандидаты каскада RAF-MEKвнеклеточно регулируемойкиназы (ERK) и митогенактивируемой протеинкиназы
(MAPK). (Составлено на основе
данных www.clinicaltrials.gov.)
59.
5.2.3.Этап МАР киназ
60.
Активированные белки Raf передают сигнал к нижестоящим цитозольным белкамMAP (mitogen active protein) или MAPK (MAP kinase), которые объединяются в
семейство МЕК. Эта группа включает 4 различных каскада, которые называются по
компоненте, стоящей после МАР киназы.
Характеристика МАР киназ
Белки MAPK
N
Тип сигнального
пути
1
Внеклеточная сигналрегулируемая киназа 1 и 2
(МЕК1 и МЕК2)
ERK1/2
2
c-Jun N-терминальная киназа 1
–3
JNK1-3
3
p38MAPK α, β, γ, δ
p38α-δ
4
ERK5
Большая MAPK
ERK1/2 каскад
передает,
г.о., митогенные
сигналы,
P38 и JNK –
активированные
стрессом, ERK5 – оба
пути
61.
Протеин-киназы в СТ62.
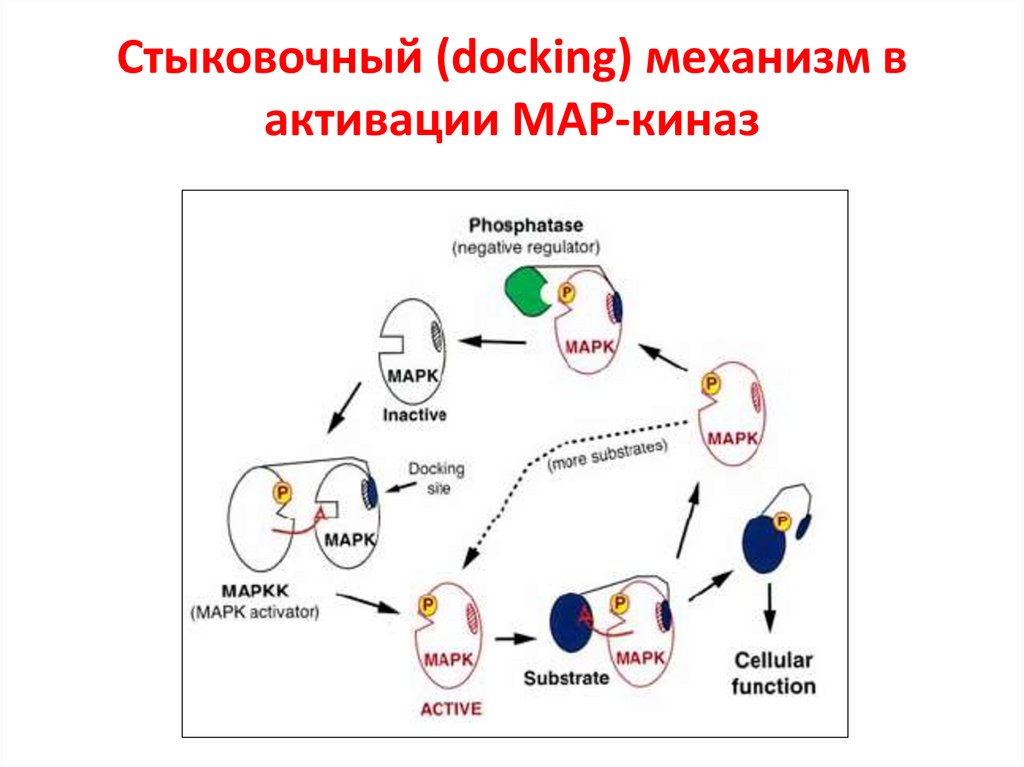
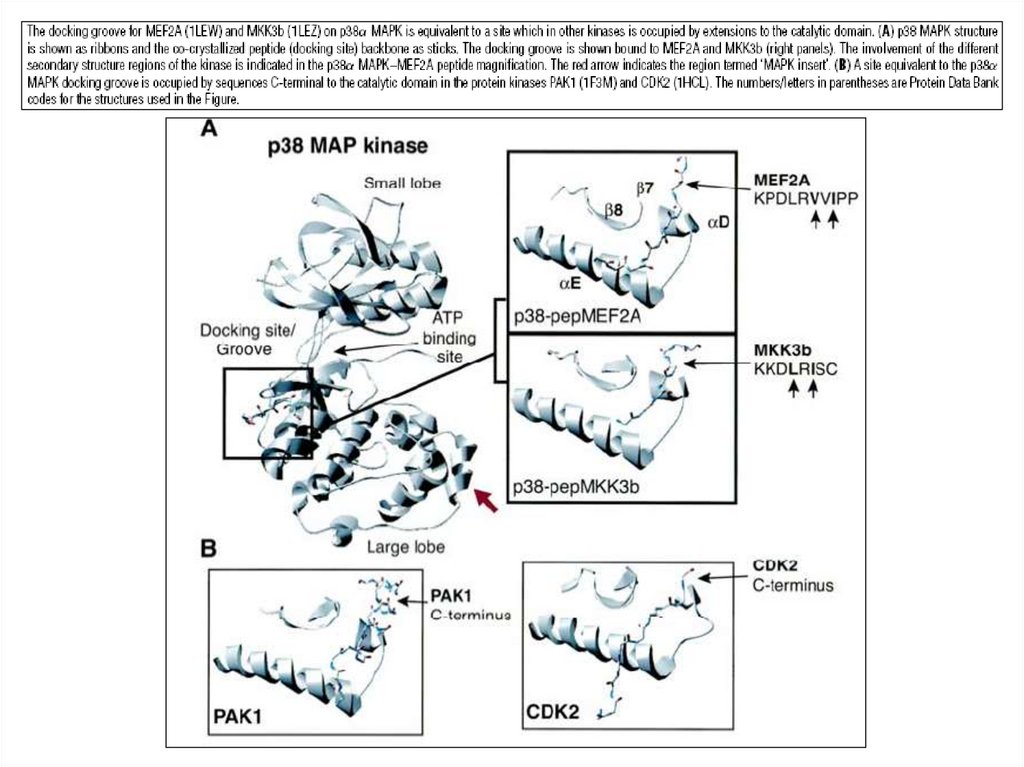
Стыковочный (docking) механизм вактивации МАР-киназ
63.
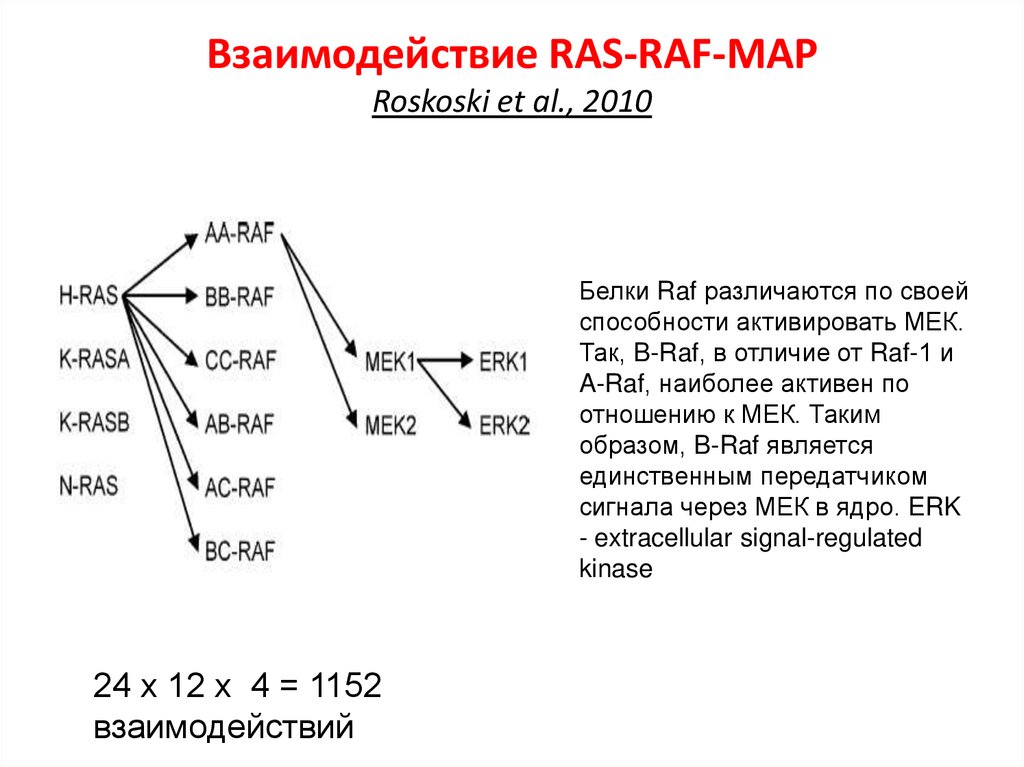
Взаимодействие RAS-RAF-MAPRoskoski et al., 2010
Белки Raf различаются по своей
способности активировать МЕК.
Так, B-Raf, в отличие от Raf-1 и
A-Raf, наиболее активен по
отношению к МЕК. Таким
образом, B-Raf является
единственным передатчиком
сигнала через МЕК в ядро. ERK
- extracellular signal-regulated
kinase
24 х 12 х 4 = 1152
взаимодействий
64.
ERK1/2 киназы• ERK1/2 – генные продукты ERK1 (MAPK3) и
ERK2 (MAPK1).
• MEK1/2-опосредованное
фосфорилирование ERK1/2 (Thr и Tyr в
последовательности Thr-Xaa-Tyr)
• Известно более 200 субстратов ERK1/2, в
том числе ФТ Elk1, c-Fos и c-Jun.
65.
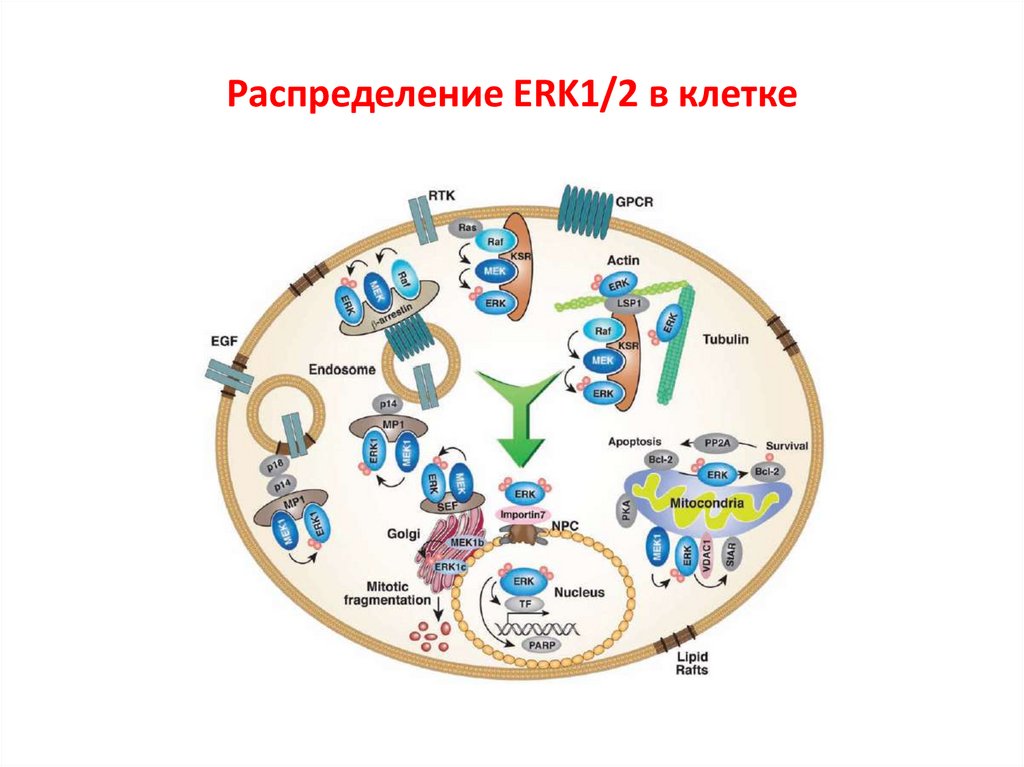
Распределение ERK1/2 в клетке66.
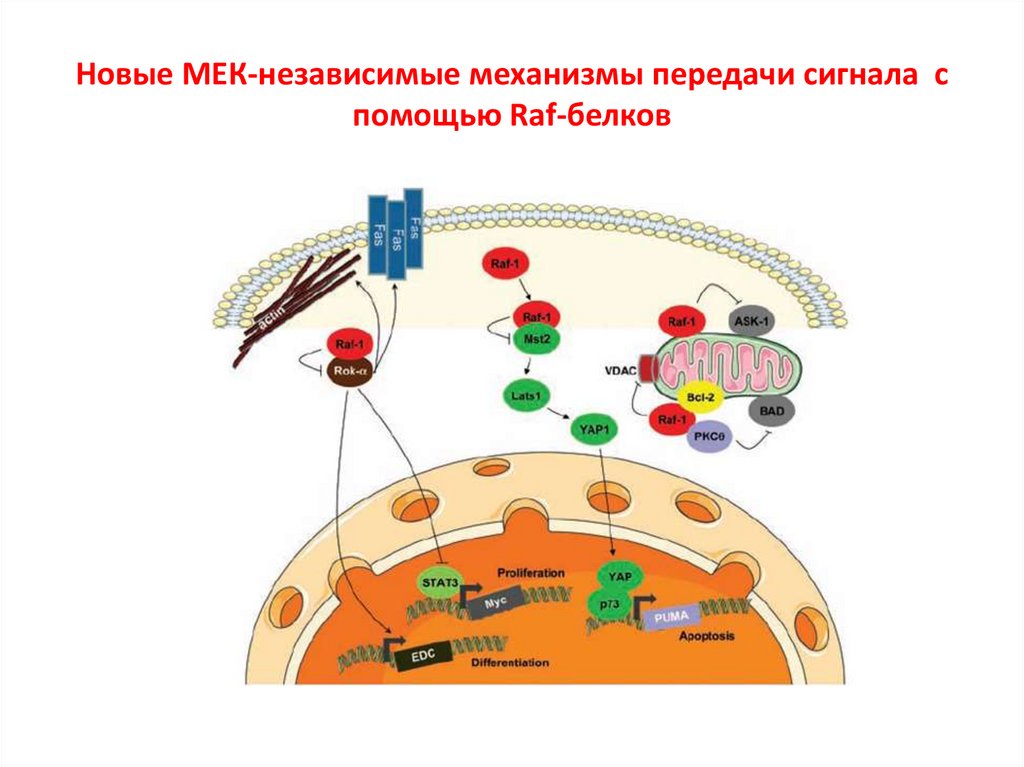
Новые МЕК-независимые механизмы передачи сигнала спомощью Raf-белков
67.
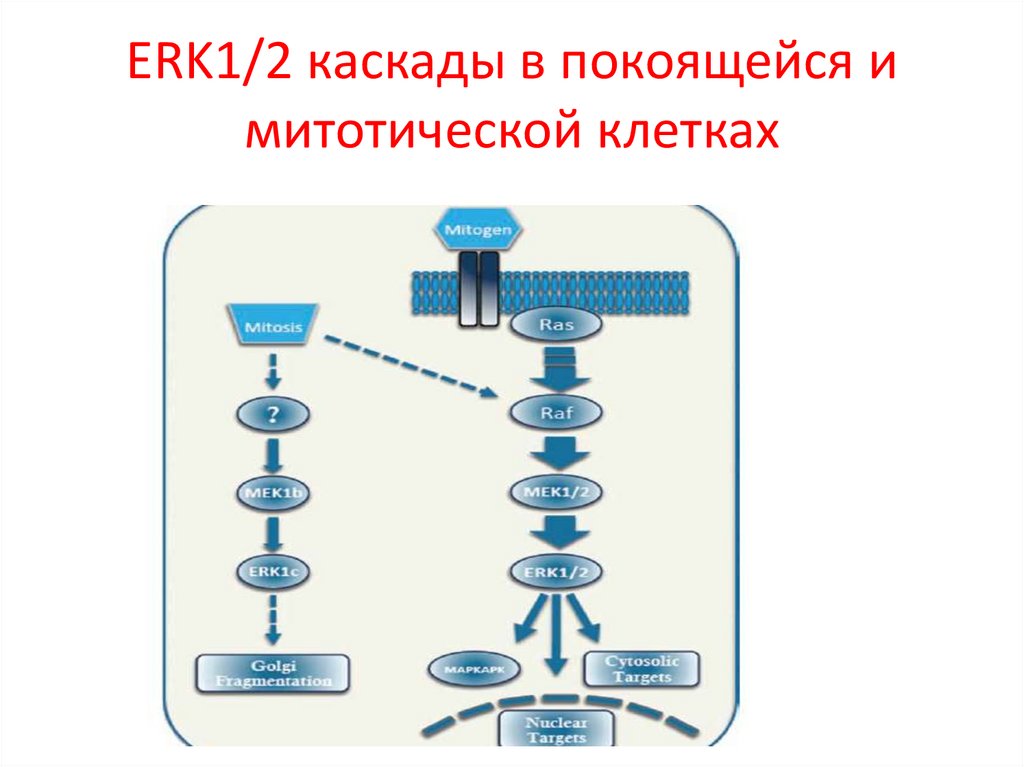
ERK1/2 каскады в покоящейся имитотической клетках
68.
р38 МАР-киназный путь69.
Механизмы активации р38 МАРК70.
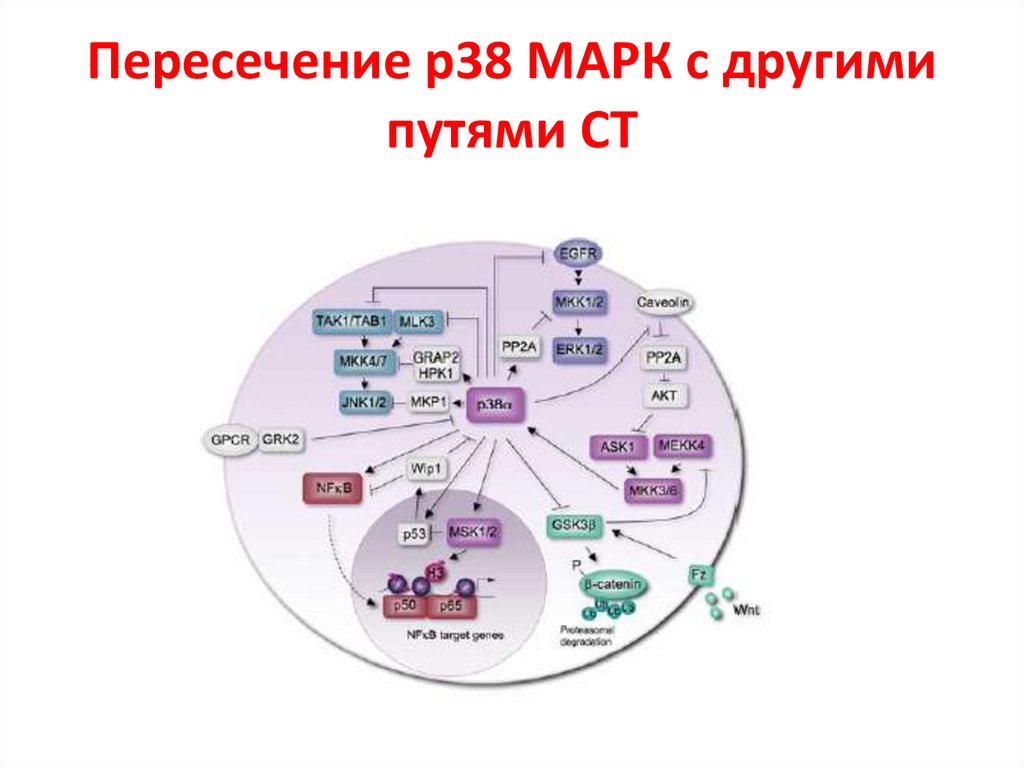
Пересечение р38 МАРК с другимипутями СТ
71.
Физиологическая роль р38 МАРК72.
73.
Компоненты трехуровневого каскада внеклеточной регулируемой киназы (ERK) и митоген-активируемойпротеинкиназы (MAPK). Каждый уровень каскада ERK MAPK состоит из родственных изоформ. Мутанты BRAF с
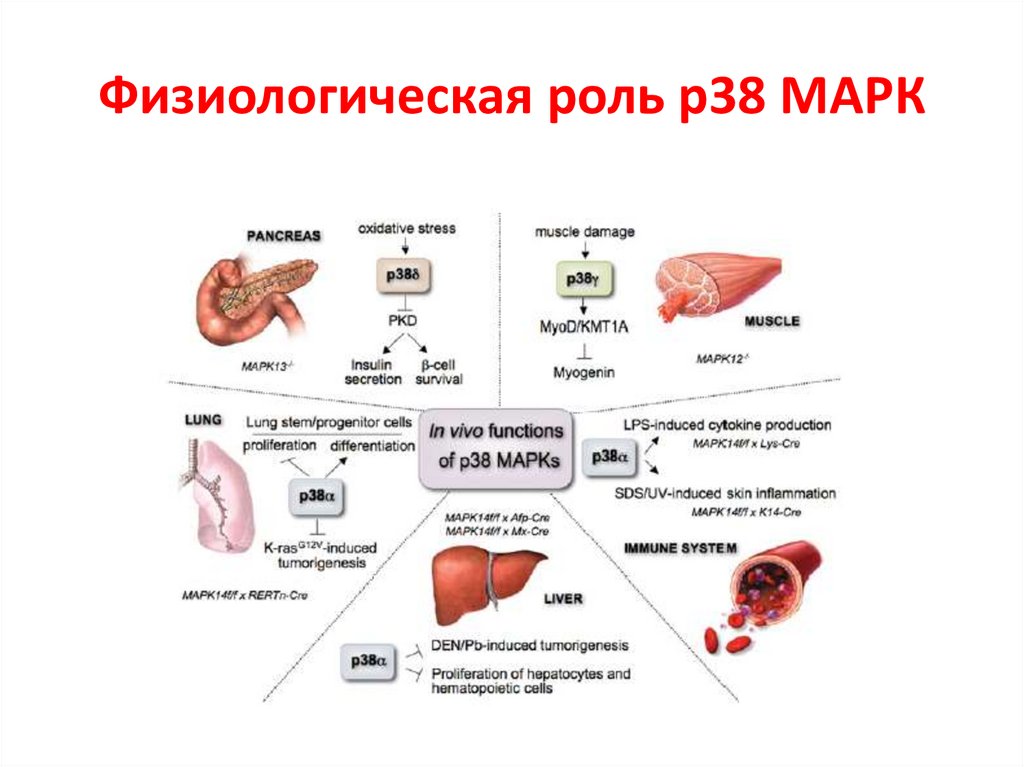
миссенс или делецией (показана делеция в клеточной линии BxPC-1) обнаруживаются при аденокарциноме
протоков поджелудочной железы (PDAC). Изоформы RAF регулируются положительной (зеленый) и отрицательной
(красный) регуляторной активностью фосфорилирования. Показаны сайты фосфорилирования, которые
активируют MEK1/2 или ERK1/2. Топология домена была определена в простом инструменте исследования
модульной архитектуры (SMART) (smart.embl-heidelberg.de). Общая идентичность последовательностей белковых и
киназных доменов указана (%/%), как определено с помощью множественного выравнивания последовательностей
CLUSTALW. * — точечная мутация; ▵, делеционная мутация.
74.
75.
Другие пути СТ76.
СТ с участием NOX белков77.
PI3K путь СТ78.
Липидная киназа PI3K• Существует 3 класса киназ PI3K,
различающихся по структуре и функциям.
Класс IA PI3K чаще всего ассоциирован с
возникновением рака. Известно 3 гена
этого класса: PIK3R1, PIK3R2 и PIK3R3,
активирующие мутации в которых находят в
опухолевых клетках человека.
79.
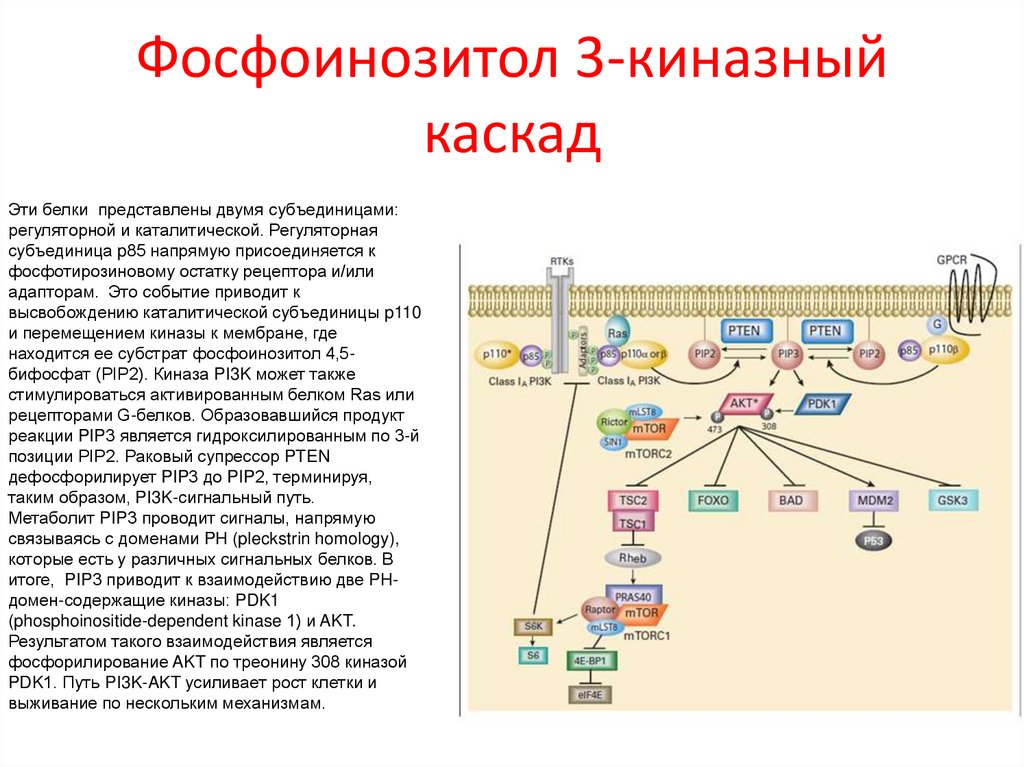
Фосфоинозитол 3-киназныйкаскад
Эти белки представлены двумя субъединицами:
регуляторной и каталитической. Регуляторная
субъединица p85 напрямую присоединяется к
фосфотирозиновому остатку рецептора и/или
адапторам. Это событие приводит к
высвобождению каталитической субъединицы p110
и перемещением киназы к мембране, где
находится ее субстрат фосфоинозитол 4,5бифосфат (PIP2). Киназа PI3K может также
стимулироваться активированным белком Ras или
рецепторами G-белков. Образовавшийся продукт
реакции PIP3 является гидроксилированным по 3-й
позиции PIP2. Раковый супрессор PTEN
дефосфорилирует PIP3 до PIP2, терминируя,
таким образом, PI3K-сигнальный путь.
Метаболит PIP3 проводит сигналы, напрямую
связываясь с доменами PH (pleckstrin homology),
которые есть у различных сигнальных белков. В
итоге, PIP3 приводит к взаимодействию две PHдомен-содержащие киназы: PDK1
(phosphoinositide-dependent kinase 1) и AKT.
Результатом такого взаимодействия является
фосфорилирование AKT по треонину 308 киназой
PDK1. Путь PI3K-AKT усиливает рост клетки и
выживание по нескольким механизмам.
80.
Р13-К путь СТ активирует РКВ(конститутивно активен во многих опухолях)
81.
mTOR путь СТ82.
mTOR• Этот путь играет ключевую роль в росте и питании клетки. Чтобы
избежать дефицита энергии и гибель, клетки достаточно быстро
ингибируют программы биосинтеза, увеличивая рециркуляцию
«старых» белков и органелл как источников метаболитов, в результате
чего пролиферация замедляется или вообще останавливается. Киназа
TOR (target of rapamycin) является своеобразным интерфейсом между
ростом и голодом клетки. Появление этой киназы у ранних эукариот
сделало возможным для одноклеточных организмов реагировать на
питательные вещества и расти в комфортных условиях. У
многоклеточных организмов у TOR появилась еще одна функция:
контролировать рост и гомеостаз. TOR млекопитающих (mTOR) играет
ключевую роль в старении, а также в развитии таких болезней
человека, как рак, метаболические болезни, включая диабет.
83.
С помощью генетических и биохимическихподходов TOR была открыта у дрожжей и
млекопитающих как мишень для
иммуносупрессора рапамицина, макролидного
препарата, синтезируемого почвенной бактерией
острова Пасхи. Белок TOR принадлежит к
семейству phospho inositide 3-kinase (PI3K)-related
protein kinases (PIKK), которое представлено
большим семейством белков, контролирующим
стресс, вызванный метаболическими,
генетическими нарушениями и нарушениями в
окружающей среде. Установлено, что mTOR
является каталитической субъединицей двух
различных комплексов: mTOR complex 1 (mTORC1)
и mTORC2
84.
mTOR complex 1 (mTORC1) иmTORC2 Regulatory-associated protein of mTOR (RAPTOR) and
rapamycin-insensitive companion of mTOR (RICTOR)
85.
У дрожжей и млекопитающихрапамицин ингибирует способность
mTORC1, но не mTORC2
фосфорилировать субстраты.
Рапамицин связывает небольшие
молекулы с м.м. 12 kDa, такие как
белок FKBP1, и ингибирует
связывание с белком RAPTOR
86.
87.
88.
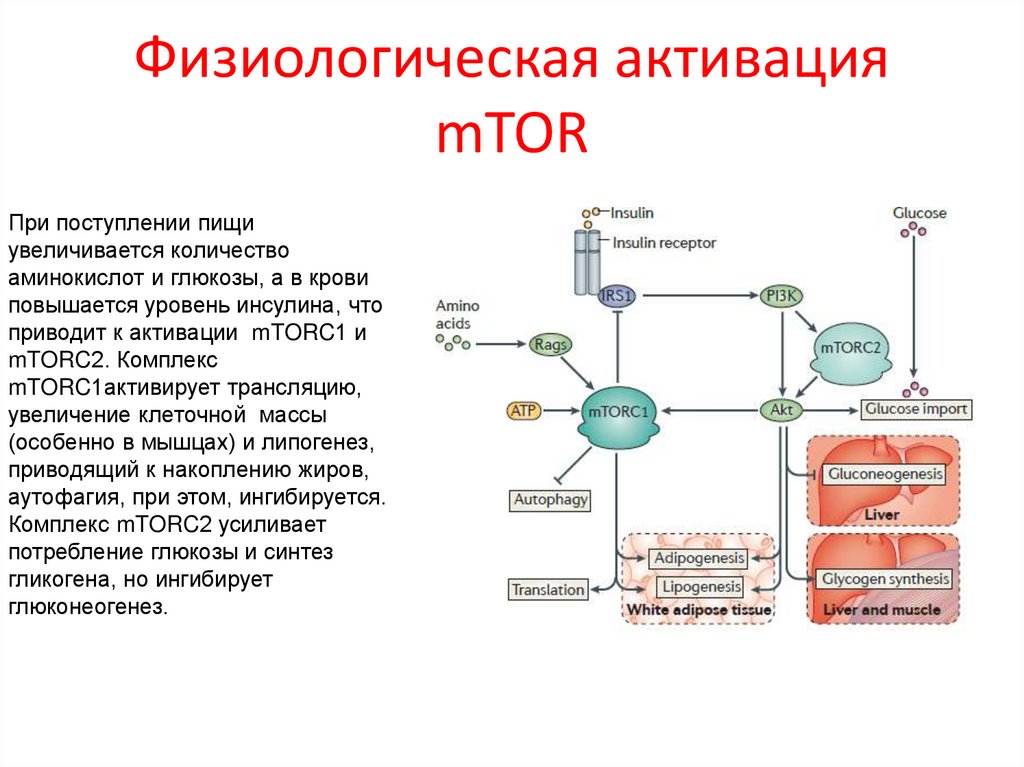
Физиологическая активацияmTOR
При поступлении пищи
увеличивается количество
аминокислот и глюкозы, а в крови
повышается уровень инсулина, что
приводит к активации mTORC1 и
mTORC2. Комплекс
mTORC1активирует трансляцию,
увеличение клеточной массы
(особенно в мышцах) и липогенез,
приводящий к накоплению жиров,
аутофагия, при этом, ингибируется.
Комплекс mTORC2 усиливает
потребление глюкозы и синтез
гликогена, но ингибирует
глюконеогенез.
89.
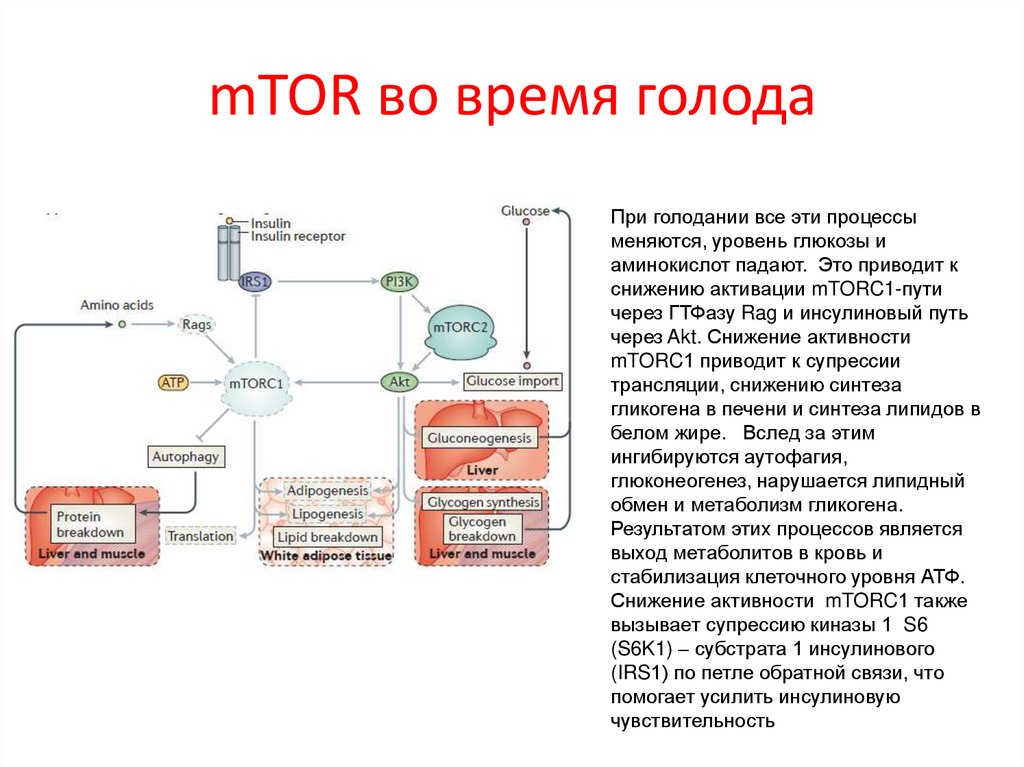
mTOR во время голодаПри голодании все эти процессы
меняются, уровень глюкозы и
аминокислот падают. Это приводит к
снижению активации mTORC1-пути
через ГТФазу Rag и инсулиновый путь
через Akt. Снижение активности
mTORC1 приводит к супрессии
трансляции, снижению синтеза
гликогена в печени и синтеза липидов в
белом жире. Вслед за этим
ингибируются аутофагия,
глюконеогенез, нарушается липидный
обмен и метаболизм гликогена.
Результатом этих процессов является
выход метаболитов в кровь и
стабилизация клеточного уровня АТФ.
Снижение активности mTORC1 также
вызывает супрессию киназы 1 S6
(S6K1) – субстрата 1 инсулинового
(IRS1) по петле обратной связи, что
помогает усилить инсулиновую
чувствительность
90.
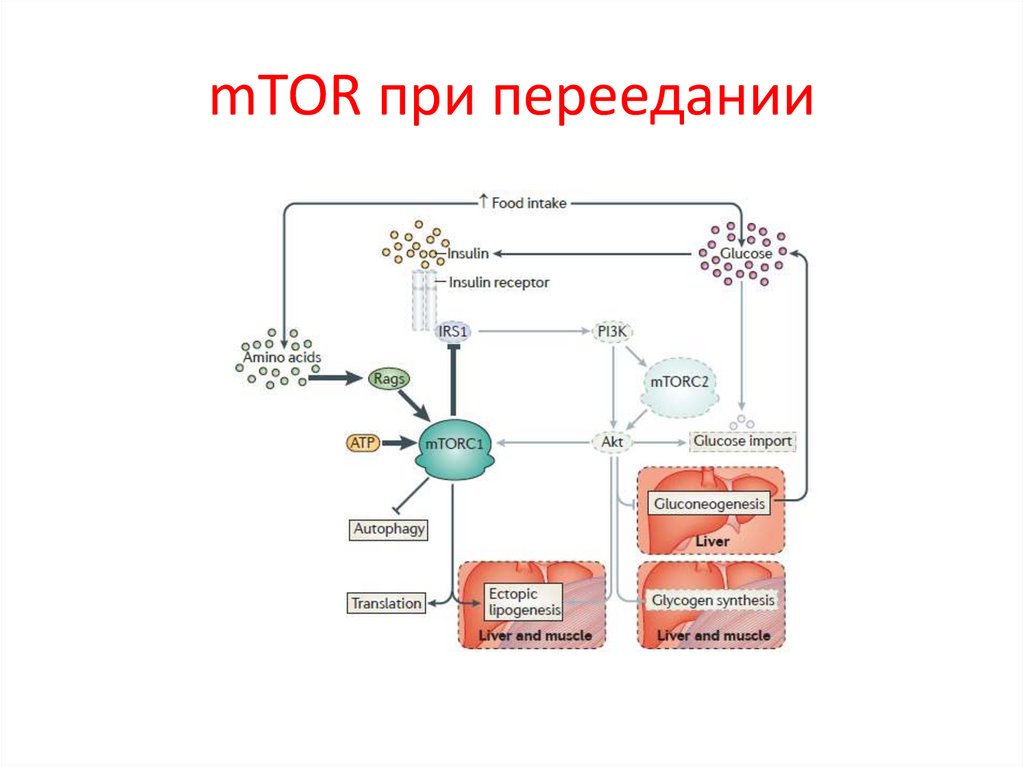
mTOR при переедании91.
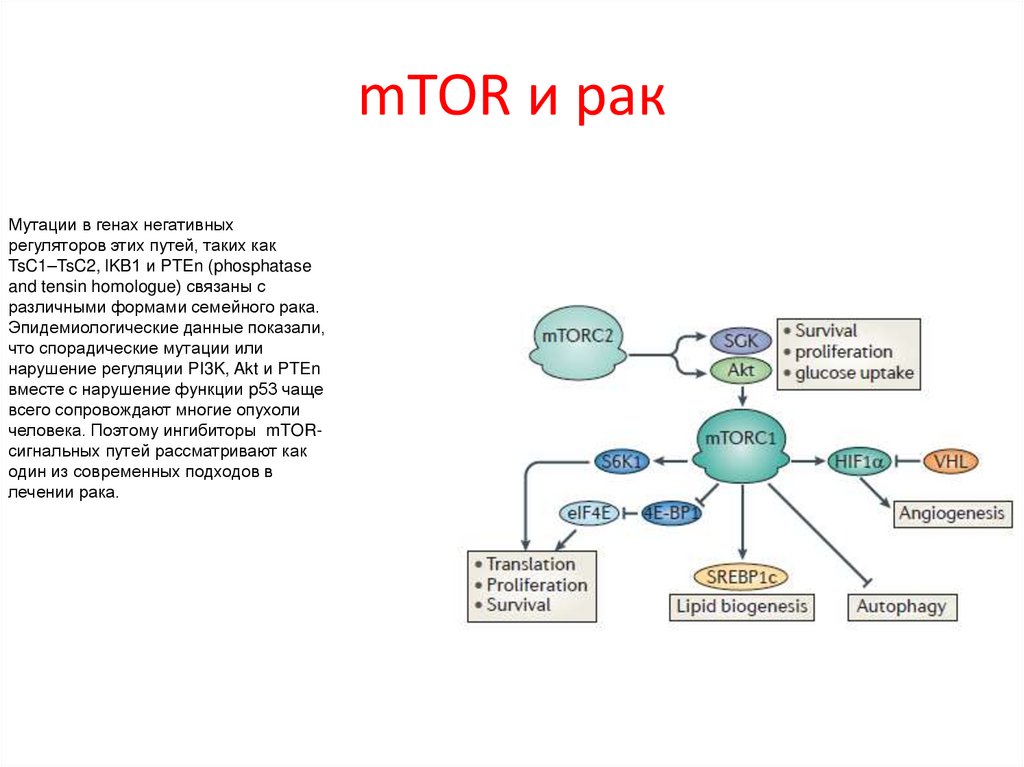
mTOR и ракМутации в генах негативных
регуляторов этих путей, таких как
TsC1–TsC2, lKB1 и PTEn (phosphatase
and tensin homologue) связаны с
различными формами семейного рака.
Эпидемиологические данные показали,
что спорадические мутации или
нарушение регуляции PI3K, Akt и PTEn
вместе с нарушение функции p53 чаще
всего сопровождают многие опухоли
человека. Поэтому ингибиторы mTORсигнальных путей рассматривают как
один из современных подходов в
лечении рака.
92.
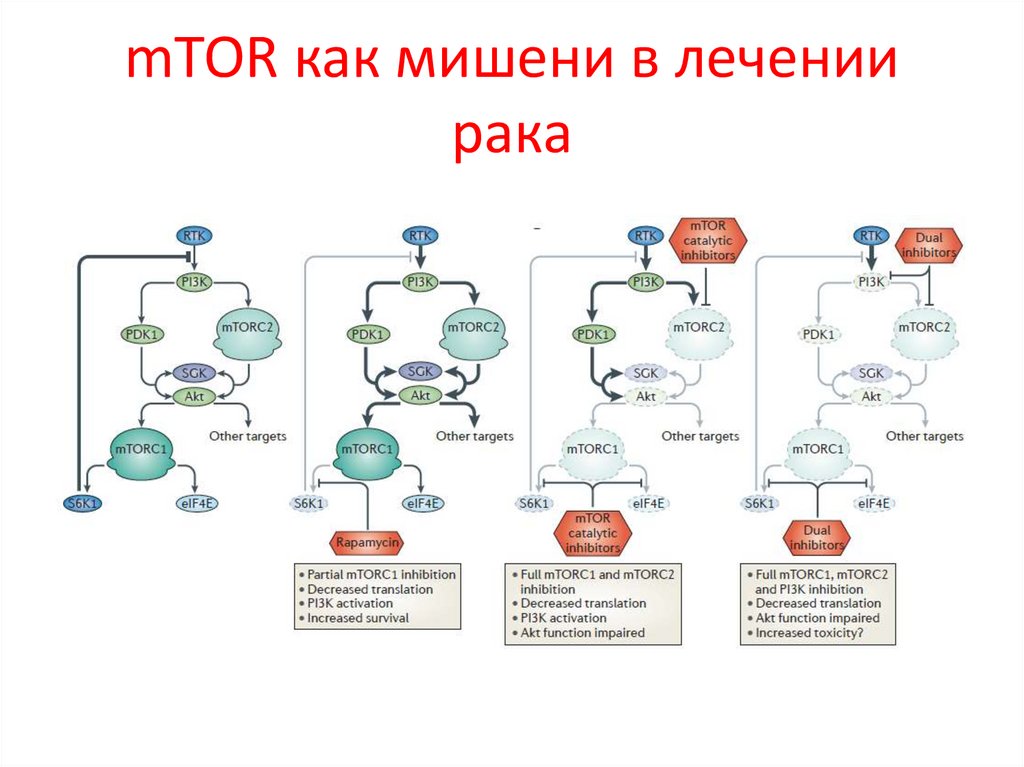
mTOR как мишени в лечениирака
93.
mTOR в старении94.
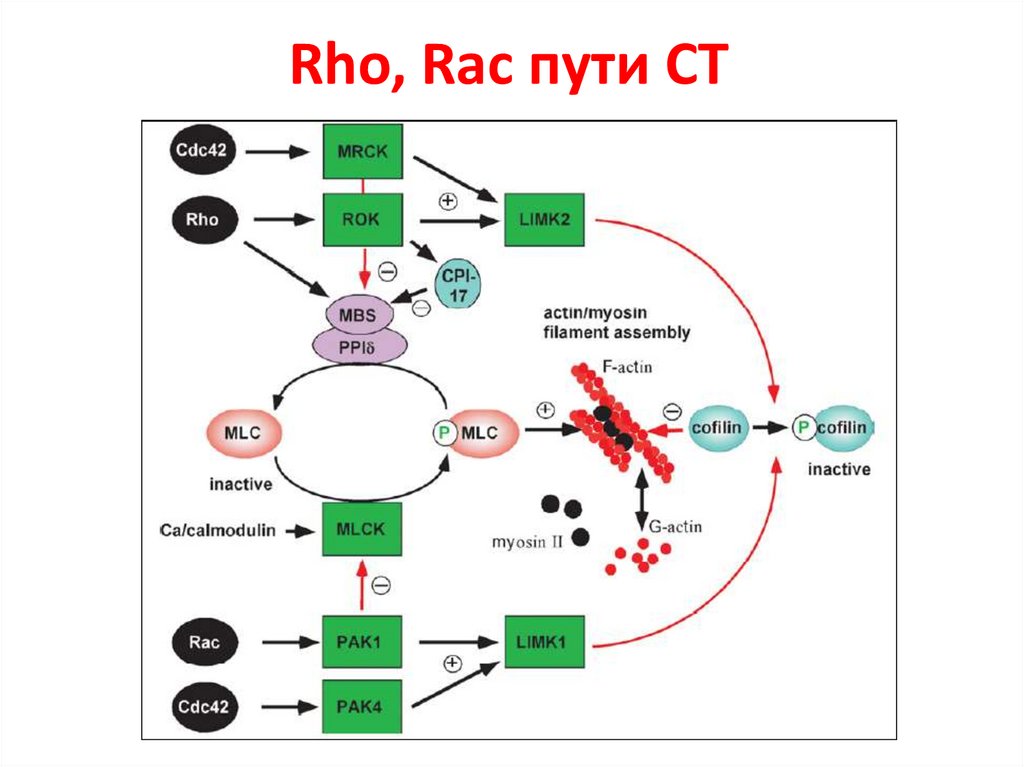
Rho, Rac пути СТ95.
cАМP в СТ96.
NOTCH1-сигнальный путь97.
NOTCH1-сигнальный путьВзаимодействие NOTCH1 рецептора с
Delta-like
и
Jagged
лигандами,
экспрессирующимися на поверхности
соседних
клеток
индуцирует
протеолитическое
расщепление
рецептора, в первую очередь, ADAM 10
металлопротеиназа (S2 cleavage) и затем
γ-secretase комплекс (S3 cleavage),
которые
высвобождают
внутриклеточный домен NOTCH1 (ICN1)
из мембраны . ICN1 транслоцируется в
ядро и взаимодействует с ДНК через
RBPJ/CSL – ДНК-связывающие белки,
рекрутируют
коактиваторы
для
экспрессии генов-мишеней NOTCH1
98.
Механизм активациисигнального пути Notch
99.
Механизм активациисигнального пути Notch
100.
Онкогенные формы NOTCH1 при T-ALLАберрантная активация NOTCH может происходить из-за мутаций. (А) рецептор
дикого типа; (b) Транслокация NOTCH1 в TCR локус индуцирует усеченные формы
NOTCH1. (c) NOTCH1 HD мутации класса 1 дестабилизируют структуру HD-LNR
повторов, ответственных за поддержание конфигурации рецептора (d) NOTCH1
H1545P мутации повреждают защиту от S2 расщепления у HD-LNR (e) NOTCH1 HD
мутации класса 2 располагают S2 МР сайт расщепления вне HD-LNR комплекса (f)
NOTCH1 JME усиливает выделение HD-LNR повторного комплекса из мембраны (g)
NOTCH1 ΔPEST у C-конца рецептора нарушает деградацию активного NOTCH1 в ядре.
101.
Распределение мутаций при лейкемии (TALL)102.
WNT (АРС) путь СТ103.
Wnt путь СТКанонический Wnts сигнал проходит через активатор
транскрипции β-catenin. В отсутствие лигандов
цитоплазматический β-catenin находится в составе комплекса
«деструктивных» белков: APC, glycogen synthase kinase 3-β
(GSK-3β), Axin и др. В этом состоянии β-catenin
фосфорилирован, убиквитинирован и деградирован, что
предотвращает его транслокацию в ядро и взаимодействие с
семейством ФТ LEF/TCF (LEF-1/LEF1, TCF-1/TCF7, TCF3/TCF7L1 и TCF-4/TCF7L2. Когда присутствуют лиганды Wnt,
они связываются с рецепторным комплексом, состоящем из 7ми трансмембранных белков Frizzled (Fz) и одного рецептора
LRP5/6 (lipoprotein-related protein 5 или 6). Связывание с этими
рецепторами рекрутирует скаффолд-белок Dishevelled (Dvl),
что приводит к фосфорилированию LRP5/6 и рекрутированию
Axin и GSK-3β вне комплекса деструкции. Это событие ведет к
освобождению β-catenin и накоплению его в ядре вместе с
LEF/TCFs. Когда возрастает его ядерная концентрация,
LEF/TCFs направляет β-catenin к генам-мишеням и
способствует взаимодействию с корегуляторами Pygopus,
BCL9/Legless и активации транскрипционных комплексов,
таких как CDK8 module of Mediator и TRRAP.
Adenomatous polyposis coli (APC) – ключевой онкосупрессор, действующий как gatekeeper
гомеостаза эпителия кишечника через контроль клеточного уровня бета-катенина, центрального
активатора Wnt signaling pathway.
104.
Структура АРС белка105.
Мутации в АРС106.
Другие пути: Hedgehog (Hh)
pathway
Путь передачи сигналов Hedgehog (Hh), также известный как Hedgehog-Patched (Hh-Ptch), Hedgehog-Gli (Hh-Gli) или
Hedgehog-Patched-Smoothened (Hh-Ptch-Smo), представляет собой эволюционно консервативный путь передачи
сигналов от клеточной мембраны к ядру. 3 белка вовлечены в Hh signaling activation: Hedgehog (Hh) ligand, Patched
(Ptch) и Smoothened (Smo).
A) В отсутствие лиганда Hedgehog полноразмерный Gli фосфорилируется протеинкиназой A, гликогенсинтазой
киназой-3 и казеинкиназой 1. Это приводит к протеолитическому расщеплению полноразмерного Gli на репрессор Gli.
Репрессор Gli подавляет экспрессию генов-мишеней. (B) после связывания лиганда Hedgehog белок Smoothened
фосфорилируется протеинкиназой A и казеинкиназой 1. Ингибирующий эффект Sufu устраняется и образуется
активатор Gli. Активатор Gli индуцирует транскрипцию генов-мишеней. Красные символы обозначают тормозящий
эффект, а зеленые стрелки показывают активирующий эффект. Hh - Hedgehog; Ptch - Patched; Smo - Smoothened; Gli glioma-associated oncogene; GliFL - full-length Gli; GliA - Gli activator; GliR - Gli repressor; CK1 - casein kinase 1; PKA protein kinase A; GSK3 - glycogen synthase kinase-3.
107.
Hh signaling pathway генымишениBosn J Basic Med Sci. 2018; 18(1): 8–20.
doi: 10.17305/bjbms.2018.2756
Skoda et al.The role of the Hedgehog signaling pathway
in cancer: A comprehensive review
108.
Три основных механизма аберрантной активации передачисигналов Hedgehog
A) Тип I - лиганд-независимая передача сигналов Hedgehog.
Этот тип включает: инактивирующую мутацию Ptch1 (зеленая
звездочка) или активирующая мутация Smo (красная
звездочка), поэтому сглаженный рецептор больше не может
подавляться с помощью Patched 1. Результатом является
конститутивная активация пути Hedgehog в отсутствие
лиганда. (B) Тип II - лиганд-зависимая аутокринная /
юкстакринная передача сигналов Hedgehog. Лиганд Hedgehog
секретируется опухолевой клеткой и попадает в ту же
опухолевую клетку (аутокринным способом) или в
близлежащие опухолевые клетки (юкстакринный способ),
таким образом активируя сигнальный каскад ниже по ходу пути
передачи сигнала Hedgehog. (C-1) Тип IIIa - лиганд-зависимая
паракринная передача сигналов. Лиганд Hedgehog
секретируется опухолевыми клетками и поглощается
стромальными клетками. Активированные стромальные клетки
синтезируют и секретируют сигналы, такие как фактор роста
эндотелия сосудов и инсулиноподобный фактор роста,
которые затем возвращаются в опухолевые клетки для
поддержки их выживания и роста. (C-2) Тип IIIb - лигандзависимая обратная паракринная передача сигналов. Лиганд
Hedgehog непосредственно секретируется стромальными
клетками и поглощается опухолевыми клетками. Таким
образом, лиганд способствует пролиферации и росту
опухолевых клеток. Hh - Hedgehog; Ptch1 - Patched 1; Smo Smoothened; Gli1 - glioma-associated oncogene 1; VEGF vascular endothelial growth factor; IGF - insulin-like growth factor.
109.
Таргетная терапия Hhsignaling pathway
Базально-клеточная
карцинома,
медуллобластома,
множественная миелома,
рак молочной железы, рак
поджелудочной железы,
глиома и лимфома










































































 biology
biology chemistry
chemistry








