Similar presentations:
Строение атома углерода по его положению в ПС
1.
Из меня состоит всеУглеродживое, .
Я – гранит, антрацит и алмаз,
Аллотропные видоизменения.
Я на улице, в щколе и в поле,
Химические
.
Я в деревьях
и в каждом изсвойства
вас.
2.
ЦЕЛИ УРОКА:1. – установить строение атома
углерода по его положению в ПС;
2. – изучить аллотропные
модификации углерода;
3. – изучить химические свойства и
применение углерода;
3.
Подстраховался углерод.Живет не ведая забот.
Всем привередам угодил:
Тверд, мягок, светел и
Темней чернил !
Содержание.
1. Строение атома и валентные
возможности атома углерода.
2. Аллотропия углерода.
3. Адсорбция.
4. Химические свойства углерода.
5. Применение углерода.
4.
5.
Учитывая положение углерода в Периодическойсистеме, ответьте на вопросы:
1. Каков химический знак углерода?
2. Каков порядковый номер
3. В каком периоде находится углерод?
4. В какой группе и подгруппе находится углерод?
5. Какова атомная масса?
6. Составьте схему строения атома
7. Сколько валентных электронов?
8. Чему равна низшая степень окисления?
9. Чему равна высшая степень окисления?
За каждый правильный ответ – 1 балл.
Алгоритм ответов
6.
алгоритм ответа1) С
2) 6
3) Период II
4) Группа IV А
5) Ar(C) = 12
6) +6 С ) )
24
7) 4
8) - 4
9) + 4
7.
Положение в периодической системе.4 группа
Главная подгруппа
2 период
Состав атома:
6 протонов, 6 электронов, 6 нейтронов.
Строение атома:
Неметалл
СО +2, +4, -4
На последнем электронном слое в
возбужденном состоянии 4 электрона.
8. Аллотропные модификации С
9.
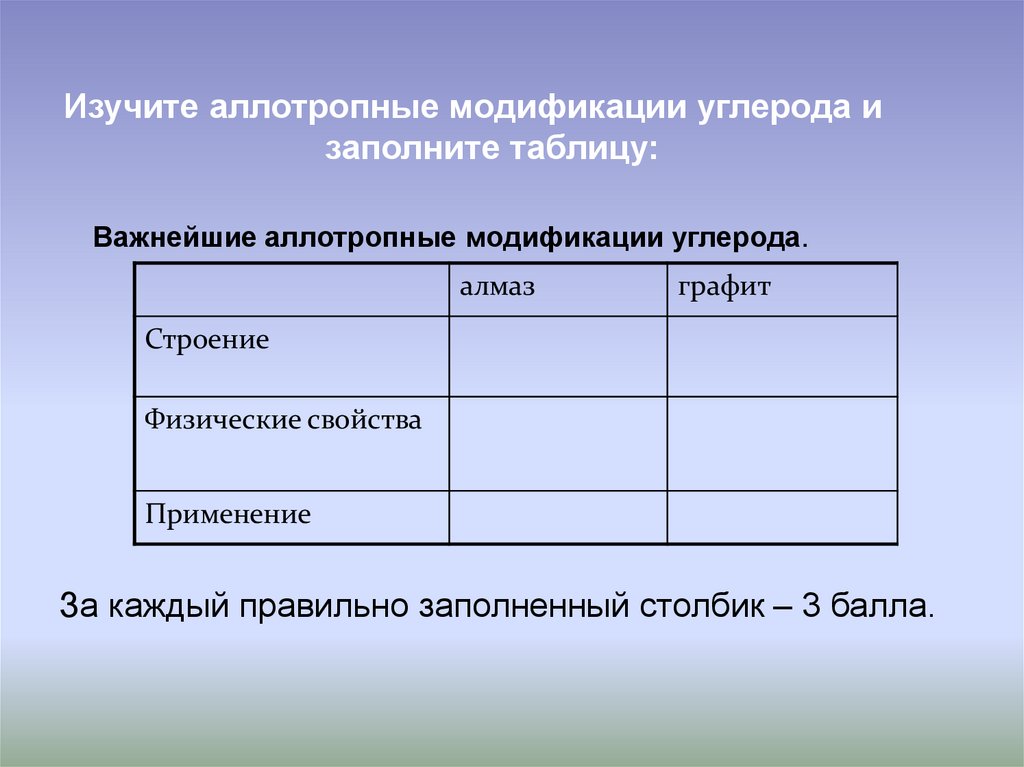
Изучите аллотропные модификации углерода изаполните таблицу:
Важнейшие аллотропные модификации углерода.
алмаз
графит
Строение
Физические свойства
Применение
За каждый правильно заполненный столбик – 3 балла.
10.
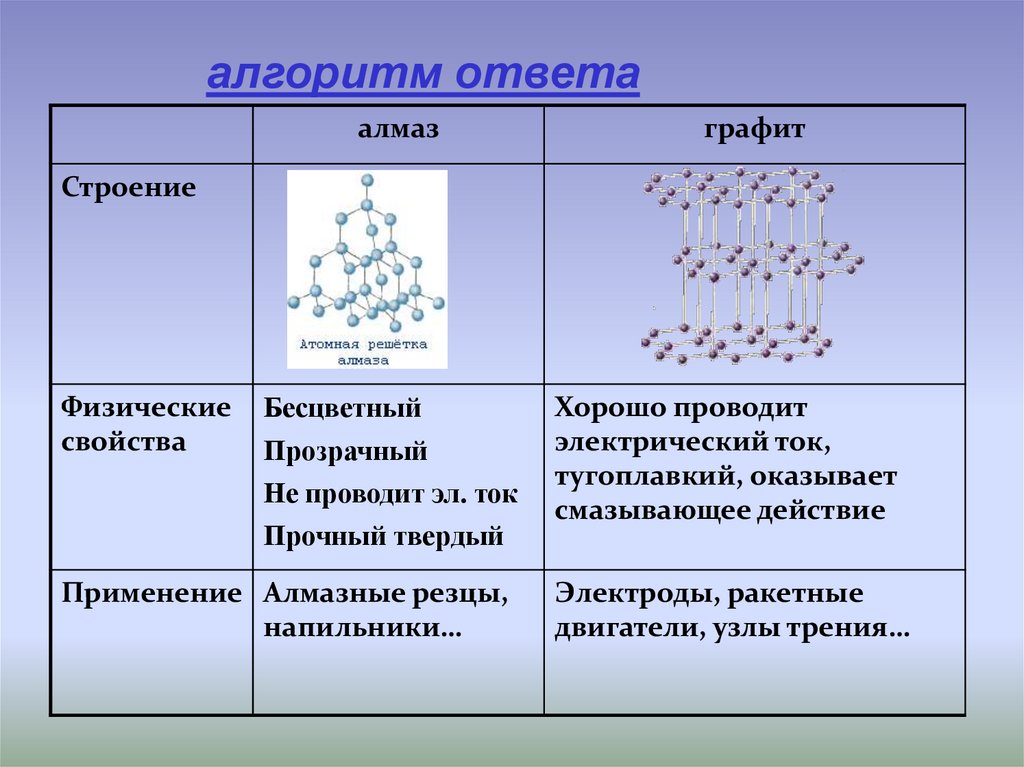
алгоритм ответаалмаз
графит
Строение
Бесцветный
Прозрачный
Не проводит эл. ток
Прочный твердый
Хорошо проводит
электрический ток,
тугоплавкий, оказывает
смазывающее действие
Применение Алмазные резцы,
напильники…
Электроды, ракетные
двигатели, узлы трения…
Физические
свойства
11.
Из предложенного перечня выберитесвойства, характерные для алмаза и графита:
• прозрачное кристаллическое вещество
• проводит тепло и ток
• имеет очень сильный блеск
• темно-серое, жирное на ощупь
кристаллическое вещество
• самое твёрдое из всех природных веществ
• не проводит тепло и ток
• расслаивается на чешуйки
• имеет металлический блеск
12. Из рисунков выберите номера тех, которые относятся к областям применения а) алмаза б) графита
13
2
1
4
5
6
13.
Алмаз1694
Флорентийцы –природа алмаза
1772
При сгорании – углекислый газ
А. Лавуазье
Бесцветный
Прозрачный
Не проводит эл. ток
Прочный
Твердый
Он в чистом виде черный, мрачный,
Неплавкий и едва горюч.
Бывает как кристалл прозрачный,
В котором блещет солнца луч.
О
Б
Л
А
С
Т
И
П
Р
И
М
Е
Н
Е
Н
И
Я
14.
Графитдо 1780 Разновидность др. минералов
1778
При сгорании – углекислый газ
•Темно-серый
К. Шееле
•Непрозрачный
•Проводит эл. ток
•Мало прочный
Тот элемент в печной трубе
•Мягкий
Находим в виде сажи
•Металлический блеск
Или в простом карандаше
•Оставляет след на бумаге
Его встречаем даже.
•Жирный на ощупь
О
Б
Л
А
С
Т
И
П
Р
И
М
Е
Н
Е
Н
И
я
15.
Какой метод очистки воды использует Рукодельница?…Между тем Рукодельница воротится, воду
процедит, в кувшины нальет, да еще какая
затейница: коли
вода не чиста, так свернет лист
Адсорбция
бумаги, наложит в него угольков да песку
крупного
насыплет,
вставит
ту бумагуна
в кувшин,
- свойство
углерода
удерживать
да нальет
в нее воды,
а вода-то,
знай, проходит
пористой
поверхности
растворенные
сквозьвещества
песок да исквозь
газы уголья и капает в кувшин
чистая, словно хрустальная.
Из сказки В. И. Одоевского « Мороз Иванович»
Н. Д. Зелинский
16. ИССЛЕДОВАНИЕ….
Выполните лабораторный опыт.Инструкция.
1. Измельчите таблетку активированного угля в ступке.
2. Высыпите измельчённый уголь в колбу (с помощью
листка-совочка);
3. Добавьте в колбу окрашенной воды из стаканчика и
закройте пробкой;
4. Энергично перемешайте содержимое колбы;
5. Изготовьте фильтр и профильтруйте полученную
смесь веществ из колбы в пробирку.
Сделайте вывод о свойствах активированного угля.
17.
ХИ
М
И
Ч
Е
С
К
И
Е
С
В
О
Й
С
Т
В
А
С
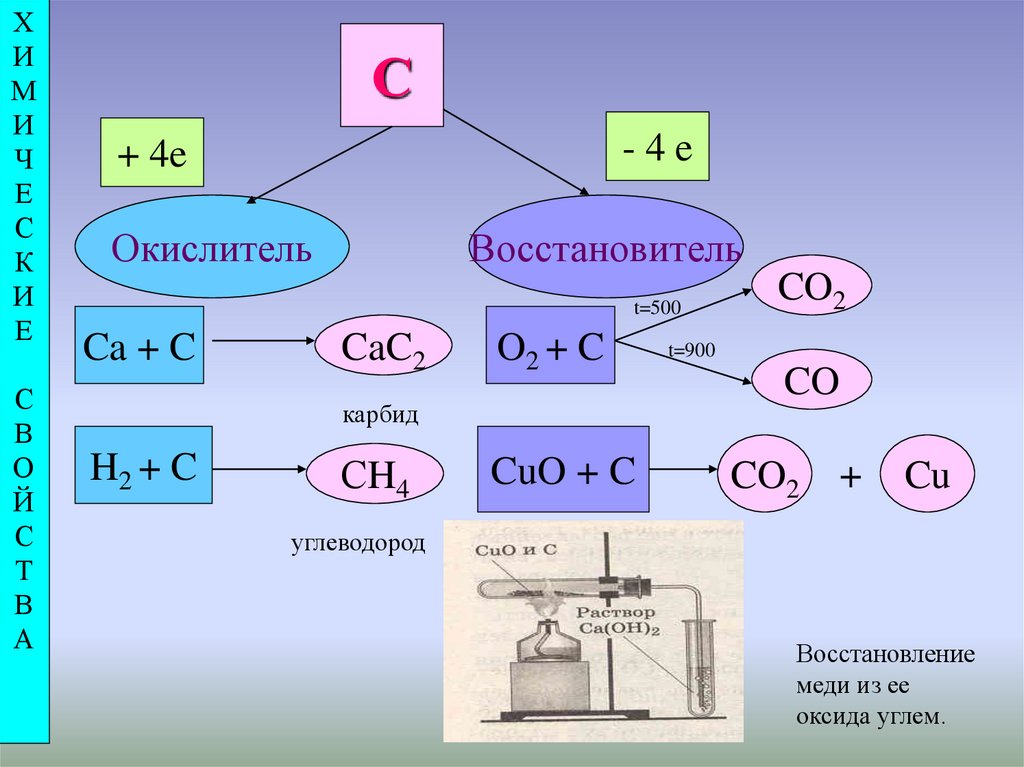
-4e
+ 4e
Окислитель
Восстановитель
t=500
Ca + C
CaC2
O2 + C
карбид
H2 + C
СH4
CuO + C
CO2
t=900
CO
CO2
+
Cu
углеводород
Восстановление
меди из ее
оксида углем.
18.
19.
Закончите уравнения реакций1. C + O2 =
2. C + O2 =
3. C + H2 =
4. C + Ca =
5. C + Al =
6. C + CuO =
7. C + FeO =
8. C + H2O =
За каждую реакцию – 1 балл.
Алгоритм ответов
20.
Закончите уравнения реакций• 2C + O2 = 2СО
• C + O2 = СО2
• C + 2H2 = СН4
• 2C + Ca = СаС2
• 4C + 3Al = Аl3С4
• C + CuO =Сu + CO.
• C + FeO = Fe + CO,
• C + H2O = CO + H2,
21.
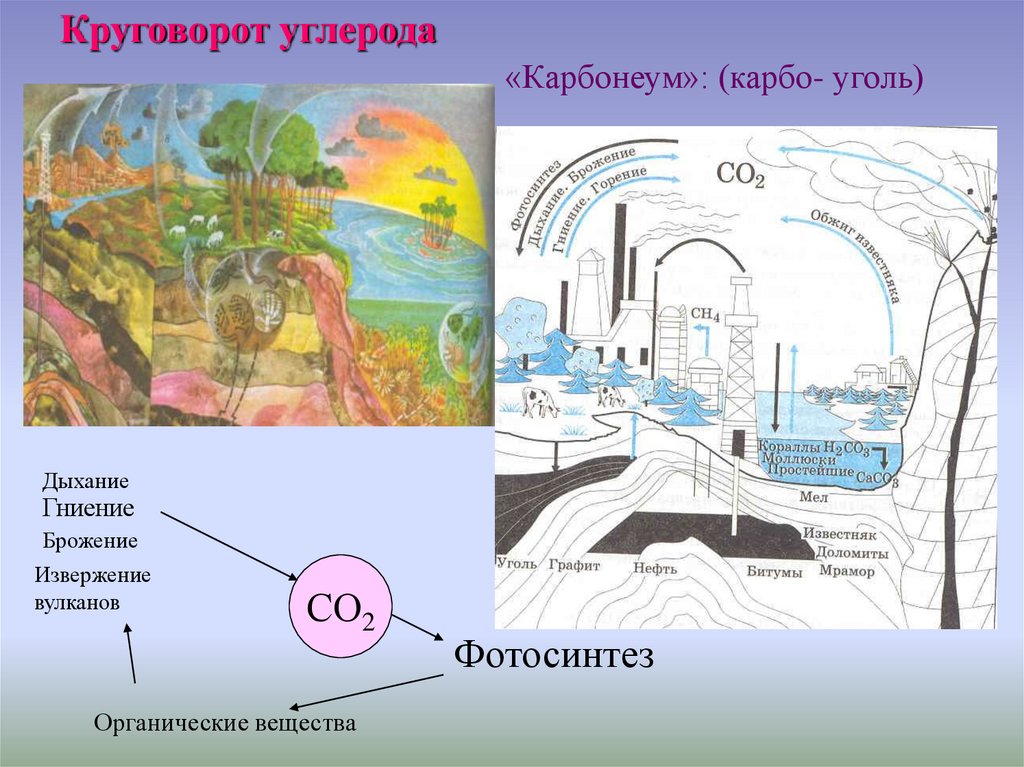
Круговорот углерода«Карбонеум»: (карбо- уголь)
Дыхание
Гниение
Брожение
Извержение
вулканов
СО2
Органические вещества
Фотосинтез
22.
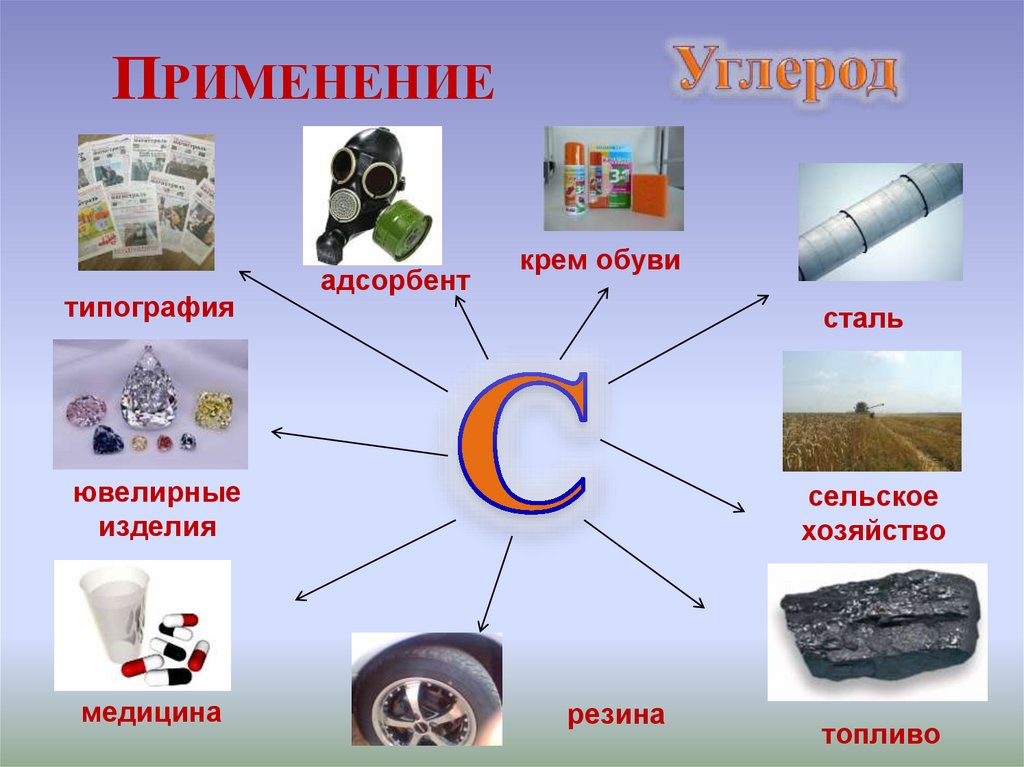
ПРИМЕНЕНИЕтипография
адсорбент
крем обуви
сталь
ювелирные
изделия
медицина
сельское
хозяйство
резина
топливо

















 chemistry
chemistry








