Similar presentations:
Основания. Классификация, номенклатура, способы получения. Урок 2
1.
ОснованияУрок 2.
Классификация, номенклатура,
способы получения.
2.
Основание Ме(OH)nметалл
n=1или2
гидроксогруппа
• сложное вещество, которое состоит из атомов
металла и одной или двух гидроксогрупп.
• валентность металла в основании I или II
• число гидроксогрупп определяется
валентностью металла
• валентность гидроксогруппы - I
• исключение Zn(OH)2 и Ве(OH)2-амфотерные
позже мы будем называть основания основными гидроксидами.
3.
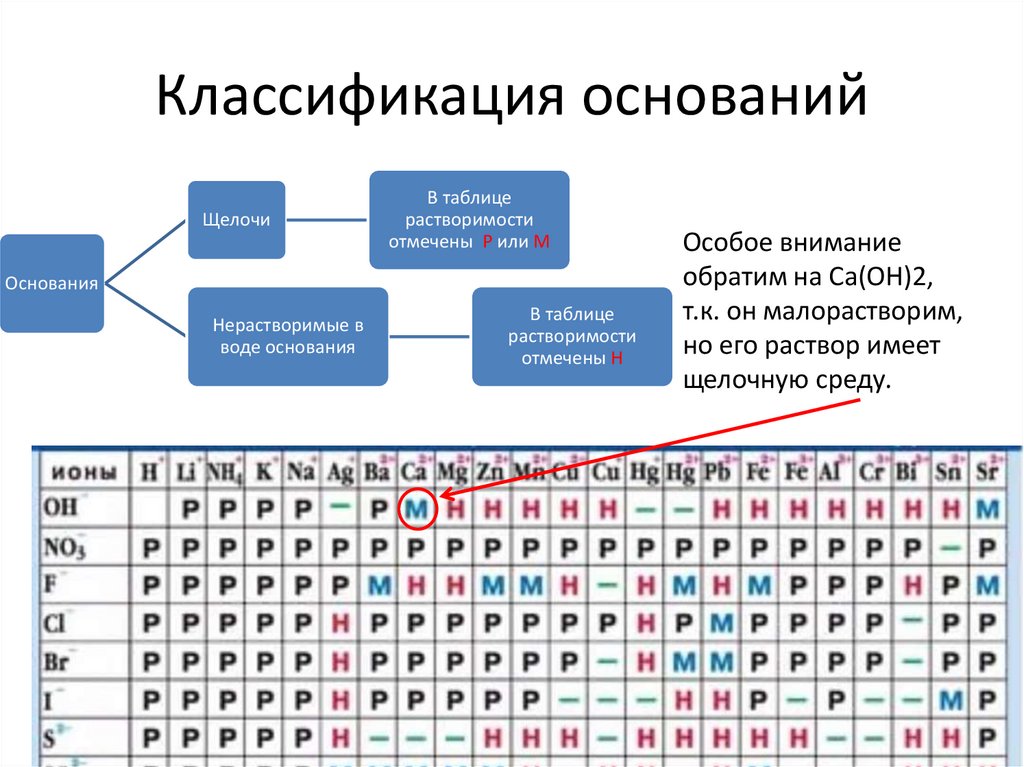
Классификация основанийЩелочи
В таблице
растворимости
отмечены Р или М
Основания
Нерастворимые в
воде основания
В таблице
растворимости
отмечены Н
Особое внимание
обратим на Сa(OH)2,
т.к. он малорастворим,
но его раствор имеет
щелочную среду.
4.
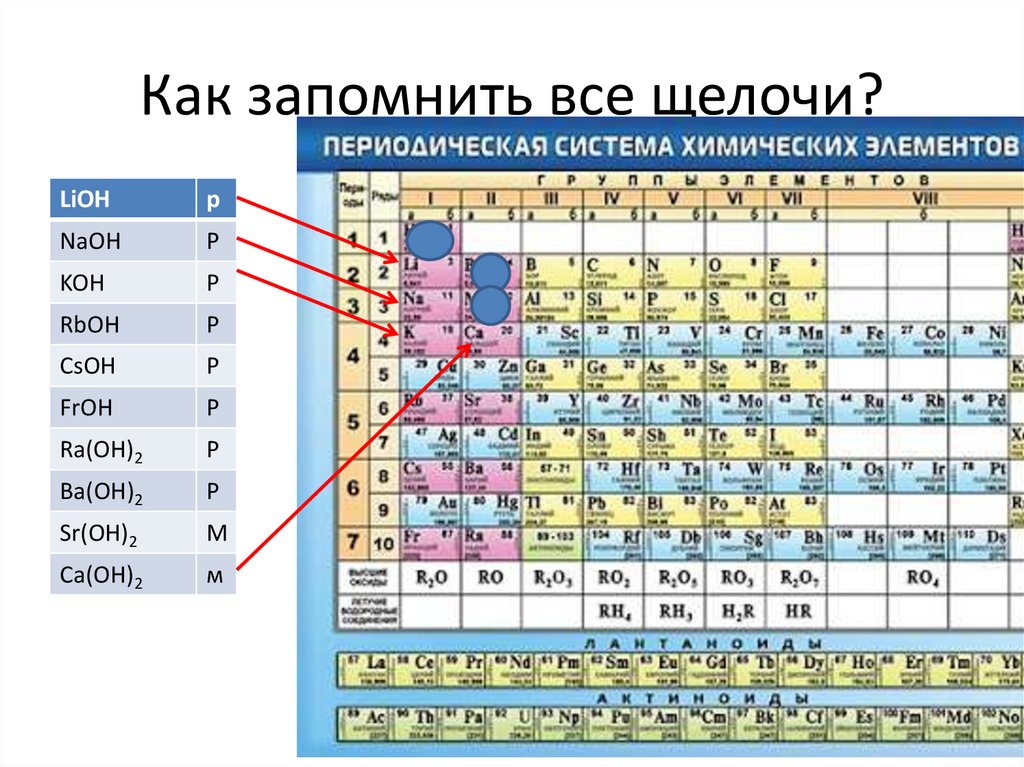
Как запомнить все щелочи?LiOH
р
NaOH
Р
KOH
Р
RbOH
Р
CsOH
Р
FrOH
Р
Ra(OH)2
Р
Ba(OH)2
Р
Sr(OH)2
М
Ca(OH)2
м
5.
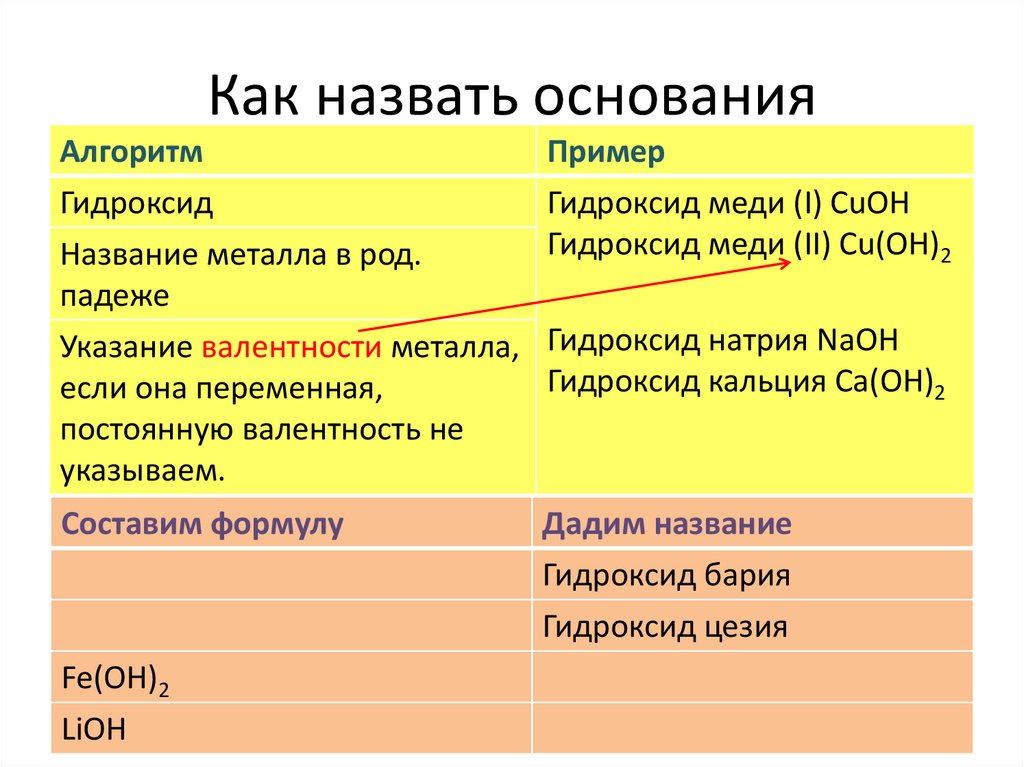
Как назвать основанияАлгоритм
Пример
Гидроксид
Название металла в род.
падеже
Гидроксид меди (I) СuOH
Гидроксид меди (II) Сu(OH)2
Указание валентности металла, Гидроксид натрия NaOH
Гидроксид кальция Са(OH)2
если она переменная,
постоянную валентность не
указываем.
Составим формулу
Дадим название
Гидроксид бария
Гидроксид цезия
Fe(OH)2
LiOH
6.
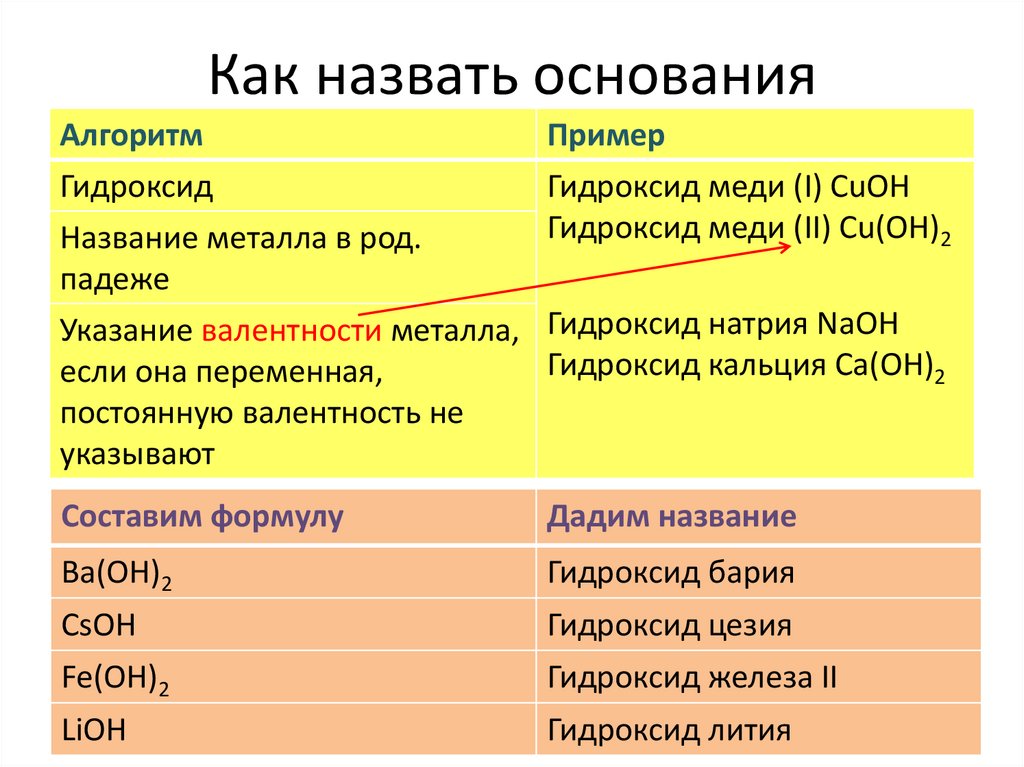
Как назвать основанияАлгоритм
Гидроксид
Название металла в род.
падеже
Указание валентности металла,
если она переменная,
постоянную валентность не
указывают
Пример
Гидроксид меди (I) СuOH
Гидроксид меди (II) Сu(OH)2
Составим формулу
Дадим название
Ва(ОН)2
Гидроксид бария
CsOH
Гидроксид цезия
Fe(OH)2
Гидроксид железа II
LiOH
Гидроксид лития
Гидроксид натрия NaOH
Гидроксид кальция Са(OH)2
7.
Тривиальные названия оснований• Едкое кали -КОН
• Едкий натр -NaOH
• Гашеная известь (тв), известковая вода(р-р),
известковое молоко(суспензия) -Ca(OH)2
• Баритова вода(р-р) -Вa(OH)2
8.
Как получить основания• Если щелочь: основный оксид + вода = щелочь
• Пример: Na2O+H2O = 2NaOH
BaO+H2O = Ba(OH)2
О протекании реакции свидетельствует изменение
окраски индикатора
• Нерастворимые основания так получить нельзя
СuO+H2O =
• Напротив, они могут термически разлагаться:
Cu(OH)2= CuO+H2O
9.
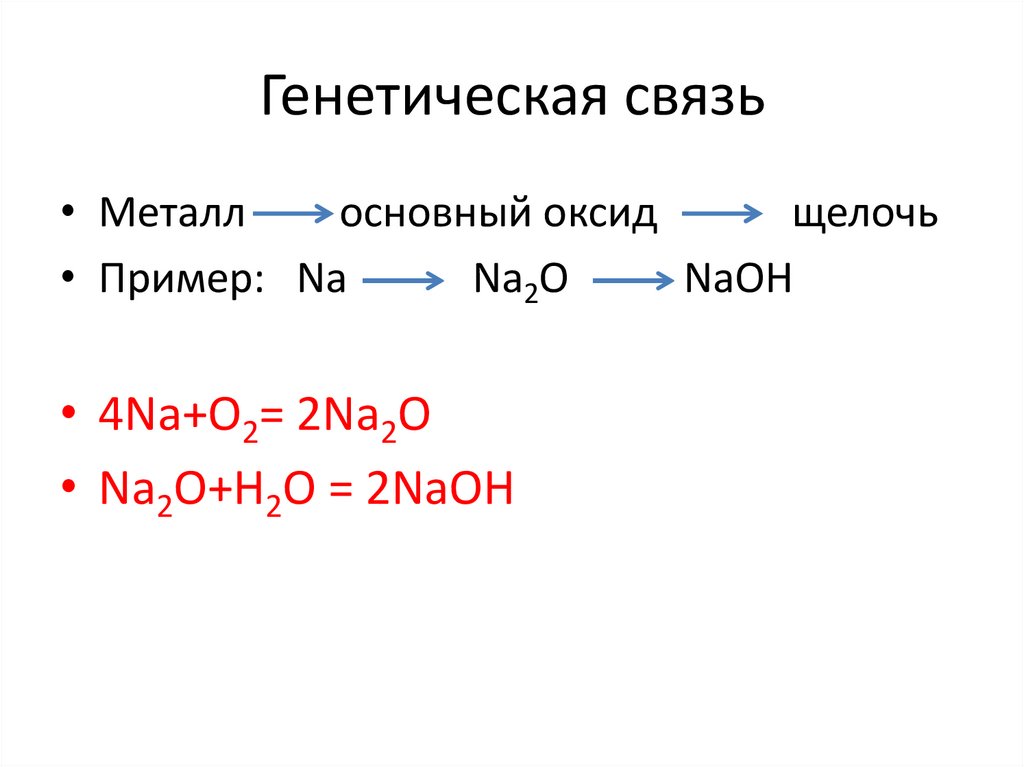
Генетическая связь• Металл
основный оксид
щелочь
• Пример: Na
Na2O
NaOH
• 4Na+O2= 2Na2O
• Na2O+H2O = 2NaOH
10.
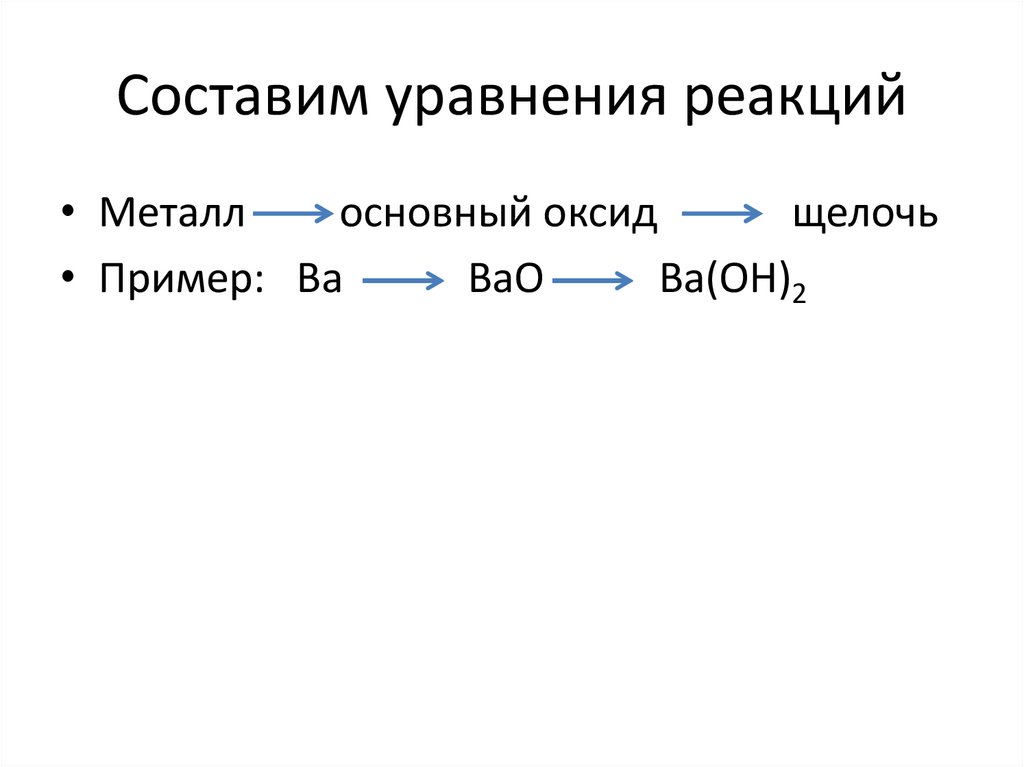
Составим уравнения реакций• Металл
основный оксид
щелочь
• Пример: Вa
ВaO
Вa(OH)2
11.
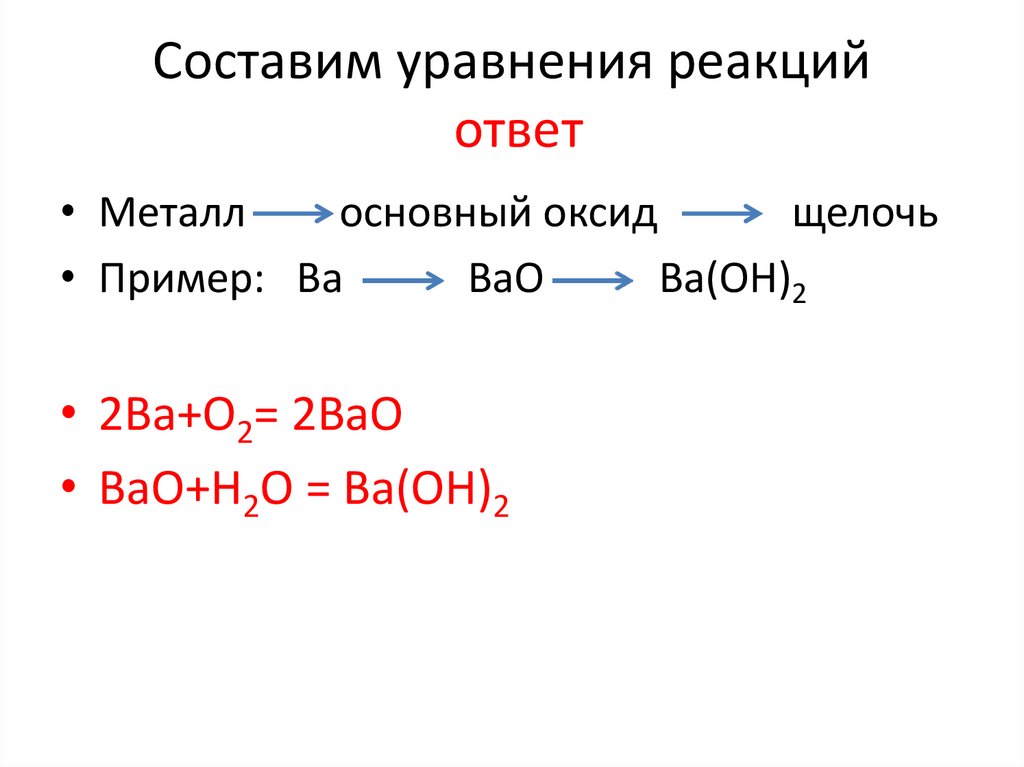
Составим уравнения реакцийответ
• Металл
основный оксид
щелочь
• Пример: Вa
ВaO
Вa(OH)2
• 2Вa+O2= 2ВaO
• ВaO+H2O = Вa(OH)2
12.
Составим уравнения реакций• Металл основный оксид
нерастворимое
основание
• Пример: Сu
CuO
Cu(OH)2
• Чем отличаются эти превращения?
13.
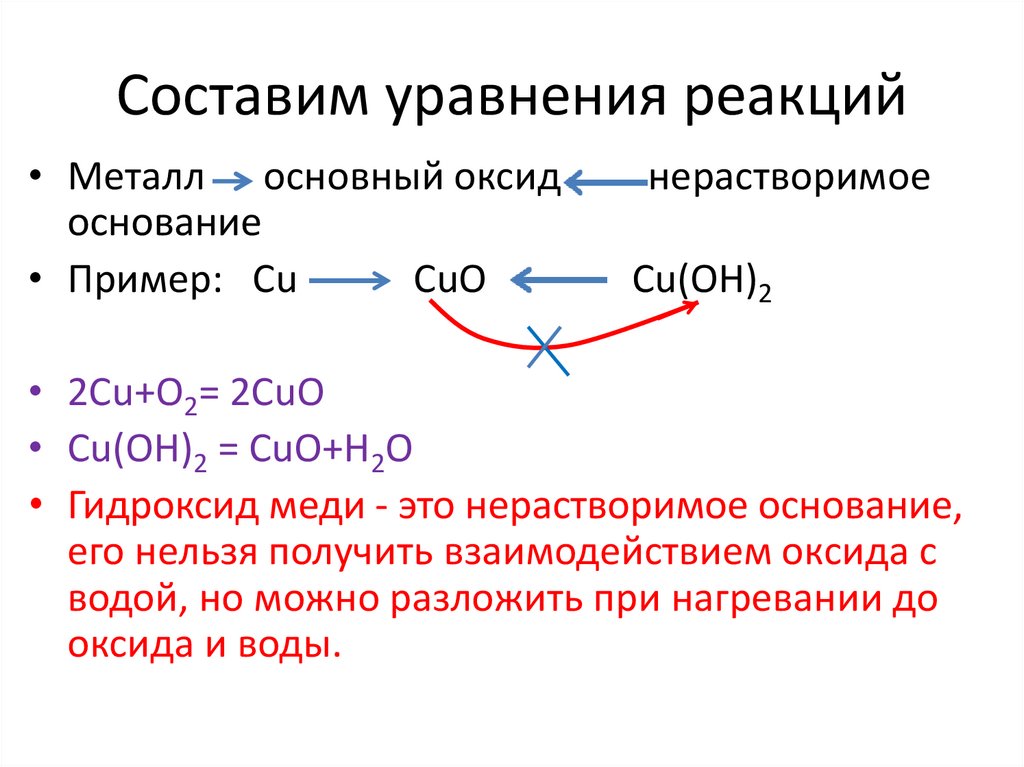
Составим уравнения реакций• Металл основный оксид
основание
• Пример: Сu
CuO
нерастворимое
Cu(OH)2
• 2Cu+O2= 2CuO
• Cu(OH)2 = CuO+H2O
• Гидроксид меди - это нерастворимое основание,
его нельзя получить взаимодействием оксида с
водой, но можно разложить при нагревании до
оксида и воды.
14.
Домашнее задание• Прочитайте параграф 31.
• Выучите определения оснований и щелочей
• Дополните конспект в тетради информацией
из презентации.
• Письменно выполните задания 1-3 после
параграфа.
• В проверочной работе нужно будет из перечня
выбрать основные оксиды и записать реакцию
их получения из металла и реакцию
взаимодействия их с водой. (пример ниже)
15.
Проверочная работа (пример)• Выберите из перечня веществ основные
оксиды и запишите реакцию получения их
из металла. Если оксид с водой образует
щелочь, то запишите уравнение этой
реакции. Если оксиду соответствует
нерастворимое основание, то запишите
уравнение реакции термического
разложения этого основания.
• Р2О5, К2О, Аl2O3, СuSO4, SrO, СО2, MgO.







 chemistry
chemistry








