Similar presentations:
Гидроксиды. Основания. Состав, классификация, свойства, получение
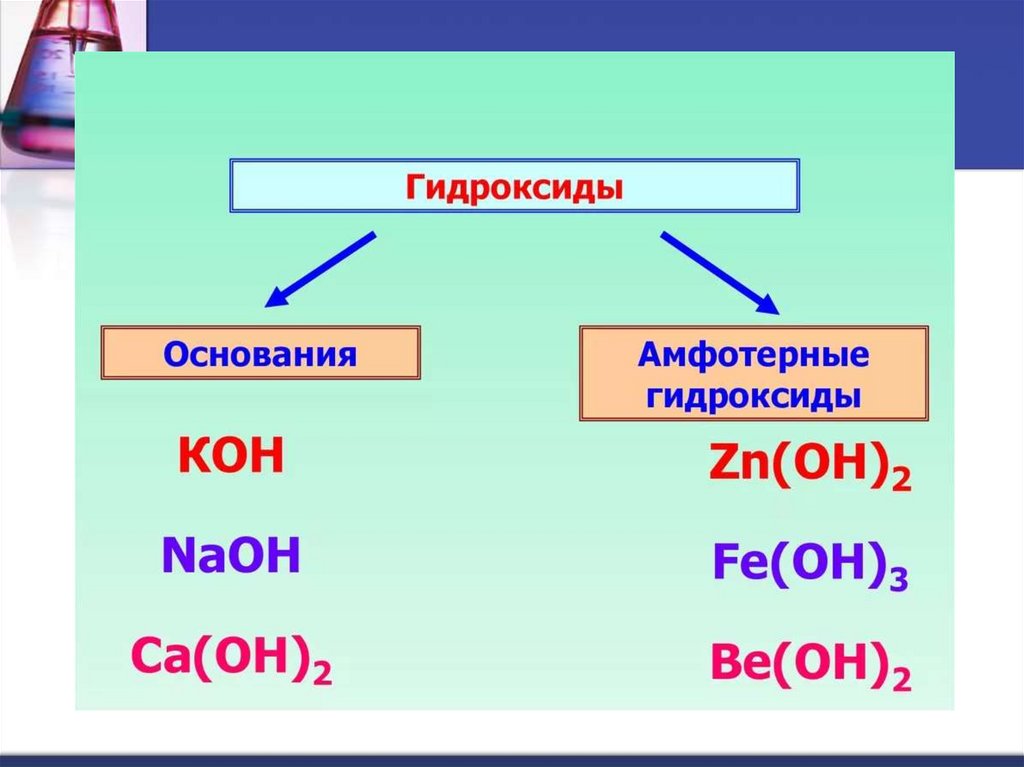
1. Гидроксиды. основания
Состав, классификация, свойства,получение.
2.
3.
Гидроксиды – сложные вещества, состоящие изатомов металла, соединенных с одной или
несколькими гидроксогруппами.
ОН – гидроксогруппа, валентность I.
Общая формула: Ме(ОН)х
Примеры: NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Cu(OH)2 – гидроксид меди (II)
4.
5.
6.
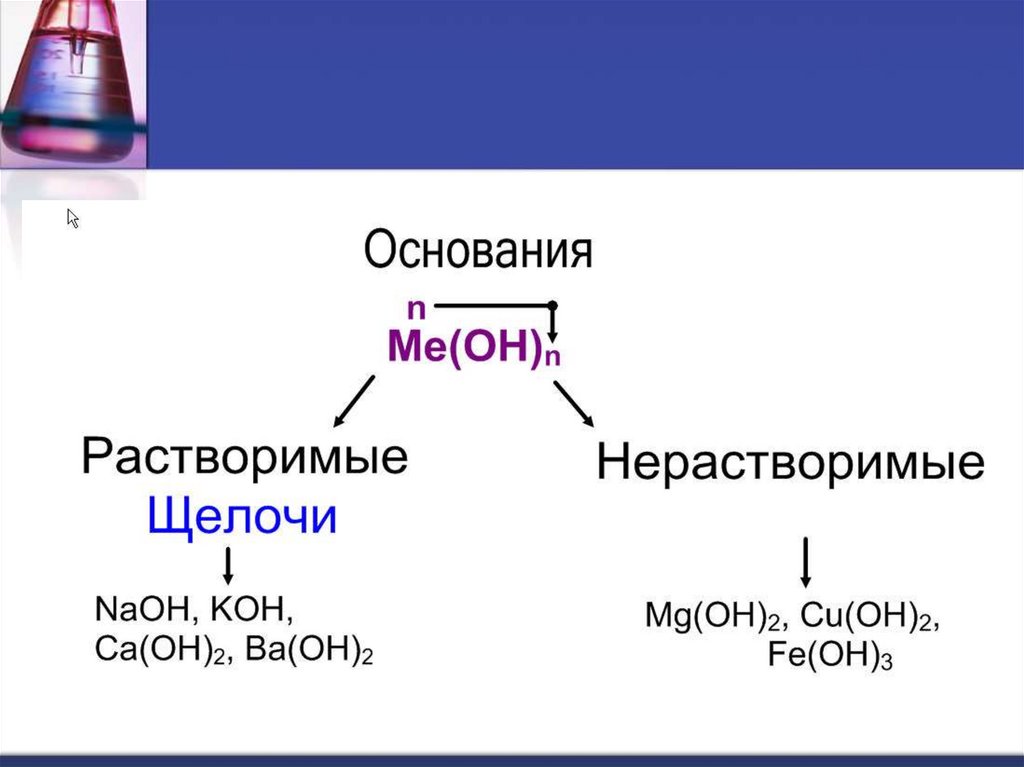
Щелочи образуютметаллы, стоящие в IA и
IIA группах (кроме Be и
Mg) Периодической
таблицы химических
элементов Д.И.
Менделеева.
!Щелочи – это едкие
вещества. При работе с
ними необходимо
соблюдать осторожность!
7.
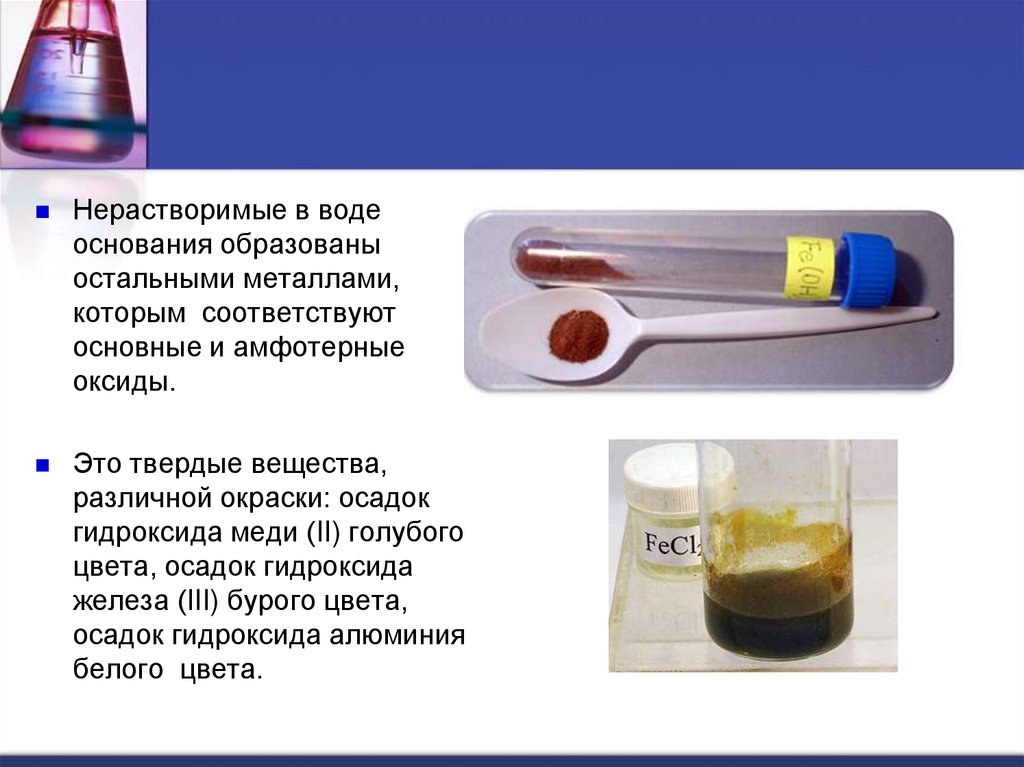
Нерастворимые в водеоснования образованы
остальными металлами,
которым соответствуют
основные и амфотерные
оксиды.
Это твердые вещества,
различной окраски: осадок
гидроксида меди (II) голубого
цвета, осадок гидроксида
железа (III) бурого цвета,
осадок гидроксида алюминия
белого цвета.
8. Получение оснований
Растворимых (щелочей)Нерастворимых
1. Активный металл + вода =
щелочь + водород
2Na + 2H2O = 2NaOH + H2
Соль 1 (в растворе) + щелочь =
нерастворимое основание +
другая соль 2
(В состав соли 1 должен входить
металл, способный
образовывать нерастворимое
основание)
2. Оксид активного металла +
вода = щелочь
CaO + H2O = Ca(OH)2
3. Электролиз растворов
хлоридов активных
металлов
CuCl2+ 2KOH = Cu(OH)2 +2KCl
- Реакция ионного обмена!
9.
10.
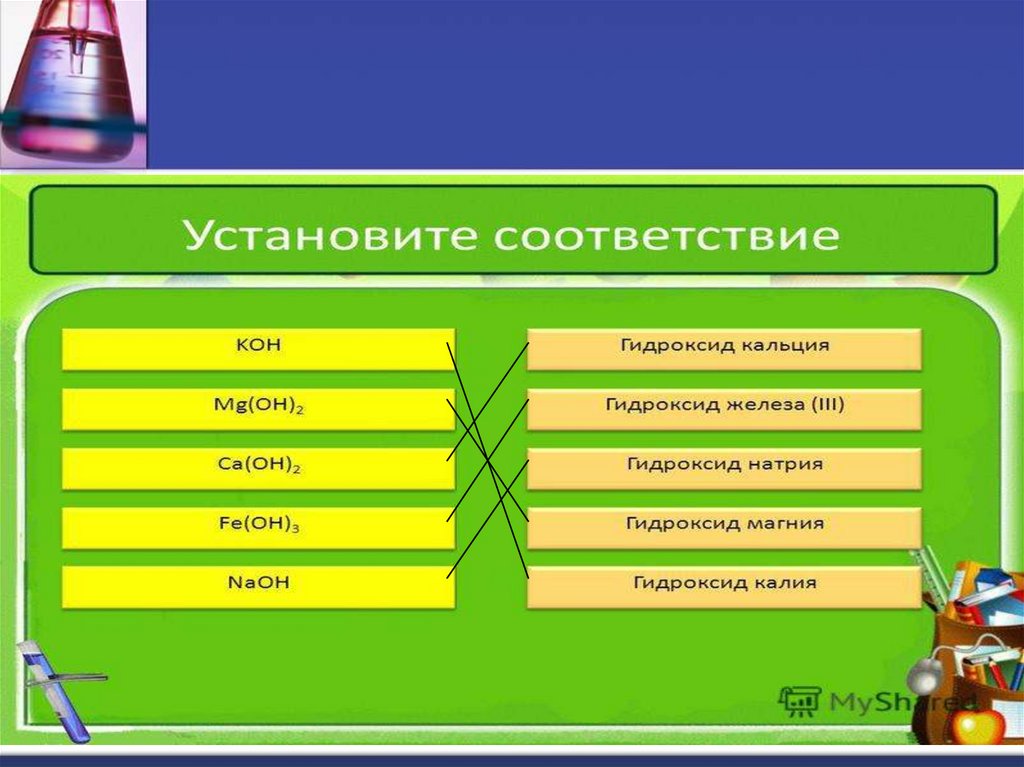
Напишите формулыоснований:
а) гидроксид калия
б) гидроксид марганца(II)
в) гидроксид кальция
г) гидроксид алюминия
д) гидроксид магния
е) гидроксид меди (II)
ж) гидроксид натрия
з) гидроксид железа (II)
и) гидроксид цинка
к) гидроксид железа (III)
Назовите гидроксиды,
формулы которых:
а) Mg(OH)2
б) Ca(OH)2
в) KOH
г) Zn(OH)2
д) CuOH
е) Cr(OH)3
ж) Fe(OH)3
з) Mn(OH)2
и) Al(OH)3
к) NaOH
11. Химические свойства
Растворимые основания (щелочи)Нерастворимые основания
1.Взаимодействие оснований с
кислотами:
1.Взаимодействие оснований с
кислотами
NaOH + HCl → NaCl + H2O
Сu(OH)2 + 2 HCl → CuCl2 + 2H2O
2. При нагревании не разлагаются.
2. При нагревании разлагаются
Cu(OH)2 → CuO + H2O
3. Реагируют с кислотными оксидами 3. С кислотными оксидами не
реагируют.
2KOH + CO2→ K2CO3 + H2O
12.
Реакция междудвумя сложными
веществами при которой они
обмениваются своими составными
частями называется реакцией обмена.
Реакция обмена между кислотой и
основанием, в результате которой
образуется соль и вода, называется
реакцией нейтрализации.
13. Химические свойства
4. Реагируют с растворами солей (еслив их состав входит металл, способный
образовывать нерастворимое
основание)
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
5. Действуют на индикаторы.
4. Реакции с растворами кислот не
характерны.
14. Изменение цвета различных индикаторов
15.
16.
Задание 1.Напишите уравнения реакций оснований с кислотами
LiOH + H3PO4 →
Ba(OH)2 + HNO3 →
Fe(OH)2 + HCl →
Задание 2.
Какие основания реагируют с кислотными оксидами? Напишите
уравнения возможных реакций.
а) NaOH + SO3 →
б) Cu(OH)2 + SiO2→
в) Fe(OH)3 + CO2 →
г) Ca(OH)2 + CO2 →
д) KOH + SiO2 →
е) NaOH + P2O5 →
17.
Домашнее задание.- Читать § 41, 42.
- нарисовать таблицу индикаторов;
- сделать карточку на картоне по
химическим реакциям
- Тестовые задания (стр.145)













 chemistry
chemistry








