Similar presentations:
Первый закон термодинамики
1.
2.
Первый закон термодинамикиПервый закон термодинамики устанавливает эквивалентность при взаимных
превращениях механической и тепловой энергии и математически может быть
выражен следующим образом:
Q=L,
где Q – количество теплоты, превращенной в работу; L – работа, полученная за
счет теплоты Q.
В СИ все виды энергии, в том числе работа и теплота, измеряются в джоулях.
Единица мощности ватт (Вт) соответствует работе 1 Дж в 1 сек (Дж/сек).
3.
В понятие внутренней энергии включают для идеальныхгазов кинетическую энергию движения молекул и энергию
колебательных движений атомов в молекуле, а для реальных
газов еще дополнительно и потенциальную составляющую
энергии, связанную с наличием сил взаимодействия между
молекулами и зависящую от расстояния между ними.
4.
Полная внутренняя энергияПолная внутренняя энергия будет являться функцией
параметров, и в данном состоянии тела будет иметь вполне
определенную величину:
u=f(T, υ); u=φ(T, p); u=ψ(p, υ) .
[U]=Дж;
[u]=Дж/кг.
5.
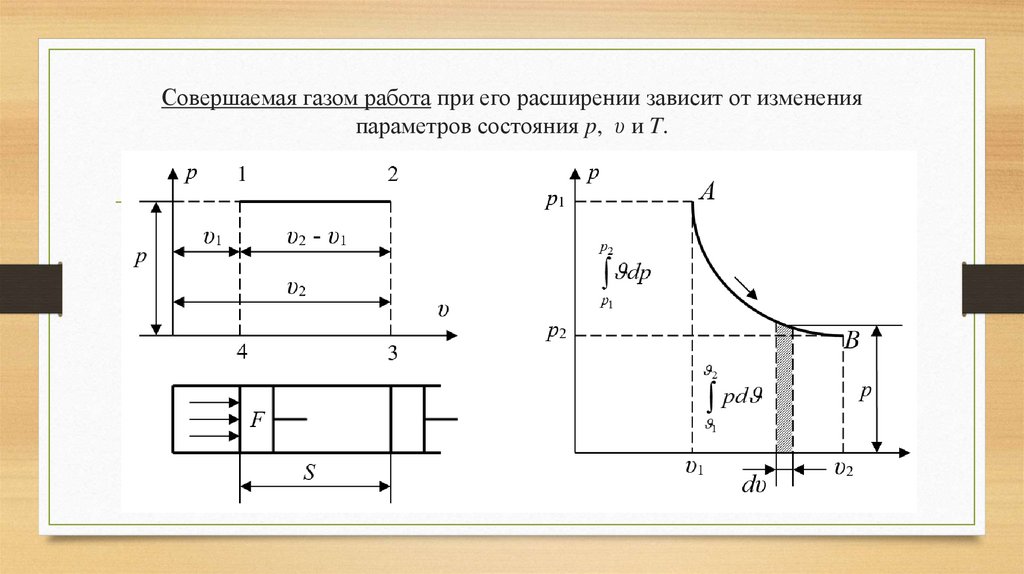
Совершаемая газом работа при его расширении зависит от измененияпараметров состояния p, υ и T.
6.
7.
8.
9.
10.
Энтальпия газовУдельная энтальпия, т. е. энтальпия, отнесенная к 1 кг,
обозначается буквой i и представляет собой по определению
сложную функцию вида:
11.
12.
13.
Термодинамические процессыидеальных газов
14.
Основные термодинамические процессы15.
Изохорный процесс16.
17.
Изобарный процесс18.
19.
20.
Изотермический процесс21.
22.
23.
Адиабатный процесс24.
25.
26.
Отношение температур заменяем отношением объемов и давлений:27.
28.
Политропный процессУсловились всякий процесс идеального газа, в котором теплоемкость
является постоянной величиной, называть политропным процессом, а
линию процесса - политропой.
Из определения политропного процесса следует, что основные
термодинамические
процессы
-
изохорный,
изобарный,
изотермический и адиабатный, если они протекают при постоянной
теплоемкости, являются частными случаями политропного процесса.
29.
Теплоемкость политропного процесса сп может принимать самыеразнообразные положительные и отрицательные значения от +∞ до ∞.
Количество теплоты, участвующее в политропном процессе, может
быть выражено произведением теплоемкости процесса сп на разность
температур t2-t1 в конечном и начальном состояниях:
30.
31.
Зависимости между начальными и конечнымипараметрами процесса:

































 physics
physics








