Similar presentations:
Redoxreaktionen
1.
Redoxreaktionen2.
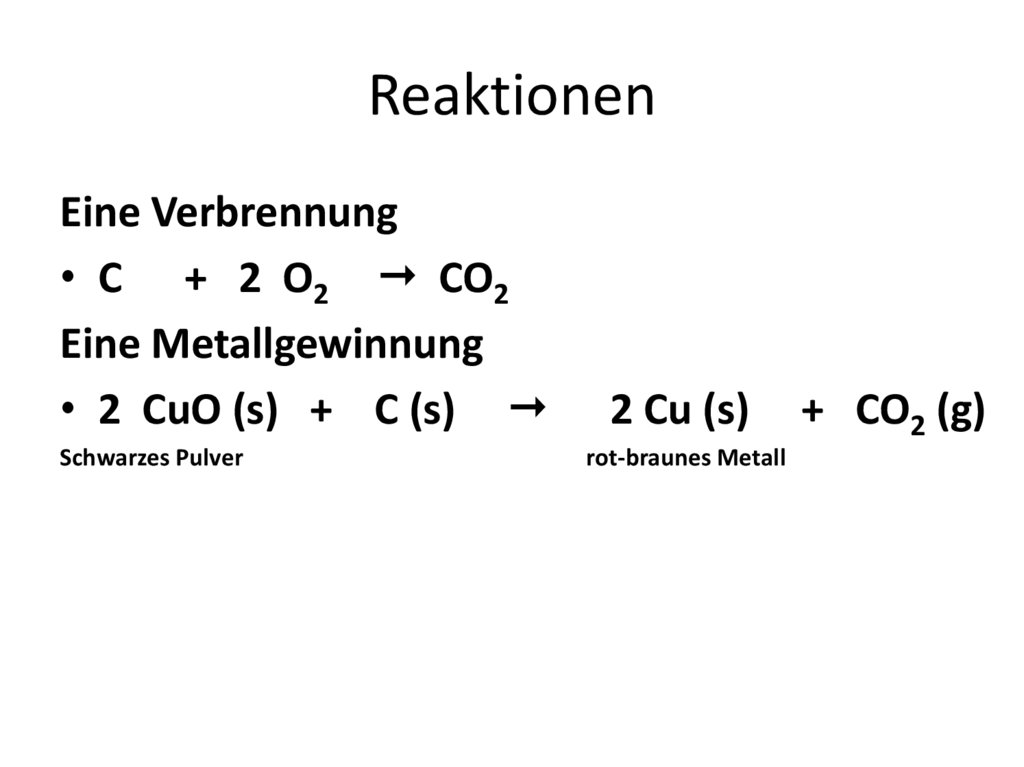
ReaktionenEine Verbrennung
• C + 2 O2 CO2
Eine Metallgewinnung
• 2 CuO (s) + C (s)
Schwarzes Pulver
2 Cu (s)
rot-braunes Metall
+ CO2 (g)
3.
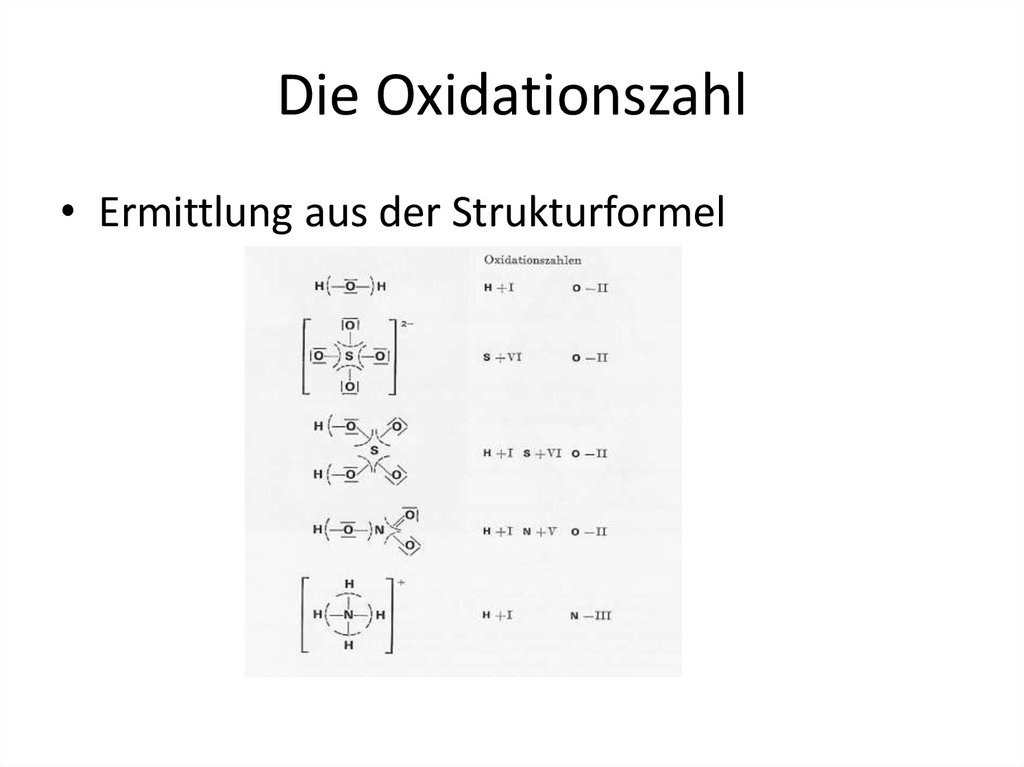
Die Oxidationszahl• Ermittlung aus der Strukturformel
4.
Oxidationszahl –Regeln für anorganische Stoffe
Verbindungen
OZ
1. In Elementverbindungen wie H2, N2, F2, usw.
0
2. Die Summe der Oxidationszahlen in einer neutralen Verbindung
0
3. Die Summe der Oxidationszahlen entspricht bei Ionen ihrer Ladung
4. Der elektronegativere Bindungspartner erhält die negative OZ
5. Bei Molekülen aus gleichen Atomen wird das bindende Elektronenpaar
homolytisch gespalten
6. Metalle haben immer positive OZ
7. Alkalimetalle
+I
8. Erdalkalimetalle
+ II
9. Wasserstoff (Ausnahme: Hydride)
+ I (-I)
10. Fluor
-I
11. Chlor, Brom, Iod;
in Verbindung mit O
12. Sauerstoff (Ausnahme: Peroxide)
-I,
≥ +I
- II (-I)
5.
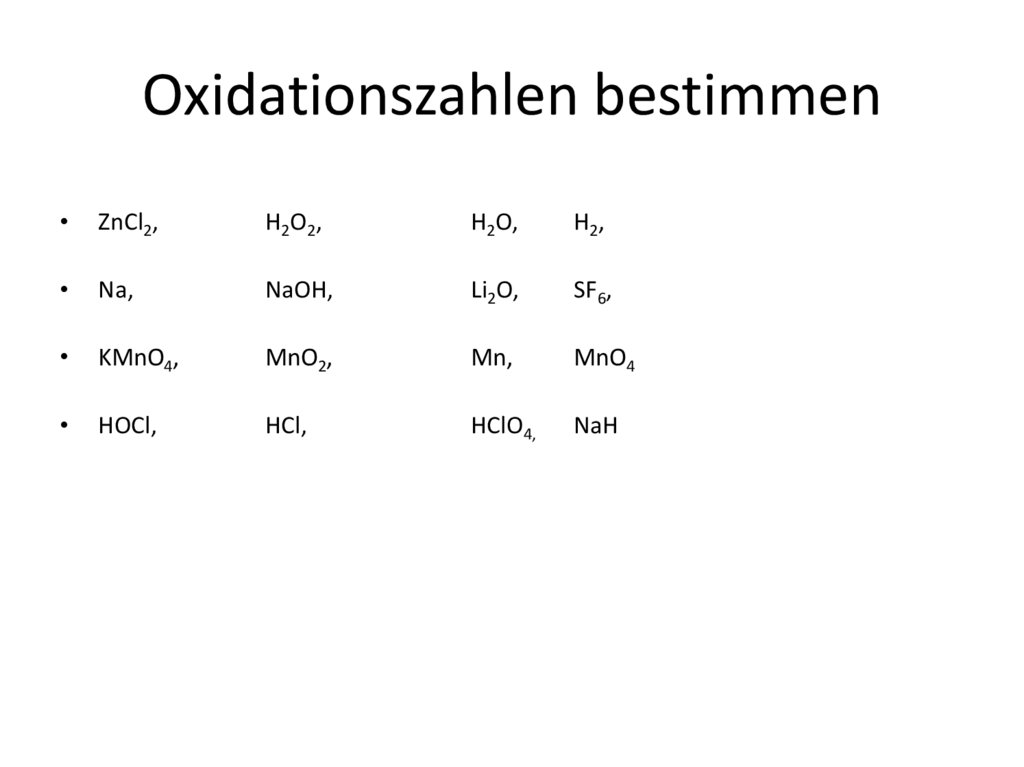
Oxidationszahlen bestimmenZnCl2,
H2O2,
H2O,
H2,
Na,
NaOH,
Li2O,
SF6,
KMnO4,
MnO2,
Mn,
MnO4
HOCl,
HCl,
HClO4,
NaH
6.
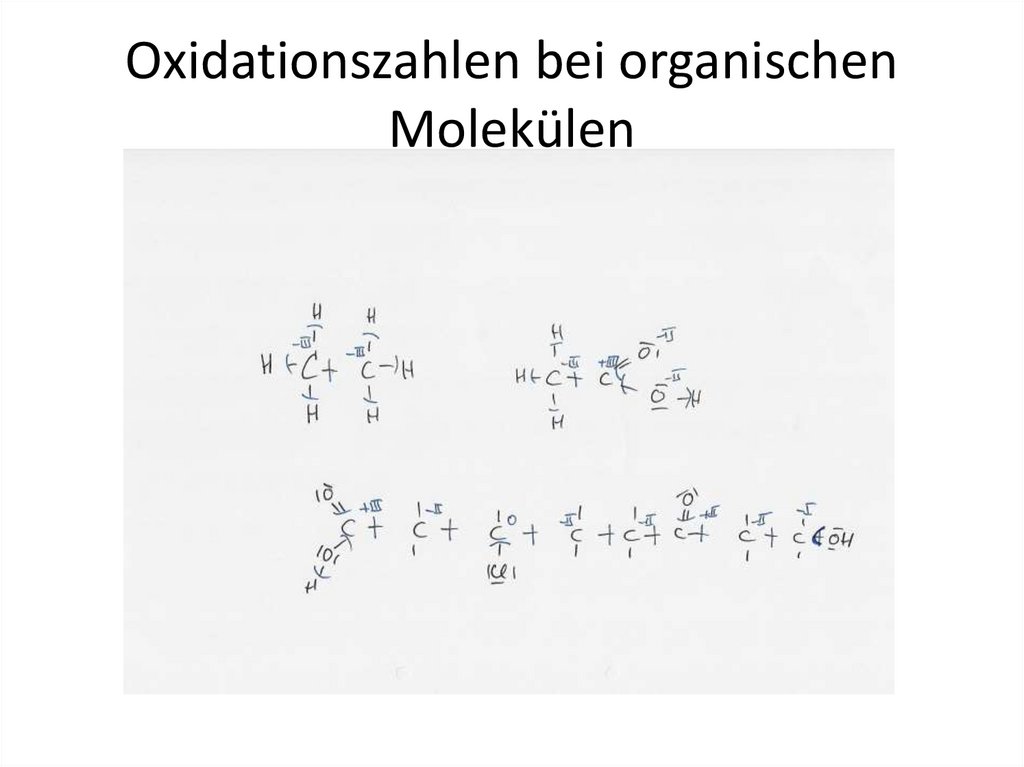
Oxidationszahlen bei organischenMolekülen
7.
Redoxgleichungen+ II -II
2 CuO (s)
+
0
C (s)
0
2 Cu (s)
+IV -II
+ CO2 (g)
Die Aufnahme von Elektronen heißt "Reduktion". (Tipp: hierbei wird die OZ kleiner)
Die Abgabe von Elektronen heißt ""Oxidation". (Tipp: hierbei wird die OZ größer)
Eine derartige Reaktion kann nur stattfinden, wenn ein Stoff als "Elektronendonator"
und der andere Stoff als "Elektronenakzeptor" funktioniert.
"konjugierte Redoxpaare".
2 CuO (s)
+
C (s)
2 Cu (s)
+ CO2 (g)
8.
Redoxgleichungen• Der Elektronendonator heißt Reduktionsmittel und gibt
Elektronen ab; das Reduktionsmittel kann andere Stoffe
reduzieren und wird selbst oxidiert.
• Der Elektronenakzeptor heißt "Oxidationsmittel" und nimmt
Elektronen auf; das Oxidationsmittel kann andere Stoffe
oxidieren und wird selbst reduziert.




 chemistry
chemistry


