Similar presentations:
Proteomic and Bioinformatics Analyses of Mouse Liver Microsomes
1.
Исследование статьиProteomic and Bioinformatics Analyses of Mouse Liver
Microsomes
Fang Peng, Xianquan Zhan, Mao-Yu Li, Fan Fang, Guoqing
Li, Cui Li, Peng-Fei Zhang, and Zhuchu Chen
2012
Докладчик: студентка 4 курса гр. 09-01
специальность биоинженерия и биоинформатика
Михайловская Анастасия Игоревна
2.
Цели и задачиЦель: систематически идентифицировать белковые компоненты
микросом печени, провести функциональную аннотацию с
биоинформационным анализом и дать представление о
биологических функциях печени.
Задачи: преодолеть низкую эффективность разделения мембранных
белков.
3.
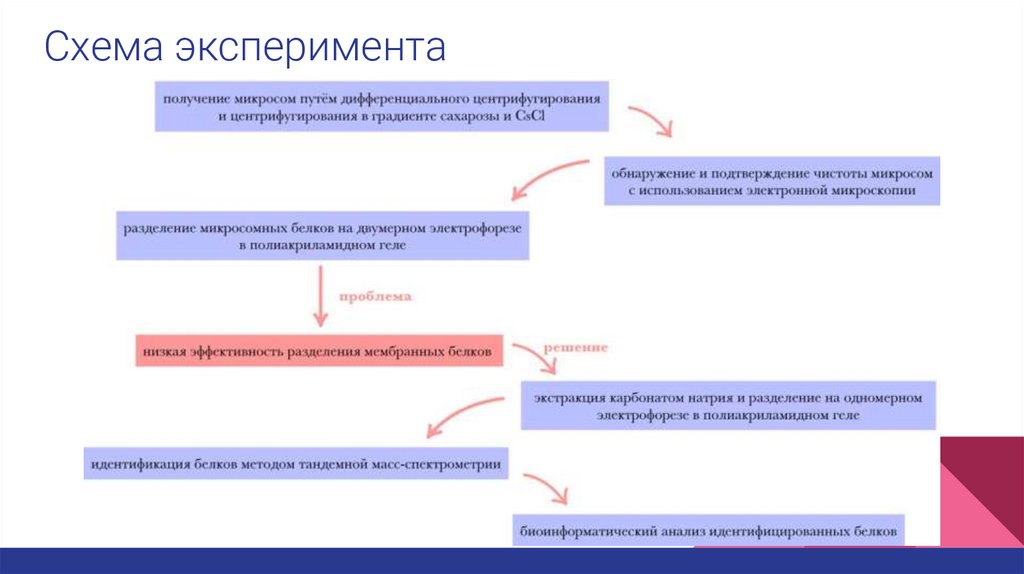
Схема эксперимента4.
Методы● центрифугирование
● центрифугирование в градиенте сахарозы
● электрофорез в полиакриламидном геле, двумерный и
одномерный
5.
ЦентрифугированиеРеактивы: измельченная и обескровленная печень (примерно 10г),
охлажденная среда для гомогенизации (0,25 М сахароза, рН 7,4)
гомогенизация
I
гомогенизация
II
TAMATO
центрифугировани
е
I
HITACHI
центрифугировани
е
II
Beckman
Instruments
центрифугировани
е
III
Beckman
Instruments
t
5-10 минут
30-60 секунд
10 минут
I 30 минут
II 30 минут
I 30 минут
II 1 час
RCF
RPM
перемешивали
вручную
1,000 rpm × 3
1,500 rpm × 3
1,000g
I 3,000g
II 8,000g
I 34,000g
II 130,000g
Результат: получение “легких” микросом
6.
Центрифугирование в градиенте сахарозыРеактивы: розовый осадок от
предыдущего центрифугирования,
52% сахароза-0.1 M H3PO4 бафер (pH
7.1), плотность сахарозы доводили до
43,7%. Фракцию помещали в одну
пробирку, последовательно
накладывали 7 мл, 5 мл, 5 мл и 6 мл
38,7%, 36,0%, 33,0% и 29,0% сахарозы.
Ротор type 70i.
Результат: получение “тяжелых”
микросом
7.
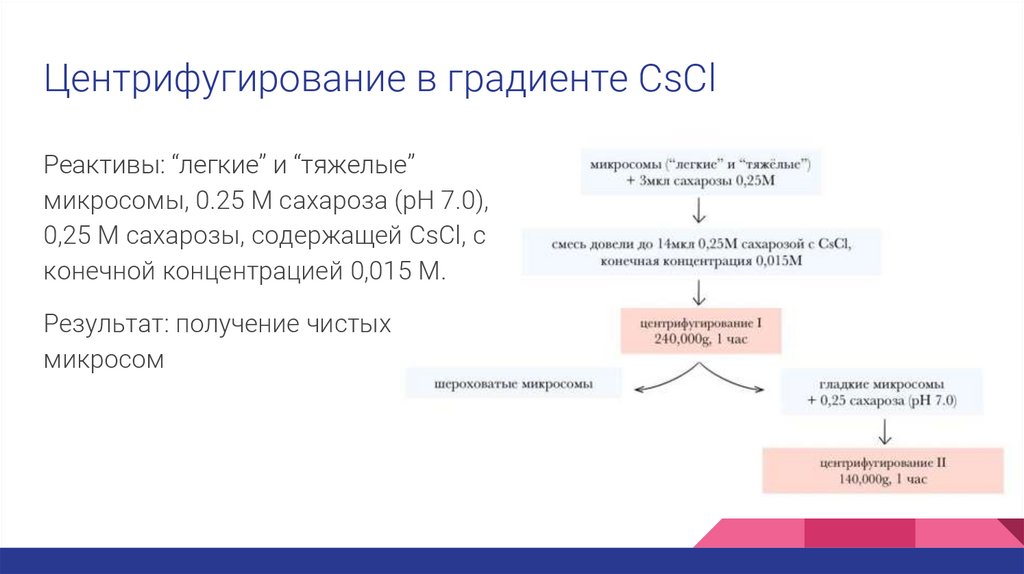
Центрифугирование в градиенте CsClРеактивы: “легкие” и “тяжелые”
микросомы, 0.25 M сахароза (pH 7.0),
0,25 М сахарозы, содержащей CsCl, с
конечной концентрацией 0,015 М.
Результат: получение чистых
микросом
8.
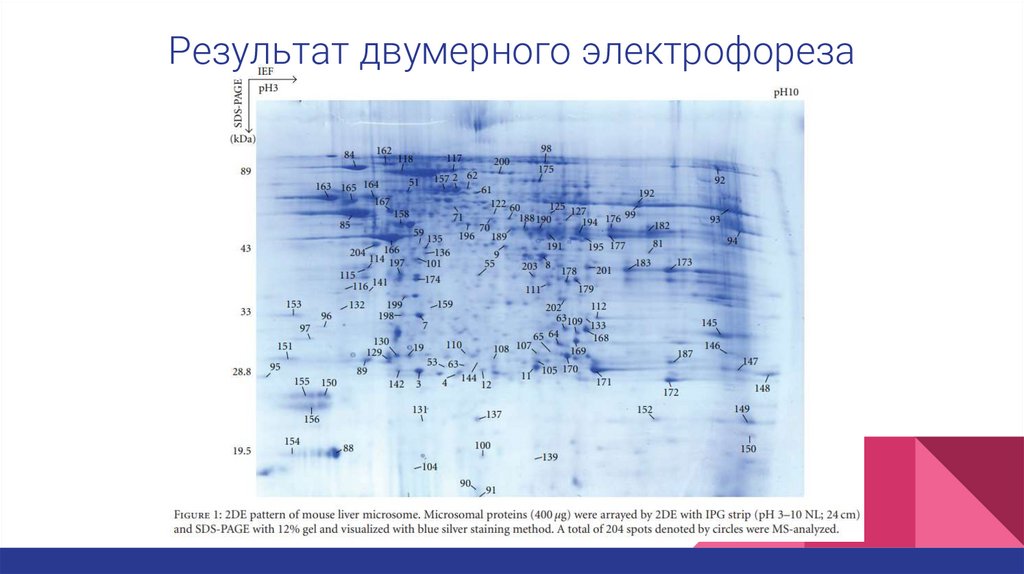
Двумерный электрофорезРеактивы: микросомные белки (400мкг), регидратационный раствор ( 7М
мочевина, 2М тиомочевина, 0,2% DTT, 0,5% pH3–10 NL IPG буфер,
бромфеноловый синий), стрипы IPG (pH 3–10 NL; 24 cm), 12% гель.
Белки фокусировали последовательно (1ч при 500В, 1ч при 1000В и 8,5ч при
8000В). После фокусирования проводили SDS-PAGE с 12% гелем на системе
Ettan DALT II. Для визуализации использовали метод окрашивания серебром.
9.
Результат двумерного электрофореза10.
11.
Одномерный электрофорезРеактивы: белки мембран микросом, 100
мM Na2CO3, (рН 11,5), денатурирующий
буфер (5% меркаптоэтанол, 2% SDS, 0.06M
Tris-HCl, pH 6.8, 10% глицерол),12% гель,
Coomassie Brilliant Blue G.
Электрофорез проводили при 80В в
течение 20 мин, затем при 100В в течение
2 часов. Гели визуализировали с
помощью Coomassie Brilliant Blue G
12.
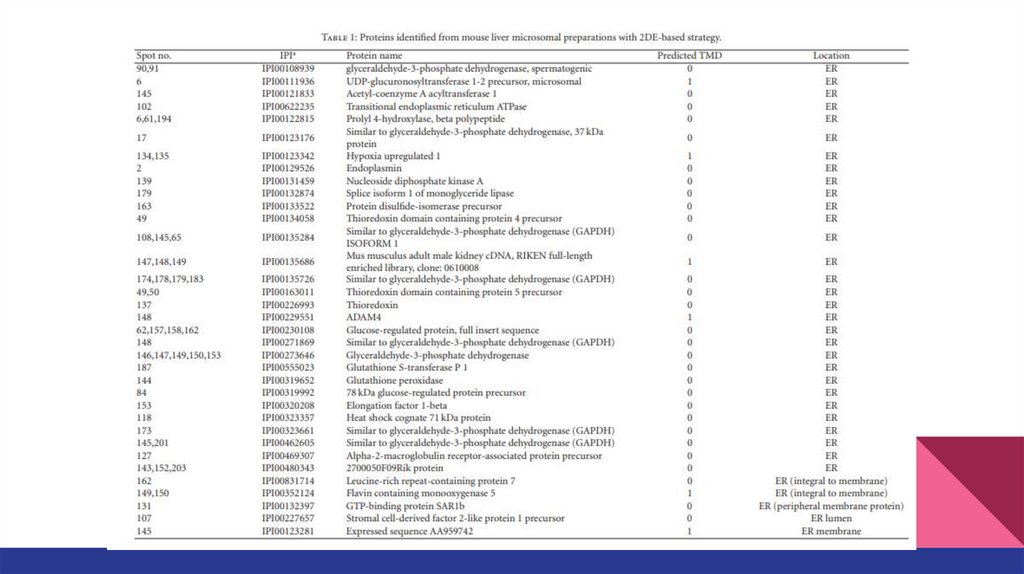
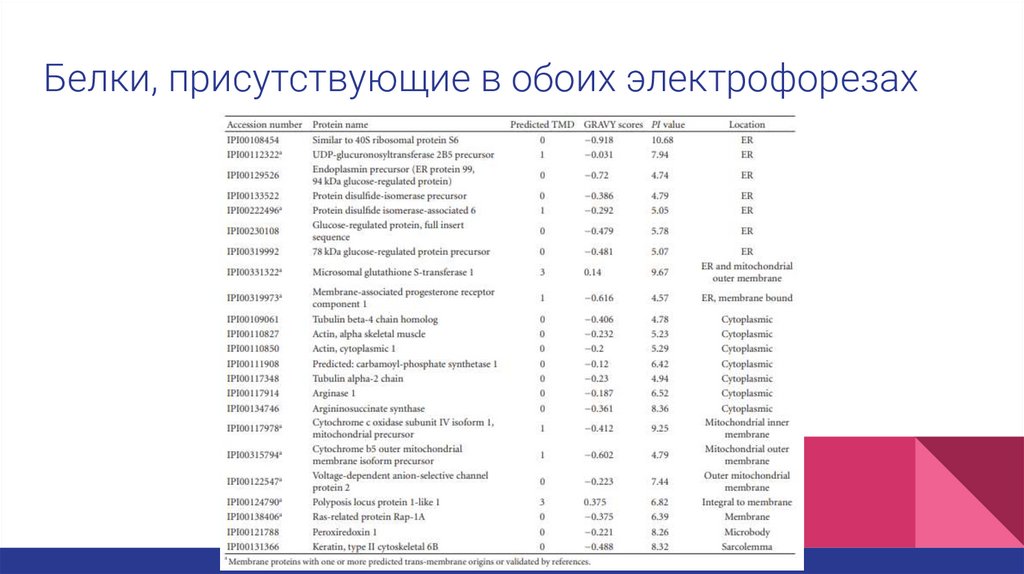
Белки, присутствующие в обоих электрофорезах13.
Выводы1. Комбинация одномерного и двумерного электрофорезов была более
эффективной для анализа микросом
2. Получение микросом печени было оптимизировано
3. Статья является важным справочным материалом для последующего
анализа микросомных белков, связанных с заболеванием печени
14.
Литература1.
Fang Peng, Xianquan Zhan, Mao-Yu Li, Fan Fang, Guoqing
Li, Cui Li, Peng-Fei Zhang, and Zhuchu Chen. Proteomic
and Bioinformatics Analyses of Mouse Liver Microsomes.
International Journal of Proteomics, 2012









 medicine
medicine








