Similar presentations:
Электролиз воды: применение для получения водорода как топлива
1. Тема урока: Электролиз воды: применение для получения водорода как топлива.
Цель обучения:-понять суть электролиза воды и его
потенциальную значимость, как источника
водородного топлива
2. Критерии оценивания:
• объясняют протекание процессов электролиза;• объясняет значение топливного элемента.
Электролиз воды
https://bilimland.kz/ru/subject/ximiya/10-klass/ehlektroliz-rastvorovsolej?mid=eabf52d1-9ee4-11e9-a361-1f1ed251dcfe
3. Электролиз воды
https://www.youtube.com/watch?v=Le3Jxjx7ABsЭлектролиз воды
Электролиз воды
4. Активити 1 Графический диктант T/F
Утверждения1.Электролизом можно считать окислительно-восстановительную
реакциию, происходящую под воздействием электрического тока.
2.Катод – отрицательно заряженный электрод.
3.На катоде происходит процесс электрохимического окисления.
4.Анион SO42- будет окисляться на аноде в вводом растворе.
5.Анион Cl -будет окисляться на аноде в вводом растворе.
6.Катион Na будет восстанавливаться на катоде в водном растворе.
7.Катион Cu будет восстанавливаться на катоде в водном растворе.
8. При электролизе раствора NaCl можно получить щелочь NaOH и
газы H2 и Cl2.
T/F
5. 1 да 2 да 3 нет 4нет 5да 6 нет 7да 8да
Дескрипторы:находит верные и ложные утверждения о
процессе электролиза и его продуктах.
6.
7. Вода
• Вода - очень слабый электролит. Оночень слабо ионизируется с
образованием ионов водорода и
гидроксид-ионов.
• H2O(l)
↔
H+(aq) + OH-(aq)
• Поэтому растворы всегда содержат
ионы H + и OH-.
8. Просмотр видео
«Электролиз воды» (общая химия – химия иокружающая среда – электролиз – электролиз воды)
https://bilimland.kz/ru/subject/ximiy
a/10-klass/ehlektroliz-rastvorovsolej?mid=eabf52d5-9ee4-11e9a361-1f1ed251dcfe
9. Водород – идеальное топливо
• химически активный• экологически чистый – при его окислении образуется
вода
• удовлетворяет условию легкого подвода в топливный
элемент и отвода продуктов реакции из ТЭ
• оптимальный источник – вода, электролизом которой
Н2 может быть получен (процесс энергоемкий)
• сейчас водород получают за счет более дешевой
переработки природного газа, основным
компонентом которого является метан
СН4 + Н2О(пар) = 3Н2 + СО
9
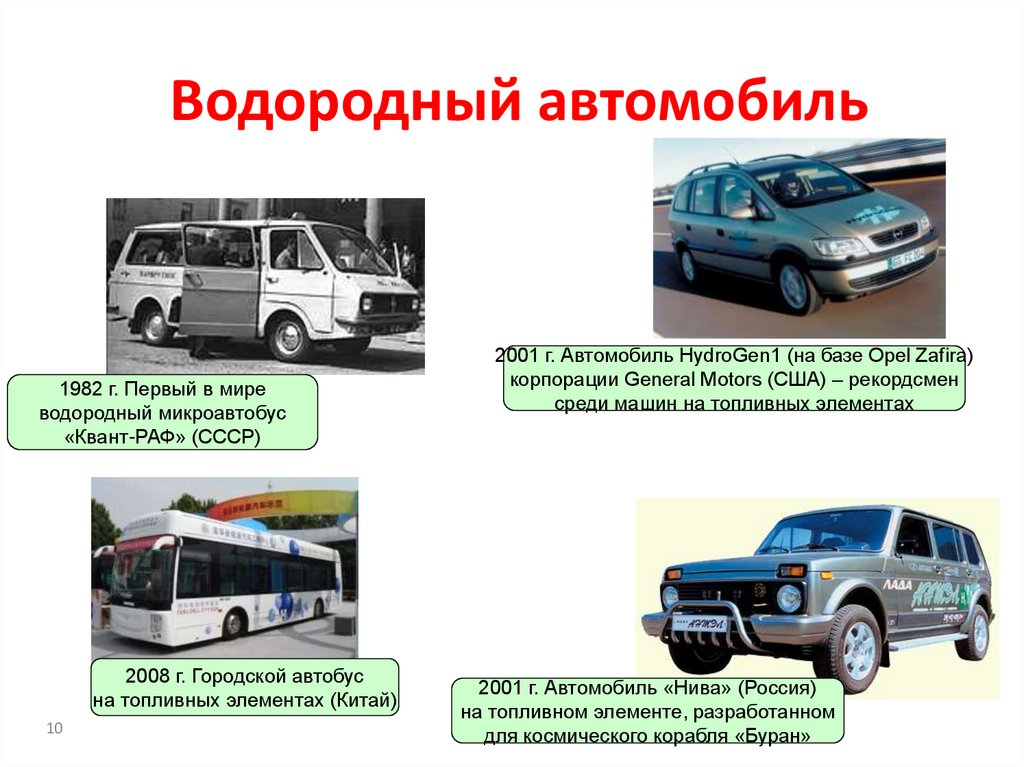
10. Водородный автомобиль
1982 г. Первый в миреводородный микроавтобус
«Квант-РАФ» (СССР)
2008 г. Городской автобус
на топливных элементах (Китай)
10
2001 г. Автомобиль HydroGen1 (на базе Opel Zafira)
корпорации General Motors (США) – рекордсмен
среди машин на топливных элементах
2001 г. Автомобиль «Нива» (Россия)
на топливном элементе, разработанном
для космического корабля «Буран»
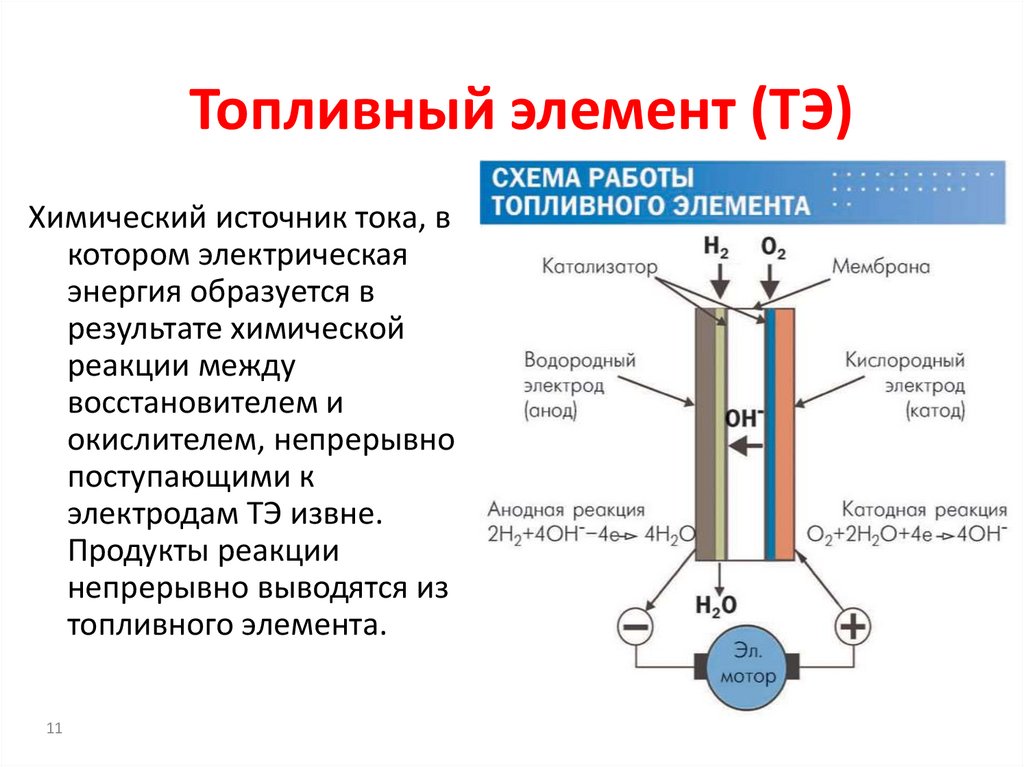
11. Топливный элемент (ТЭ)
Химический источник тока, вкотором электрическая
энергия образуется в
результате химической
реакции между
восстановителем и
окислителем, непрерывно
поступающими к
электродам ТЭ извне.
Продукты реакции
непрерывно выводятся из
топливного элемента.
11
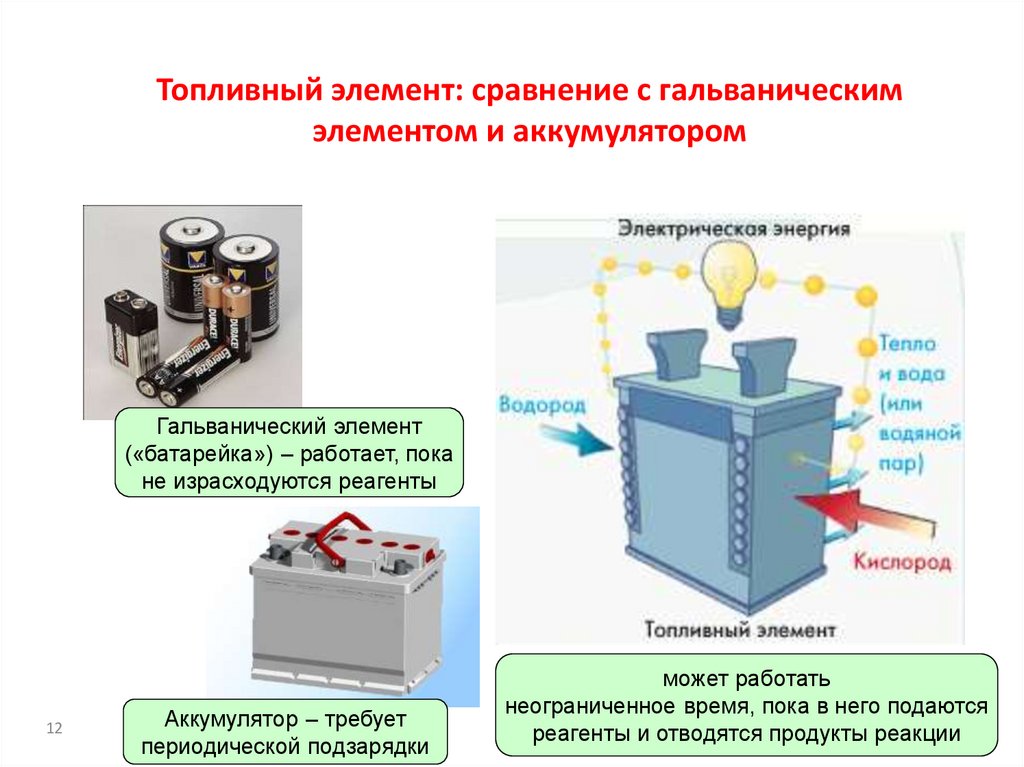
12. Топливный элемент: сравнение с гальваническим элементом и аккумулятором
Гальванический элемент(«батарейка») – работает, пока
не израсходуются реагенты
12
Аккумулятор – требует
периодической подзарядки
может работать
неограниченное время, пока в него подаются
реагенты и отводятся продукты реакции
13. Преимущества топливных элементов
• высокий коэффициент полезного действия• экологическая чистота
• бесшумность
• широкий диапазон мощностей и применяемого
топлива
• возможность параллельной генерации тепла
• при необходимости можно использовать воду,
которая является продуктом химической реакции
13
14. Проблемы коммерциализации ТЭ
• высокая стоимость по сравнению страдиционными установками
• недостаточный срок службы
14
15.
• С:• 1 При электролизе расплава 25,98 г иодида
щелочного металла на аноде выделилось12,7
г йода. Иодид какого именно металла был
взят ?
• 2. При электролизе водного раствора
сульфата никеля( II) на катоде получили
никель массой 177 г, выход которого
составил 75%. Какой объем кислорода (н.у.)
выделится при этом на аноде?














 chemistry
chemistry








