Similar presentations:
Химическая энергия
1. Химическая энергия
В.В. ЕреминХимический факультет МГУ
2. Основные темы
21.
Энергия и формы ее передачи. Закон сохранения
энергии. Энергетические проблемы
человечества.
2.
Энергия химических связей. Термохимические
циклы.
3.
Химические источники тока. Топливные
элементы.
4.
Водород как основа энергетики будущего.
Водородные топливные элементы.
3. Энергия
Энергия – общая количественная мерадвижения и взаимодействия всех видов
материи
3
4. Закон сохранения энергии
1) Полная энергия изолированной системыпостоянна. Энергия не создается из ничего и
не исчезает в никуда.
2) Энергия может переходить из одной формы в
другую
Формы энергии:
механическая, электрическая, световая,
химическая и др.
4
5. Единицы энергии
В системе СИ единица энергии – джоуль (Дж).Много это или мало?
а) 1 Дж расходуется на одно сокращение сердечной мышцы.
б) 1 кВт ч = 3 600 000 = 3.6x106 Дж.
в) Чтобы расплавить кубик льда, необходимо 300 Дж.
г)
Чтобы вскипятить чайник объемом 1 л, необходимо
2 400 000 = 2.4x106 Дж = 0.7 кВт ч.
д) Человек за сутки в среднем потребляет около
10 000 000 = 107 Дж, то есть 3 кВт ч (или 4 чайника)
Несистемная единица – калория (кал).
1 кал требуется для нагревания 1 г воды на 1 градус
1 кал = 4.2 Дж
5
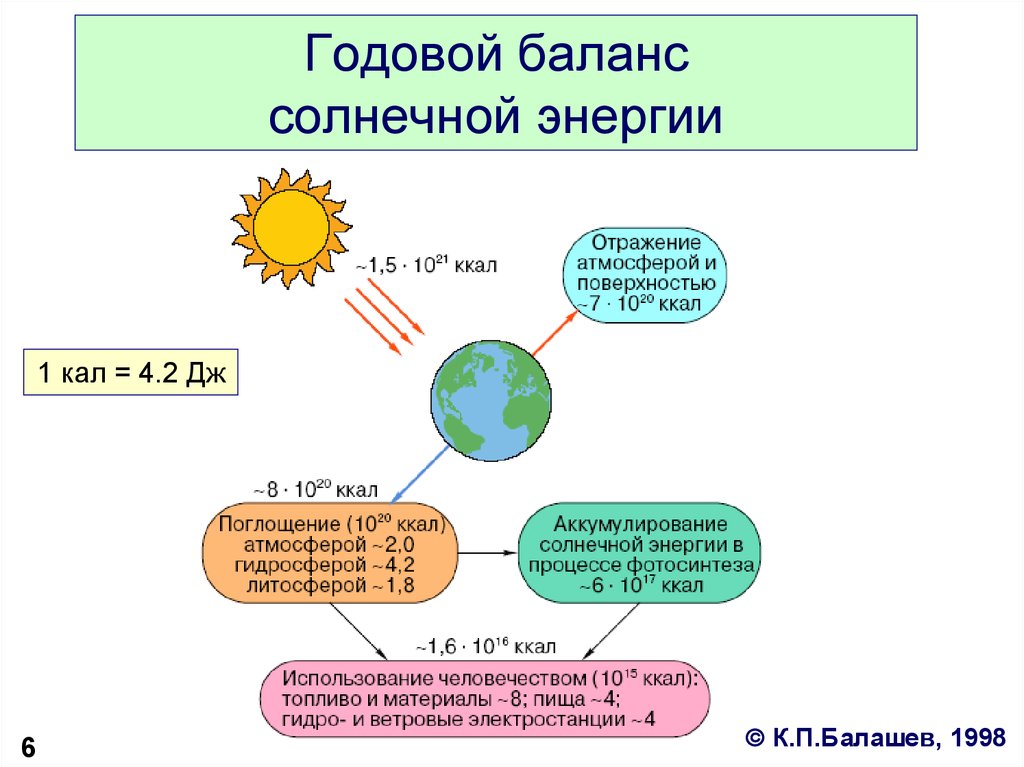
6. Годовой баланс солнечной энергии
1 кал = 4.2 Дж6
К.П.Балашев, 1998
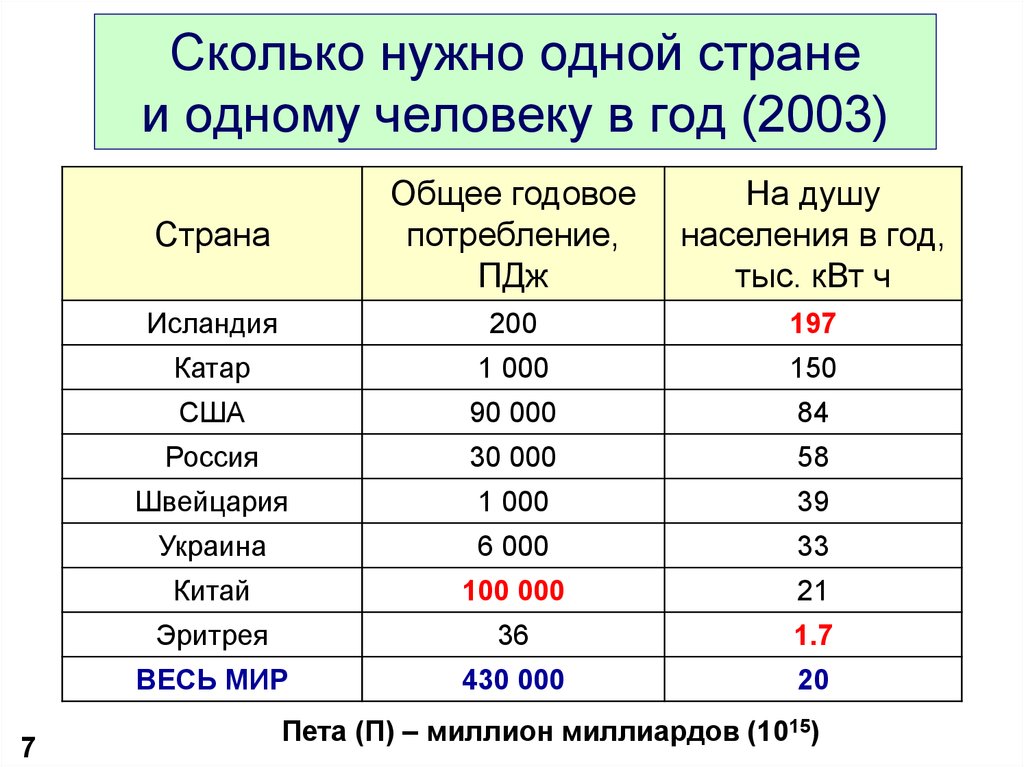
7. Сколько нужно одной стране и одному человеку в год (2003)
7Страна
Общее годовое
потребление,
ПДж
На душу
населения в год,
тыс. кВт ч
Исландия
200
197
Катар
1 000
150
США
90 000
84
Россия
30 000
58
Швейцария
1 000
39
Украина
6 000
33
Китай
100 000
21
Эритрея
36
1.7
ВЕСЬ МИР
430 000
20
Пета (П) – миллион миллиардов (1015)
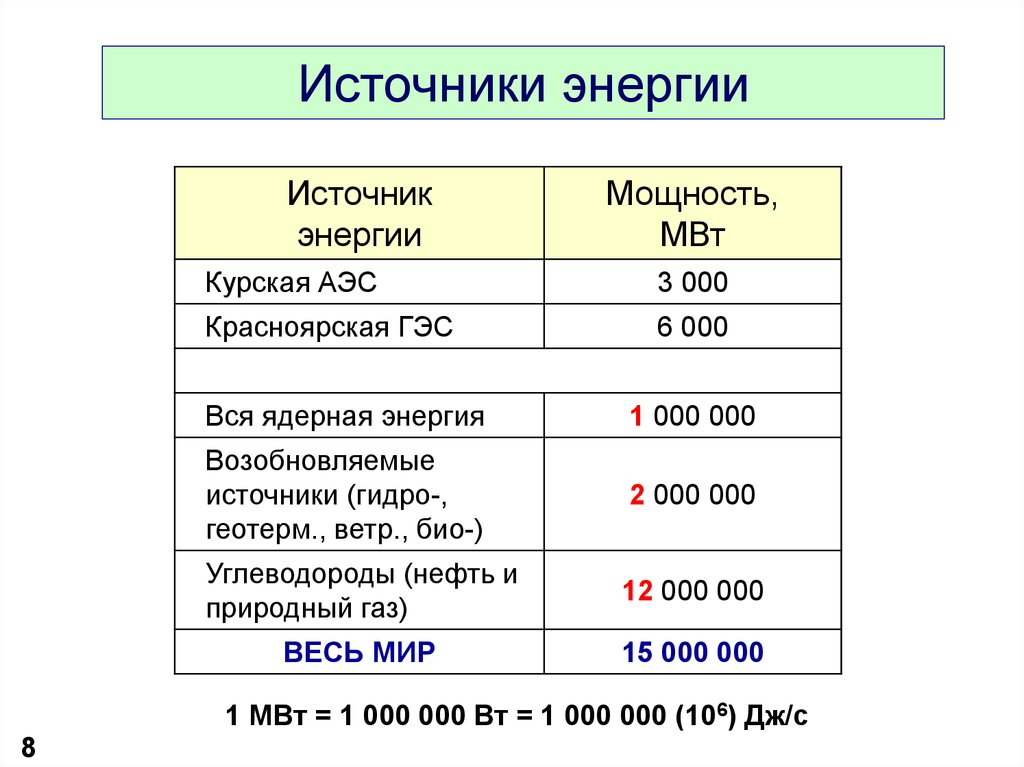
8. Источники энергии
Источникэнергии
Мощность,
МВт
Курская АЭС
3 000
Красноярская ГЭС
6 000
Вся ядерная энергия
1 000 000
Возобновляемые
источники (гидро-,
геотерм., ветр., био-)
2 000 000
Углеводороды (нефть и
природный газ)
12 000 000
ВЕСЬ МИР
15 000 000
1 МВт = 1 000 000 Вт = 1 000 000 (106) Дж/c
8
9. Формы передачи энергии
DU = Q – WПервый закон термодинамики
1) Теплота Q (неупорядоченная форма) – изменяется
только температура
2) Работа W (упорядоченная форма) – изменяются
внешние параметры: объем (мех.), заряд (электрич.),
количество вещества (хим.)
Теплота и работа НЕэквивалентны
В циклическом процессе теплоту нельзя
полностью превратить в работу
9
(Второй закон термодинамики)
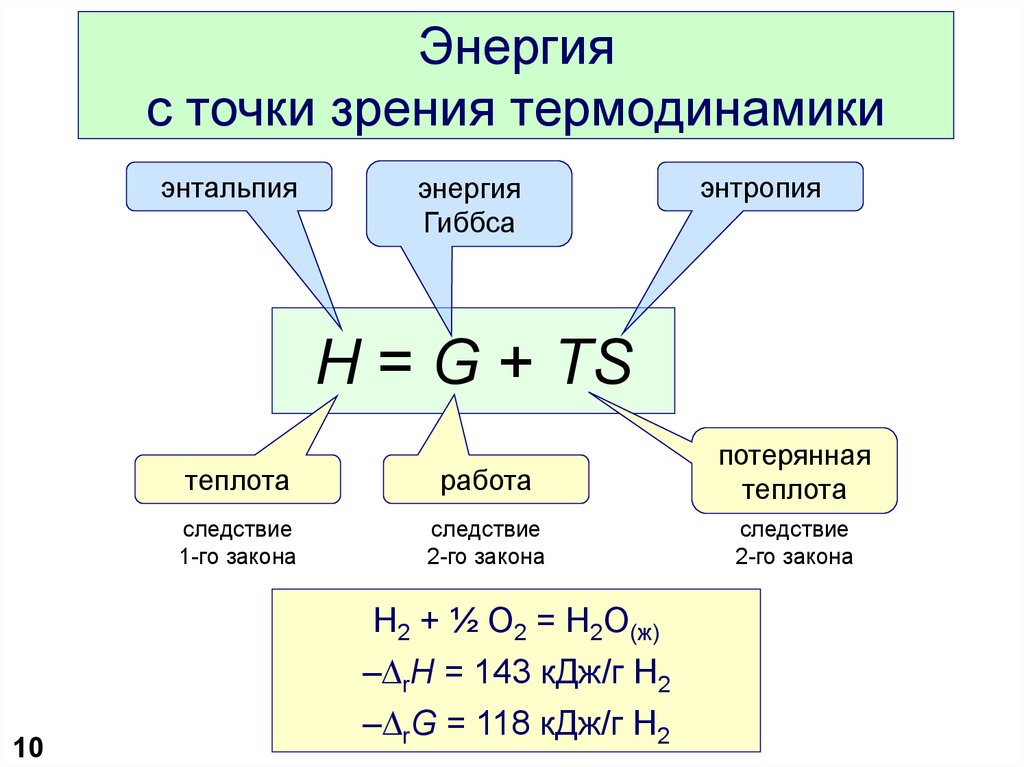
10. Энергия с точки зрения термодинамики
энтальпияэнергия
Гиббса
энтропия
H = G + TS
теплота
работа
потерянная
теплота
следствие
1-го закона
следствие
2-го закона
следствие
2-го закона
H2 + ½ O2 = H2O(ж)
10
–DrH = 143 кДж/г H2
–DrG = 118 кДж/г H2
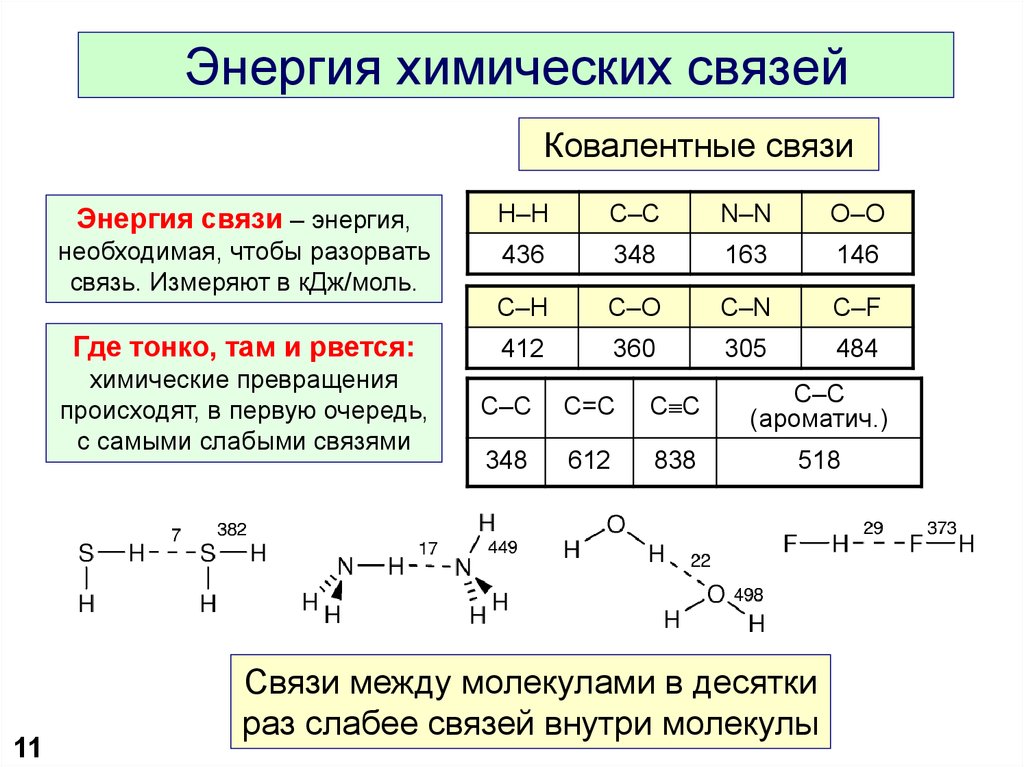
11. Энергия химических связей
Ковалентные связиЭнергия связи – энергия,
H–H
C–C
N–N
O–O
необходимая, чтобы разорвать
связь. Измеряют в кДж/моль.
436
348
163
146
C–H
C–O
C–N
C–F
412
360
305
484
Где тонко, там и рвется:
химические превращения
происходят, в первую очередь,
с самыми слабыми связями
11
C–C
C=C
C C
C–C
(ароматич.)
348
612
838
518
Связи между молекулами в десятки
раз слабее связей внутри молекулы
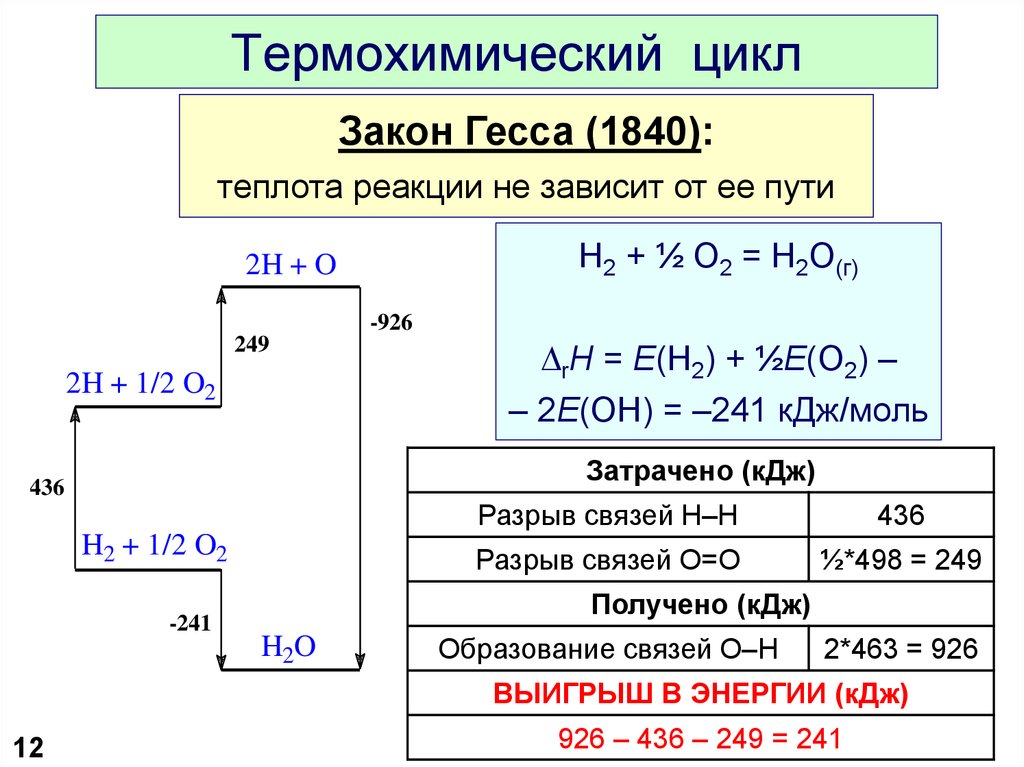
12. Термохимический цикл
Закон Гесса (1840):теплота реакции не зависит от ее пути
H2 + ½ O2 = H2O(г)
2H + O
-926
249
2H + 1/2 O2
DrH = E(H2) + ½E(O2) –
– 2E(OH) = –241 кДж/моль
Затрачено (кДж)
436
H2 + 1/2 O2
-241
Разрыв связей H–H
436
Разрыв связей O=O
½*498 = 249
Получено (кДж)
H2O
Образование связей O–H
2*463 = 926
ВЫИГРЫШ В ЭНЕРГИИ (кДж)
12
926 – 436 – 249 = 241
13. Хочу ездить на воздухе! Проект 1994 года
полныйбред!
13
14. Еще один бредовый проект
Намагничиватель топлива (США)Экономит до 25% топлива.
Устройство меняет молекулярную структуру топлива, в результате
отрицательно заряженные молекулы топлива и кислорода
притягиваются друг к другу, что увеличивает эффективность горения.
(Текст из рекламы товара)
Общие свойства российских лже-проектов
1) Самые популярные темы – изменение структуры воды или активация
того или иного вида топлива
2) Как правило, используются модные научные и псевдо-научные
термины: «резонанс», «кластер», «энергоинформационное
воздействие», «торсионные поля», «наноструктурированный»
3) Много пафоса, утверждается приоритет России.
4) Прогнозируется огромный экономический эффект, предлагаемое
средство обладает универсальным действием (лечит от всего и сразу)
5) Полностью игнорируются законы природы, особенно часто достается
законам сохранения – энергии и вещества.
14
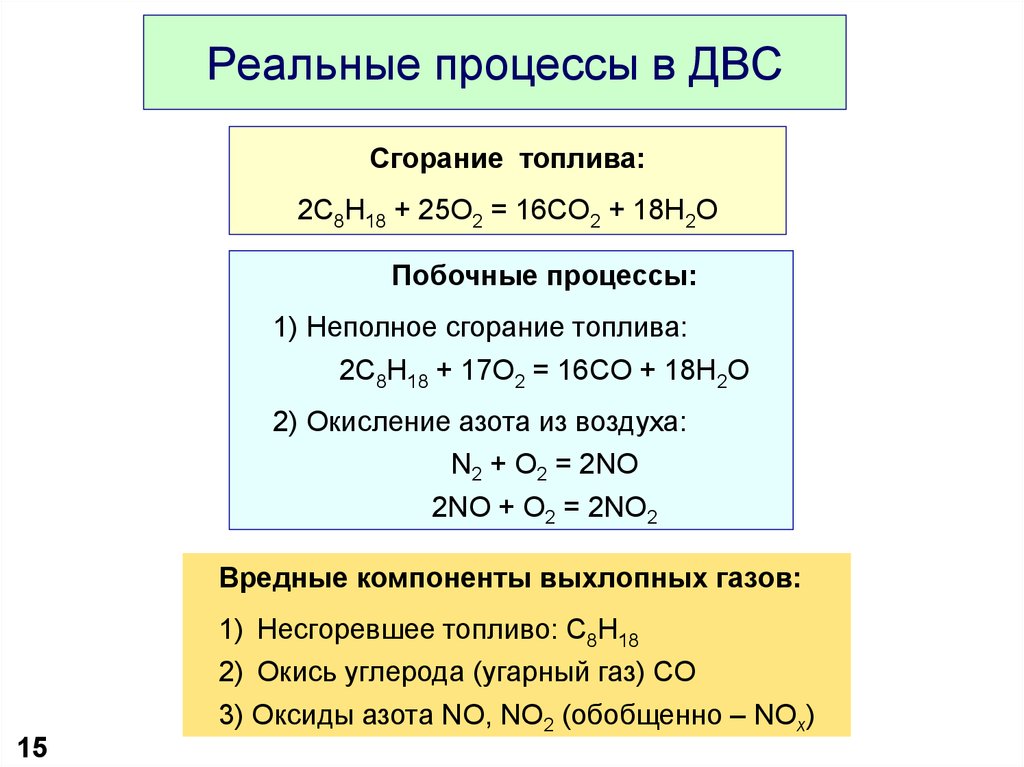
15. Реальные процессы в ДВС
Сгорание топлива:2C8H18 + 25O2 = 16CO2 + 18H2O
Побочные процессы:
1) Неполное сгорание топлива:
2C8H18 + 17O2 = 16CO + 18H2O
2) Окисление азота из воздуха:
N2 + O2 = 2NO
2NO + O2 = 2NO2
Вредные компоненты выхлопных газов:
1) Несгоревшее топливо: C8H18
2) Окись углерода (угарный газ) CO
3) Оксиды азота NO, NO2 (обобщенно – NOx)
15
16. Химические источники тока
• гальванические элементы• аккумуляторы
• топливные элементы
Гальванические элементы – источники тока
одноразового действия; после расходования
реагентов становятся неработоспособными.
Аккумуляторы можно использовать многократно.
При пропускании постоянного тока от внешнего
источника происходит регенерация
израсходованных реагентов (зарядка аккумулятора).
16
17. Свинцовый аккумулятор
Pb | H2SO4 | PbO2 | PbЭлектролит – 30 %-ный водный раствор H2SO4.
Электродные процессы :
Pb + SO42– – 2e = PbSO4 (анод)
PbO2 + 4H+ + SO42– + 2e = PbSO4 + 2H2O (катод)
_____________________________________________________________
Pb + PbO2 + 4H+ + 2SO42– = 2PbSO4 + 2H2O
При разряде аккумулятора реакция протекает
слева направо, при заряде – справа налево.
Разряд – самопроизвольный процесс (DG < 0)
17
18. Топливные элементы (ТЭ) (FC – fuel cells)
способны непрерывно работать в течение длительноговремени, пока к электродам подводятся реагенты.
Окислитель – кислород или воздух,
Восстановитель (топливо) – водород,
гидразин, метанол, углеводороды и т. п.
Водородно-кислородный топливный элемент
ЭлектродныеHпроцессы
2 + ½ O2 =: H2O(ж)
Удельная теплота: –DH = 143 кДж/г H2
Полезная работа: –DG = 118 кДж/г H2
при комнатной температуре
18
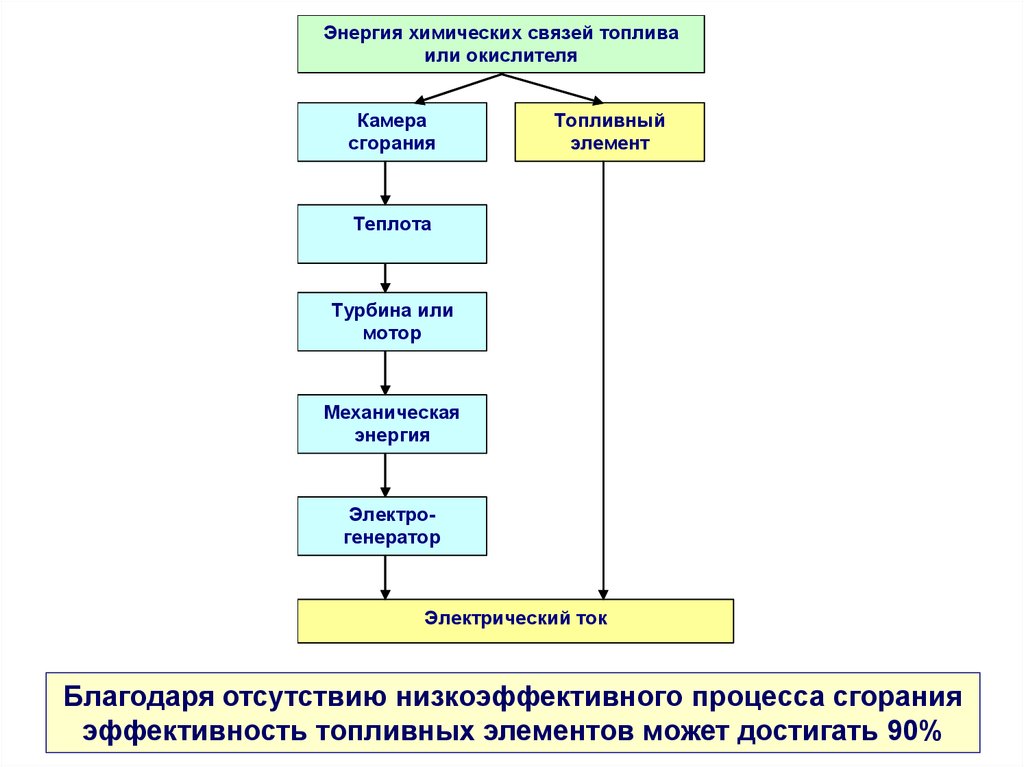
19.
Энергия химических связей топливаили окислителя
Камера
сгорания
Топливный
элемент
Теплота
Турбина или
мотор
Механическая
энергия
Электрогенератор
Электрический ток
Благодаря отсутствию низкоэффективного процесса сгорания
эффективность топливных элементов может достигать 90%
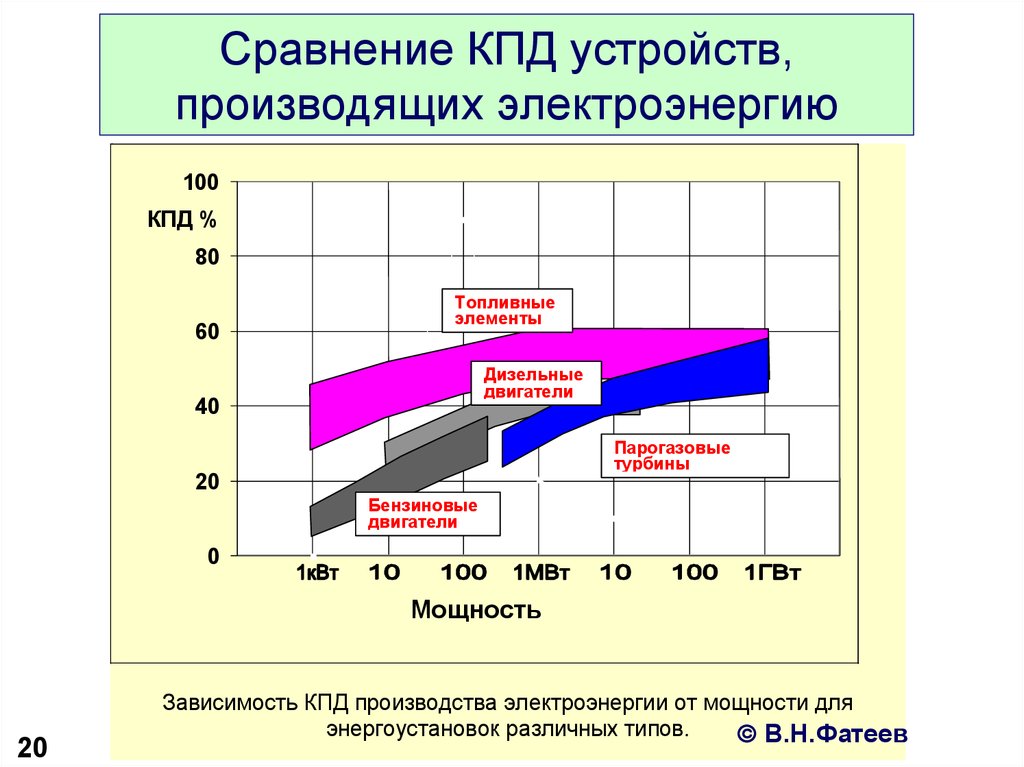
20. Сравнение КПД устройств, производящих электроэнергию
100КПД %
80
60
Топливные
элементы
Дизельные
двигатели
40
Парогазовые
турбины
20
Бензиновые
двигатели
0
Мощность
20
Зависимость КПД производства электроэнергии от мощности для
энергоустановок различных типов.
В.Н.Фатеев
21. Преимущества водородного топлива
• Количество водорода на Земле практически неограничено (15 ат.% в земной коре, в Мировом
океане – 1014 т).
• Водород – возобновляемое топливо.
• Продукт сгорания – чистая вода.
• Наибольшая среди всех видов топлива
удельная теплота сгорания: 140 кДж/г
(углеводороды – 50, уголь – 30).
• Горит быстрее и при более низкой температуре,
чем углеводороды.
• Возможность создания ТЭ различного типа.
21
22. Недостатки водородного топлива
Трудности хранения: большой объем резервуаров.
Реагирует с металлами, делая их хрупкими.
Взрывоопасен.
Высокая стоимость ТЭ (катализатор – платина).
Высокая стоимость производства водорода; при
получении из природного газа образуются оксиды
углерода.
• Создание сети для транспортировки водорода
потребует триллионов долларов.
22
23. Основные задачи водородной энергетики
производство водородахранение, транспортировка и
распределение водорода
окисление водорода и производство
энергии
23
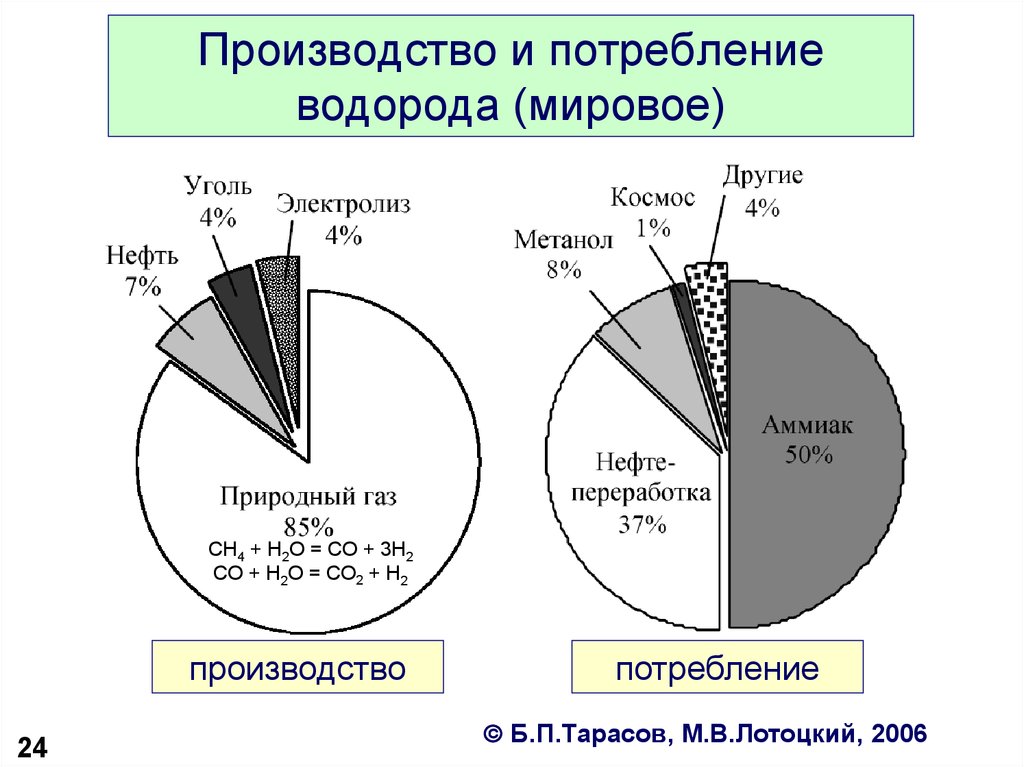
24. Производство и потребление водорода (мировое)
CH4 + H2O = CO + 3H2CO + H2O = CO2 + H2
производство
24
потребление
Б.П.Тарасов, М.В.Лотоцкий, 2006
25. Способы хранения водорода
Физические – в сжатом или сжиженном состоянииФизико-химические, в первую очередь –
адсорбция. Наиболее перспективны здесь
наноматериалы, так как способность к адсорбции у
них очень велика.
Химические – связывание водорода легкими
композитными материалами.
25
26. Идеальная солнечно-водородная энергетика
Идеальная солнечноводородная энергетика26
К.П.Балашев, 1998
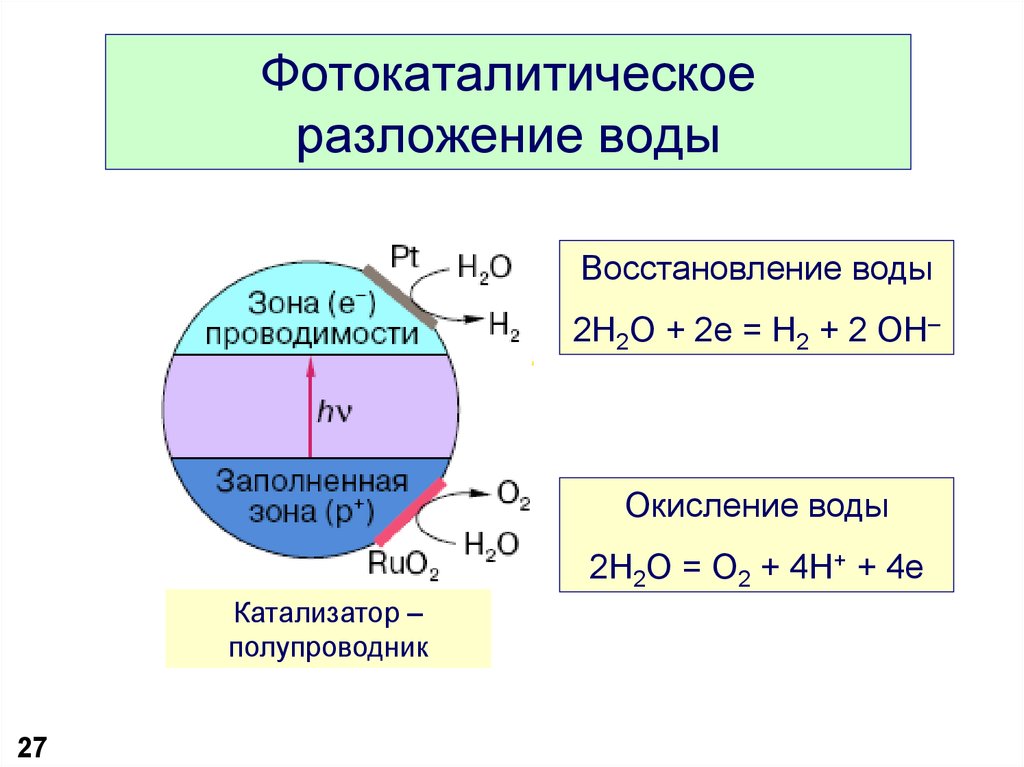
27. Фотокаталитическое разложение воды
Восстановление воды2H2O + 2e = H2 + 2 OH–
Окисление воды
2H2O = O2 + 4H+ + 4e
Катализатор –
полупроводник
27
28. Типы водородных ТЭ
КислотныеТвердополимерный, с протонпроводящей
мембраной (80 оС)
Фосфорнокислый (200 оС)
Щелочные (80 оС)
Используются в космонавтике и на флоте,
для работы требуется чистый кислород
Твердооксидные (1000 оС)
Используют твердотельный керамический электролит,
пригодны для создания крупных источников тока
Карбонатные (700 оС)
Электролит – расплавленный карбонат
Регенеративные (отдаленное будущее)
Автономные, работают на воде и солнечном свете
28
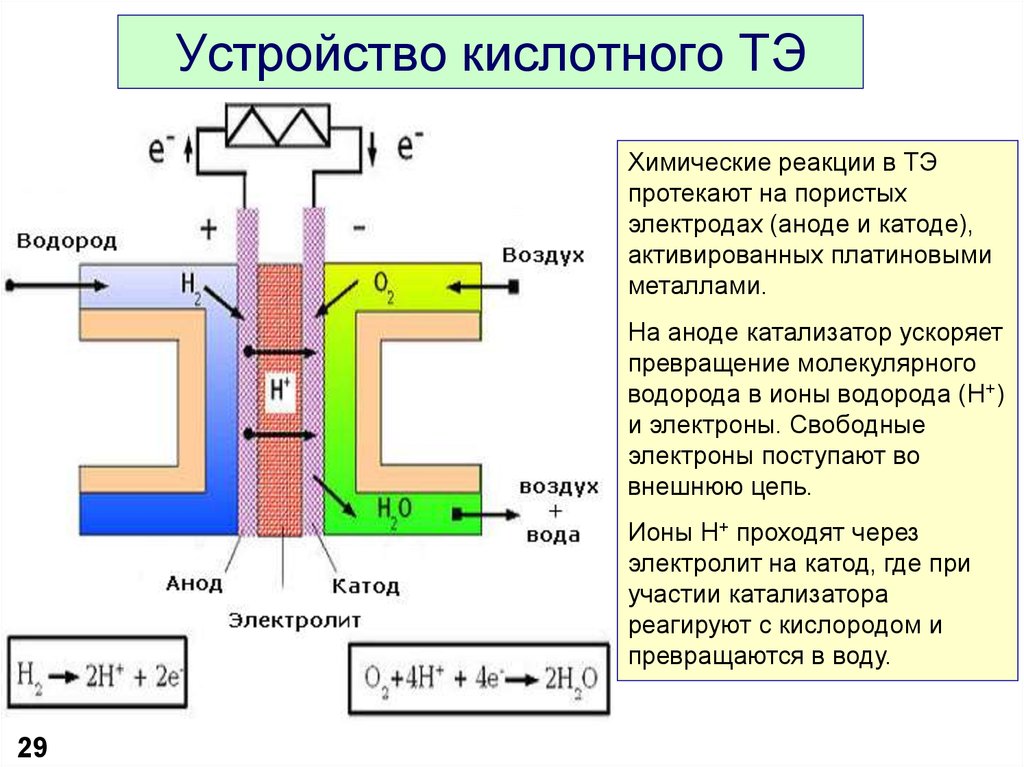
29. Устройство кислотного ТЭ
Химические реакции в ТЭпротекают на пористых
электродах (аноде и катоде),
активированных платиновыми
металлами.
На аноде катализатор ускоряет
превращение молекулярного
водорода в ионы водорода (Н+)
и электроны. Свободные
электроны поступают во
внешнюю цепь.
Ионы Н+ проходят через
электролит на катод, где при
участии катализатора
реагируют с кислородом и
превращаются в воду.
29
30. Полуреакции окисления и восстановления в водородных ТЭ
Кислотный ТЭАнод (окисление):
Катод (восстановление):
H2 – 2e 2H+
|2
O2 + 4H+ + 4e 2H2O | 1
Суммарное уравнение: 2H2 + O2 2H2O
Щелочной ТЭ
Анод (окисление):
Катод (восстановление):
H2 + 2 OH– – 2e 2H2O | 2
O2 + 2H2O + 4e 4 OH– | 1
Суммарное уравнение: 2H2O 2H2 + O2
30
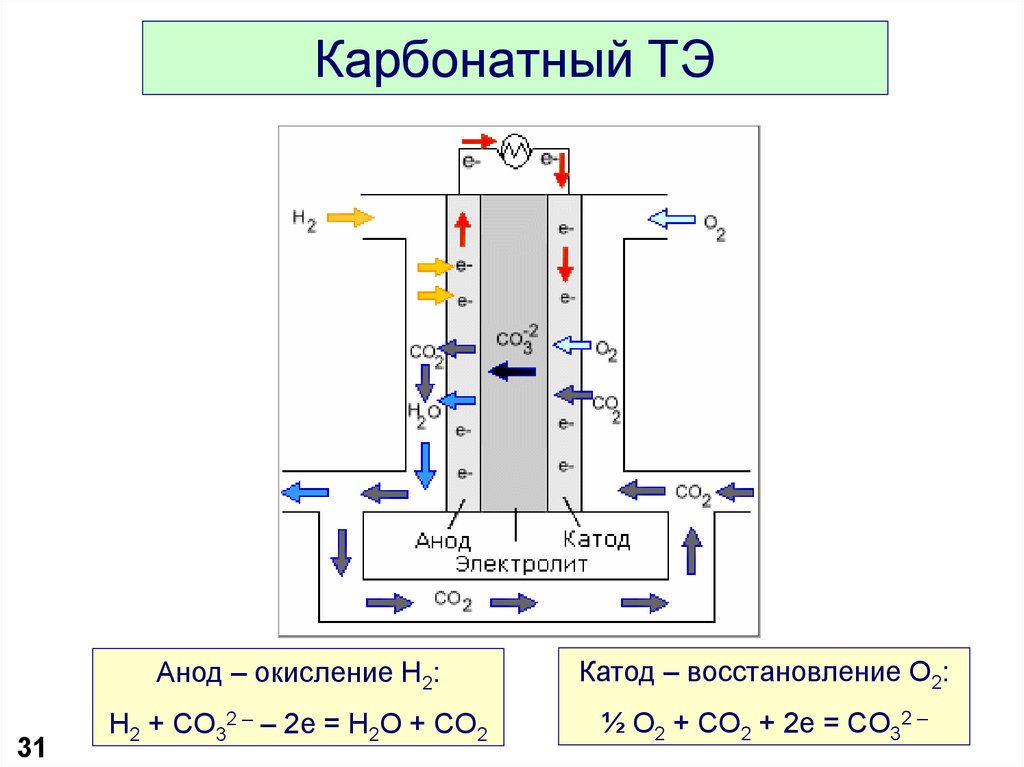
31. Карбонатный ТЭ
31Анод – окисление H2:
Катод – восстановление O2:
H2 + CO32 – – 2e = H2O + CO2
½ O2 + CO2 + 2e = CO32 –
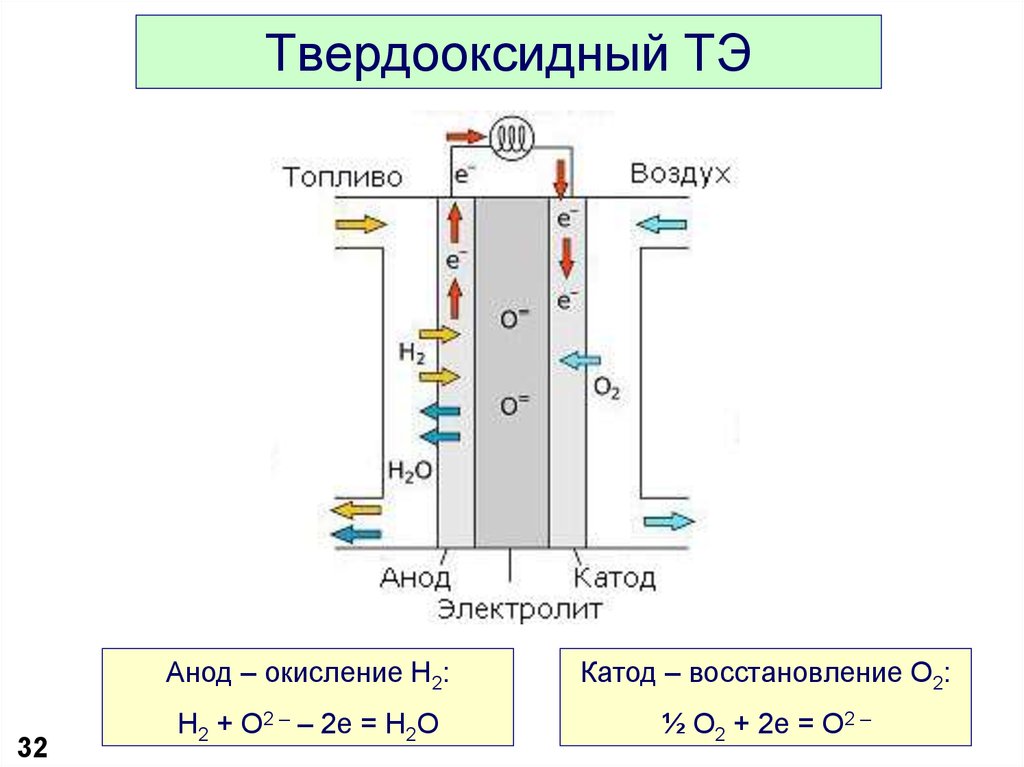
32. Твердооксидный ТЭ
32Анод – окисление H2:
Катод – восстановление O2:
H2 + O2 – – 2e = H2O
½ O2 + 2e = O2 –
33. Типы водородных ТЭ (более подробно)
33Щелочной
ТЭ (AFC)
Электролит – концентрированный раствор KOH (85% в высокотемпературных
ячейках и 35-50% при более низких температурах (<120ºC). Они использовались
в космических аппаратах «Буран» и «Шаттл». Требуют чистого кислорода,
поэтому электроэнергия – дорогая, на Земле используются редко. Типичный кпд
– 60%.
ТЭ с протонпроводящей
мембраной
(PEMFC)
Электролит – твердая полимерная мембрана, проводящая ионы H+. Высокая
плотность тока, небольшие масса, объем и стоимость. Низкая рабочая
температура (ниже 100˚C). Эти ТЭ идеальны для транспортных приложений и
небольших стационарных источников тока. Доля – 5% от общей мощности ТЭ.
Фосфорнокислый ТЭ
(PAFC)
Электролит - 100% фосфорная кислота, содержащаяся в матрице из карбида
кремния. Эти ТЭ первыми нашли коммерческое применение: резервные
источники энергии в больницах, аэропортах. Кпд: от 40 до 85%. Доля – 75%.
Карбонатный ТЭ
(MCFC)
Электролит – смесь карбонатов натрия и калия, содержащаяся в керамической
матрице LiAlO2. Рабочая температура – от 600 до 700ºC, катализатор - никель.
Кпд – от 60% до 80%. На сегодняшний в США и Японии – множество
демонстрационных мини-установок мощностью до 1.8 МВт. Доля – 16%.
Твердооксидный
ТЭ (SOFC)
Электролит – керамический материал, проводящий ионы O2-, обычно – ZrO2,
легированный Y2O3. Рабочая температура – от 650 до 1000ºC. Кпд – около 60%.
Пригодны для использования в крупномасштабных источниках тока. Доля – 4%.
34. Проект создания управляемого термоядерного реактора (бредовый)
34Вот одно из открытий, полученных благодаря знаниям о наномире. Основная идея
открытия заключается в том, что термоядерные реакции происходят в
Солнечной короне, температура сгорания топливной смеси (средняя) 1-1,5 млн К.
Именно здесь существуют необходимые физические условия для прохождения
термоядерной реакции. … Около зоны горения солнечной короны существуют
физические условия, при которых размеры атомов увеличиваются и значительно
снижаются кулоновские силы. При соприкосновении атомы топливной смеси
сливаются и синтезируют новые элементы с большим выделением тепла. Это
реально, наглядно, красиво. Более подробную информацию изложим при
сотрудничестве.
В классической физике все представляется иначе. Поэтому нет положительного
результата. Спросите любого Вашего рецензента-академика. Почему физики,
придерживающиеся классических представлений о термоядерном синтезе на
Солнце, считают, что температуры внутри Солнца от 16 до 100 млн. К, на
поверхности 5800 градусов, а в солнечной короне 1,5 млн. К? Почему такая
несуразица? Пусть хоть кто-нибудь объяснит это. Наши же объяснения полностью
понятны.
Если применить найденные физические принципы для получения физических
условий в термоядерном реакторе, что и сделано нами в патенте, то можно создать
управляемый термоядерный реактор. Недорого и быстро. Нам известно, как создать
подобные условия. Обращайтесь, и Вы победите.
35. Коротко о главном
1. Основные формы передачи энергии – теплота и работа. Теплотунельзя полностью превратить в работу в циклическом процессе.
2. В химических реакциях энергия затрачивается на разрыв химических
связей и выделяется при их образовании. Теплота реакции не зависит
от ее пути.
3. Два основных способа превращения химической энергии топлива в
электрическую: а) сжигание топлива и использование теплоты
сгорания; б) прямое получение электрического тока в топливных
элементах.
4. Важнейшие перспективные источники энергии: а) солнечный свет;
б) ядерная энергия; в) водородная энергия.
5. Водород – основное топливо для большинства ТЭ. Он обладает
огромными преимуществами перед другими видами топлива и может
стать основой энергетики будущего.
6. Эффективная водородная энергетика должна успешно решать три
задачи: 1) производство водорода; 2) хранение, транспортировка и
35 распределение водорода; 3) производство энергии.





















 physics
physics chemistry
chemistry








