Similar presentations:
Кислоты как электролиты
1. Кислоты как электролиты
2. Цель урока:
Сформировать понятие о кислотах как классеэлектролитов.
Рассмотреть их классификацию и общие свойства
в свете ионных представлений.
Закрепить навыки обращения с веществами и
оборудованием
3. Давайте вспомним
Что такое кислоты?Какие общие свойства кислот вам
известны?
Чем обусловлены общие свойства кислот?
4. Взаимосвязь важнейших классов неорганических соединений
Генетическийряд
неМе
Генетический
ряд
Ме
неМе
Кислотный
оксид
неМеО
Кислоты
НКо
Ме
+
Основный
оксид МеО
+
Основания
Ме(ОН)n
+
Соли МеКо
+
Соли Ме Ко
5. Серная кислота – мать всех кислот
«Едва ли найдется другое, искусственнодобываемое вещество, столь часто
применяемое в технике, как H2SO4.
Где нет заводов для ее добывания,
немыслимо
выгодное
производство
многих
других веществ, имеющих
важное техническое значение».
Д.И. Менделеев
“Основы химии”
6. Кислоты - это
электролиты, при диссоциации которыхобразуются катионы водорода и анионы
кислотных остатков.
+
HCl = H +Cl
-
+
3 H3РO4 = 3H +PO4
7.
КИСЛОТЫКИСЛОРОДСОДЕРЖАЩИЕ
H2SO4, HNO3
БЕСКИСЛОРОДНЫЕ
HCl, HBr
ОДНООСНОВНЫЕ
HCl, HNO3
ДВУХОСНОВНЫЕ
H2SO4, H2S
ТРЕХОСНОВНЫЕ
H3PO4
СИЛЬНЫЕ
H2SO4, HCl
СЛАБЫЕ
H2SO3, H2S
РАСТВОРИМЫЕ
H2SO4, HNO3
НЕРАСТВОРИМЫЕ
ЛЕТУЧИЕ
НЕЛЕТУЧИЕ
H2SiO3
H2S, HCl
H2SO4, H3PO4
8.
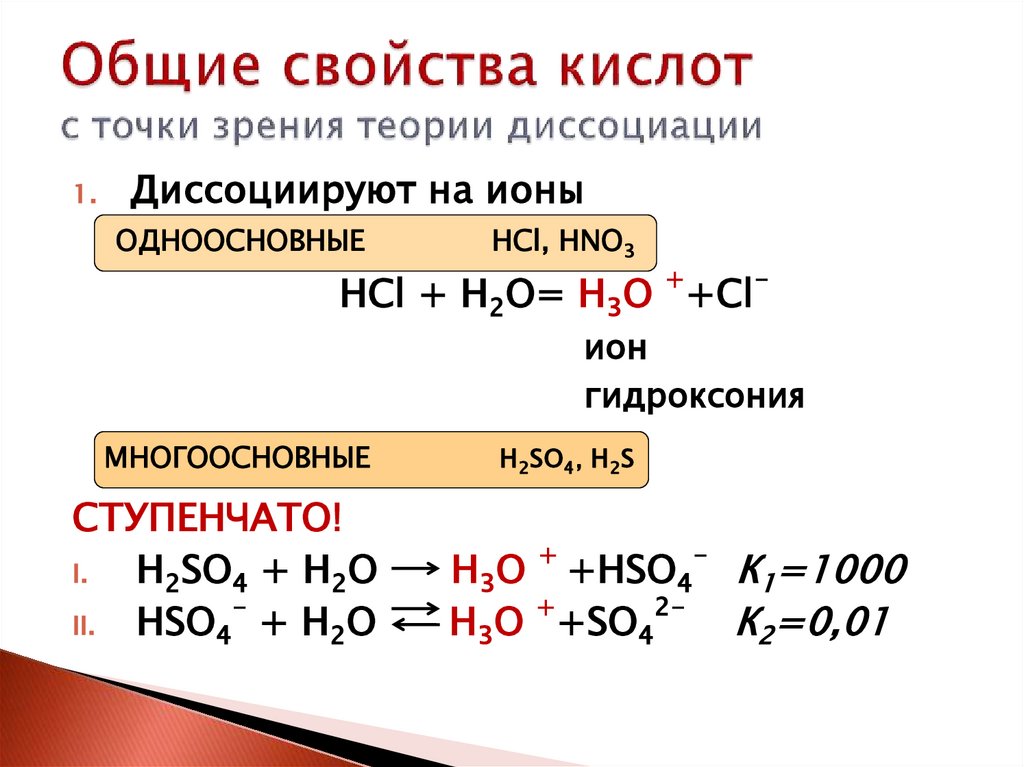
1.Диссоциируют на ионы
ОДНООСНОВНЫЕ
HCl, HNO3
+
HCl + Н2О= Н3О +Cl
-
ион
гидроксония
МНОГООСНОВНЫЕ
СТУПЕНЧАТО!
I.
H2SO4 + Н2О
II.
HSO4 + Н2О
H2SO4, H2S
+
Н3О +HSO4
+
2Н3О +SO4
-
К1=1000
К2=0,01
9.
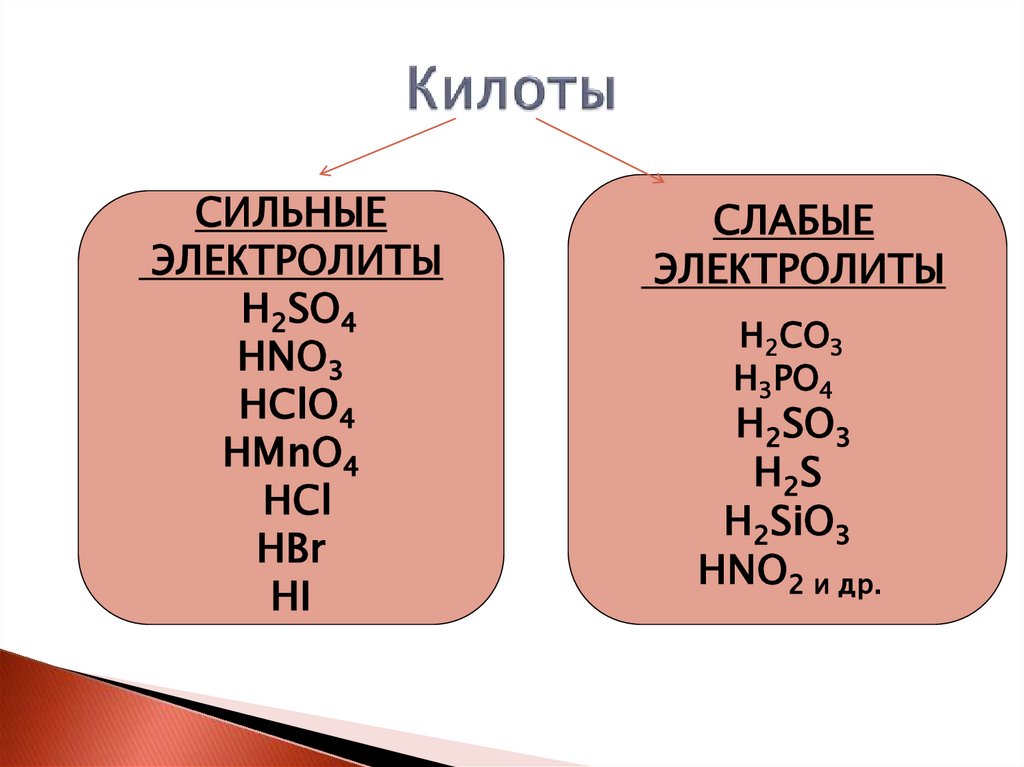
СИЛЬНЫЕЭЛЕКТРОЛИТЫ
H2SO4
HNO3
HClO4
HMnO4
HCl
HBr
HI
СЛАБЫЕ
ЭЛЕКТРОЛИТЫ
H2СO3
H3РO4
H2SO3
H2 S
H2SiO3
HNO2 и др.
10.
ЛАКМУС+
+H
КРАСНЫЙ
МЕТИЛОВЫЙ
+
ОРАНЖЕВЫЙ + H
КРАСНЫЙ
11. Классификация кислот
Кислота + металл = соль + водород2HCl +Zn = ZnCl2 + H2
2H+ + Zn0 =Zn2+ +H2
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb, H, Cu, Hg, Ag, Au
Условия:
в ряду напряжений металл должен стоять между Mg
и водородом
- в результате реакции должна получиться
растворимая соль
- нерастворимая кремниевая кислота не
взаимодействует с металлами
-концентрированный раствор серной кислоты и
раствор азотной кислоты взаимодействуют иначе
-
12. Общие свойства кислот с точки зрения теории диссоциации
Кислота + оксид металла = соль +водаH2SO4 + CuO = CuSO4 + H2O
2H+ +CuO = Cu2+ + H2O
13. Килоты
Кислота + основание = соль + водаH2SO4 +2 NaOH = Na2SO4 + 2H2O
H+ +OH- = H2O
С нерастворимыми основаниями
2НNO3+Fe(OH)2=Fe(NO3)2+2H2O
2H++Fe(OH)2=Fe2++2H2O
14. 2. Кислоты изменяют окраску индикаторов
Кислота + соль = новая кислота + новая сольУсловия:
- более сильная кислота вытесняет менее
сильную из состава соли
-в результате реакции должны получиться газ
или осадок
H2SO4 + BaCL2 = BaSO4 + 2HCL
SO42- + Ba2+ = BaSO4
2HNO3 +CaCO3=Ca(NO3)2+H2O+CO2
2H+ +CaCO3=Ca2++H2O+CO2
15. 3. Кислоты реагируют с металлами
§9,в задачнике: № 2.22, 2.29, 2.53 б
ПОВТОРИТЬ! свойства оснований
16. 4. Взаимодействуют с основными и амфотерными оксидами
§13, вопросы 1-4на стр. 44,в задачнике: № 2.22, 2.29
ПОВТОРИТЬ! свойства оснований
17. 5. Взаимодействие кислот с основаниями является реакцией нейтрализации
Выполните в задачнике на стр. 20-23№ 2-21
№ 2-27
№ 2-53 д















 chemistry
chemistry








