Similar presentations:
Химическое равновесие. Гидролиз. Буферные растворы. Индикаторы. Лекция №3
1.
Санкт-Петербургский государственный университетпромышленных технологий и дизайна
Высшая школа технологии и энергетики
Кафедра общей и неорганической химии
Аналитическая химия и
физико-химические методы анализа
Лекция №3
«Химическое равновесие. Гидролиз.
Буферные растворы. Индикаторы»
Смит Регина Анатольевна
2.
Влияние рН раствора на диссоциациюслабых одноосновных кислот
НА ↔ Н+ + АС (НА) = [НА] + [А-]
α0 + α 1 = 1
2
3.
в кислой среде, при [Н+] >> Ка, α0 ≈ 1;в щелочной среде [Н+] << Ка α1 ≈ 1
в нейтральной среде [Н+] = Ка, т.е. рН = рКа
α0 = α1 = 0,5
3
4.
Гидролизреакция взаимодействия соли с водой или
реакция, обратная реакции нейтрализации
Гидролизу подвергаются соли, образованные:
слабой кислотой и сильным основанием,
слабым основанием и сильной кислотой,
слабой кислотой и слабым основанием.
Соли, образованные сильной кислотой и
сильным основанием являются сильными
электролитами, диссоциируют нацело,
ГИДРОЛИЗУ НЕ ПОДВЕРГАЮТСЯ
4
5.
СТЕПЕНЬ ГИДРОЛИЗАотношение концентрации
гидролизованной части
соли к её общей
концентрации
Степень гидролиза зависит от:
природы кислоты или основания,
концентрации соли (не актуально для соли,
образованной слабой кислотой и слабым основанием),
температуры.
УСИЛИТЬ ГИДРОЛИЗ:
↓ С соли,
↑ температуры
удалить продукты гидролиза
ПОДАВИТЬ ГИДРОЛИЗ:
↑ С соли,
↓ температуры
добавить продукты гидролиза
5
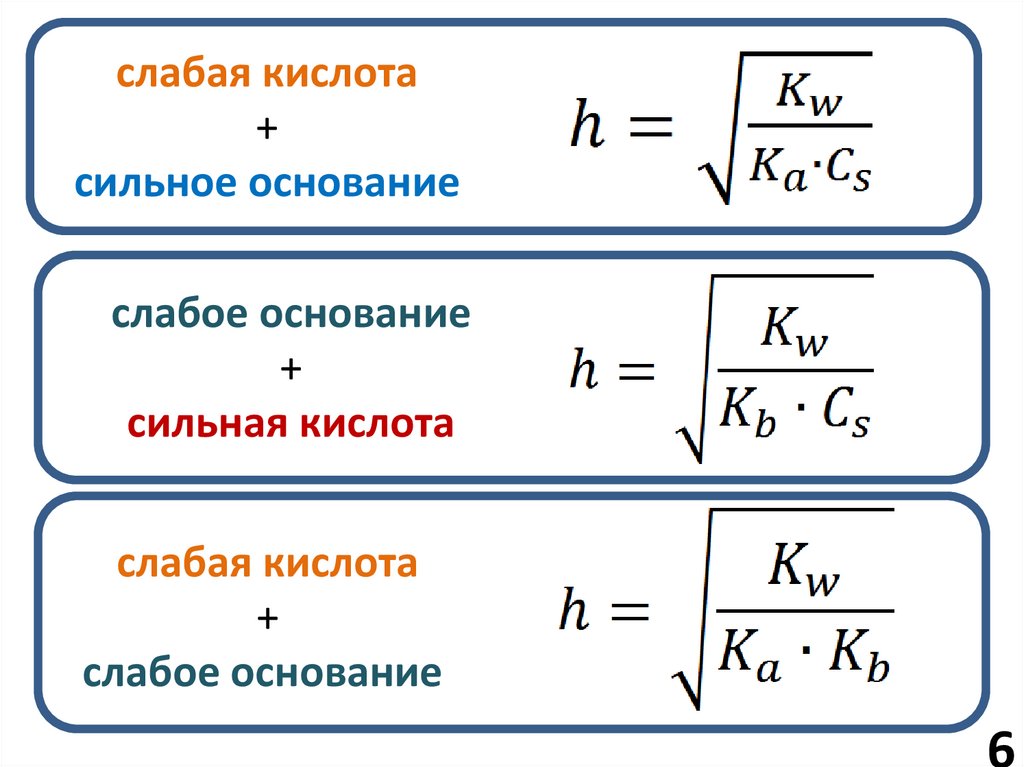
6.
слабая кислота+
сильное основание
слабое основание
+
сильная кислота
слабая кислота
+
слабое основание
6
7.
МОН + НА ↔ МА + Н2ОА- + Н2О ↔ НА + ОН-
Константа
гидролиза
7
8.
[НА] = [ОН-], а [А-] = Сs8
9.
910.
1011.
Буферные растворыиспользуются для поддержания постоянного pH системы;
образуются самопроизвольно при кислотно-основном
титровании
Кислый буферный раствор – это смесь слабой кислоты и соли
этой же кислоты с сильным основанием
СН3СООН+СН3СООNа
Основной буферный раствор – это смесь из слабого основания и
соли этого же основания с сильной кислотой
NH4OH + NH4Cl
NaH2PO4 + Na2HPO4
рН буферных растворов практически не изменяется при:
введении в такие растворы небольших количеств сильных кислот или
сильных оснований;
их разбавлении.
11
12.
Буферная ёмкостьколичество моль сильной кислоты или
сильного основания, которое необходимо
добавить к 1 дм3 раствора, чтобы его рН
изменилось на единицу
Кислый буфер
Основный буфер
12
13.
Расчёт равновесия кислогобуферного раствора
+
СН3СООН ↔ СН3СОО + Н
+
СН3СООNa → СН3СОО + Na
[СН3СООН] ~ С(HA)
[СН3СОО-] ~ Сs
13
14.
1415.
Индикаторы• В кислотно-основном титровании
HInd ↔ H+ + Ind • В окислительно-восстановительном
титровании
Indox + e- ↔ Indred
• В комплексометрическом титровании
Mn+ + Ind- ↔ [MInd](n-1)+
На показания индикаторов влияют: температура,
присутствие в растворе органических растворителей,
белковых веществ и коллоидов.
15
16.
Требования к индикаторам вкислотно-основном титровании
• Изменение окраски индикатора должно
быть обратимым процессом.
• Цветовые формы индикатора должны
резко отличаться.
• Изменение окраски индикатора должно
происходить в узком интервале рН.
• Изменение окраски должно
происходить при близких значениях рН.
16
17.
Ионная теория индикаторовкислотно-основного титрования
• Основные индикаторы
IndOH ↔ Ind+ + OН• Кислотные индикаторы
HInd ↔Ind- + H+
Интервал перехода окраски индикаторов
17
18.
Величина рН при котором заканчивают титрованиес данным индикатором называется показателем
индикатора и обозначается рТ.
Желательно, чтобы
рТ ≈ pH точки эквивалентности
18
19.
Хромофорная теория индикаторовИндикаторы содержат особые группы атомов с
сопряженными двойными связями и
неподелёнными парами электронов - хромофоры
(носители цветности)
Нитрогруппа
Азогруппа
бензольная
хиноидная
Способствуют усилению окраски - ауксохромы
Важнейшими ауксохромами являются группы ОН- и –NH2, а также их
производные, содержащие различные радикалы, например,
–ОСН3, –N(CH3)2 и т.д.
19
20.
2021.
Жёлтая форма, щелочной растворКрасная форма, кислый раствор
21
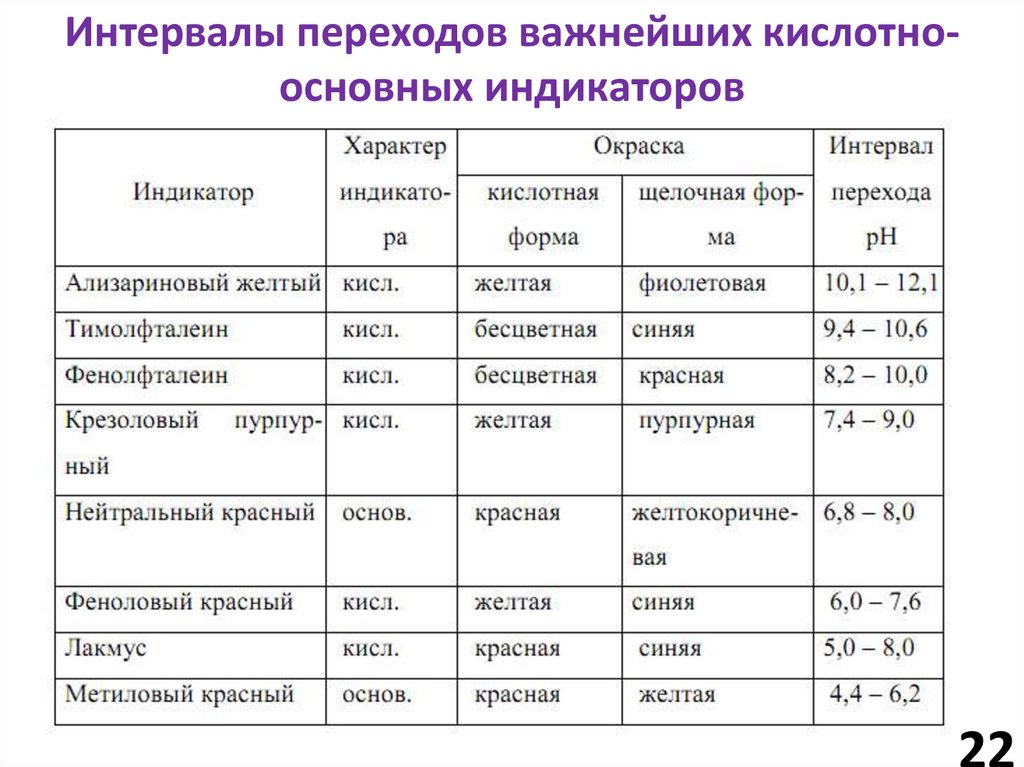
22.
Интервалы переходов важнейших кислотноосновных индикаторов22
23.
Благодарюза внимание






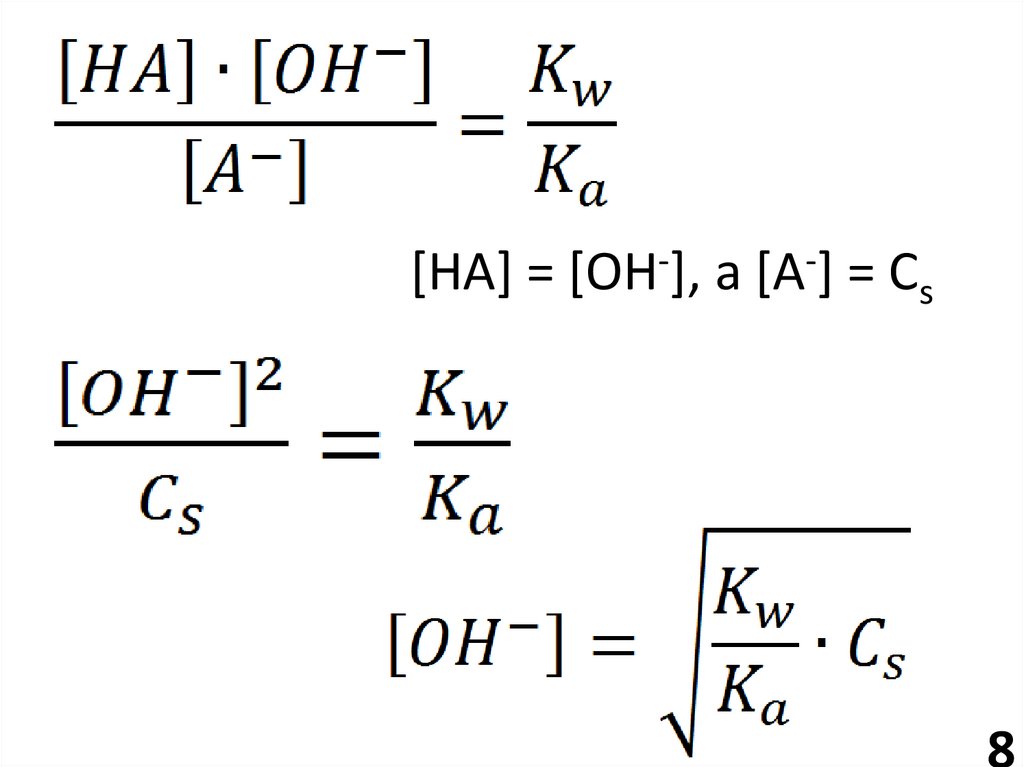














 chemistry
chemistry








