Similar presentations:
Электролиз расплавов
1.
Электрохимия2.
Тема урокаЭлектролиз расплавов
3.
Цели обучения• Знать ионные соединения и их
движение в растворе;
• Понимать движение ионов в
расплаве;
4.
Критерии оцениванияУчащийся достиг цели, если:
• Называет процессы окисления и восстановления,
идущие на электродах
• Различает электролиз расплавов и растворов
• Записывает уравнения полуреакций восстановления
• Записывает уравнения полуреакций окисления
• Составляет уравнения электролиза расплавов и
растворов
• Называет продукты, образующиеся в процессе
электролиза
5.
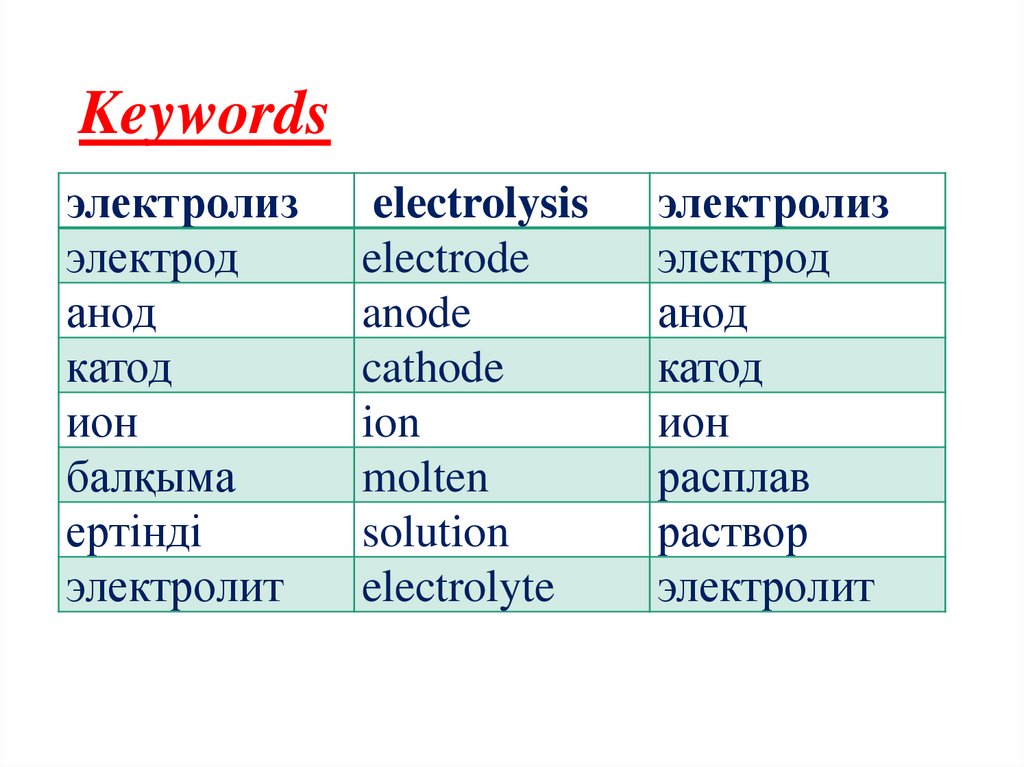
Keywordsэлектролиз
электрод
анод
катод
ион
балқыма
ертінді
электролит
electrolysis
electrode
anode
cathode
ion
molten
solution
electrolyte
электролиз
электрод
анод
катод
ион
расплав
раствор
электролит
6.
Блиц турнирПодумай и
ответь!
Найди нужный
блок для
застройки дома
7.
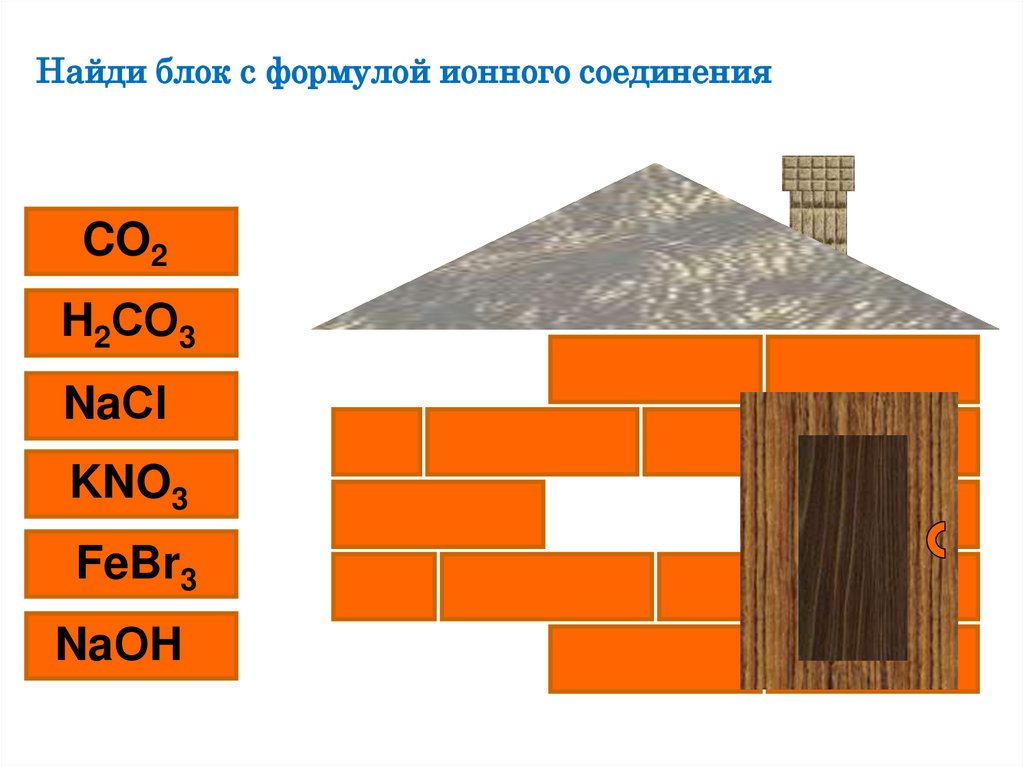
Найди блок с формулой ионного соединенияCO2
H2СО3
NaСl
KNO3
FeBr3
NaОH
8.
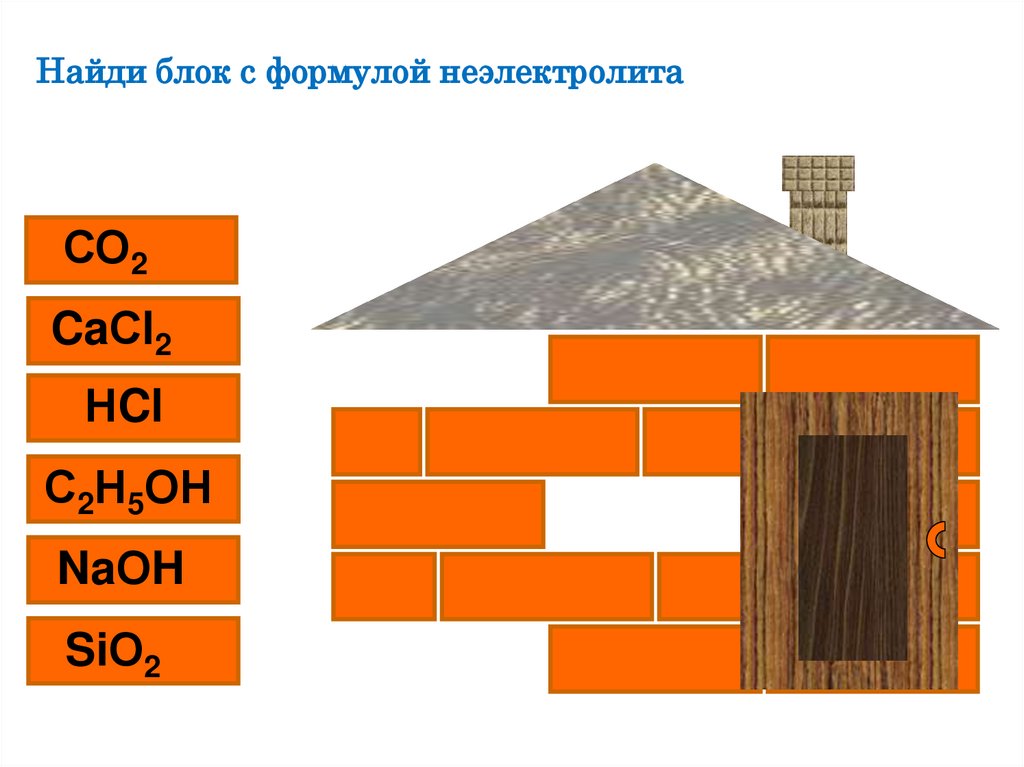
Найди блок с формулой неэлектролитаСО2
CaСl2
НCl
С2Н5ОН
NaОH
SiО2
9.
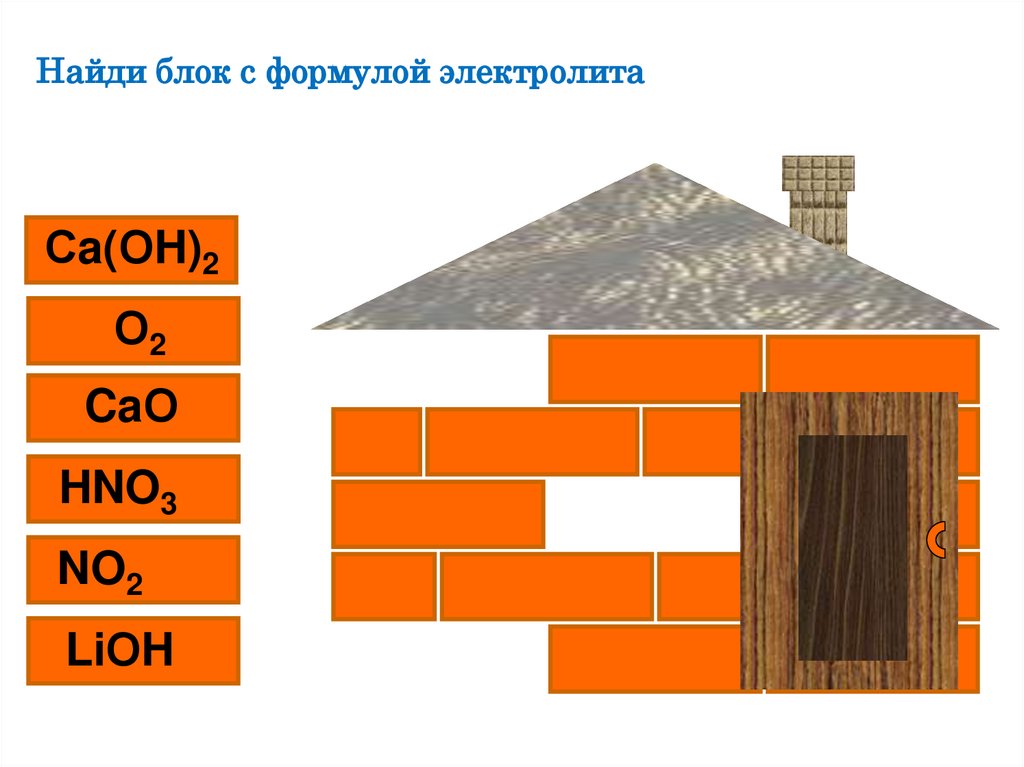
Найди блок с формулой электролитаСa(ОH)2
О2
CaО
HNO3
NO2
LiОH
10.
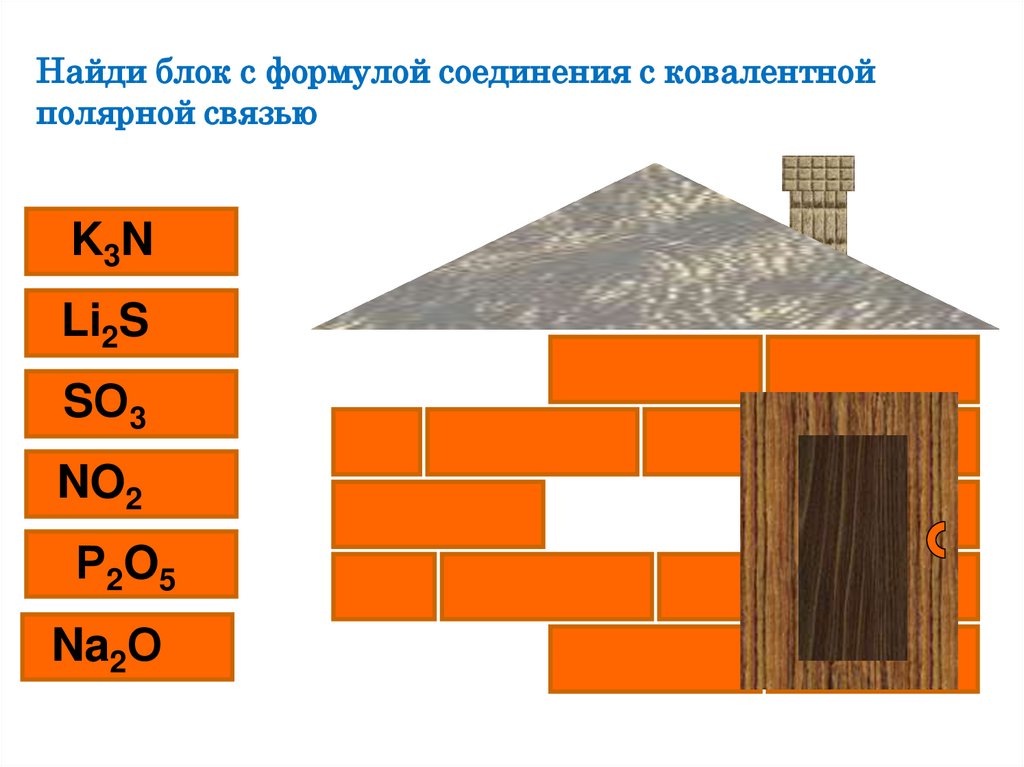
Найди блок с формулой соединения с ковалентнойполярной связью
K 3N
Li2S
SО3
NO2
Р 2O 5
Na2О
11.
Мозговой штурм• Растворы и расплавы некоторых
веществ способны проводить
электрический ток. Объясните,
почему.
12.
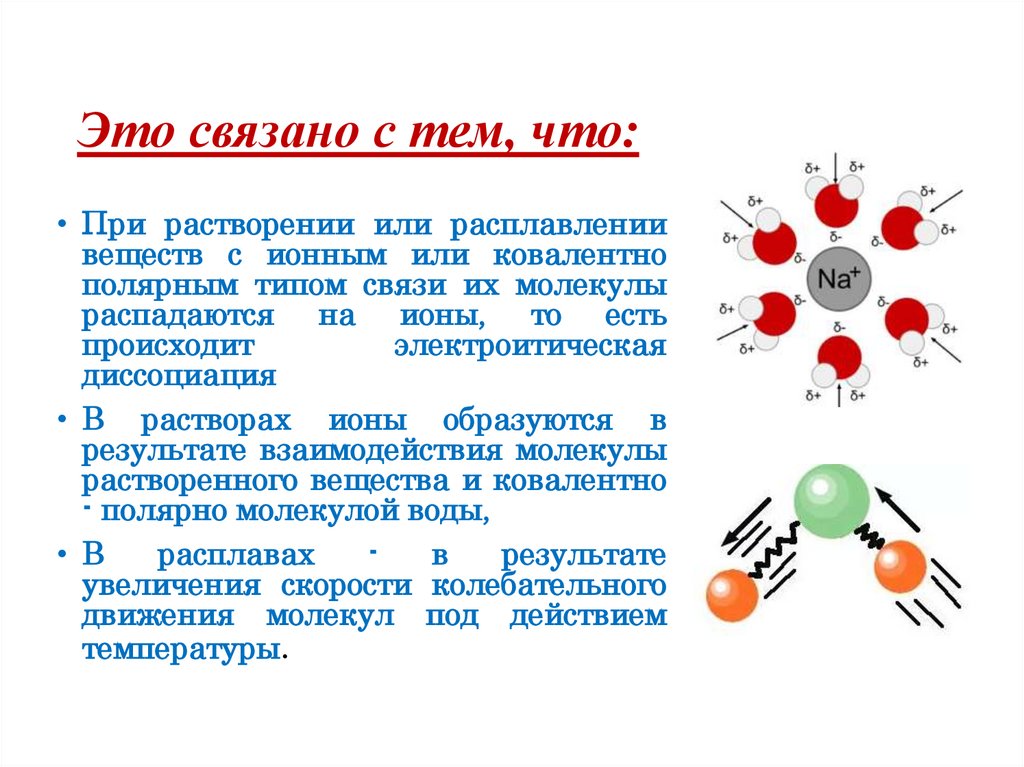
Это связано с тем, что:• При растворении или расплавлении
веществ с ионным или ковалентно
полярным типом связи их молекулы
распадаются на ионы, то есть
происходит
электроитическая
диссоциация
• В растворах ионы образуются в
результате взаимодействия молекулы
растворенного вещества и ковалентно
- полярно молекулой воды,
• В
расплавах
в
результате
увеличения скорости колебательного
движения молекул под действием
температуры.
13.
Используя интерактивную доску Padlet.com. Напишитеуравнения диссоциации следующих соединений:
H2CO3, Ba(OH)2, Na2SO4
Padlet.com.
https://padlet.com/uralbaeva_kar/z34fx580wcgog6wo
14.
Ответьте на вопросы, используя интерактивнуюдоску Padlet.com.
Химический диктант
Fill in the gapp
Растворы и расплавы солей, кислот и щелочей, способные проводить электрический ток
называются 1................................
Заряженные частицы в растворах или расплавах электролитов называются 2...................
В воде силы внутреннего притяжения между ионами ослабевают и молекулы распадаются на
ионы. Такой процесс называется 3. ...........................
Отрицательно-заряженные ионы называются 4. ......................
Положительно- заряженные ионы называются 5. .......................
Окислительно-восстановительный процесс, протекающий на электродах при прохождении
электрического
тока
через
раствор
или
расплав
электролита
называется
6....................................
Padlet.com.
https://padlet.com/uralbaeva_kar/rahaxowsxrpjfk9l
15.
16.
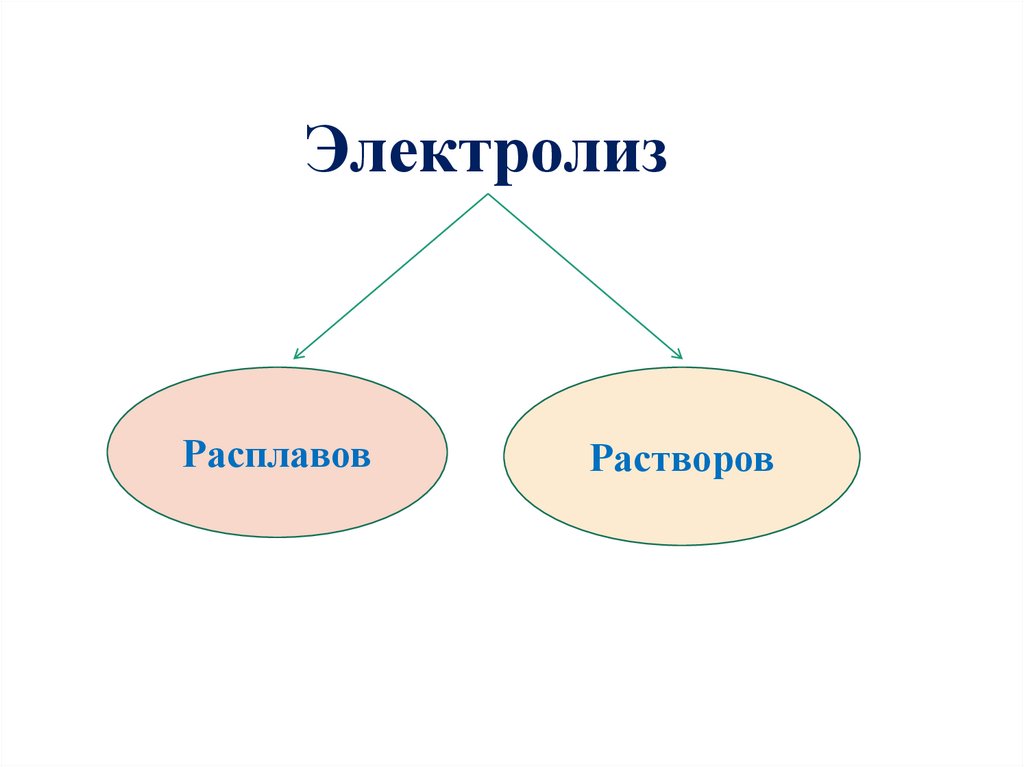
ЭлектролизРасплавов
Растворов
17.
Электролиз расплава хлорида натрияhttps://www.youtube.com/watch?v=YEhnXRnnlyM
18.
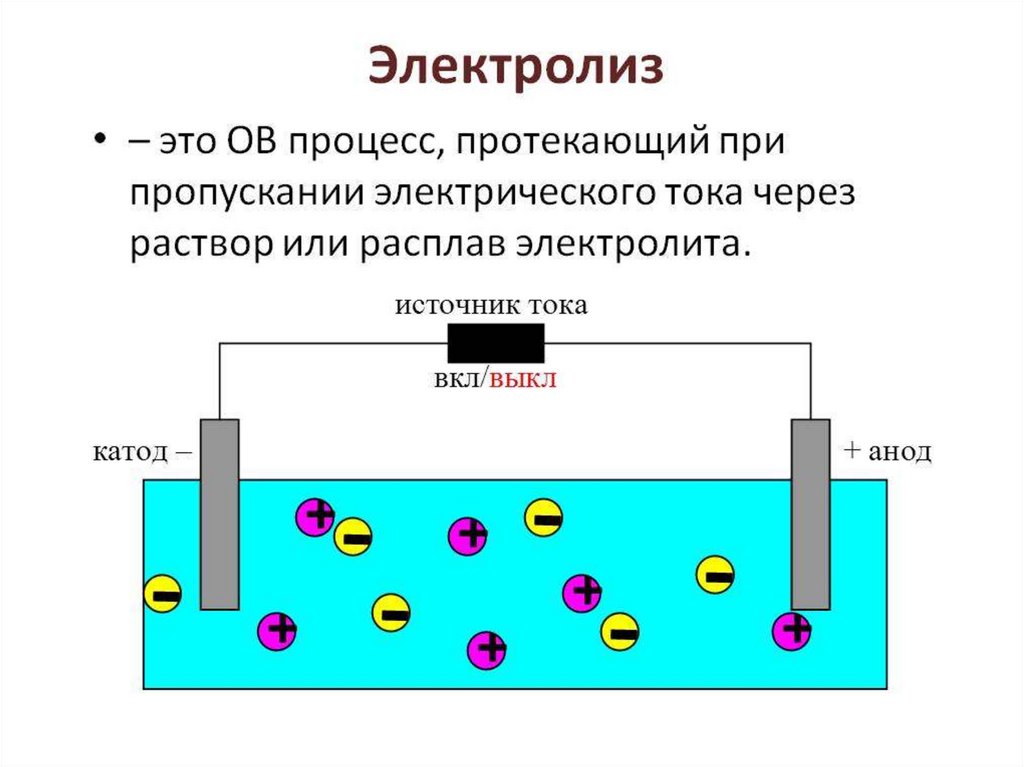
Прибор для проведения электролизаЭлектролиз осуществляется
в сосуде, содержащем
электролит, в который
погружено два
металлических или
графитовых
электрода.
Материал электрода нужно
выбрать так, чтобы избежать
реакции с электролитом.
19.
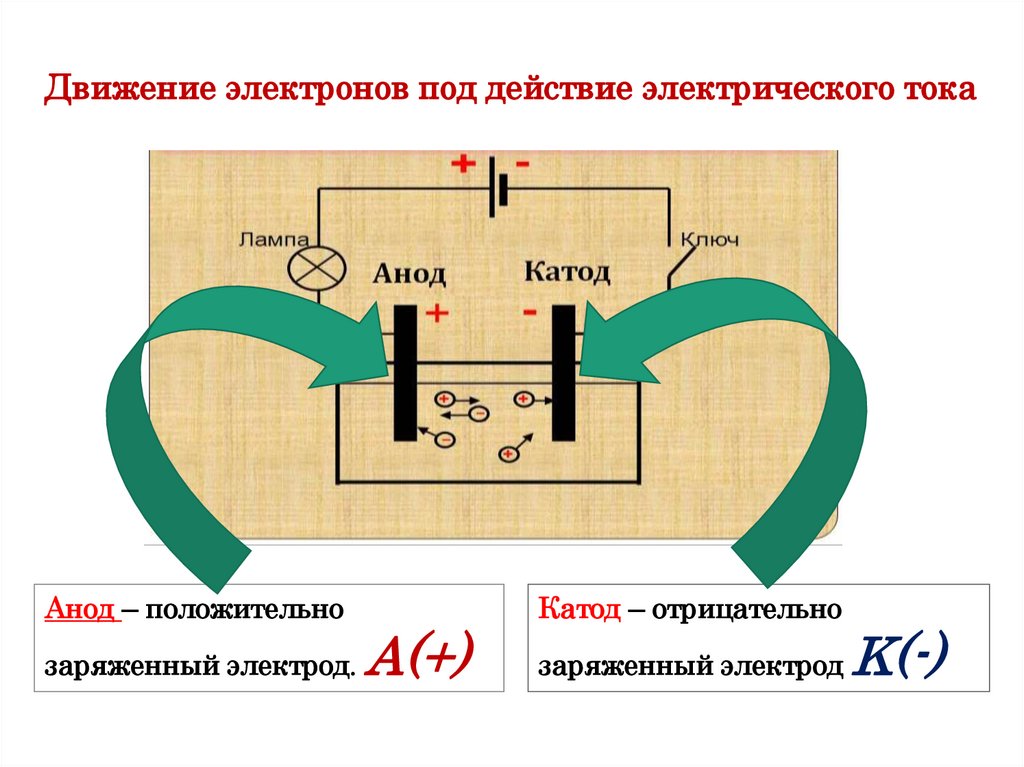
Движение электронов под действие электрического токаАнод – положительно
заряженный электрод.
A(+)
Катод – отрицательно
заряженный электрод
K(-)
20.
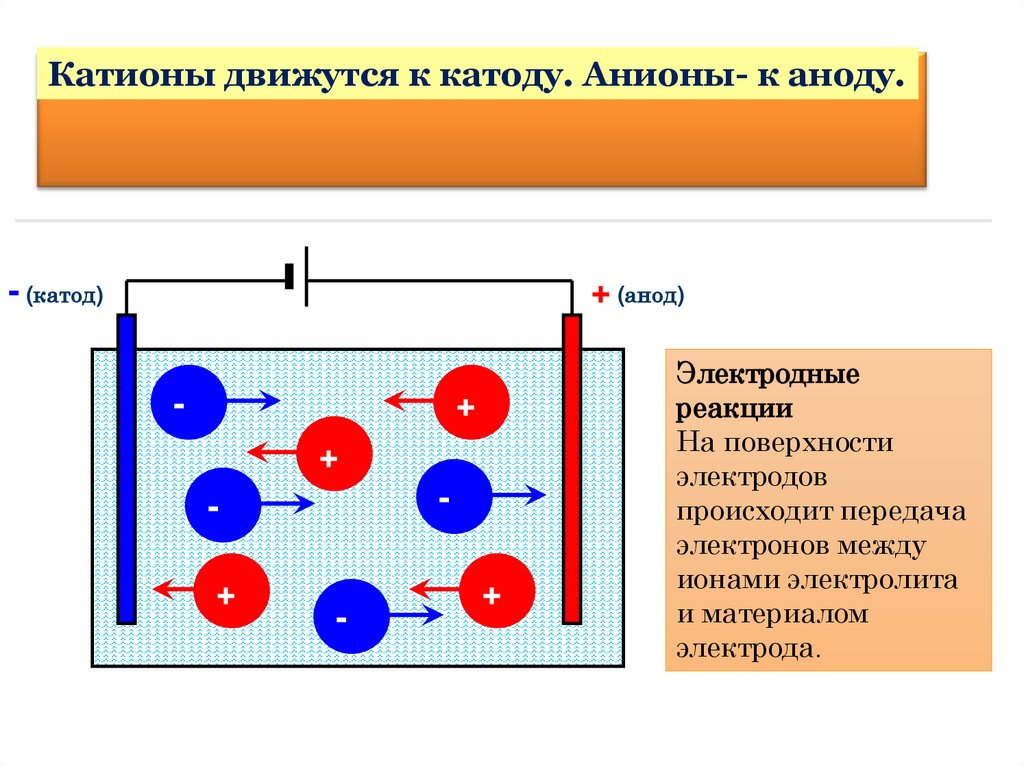
Катионы движутся к катоду. Анионы- к аноду.- (катод)
+ (анод)
-
+
+
-
+
-
+
Электродные
реакции
На поверхности
электродов
происходит передача
электронов между
ионами электролита
и материалом
электрода.
21.
• Электролит может состоять из расплавленногоионного вещества или водного раствора соли,
кислоты или основания.
• В проводниках носителями электрического тока
являются электроны. В растворах- заряженные
ионы.
22.
Это надо знать!Отрицательно заряженные ионы,
образующиеся в результате
диссоциации электролитов,
притягиваются к аноду,
положительно заряженные ионы к катоду.
23.
Электролиз расплавов24.
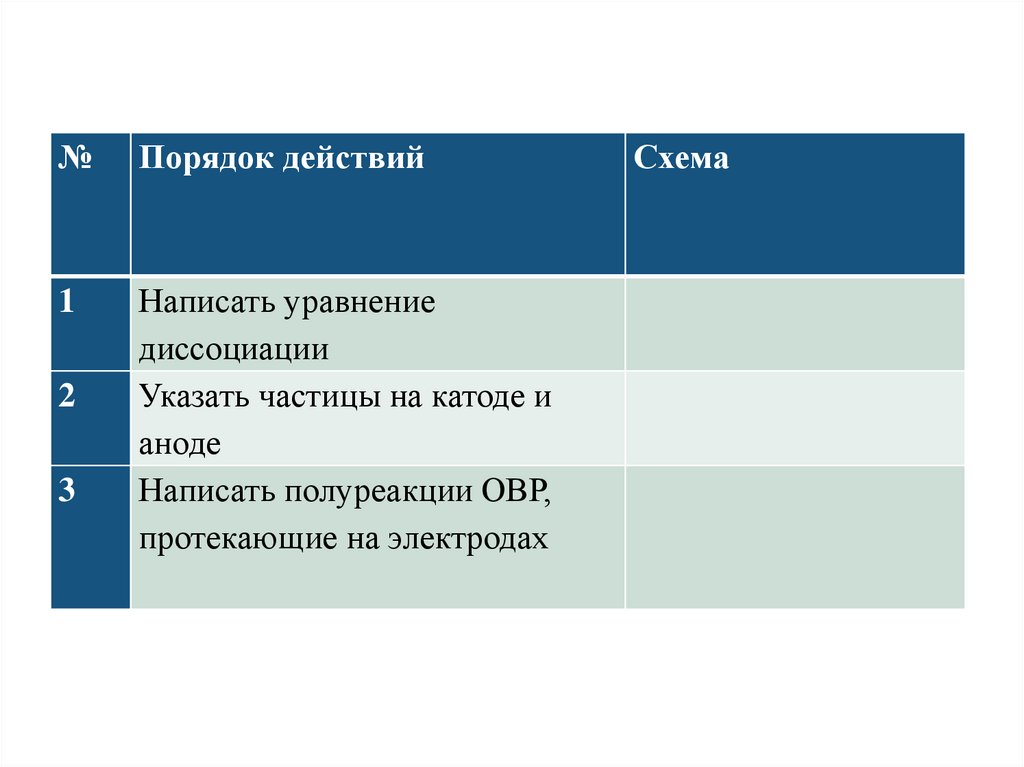
№Порядок действий
1
Написать уравнение
диссоциации
Указать частицы на катоде и
аноде
Написать полуреакции ОВР,
протекающие на электродах
2
3
Схема
25.
Электролиз расплавовВ расплавах бинарных ионных соединений ионы металла
движутся к катоду, ионы неметалла - к аноду.
Пример 1:
NaCl↔ Na+ + ClK (-) Na+
Na + + e- → Na0 окислитель / восстанавливается
A (+) Cl2Cl- -2e- →Cl20
восстановитель/ окисляется
Уравнение электролиза:
2 NaCl↔ 2Na0 + Cl2↑
26.
Электролиз расплавовВ расплавах бинарных ионных соединений ионы металла
движутся к катоду, ионы неметалла - к аноду.
Пример 1:
CuCl2↔ Cu2+ + 2ClK (-) Cu2+
Cu 2+ + 2e- → Cu0 окислитель / восстанавливается
A (+) Cl2Cl -2e- →Cl20 восстановитель/ окисляется
Уравнение электролиза:
CuCl2↔ Cu0 + Cl2↑
27.
А) Схема электролиза соли, состоящей из атомовметалла и остатка бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): Na+ + 1e = Na0
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
2NaCl → (электролиз) 2Na + Cl2
Примеры : KCl, CuCl2
28.
В) Схема электролиза расплава щелочиNaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
4NaOH → (электролиз) 4Na + 2H2O + O2
Пример : KOH
29.
С) Схема электролиза расплава соли, образованнойостатком кислородсодержащей кислоты
Na2SO4↔ 2Na+ + SO424 K(-): Na+ +1e→ Na0
1 A(+): 2SO42- -4e →2SO3+O2
ионное уравнение электролиза:
4Na + + 2SO42- → 4Na0 + 2SO3+O2
молекулярное уравнение электролиза:
2Na2SO4 → электролиз 4Na + 2SO3 + O2
30.
Задание.Определите продукты и напишите
уравнение электролиза расплава
хлорида калия.
31.
Проверь свой ответ32.
Выполните задание• Запишите ионные и молекулярные уравнения
электролиза расплавов следующих веществ:
a. Сульфата меди (II)
b. Оксида алюминия
33.
Заполните таблицуThe molten
compound
Lead
bromide
Lead iodide
Sodium
chloride
What
forms at
the
cathode?
What
The
forms at
decomposition
the anode?
34.
Повторим новую темуВопросы для закрепления
35.
Задание 1При Определите продукт электролиза
расплава бромида калия,
образующегося на аноде
1.бром
2. калий
3. кислород
4. водород
36.
Задание 2Определите продукт электролиза
расплава хлорида натрия,
образующегося на катоде
1) натрий
2) водород
3) кислород
4) хлор
37.
Ответьте на вопросы, используя интерактивную доскуPadlet.com.
Напишите уравнение электролиза расплавов
солей:
ZnCl2, BaI2
Padlet.com.
https://padlet.com/uralbaeva_kar/zwvrfuslq8v159yk
38.
Решите задачуПри электролизе расплава хлорида
меди (II) масса катода увеличилась на
8 г. Какой газ выделяется на аноде и
какова его масса?
39.
Домашнее задание№1: Напишите уравнения электролиза расплавов
следующих солей:
a) Бромид натрия
b) Йодид лития
№2: Рассчитайте массу брома, выделяющегося на
аноде при электролизе 4,6 г расплава бромида
натрия.
40.
Рефлексия-
Сегодня я узнал....
- Я был активен на уроке...
- Я был пассивен на уроке....
- Я понял, что...
- Мне было сложно....
- Мне было легко....




























 chemistry
chemistry








