Similar presentations:
Электролиз растворов и расплавов электролитов. Лекция №15
1.
Электролиз растворов ирасплавов электролитов
Лекция №15
Подготовка к ЕГЭ
2.
План1. Электролиз. Катод. Анод.
2. Электролиз расплавов.
3. Электролиз растворов
электролитов с инертными
электродами.
4. Электролиз растворов солей с
растворимым анодом.
3.
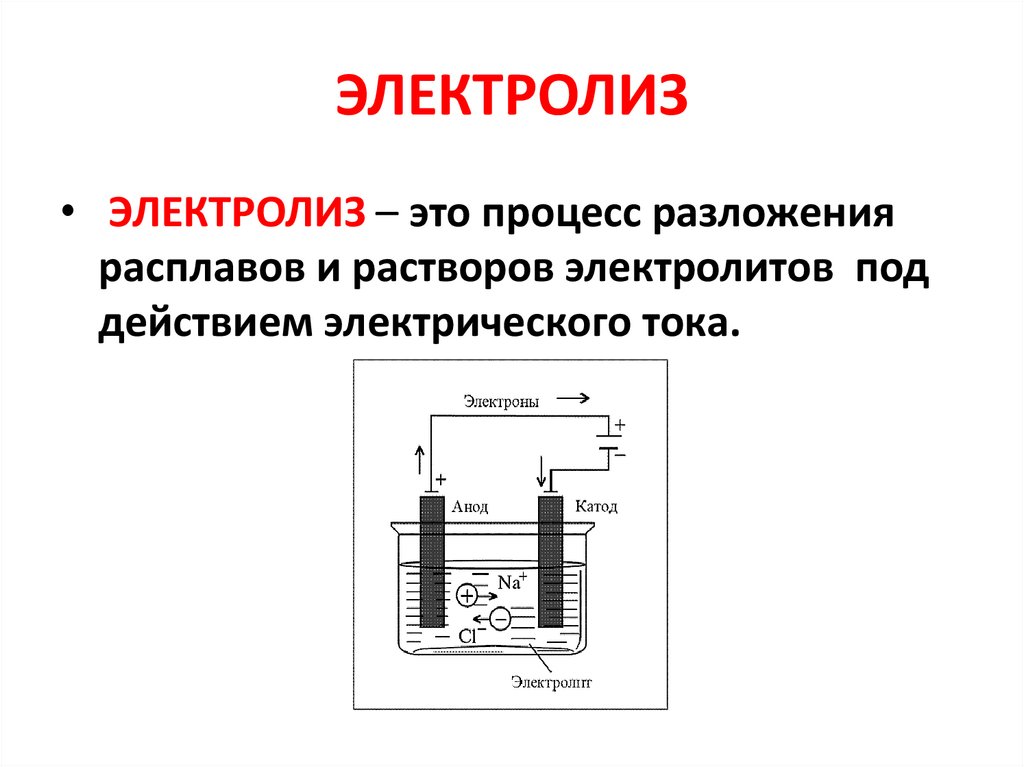
ЭЛЕКТРОЛИЗ• ЭЛЕКТРОЛИЗ – это процесс разложения
расплавов и растворов электролитов под
действием электрического тока.
4.
Катод и анод• В раствор или расплав
какого-либо электролита
опускают электроды:
катод (-) и анод (+).
• При этом ионы,
образовавшиеся при
диссоциации
электролита, движутся к
электродам и
разряжаются на них,
принимая или отдавая
электроны.
5.
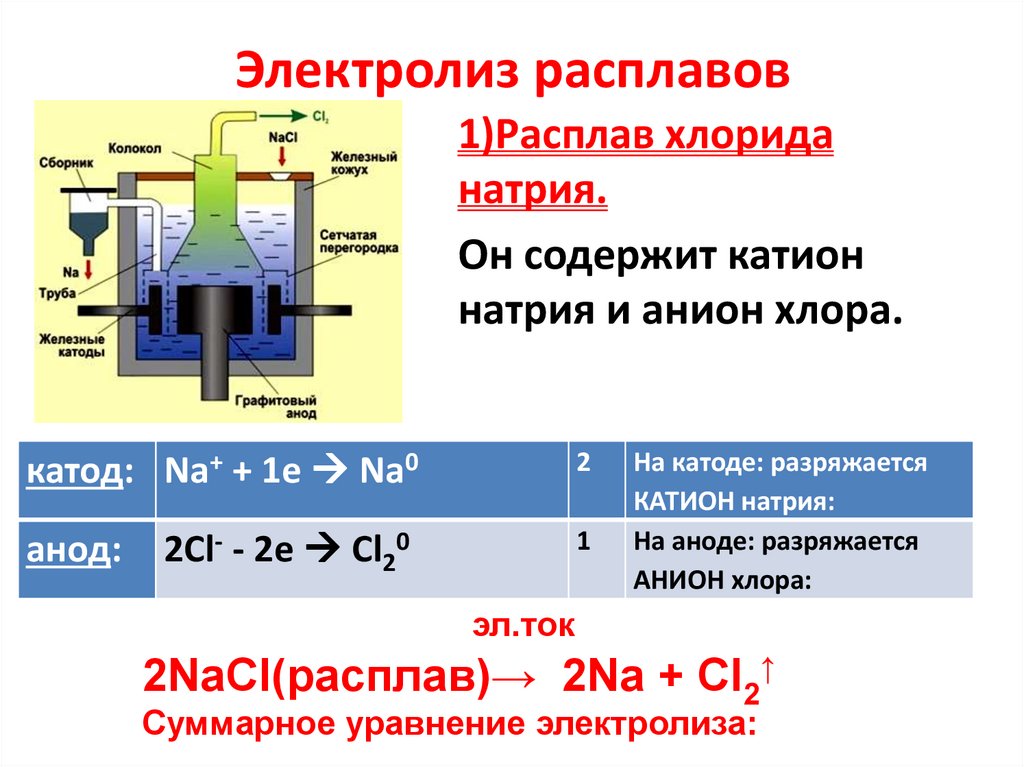
Электролиз расплавов1)Расплав хлорида
натрия.
Он содержит катион
натрия и анион хлора.
катод: Na+ + 1e Na0
анод:
2
2Cl- - 2e Cl20
1
На катоде: разряжается
КАТИОН натрия:
На аноде: разряжается
АНИОН хлора:
эл.ток
2NaCl(расплав)→ 2Na + Cl2↑
Cуммарное уравнение электролиза:
6.
2) Расплав гидроксида натриякатод:
Na+ + 1e Na0
4
анод:
4ОН- - 4e O2 + 2H2O
1
эл.ток
4NaOH (расплав)→ 4Na + O2↑ + 2H2O
7.
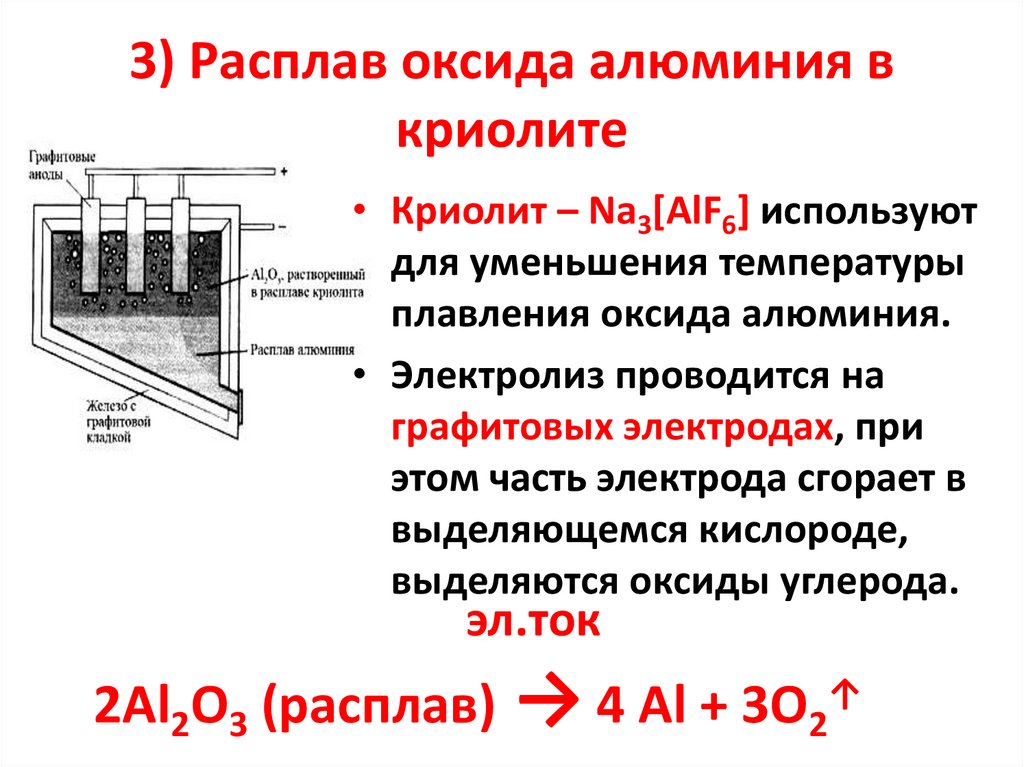
3) Расплав оксида алюминия вкриолите
• Криолит – Na3[AlF6] используют
для уменьшения температуры
плавления оксида алюминия.
• Электролиз проводится на
графитовых электродах, при
этом часть электрода сгорает в
выделяющемся кислороде,
выделяются оксиды углерода.
эл.ток
2Al2O3 (расплав)
→ 4 Al + 3O2↑
8.
Электролиз растворов электролитовс инертными электродами
Катодный процессАнодный процесс
разрядка катиона
зависит от положения в
электрохимическом ряду
напряжений.
1. Металлы правее Н:
1. Анионы бескислородных
разряжаются на катоде
кислот (кроме F-) –
Ме
разряжаются до простого
вещества:
S2- >I- >Br ->Cl-
9.
Электролиз растворов электролитовс инертными электродами
Катодный процесс-разрядка
Анодный процесс
катиона зависит от положения в
электрохимическом ряду
напряжений.
2. Металлы от Al до Н:
идёт два параллельных
процесса:
а) разрядка металла
Ме
б) разрядка воды: Н2
2. Анионы
кислородсодержащих
кислот и F- не
разряжаются, идёт
разрядка воды: О2
10.
Электролиз растворов электролитовс инертными электродами
Катодный процесс-разрядка
Анодный процесс
катиона зависит от положения в
электрохимическом ряду
напряжений.
3. Если в растворе
ионы Н+ - они
разряжаются до
Н2
3. Если есть ОН- он
разряжается
с выделением О2
11.
Электролиз растворов электролитовс инертными электродами
Катодный процесс-разрядка
Анодный процесс
катиона зависит от положения в
электрохимическом ряду
напряжений.
4. Металлы левее алюминия 4. Анионы карбоновых кислот –
– НЕ РАЗРЯЖАЮТСЯ, идёт
реакция Кольбе. Происходит
разрядка воды: Н2
процесс декарбоксилирования и
выделяется алкан (в результате
сдваивания алкильных
радикалов). Пример:
2CH3COO- -2e 2CO2+ CH3-CH3
12.
Примеры:1) раствор хлорида
натрия
эл.ток
NaCl + H2O→
• На электродах выделяются
газообразные продукты – хлор и
водород, в растворе накапливается
гидроксид натрия.
2Н2О +2е H2 + OH- 1
катод: около катода Na+ и H2O.
Натрий левее Al, поэтому идёт
разрядка воды.
2Cl- - 2e Cl2
1
анод: около анода хлорид-анион
и вода. Разряжается ион ClCуммарное уравнение электролиза:
эл.ток
2NaCl + 2H2O → Сl2↑ + H2 ↑+ 2NaOH
13.
Примеры:2) раствор сульфата меди (II) CuSO4 + H2O
Cu2+ +2е Cu
2H2O - 4e O2+ 4H+
1 катод: около катода Cu2+ и H2O.Медь
левее Н, поэтому она сама будет
разряжаться на катоде:
1 анод: около анода – сульфат- анион
и вода. Разряжается вода.
Cуммарное уравнение электролиза:
эл.ток
CuSO4 + H2O → Cu + O2 + H2SO4
На катоде выделяется металл – медь, на
аноде – газообразный кислород, в растворе
накапливается серная кислота.
14.
Электролиз растворов солей срастворимым анодом
Если анод из того же металла, что и металл в
составе соли (например, медный анод в
растворе сульфата меди), то на аноде не
происходит разрядки воды или аниона.
Происходит процесс РАСТВОРЕНИЯ АНОДА:
Ме+n + nē = Ме0
Пример: электролиз раствора сульфата никеля
с никелевыми электродами.
катод: Ni2+ + 2ē = Ni0
анод: Ni0 - 2ē = Ni2+
15.
Источники• http://egeigia.ru/all-ege/materialyege/himiya/566-ege-him-2012-5
16.
• Автор: Калитина Тамара Михайловна• Место работы: МБОУ СОШ №2
с.Александров-Гай Саратовской области
• Должность: учитель химии
• Дополнительные сведения:
• Мини-сайт http://www.nsportal.ru/kalitinatamara-mikhailovna













 chemistry
chemistry








