Similar presentations:
Паняцце аб энтрапіі
1.
ПАНЯЦЦЕ АБ ЭНТРАПІІ• Хімічныя рэакцыі, якія праходзяць без
паступлення энергіі звонку, называюцца
самаадвольнымі. Рэакцыі, якія не ідуць без
вонкавага
энергетычнага
ўздзеяння,
называюцца несамаадвольнымі.
• Пытанне аб тым, у якім кірунку працэс будзе
працякаць самаадвольна, а ў якім - толькі пры
наяўнасці знешніх энергетычных уздзеянняў,
з'яўляецца адным з асноўных пытанняў хімічнай
тэрмадынамікі
2.
Прынцып Бертло (1867)• Адной з ранейшых спроб скарыстацца першым
пачаткам
тэрмадынамікі
для
ацэнкі
накіраванасці працэсаў з'яўляецца прынцып
Бертло: у хімічнай сістэме працякае тая
рэакцыя, пры працяканні якой вылучаецца
максімальная колькасць цеплыні.
3.
• Большасцьэкзатэрмічных
рэакцый
працякаюць самаадвольна (гарэнне вугалю,
вадароду, узаемадзеянне натрыю з вадой,
утварэнне іржы на металах). Чым больш
цеплыні вылучаецца, тым больш устойлівыя
прадукты рэакцыі ў параўнанні з зыходнымі
рэчывамі. Аднак з пазіцый прынцыпу Бертло
немагчыма
растлумачыць
працяканне
эндатэрмічных
рэакцый,
напрыклад
разлажэнне хларыду амонію :
NH4Cl = NH3 + HCl; Но = +176 кДж.
4.
• Такім чынам, змяненне энтальпіі нельгавыкарыстоўваць
у
якасці
крытэрыя
самаадвольнага працякання хімічных працэсаў.
• Для вырашэння пытання аб магчымасці
самаадвольнага
працякання
рэакцыі
ў
ізаляваных
сістэмах
выкарыстоўваюць
змяненне энтрапіі ( S), а ў закрытых сістэмах змяненне энергіі Гібса ( G).
5.
• У тэрмадынаміцы энтрапія (S) ўводзіцца якфункцыя стану сістэмы, змяненне якой ў
абарачальным
ізатэрмічным
працэсе
вызначаецца адносінамі колькасці цеплыні Q,
атрыманай (або аддадзенай) сістэмай пры
тэмпературы Т, да тэмпературы :
Q
S = T
6.
Для неабарачальнага ізатэрмічнага працэсу:Q
Q
ΔS > T . Аб'яднаны выраз ΔS ≥ T з'яўляецца
матэматычным
выразам
другога
пачатку
тэрмадынамікі:
у
ізаляванай
сістэме
самаадвольна могуць працякаць толькі такія
працэсы,
якія
вядуць
да
павелічэння
неўпарадкаванасці сістэмы, г.зн. да росту
энтрапіі.
Энтрапія - функцыя стану сістэмы, яе змяненне не
залежыць ад шляху правядзення працэсу
7.
• Фізічны сэнс энтрапіі стаў больш зразумелы саз'яўленнем
статыстычнай
тэрмадынамікі.
Больцман (1896 г.) паказаў, што сэнс энтрапіі
вызначаецца атамна-малекулярнай будовай
рэчыва, атрымаў формулу, якая звязвае
энтрапію S і тэрмадынамічную верагоднасць
сістэмы W:
S = k · lnW
8.
• k = – канстанта Больцмана,R
8,314
23 Дж
1,38 10
k=
23
NA
6,02 10
К
• W - тэрмадынамічная верагоднасць сістэмы,
роўная ліку мікрастанаў, якімі ажыццяўляецца
макрастан дадзенай сістэмы
9.
• Тэрмадынамічная верагоднасць вызначаеццане толькі энергіяй руху часціц, але і іх
узаемным размяшчэннем, г.зн. яна звязаная з
неўпарадкаванасцю сістэмы. Чым больш
неўпарадкаваная
сістэма,
тым
больш
тэрмадынамічная верагоднасць такога стану
(тым больш такая сістэма верагодная) і тым
больш яе энтрапія.
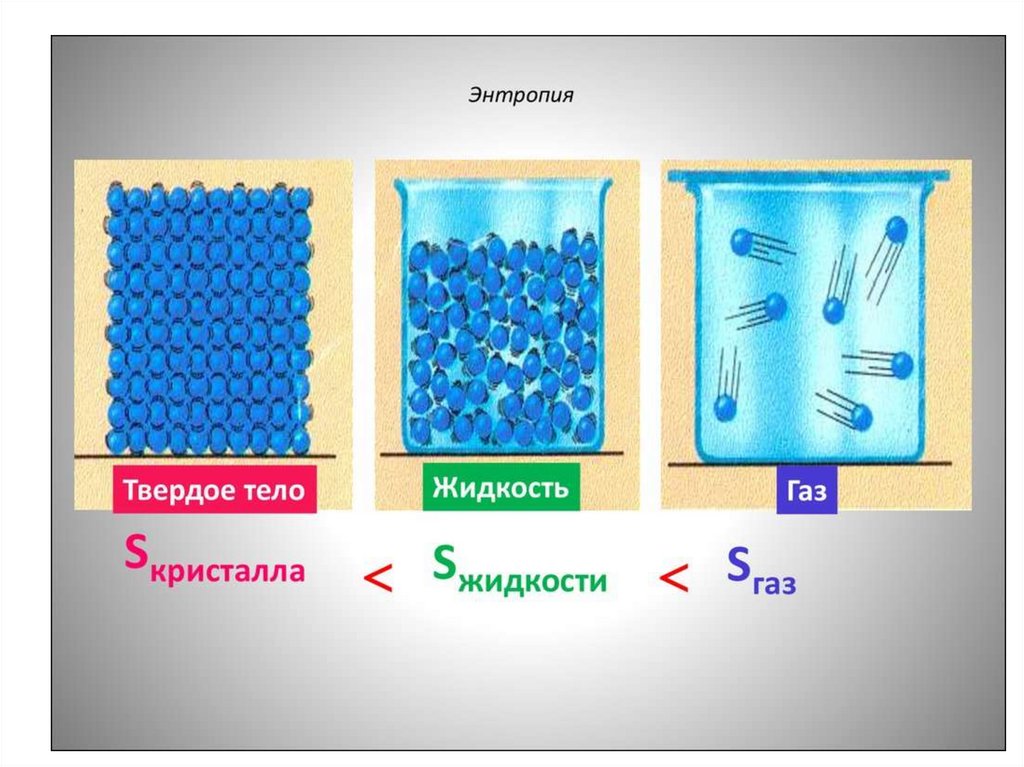
• Энтрапія - гэта мера неўпарадкаванасці
сістэмы.
10.
Чым большая энтрапія, тым большнеўпарадкаваная сістэма
11.
• Тэрмадынамічная верагоднасць вызначаецца нетолькі энергіяй руху часціц, але і іх узаемным
размяшчэннем,
г.зн.
яна
звязаная
з
неўпарадкаванасцю сістэмы. Чым большая
неўпарадкаванасць
сістэмы,
тым
большая
тэрмадынамічная верагоднасць такога стану (тым
больш такая сістэма верагодная) і тым больш яе
энтрапія.
• Энтрапія - гэта мера неўпарадкаванасці сістэмы.
12.
13.
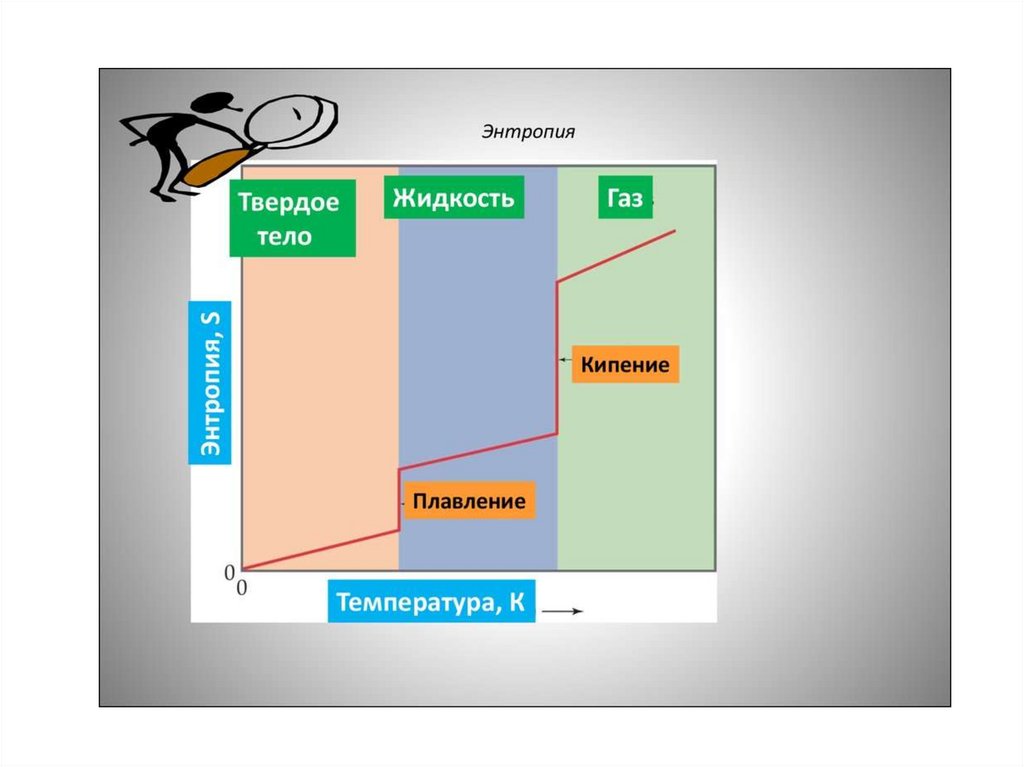
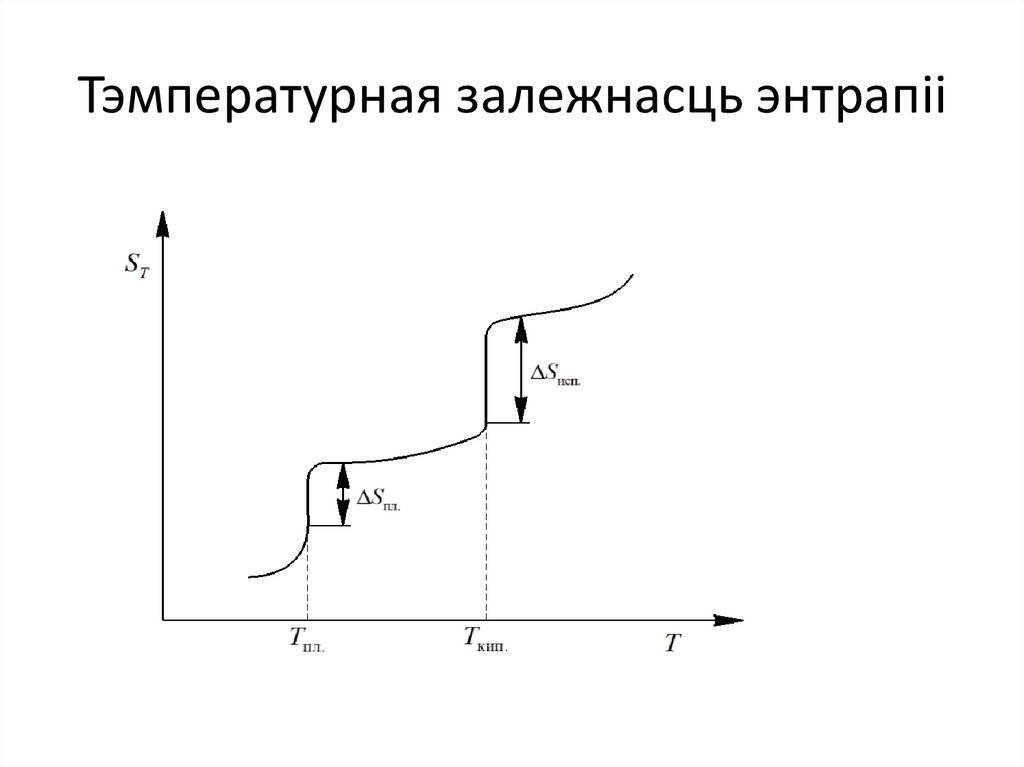
Тэмпературная залежнасць энтрапіі14.
• Наадварот, пры павелічэнні парадку, напрыкладпры крышталізацыі вадкасці, памяншаецца
энтрапія сістэмы і вылучаецца цеплыня
плаўлення.
15.
• У адпаведнасці з пастулатам М. Планкаэнтрапія ідэальна пабудаванага крышталя
чыстага рэчыва пры абсалютным нулі
роўная нулю.
• Пастулат Планка называюць трэцім законам
тэрмадынамікі. Ён задае пункт адліку энтрапіі і
дазваляе ўвесці паняцце абсалютнай энтрапіі
рэчыва, г.зн. энтрапіі, адлічанай ад нулявога
значэння пры T = 0 К.
16.
17.
18.
• Стандартнай лічыцца энтрапія, аднесеная да 1моль рэчыва пры стандартных умовах (ціск 1
атм (101,32 кПа) і тэмпература 298 К (25оС)).
Значэнні абсалютных стандартных малярных
энтрапій (S 0298 ) для большасці хімічных рэчываў і
іёнаў прадстаўлены ў даведачнай літаратуры.
Адзінка вымярэння S – Дж /(моль К).
19.
• Для розных працэсаў стандартнае змяненнеэнтрапіі разлічваюць па раўнанні :
S 298=
0
i
o
ni S298,прад.
i
o
n
S
– j 298,рэагентаў j
j
• Размернасць S 0298 – Дж/К
20.
• S Т0 – стандартнае змяненне энтрапіі рэакцыіпры адпаведнай тэмпературы Т і Р = 1 атм.
• Для разлікаў, якія не патрабуюць высокай
дакладнасці, можна лічыць
S ≈ S
0
Т
0
298
21.
• Ацаніць знак змянення энтрапіі ў розных працэсахможна нават не праводзячы разлікаў, а
грунтуючыся толькі на лагічных разважаннях.
• Энтрапія газаў значна больш, чым цвёрдых целаў і
вадкасцей, таму ў хімічных рэакцыях з удзелам
газападобных рэчываў знак ΔS 0298 можа быць
вызначаны па змяненні колькасці молей
газападобных рэчываў. Калі лік молей газу ў
рэакцыі павялічваецца, то энтрапія пры рэакцыі
таксама павялічваецца.
22.
23.
• Напрыклад:• [CaCO3] [CaO] + (CO2); S 0298> 0
0
• [NH4Cl] (NH3) + (HCl); S 298 > 0
• 2[Mg] + (О2) 2[MgO]; S 0298 < 0.





















 physics
physics chemistry
chemistry

