Similar presentations:
Реакции ионного обмена
1.
«Реакции ионного обмена»2.
Демонстрационныйэксперимент
1. Сливаем
попарно растворы:
А) сульфата железа (II) и гидроксида
натрия
Б) карбоната натрия и азотной кислоты
В) гидроксида калия (добавьте несколько
капель фенолфталеина) и азотной
кислоты
Г) карбоната калия и хлорида натрия
3.
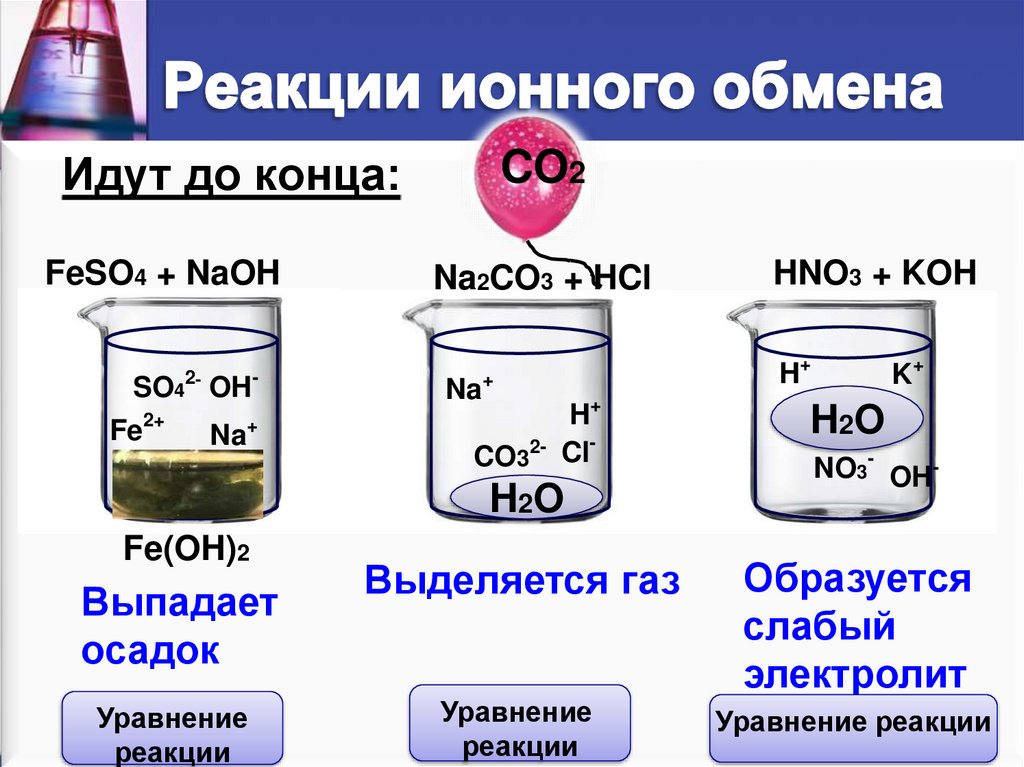
Идут до конца:FeSO4 + NaOH
2-
SO4 OH
Fe
2+
Na
-
+
CO2
Na2CO3 + HCl
Na
+
H+
CO32- Cl
H2O
Fe(OH)2
Выпадает
осадок
Уравнение
реакции
HNO3 + KOH
H+
K+
H2O
NO3- OH-
Выделяется газ
Образуется
слабый
электролит
Уравнение
реакции
Уравнение реакции
4.
3.Составитьионное ионы
уравнение
(записать
4.Найти полное
одинаковые
в левой
и
1.Записать
уравнение
реакции
в
диссоциацию
растворимых
исходных
веществ
2.По
таблице
растворимости
определить
правой
частях,
сократить
их
и
записать
молекулярном
виде
и продуктов реакции)
растворимость
каждого
вещества
сокращенное ионное
уравнение
Молекулярное уравнение
FeSO4+2NaOH = Fe(OH)2 + Na2SO4
Полное ионное уравнение
2+
+
2-
-
+
2-
Fe + SO4 +2Na+2OH =Fe(OH)2 +2Na +SO4
Сокращенное ионное уравнение
2+
-
Fe + 2OH = Fe(OH)2
5.
ПравилаПростые вещества, вода, оксиды, а также
нерастворимые кислоты, основания и соли не
диссоциируют.
Для реакции берут растворы веществ, поэтому даже
малорастворимые вещества находятся в растворах
в виде ионов.
Если малорастворимое вещество образуется в
результате реакции, то при записи ионного
уравнения его считают нерастворимым.
Сумма электрических зарядов ионов в левой части
уравнения должна быть равна сумме электрических
зарядов ионов в правой части.
6.
Молекулярное уравнениеNa2CO3 + 2HNO3=2NaNO3 + H2CO3 H2O
Т2
CO2
Полное ионное уравнение
+
2+
+
2Na + CO3 +2H+2 NO3 =2 Na +2NO3+ H2O
+ CO2
Сокращенное ионное уравнение
23
CO + 2H
+
= CO2 + H2O
7.
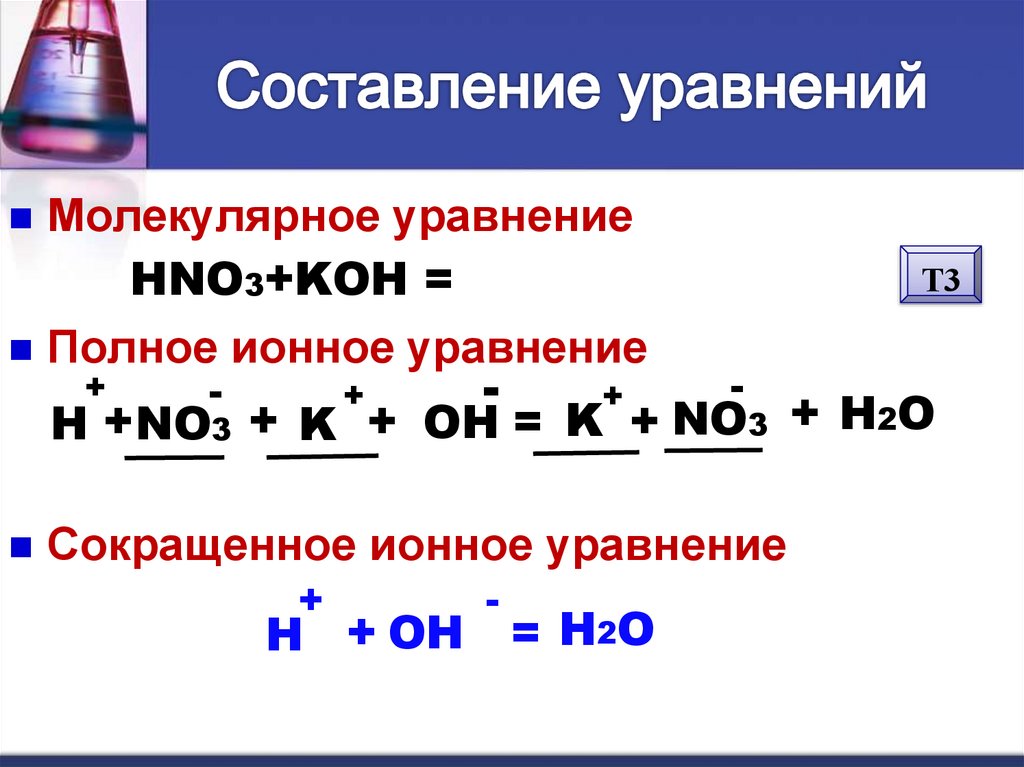
Молекулярное уравнениеHNO3+KOH = KNO3 + H2O
Полное ионное уравнение
+
-
+
-
+
-
Т3
H + NO3 + K + OH = K + NO3 + H2O
Сокращенное ионное уравнение
+
H + OH
-
= H2O
8.
Na2SO4 + KNO31.Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
Na+
NO3-
SO42K+
9.
Молекулярное уравнениеNa2SO4+2KNO3 2NaNO3 + K2SO4
Полное ионное уравнение
+
2-
+
-
+
-
+
Т4
2-
2Na+SO4 +2K +2NO3 2Na+2NO3+2K + SO4
Обратимые реакции – реакции, идущие
во взаимно
противоположных направлениях
10.
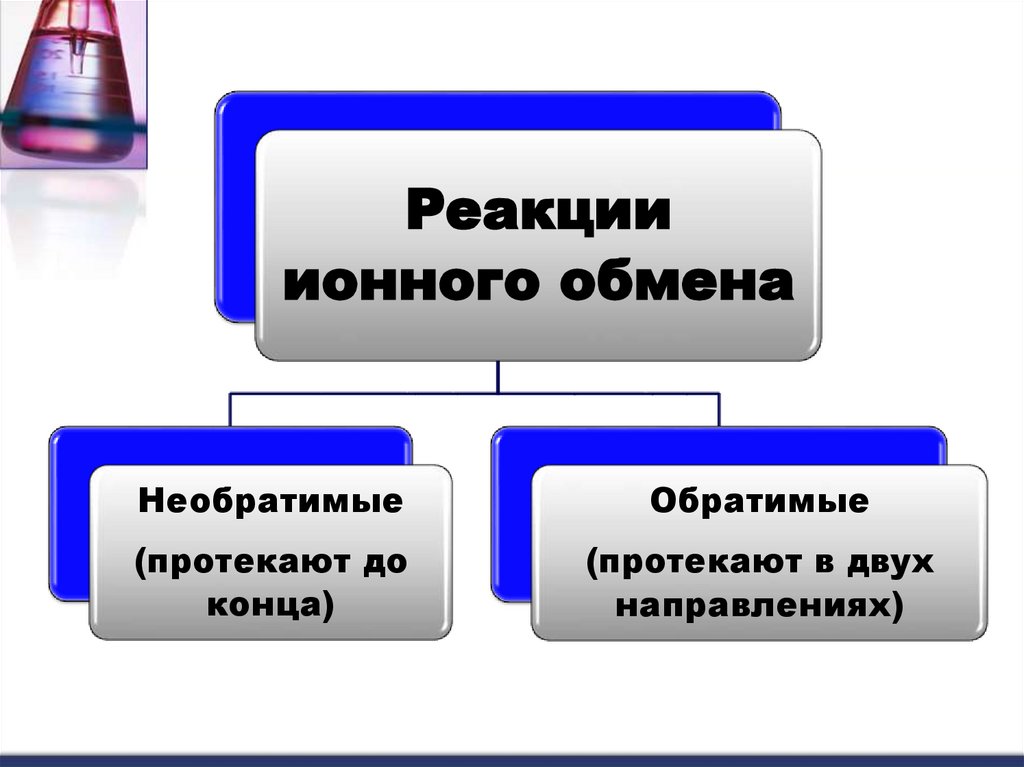
Реакцииионного обмена
Необратимые
Обратимые
(протекают до
конца)
(протекают в двух
направлениях)
11.
Правила техникибезопасности
1. Приступать к эксперименту можно
только с разрешения учителя.
2.Категорически запрещается
пробовать на вкус вещества в
кабинете химии.
3.Нюхать их можно лишь направляя
легким движением руки испарения к
носу, при этом нельзя вдыхать полной
грудью.
12.
Михаил и Алексей делали домашнее задание. Они составилиуравнения реакций, но случайно на лист бумаги пролили
чернила. Помогите ученикам восстановить запись. Составьте к
восстановленным уравнениям полные и сокращенные ионные
уравнения
1) NaOH + HCl
NaCl
+ H2O
2) MgCl2 + Na2SO3
MgSO3 + 2NaCl
3) K2SO3 + HNO3
KNO3 + H2O + SO2
4) ZnSO4 + 2NaOH
Zn(OH)2 + Na2SO4
5) Al(OH)3 + 3HNO3
Al(NO3)3 + 3H2O
6) CaCO3 + 2 HCl
CaCl2 + H2O + CO2









 chemistry
chemistry








