Similar presentations:
Растворы электролитов
1.
Растворы электролитов.2.
План:• 1.Растворы электролитов. Основы теории электролитической
диссоциации.
• 2.Слабые и сильные электролиты.
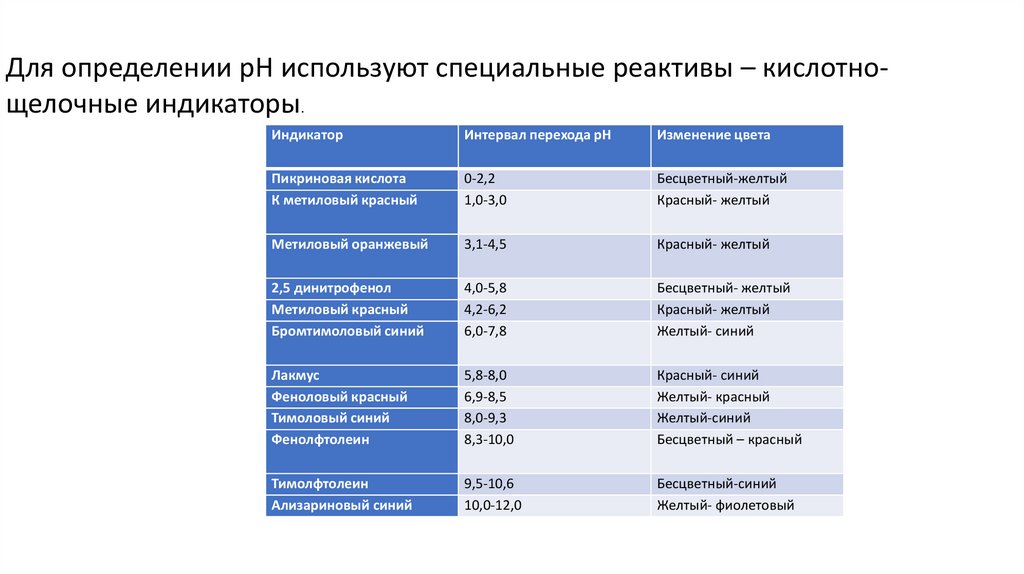
• 3.Диссоциация воды, водородный показатель.
• 4. Молекулярные и ионно- молекулярные реакции обмена в
растворах электролитов.
• 5.Диссоциация кислот, оснований, солей в водных растворах.
• 6. Произведение растворимости.
• 7. Современные представления о природе кислот и оснований.
3.
• Известно, что существуют две основные причины прохожденияэлектрического тока через проводники: либо за счет движения
электронов в электрическом поле, либо за счет движения ионов.
Электронная проводимость присуща прежде всего металлам. Ионная
проводимость – химическим соединениям ионного строения,
например, солям в твердом или расплавленном состоянии, а также
водным и неводным растворам. Поэтому все вещества по их
поведению растворах делят на электролиты и не электролиты.
• Вещества, распадающиеся на ионы в растворах или расплавах и
поэтому проводящие электрический ток называют электролитами. К
электролитам относятся соли, кислоты, основания.
• Свойства растворов электролитов были изучены и обобщены
основоположником теории электролитической диссоциацииАррениусом (1887 г.)
4.
• Распад электролитов на ионы при растворении их в воденазываются электрохимической диссоциации. Её основные
положения:
• При растворении солей, кислот и оснований в воде
происходит диссоциация этих веществ с образованием
электрически заряженных частиц – катионов и анионов;
• Электрическая проводимость водных растворов солей,
кислот и оснований пропорциональны общей концентрации
ионов в растворе.
• Причины и механизм диссоциации электролитов объясняется
теорией растворов Менделеева, а также природой
химической связи.
5.
• Например, растворителя NaCl – вещество образовано ионнойсвязью, диполи воды ориентирующиеся вокруг положительного и
отрицательного ионов.
Между ионами и диполями воды возникают силы взаимного притяжения. В
результате кристаллическая решетка разрушается и происходит переход ионов из
кристалла в раствор. В растворе ионы электролита совершают хаотическое
движение вместе со « свитой» связанных с ними молекул воды, такие ионы
называют гидратированными.
6.
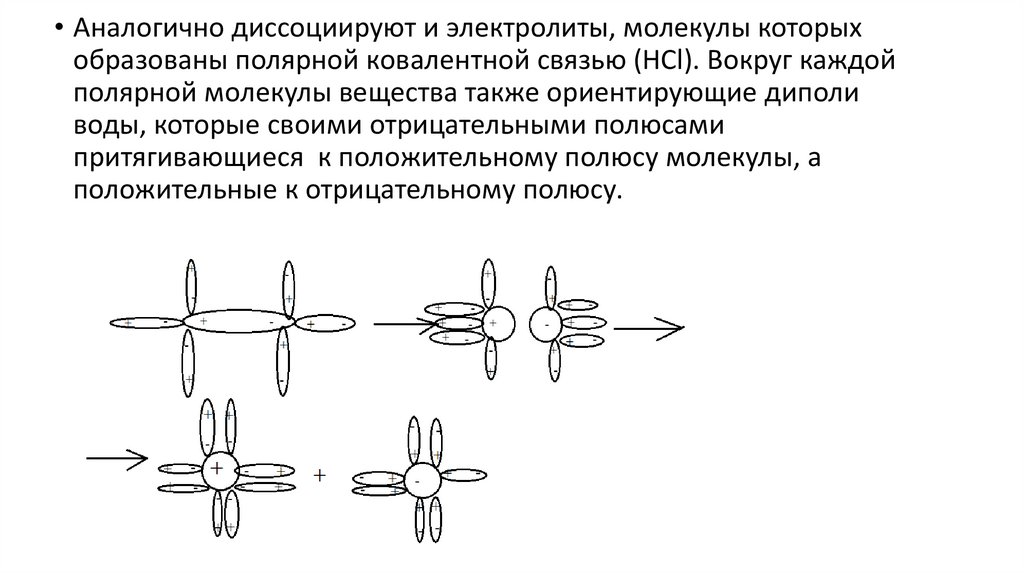
• Аналогично диссоциируют и электролиты, молекулы которыхобразованы полярной ковалентной связью (HCl). Вокруг каждой
полярной молекулы вещества также ориентирующие диполи
воды, которые своими отрицательными полюсами
притягивающиеся к положительному полюсу молекулы, а
положительные к отрицательному полюсу.
7.
• В результате этого взаимодействие связующее электронное облакополностью смещается к атому с большей
электроотрицательностью, полярная молекула превращающаяся в
ионную и затем легко образующиеся гидратированные ионы.
• Процесс электрической диссоциации пользуясь химическими
уравнениями, например, HCl=




















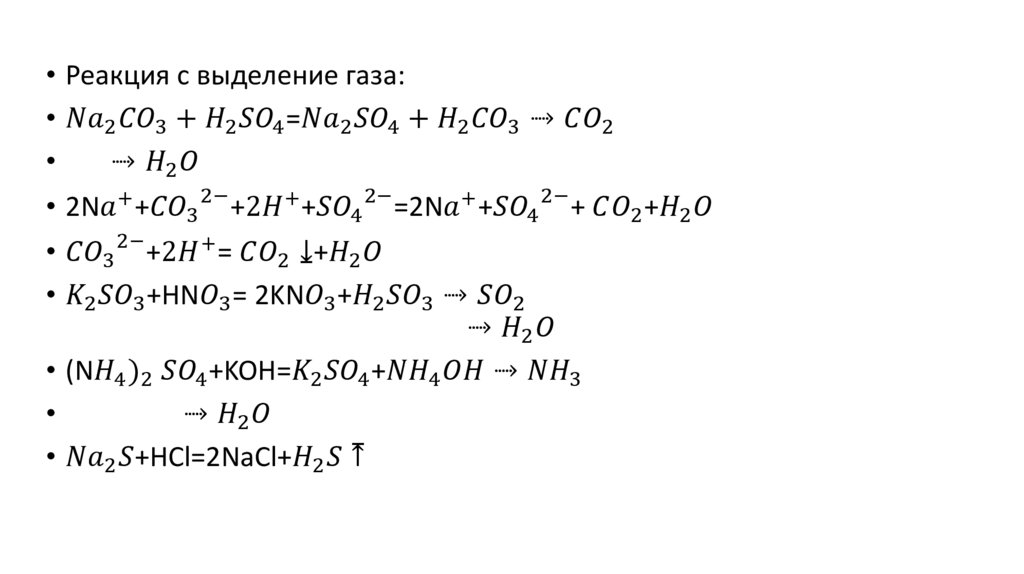





 chemistry
chemistry








