Similar presentations:
Электролитическая диссоциация (Т.Э.Д.)
1.
Лицей им. Н.В.ГоголяЭлектролитическая
диссоциация (Т.Э.Д.)
2.
История открытия теорииэлектролитической диссоциации
В 1800 г. Карлейль и Никольс
впервые произвели разложение воды
действием электрического тока.
1857 г. Р. Клаузиус создал теорию
электропроводности.
Ионы образуются в растворе без
воздействия тока.
В 1887г. Шведский учёный
С.Аррениус для объяснения
особенностей водных растворов
веществ предложил теорию
электролитической диссоциации.
В дальнейшем эта теория была
развита многими учёными, в том
числе И.А. Каблуковым и
В.А. Кистяковским.
2
3.
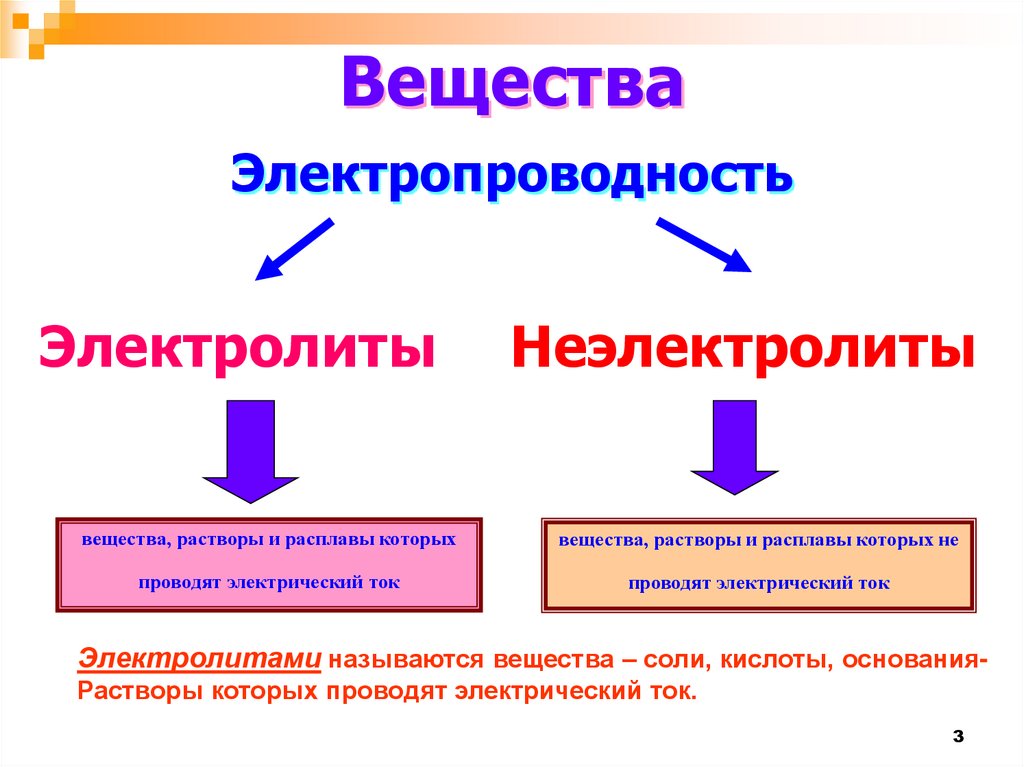
ВеществаЭлектропроводность
Электролиты
Неэлектролиты
вещества, растворы и расплавы которых
вещества, растворы и расплавы которых не
проводят электрический ток
проводят электрический ток
Электролитами называются вещества – соли, кислоты, основанияРастворы которых проводят электрический ток.
3
4.
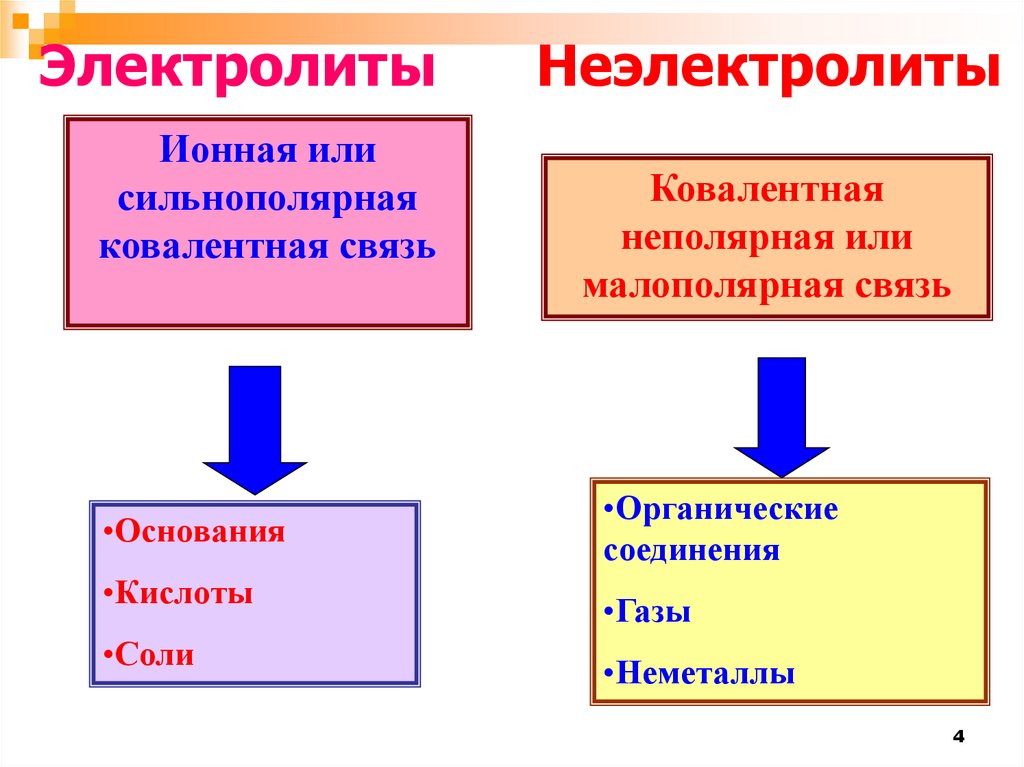
ЭлектролитыИонная или
сильнополярная
ковалентная связь
•Основания
•Кислоты
•Соли
Неэлектролиты
Ковалентная
неполярная или
малополярная связь
•Органические
соединения
•Газы
•Неметаллы
4
5.
Причины распада веществана ионы в расплавах
Нагревание
усиливает колебания
ионов в узлах
кристаллической
решётки кристаллическая
решётка
разрушается.
5
6.
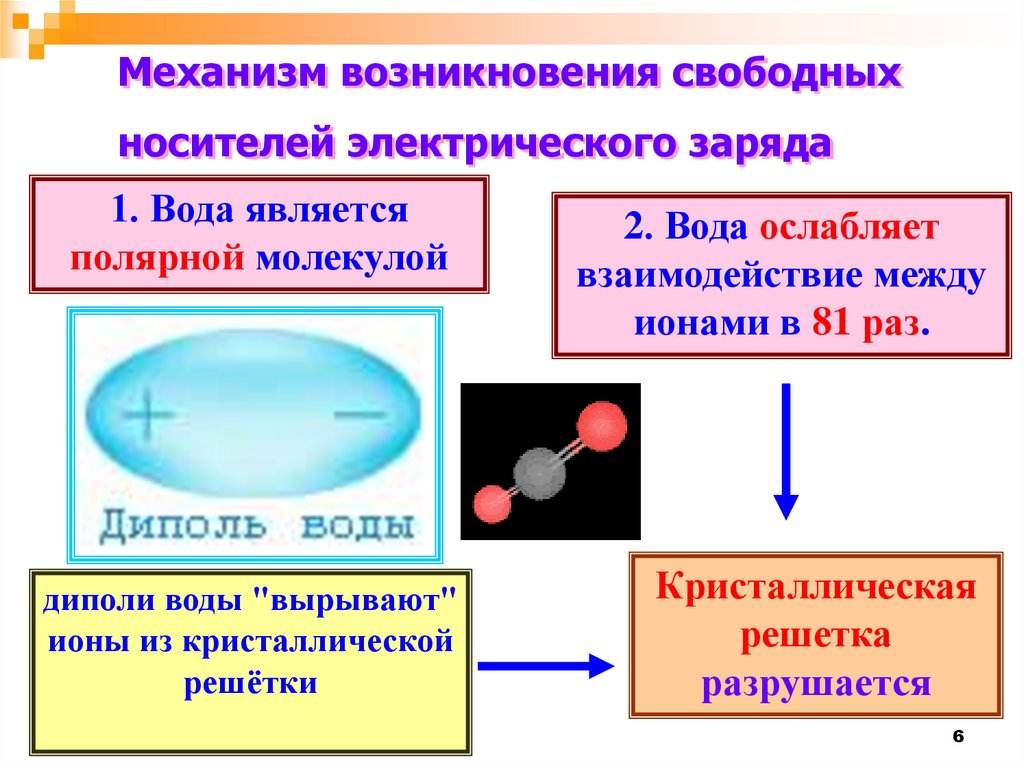
Механизм возникновения свободныхносителей электрического заряда
1. Вода является
полярной молекулой
2. Вода ослабляет
взаимодействие между
ионами в 81 раз.
диполи воды "вырывают"
ионы из кристаллической
решётки
Кристаллическая
решетка
разрушается
6
7.
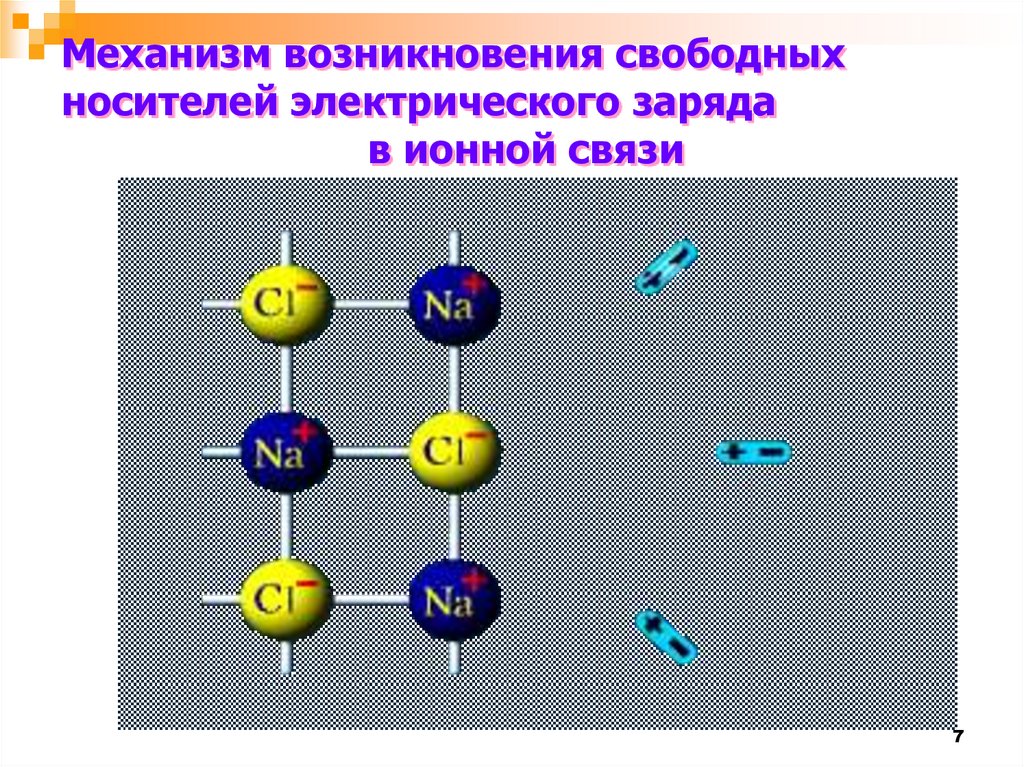
Механизм возникновения свободныхносителей электрического заряда
в ионной связи
7
8.
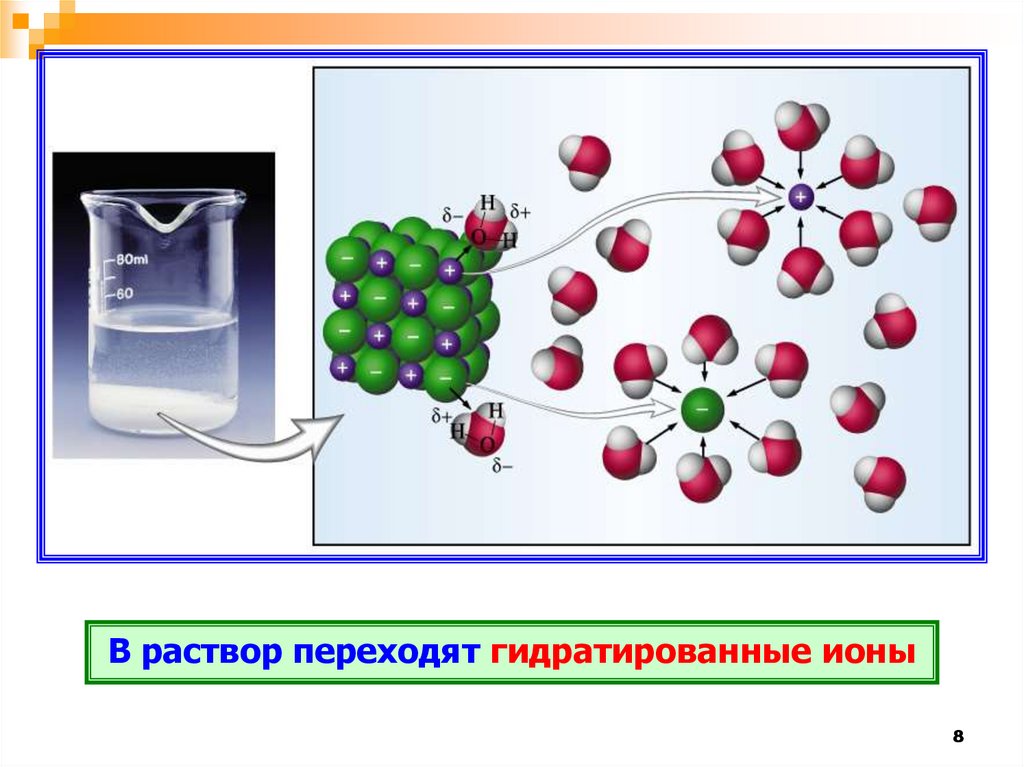
В раствор переходят гидратированные ионы8
9.
Механизм возникновения свободныхносителей электрического заряда в КПС
9
10.
Диссоциация – процессрасщепления веществ на
ионы противоположного
знака.
Д
Электролитывещества с ионной проводимостью.
11.
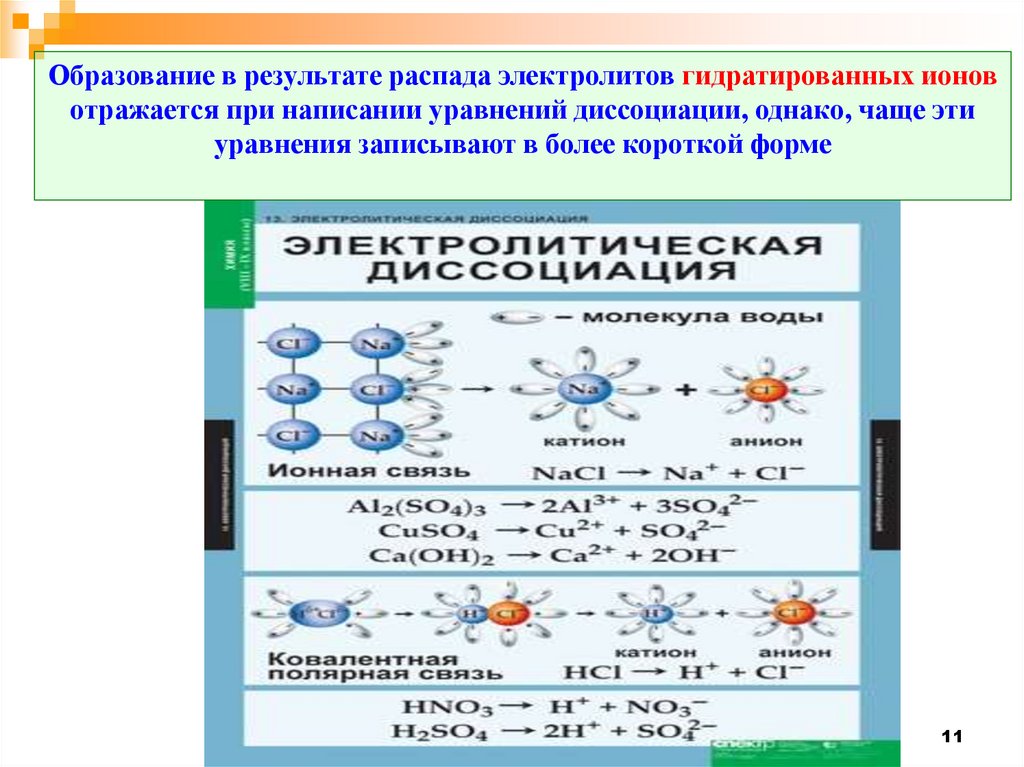
Образование в результате распада электролитов гидратированных ионовотражается при написании уравнений диссоциации, однако, чаще эти
уравнения записывают в более короткой форме
11
12.
Количественная характеристикапроцесса диссоциации
Отношение числа распавшихся молекул к
общему числу молекул в растворе
Сила электролита
12
13.
1314.
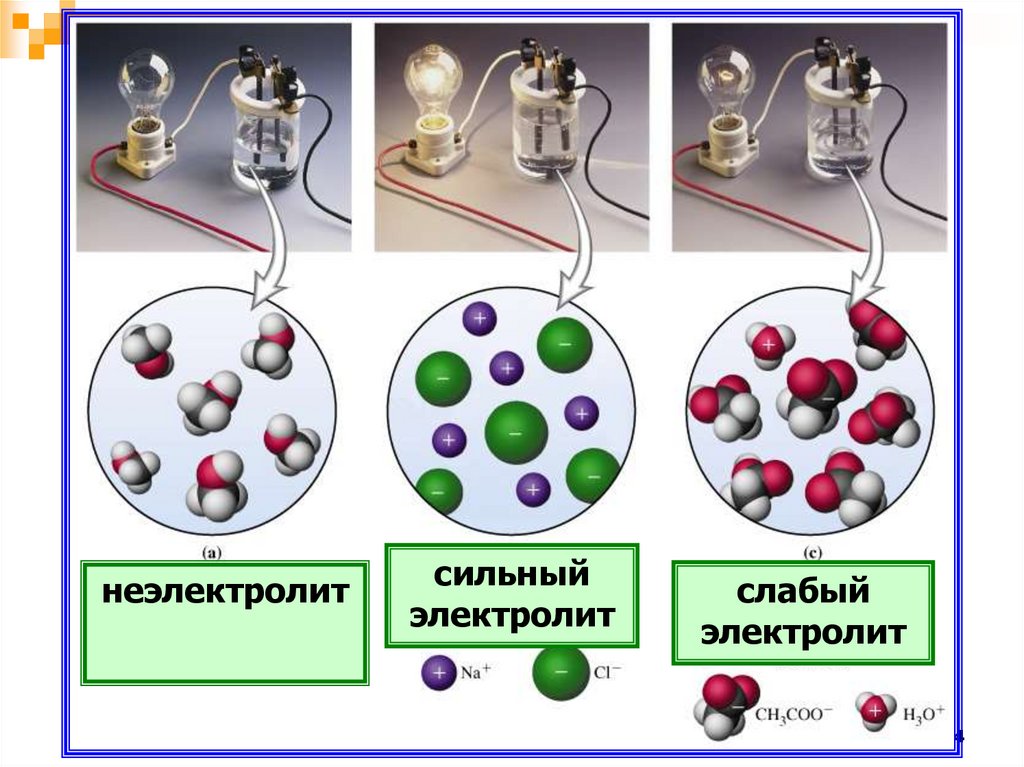
неэлектролитсильный
электролит
слабый
электролит
14
15.
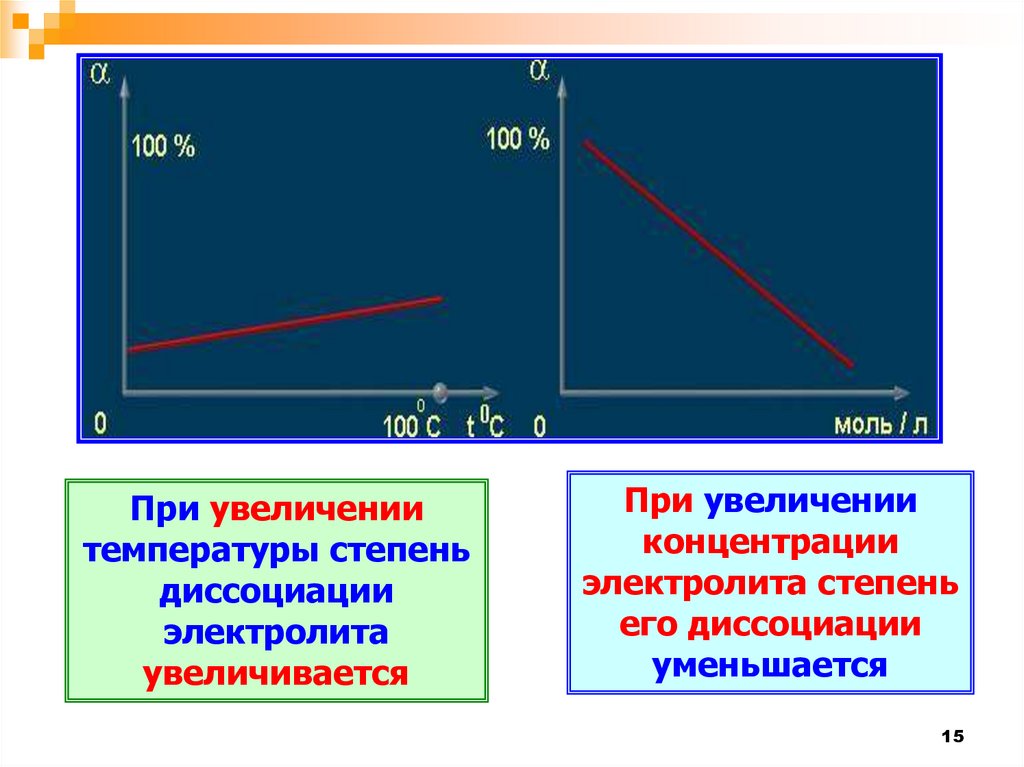
При увеличениитемпературы степень
диссоциации
электролита
увеличивается
При увеличении
концентрации
электролита степень
его диссоциации
уменьшается
15
16.
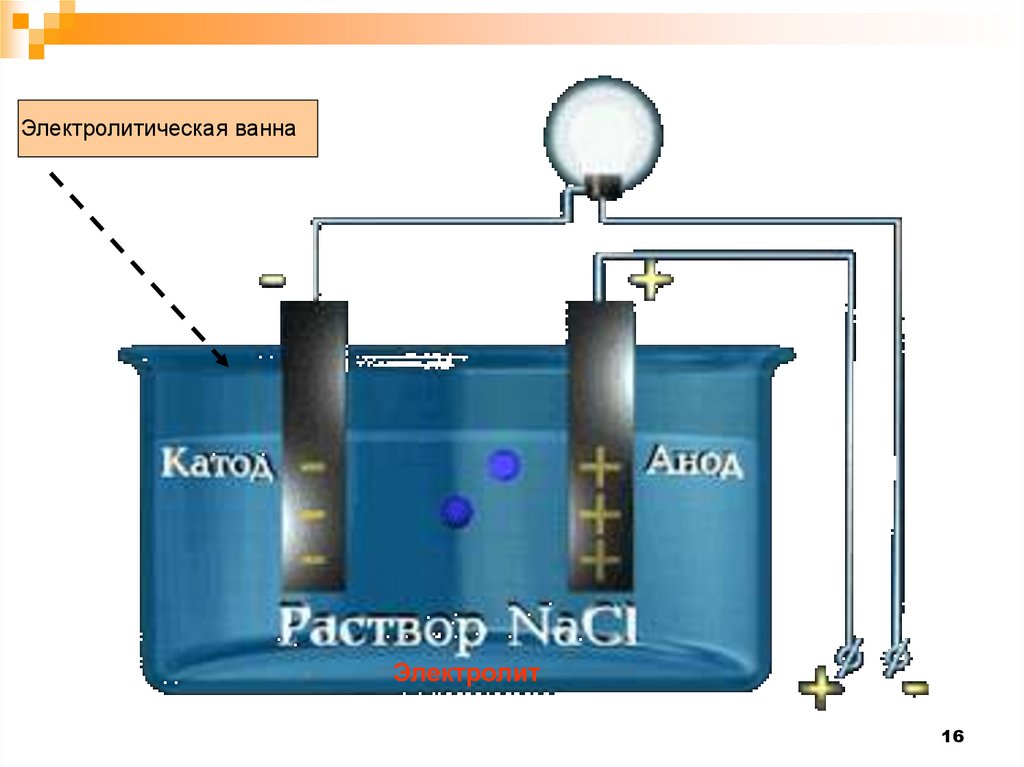
Электролитическая ваннаЭлектролит
16
17.
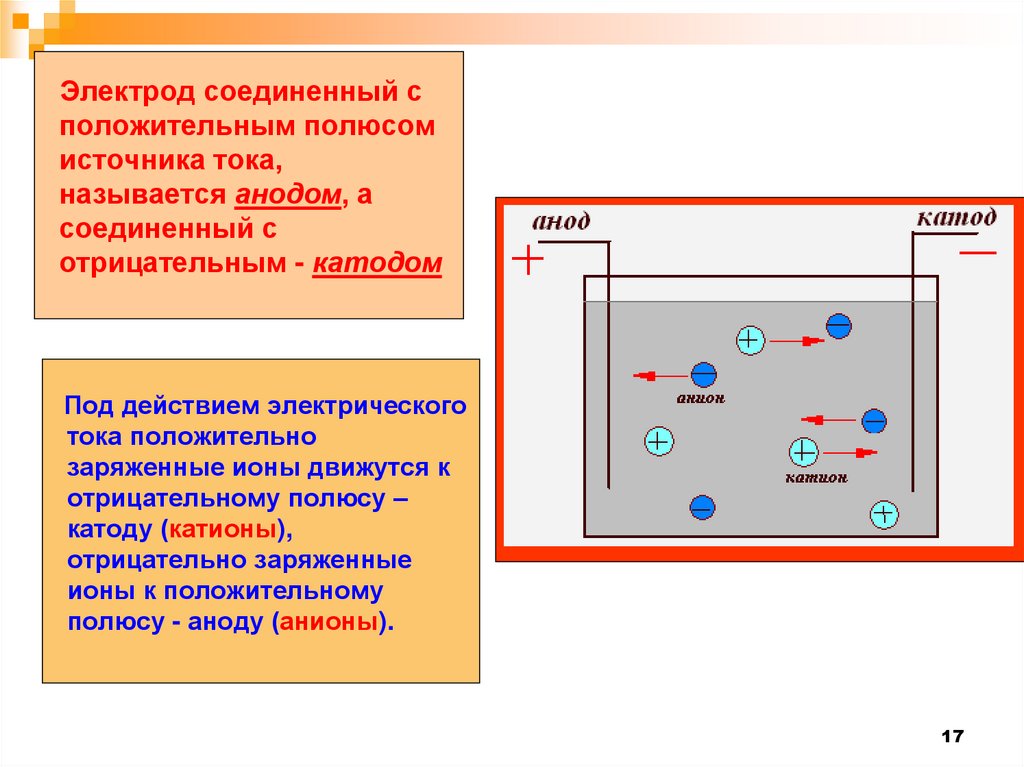
Электрод соединенный сположительным полюсом
источника тока,
называется анодом, а
соединенный с
отрицательным - катодом
Под действием электрического
тока положительно
заряженные ионы движутся к
отрицательному полюсу –
катоду (катионы),
отрицательно заряженные
ионы к положительному
полюсу - аноду (анионы).
17
18.
Катионы- этоположительные ионы.
Анионы- это
отрицательные ионы.
19.
Кислоты- это электролиты,диссоциирующие на катионы
+
водорода и анионы кислотного
остатка: +
HCI= H + CI
+
-
-
HNO3= H + NO3
2+
H2SO4= 2H + SO4
20.
Основания- это электролиты,диссоциирующие на катион
металла +и гидроксид ионы:
-
NaOH=Na + OH
Са(OH)2= Ca +2OH
21.
Соли- это электролиты,диссоциирующие на катион
металла и анион кислотного
остатка:
2+
2CuSO4 = Cu +SO4
+
3K3PO4= 3K +PO4
3+
2-
AI2(SO4)3 = 2AI + 3SO4
22.
--
-
+
+
+
Спасибо за внимание
-
+
+
22











 chemistry
chemistry








