Similar presentations:
Электролитическая диссоциация
1.
Электролитическаядиссоциация
2.
• Домашнее задание:• Смешали 30 г 15% раствора хлорида калия и
50 г 10% раствора хлорида калия. Рассчитать
массовую долю полученного раствора.
11.11.2021
2
3.
Что такое электрический ток?Способность проводить
электрический ток — одна из
важнейших характеристик растворов
веществ.
4.
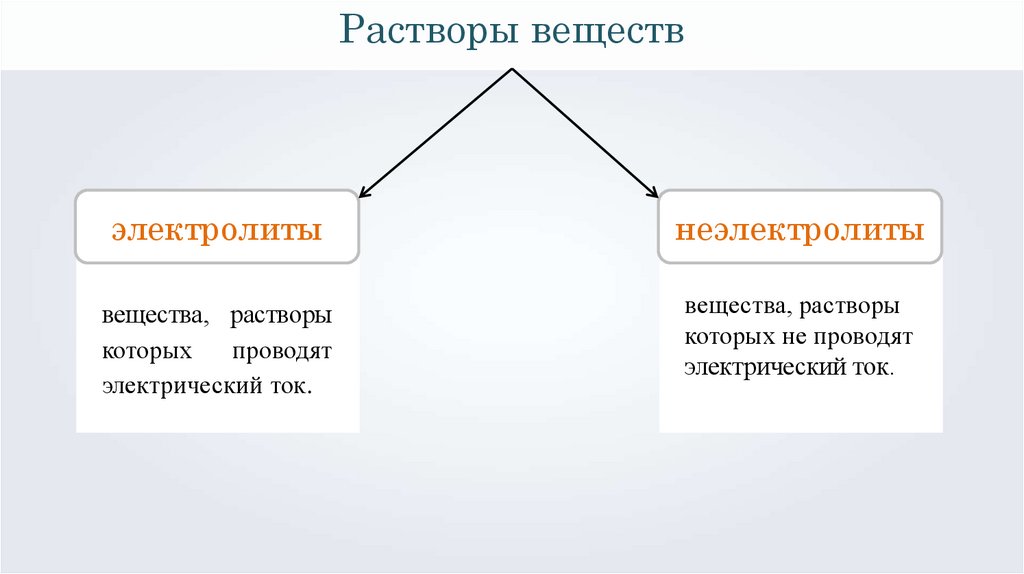
Растворы веществэлектролиты
неэлектролиты
вещества, растворы
которых
проводят
электрический ток.
вещества, растворы
1 проводят
которых не
электрический ток.
5.
–+
+
–
Электролитическая
диссоциация — процесс распада
электролита на ионы.
6.
–+
–
+
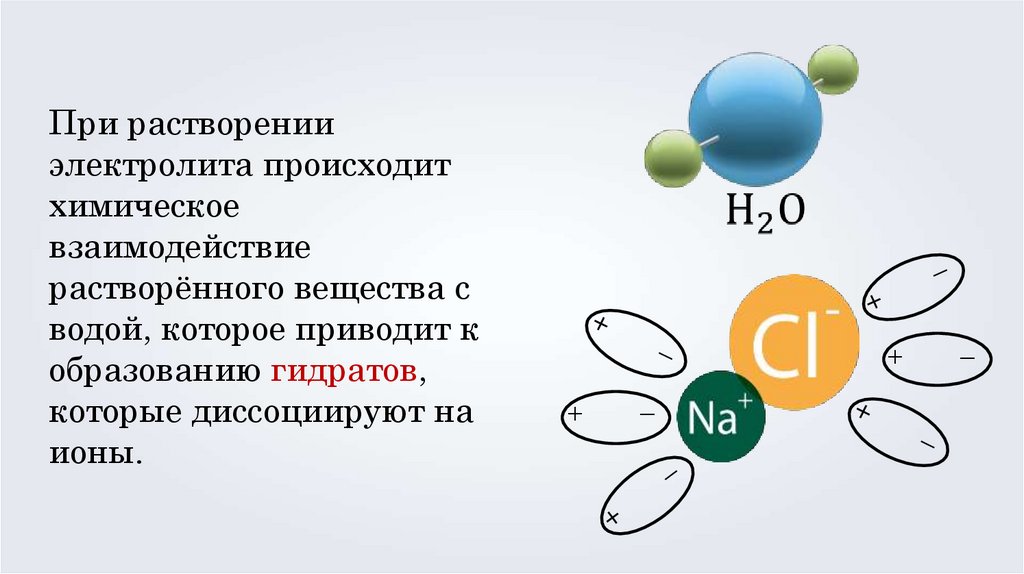
При растворении
электролита происходит
химическое
взаимодействие
растворённого вещества с
водой, которое приводит к
образованию гидратов,
которые диссоциируют на
ионы.
7.
Диссоциация вещества–
+
–
+
8.
Диссоциация вещества+
–
+
+
–
–
+
–
–
+
+
–
–
+
–
+
9.
Процессы при диссоциациивеществ в воде
1. Ориентация двухполярных молекул воды около
ионов кристалла.
2. Взаимодействие молекул воды с противоположно
заряженными ионами поверхностного слоя
кристалла или гидратация.
3. Распад кристалла электролита
на гидратированные ионы (диссоциация).
10.
–+
–
Ассоциация — процесс, при
котором хаотически движущиеся
гидратированные ионы могут
столкнуться и объединиться.
+
11.
+-
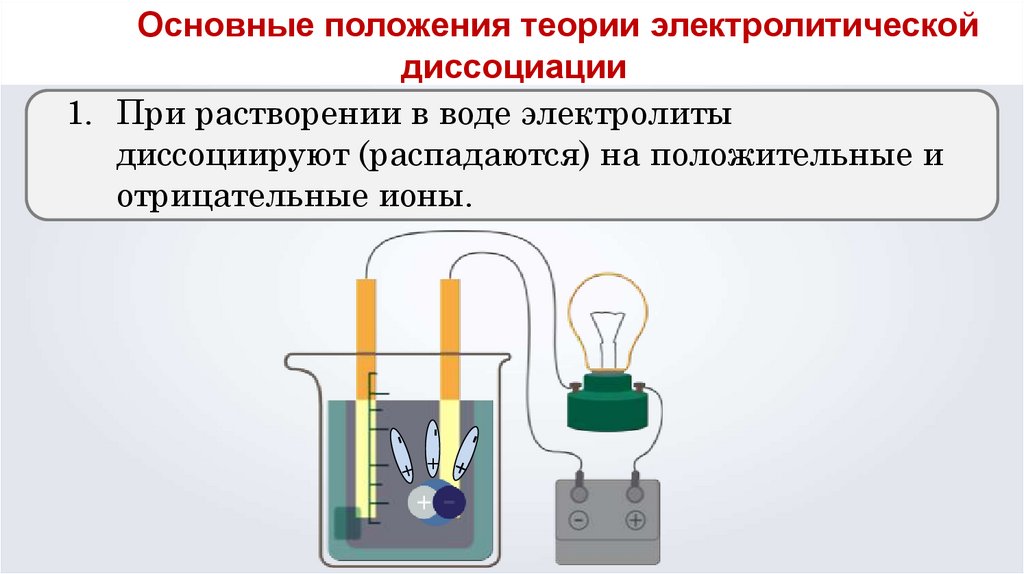
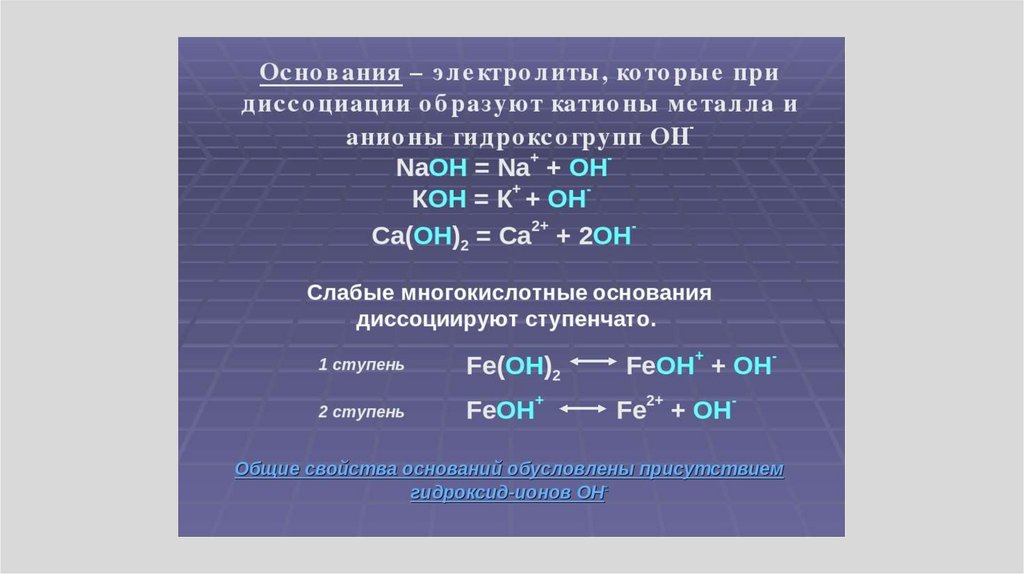
Основные положения теории электролитической
диссоциации
1. При растворении в воде электролиты
диссоциируют (распадаются) на положительные и
отрицательные ионы.
12.
Ионы+
H
+
Na
—
Cl
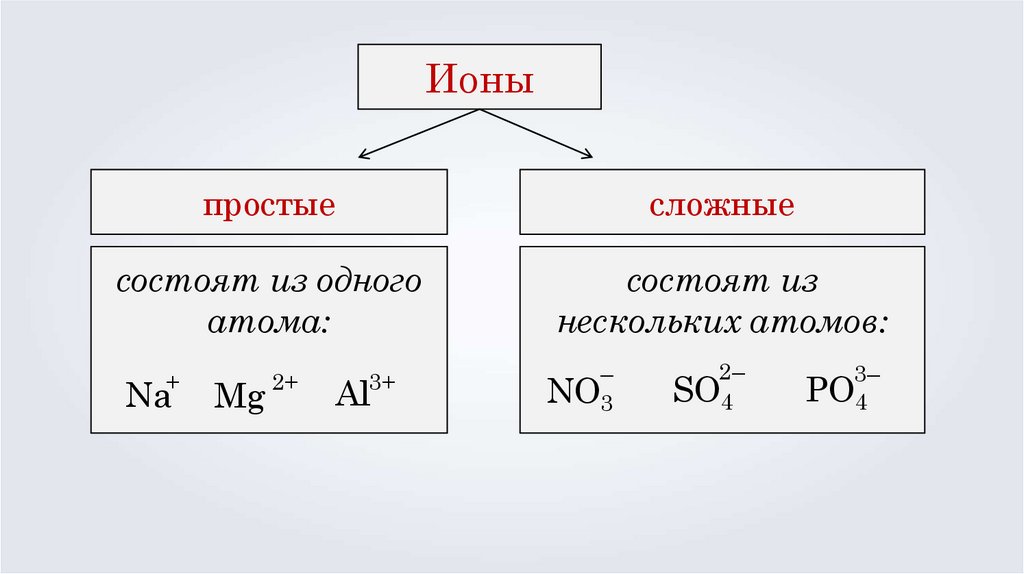
Ионы — это атомы или группы атомов,
обладающие положительным или отрицательным
зарядом.
13.
Ионыпростые
сложные
состоят из одного
атома:
состоят из
нескольких атомов:
+
Na
Мg
2+
3+
Al
–
NO3
2–
SO4
3–
PO4
14.
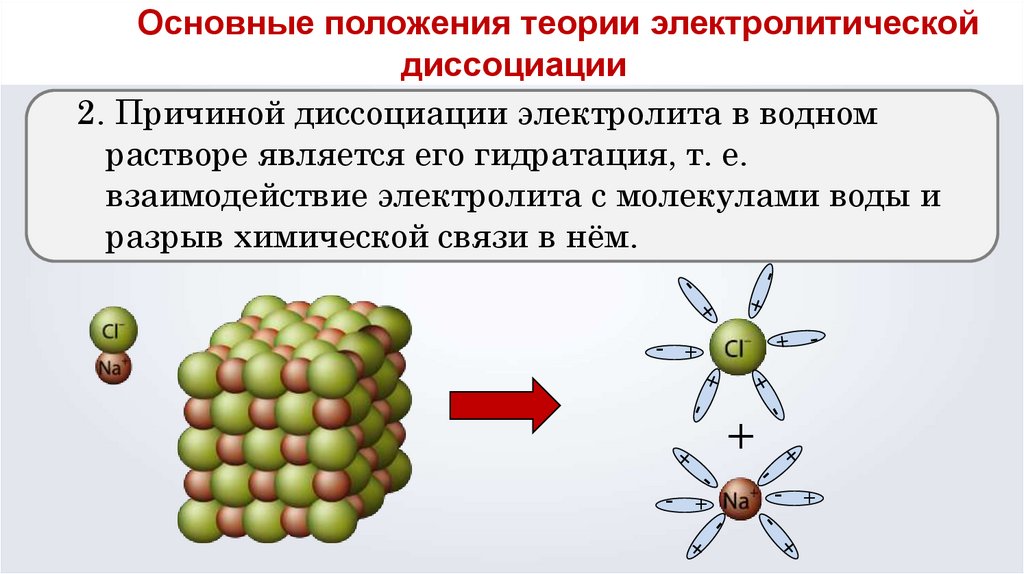
Основные положения теории электролитическойТеория электролитической
диссоциации
диссоциации
2. Причиной диссоциации электролита в водном
растворе является его гидратация, т. е.
взаимодействие электролита с молекулами воды и
разрыв химической связи в нём.
+
-
+
+
-
+
-
15.
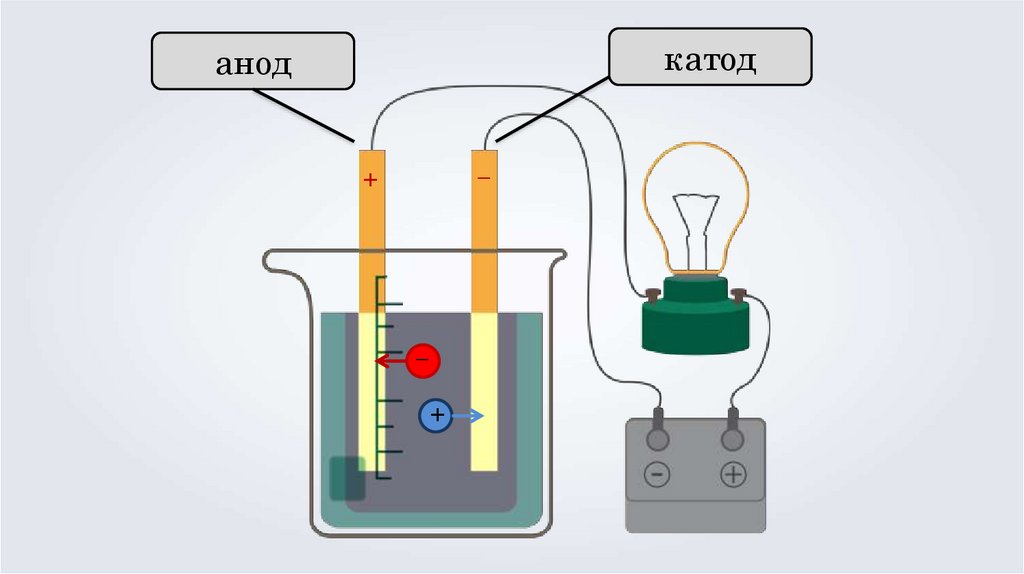
Основные положения теории электролитическойдиссоциации
3. Под действием электрического тока, положительно
заряженные ионы движутся к отрицательно
заряженному полюсу источника тока — катоду,
поэтому их называют катионами, а отрицательно
заряженные ионы движутся к положительному
полюсу источника тока — аноду, поэтому их
называют анионами.
16.
катоданод
–
+
–
+
17.
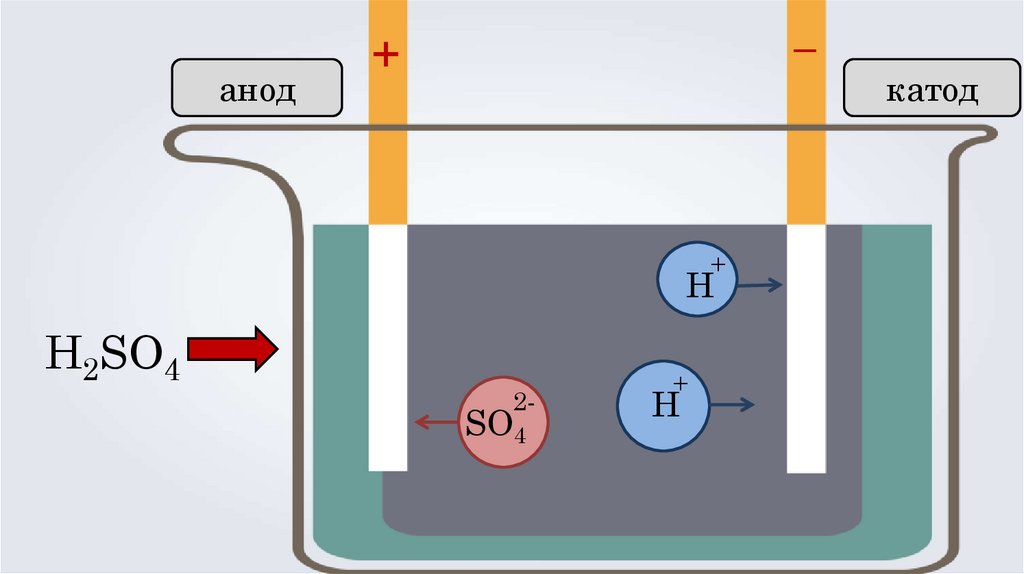
анод–
+
+
Н
H2SO4
2-
SO4
+
Н
катод
18.
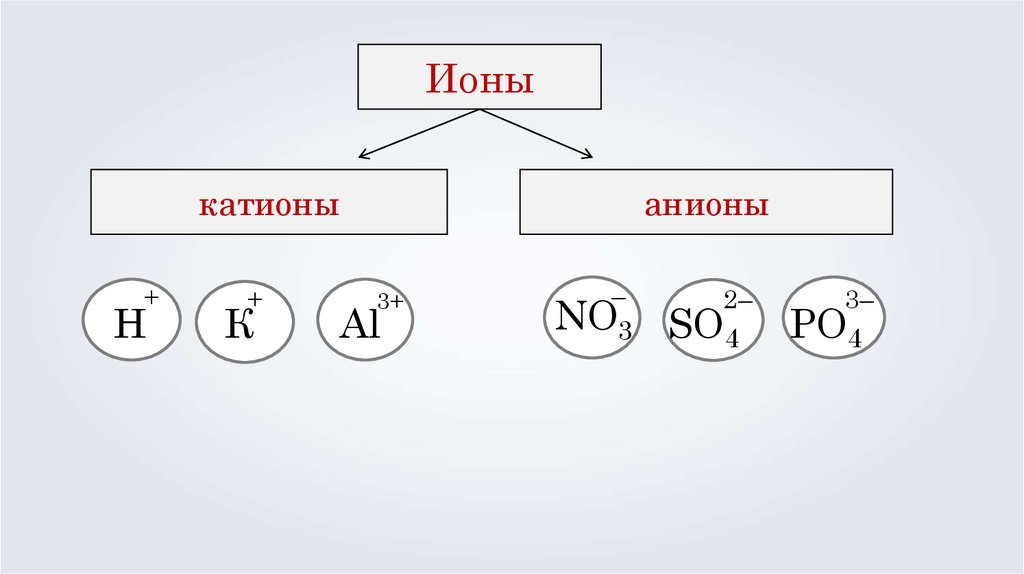
Ионыкатионы
+
Н
+
К
анионы
3+
Al
–
NO3
2–
SO4
3–
PO4
19.
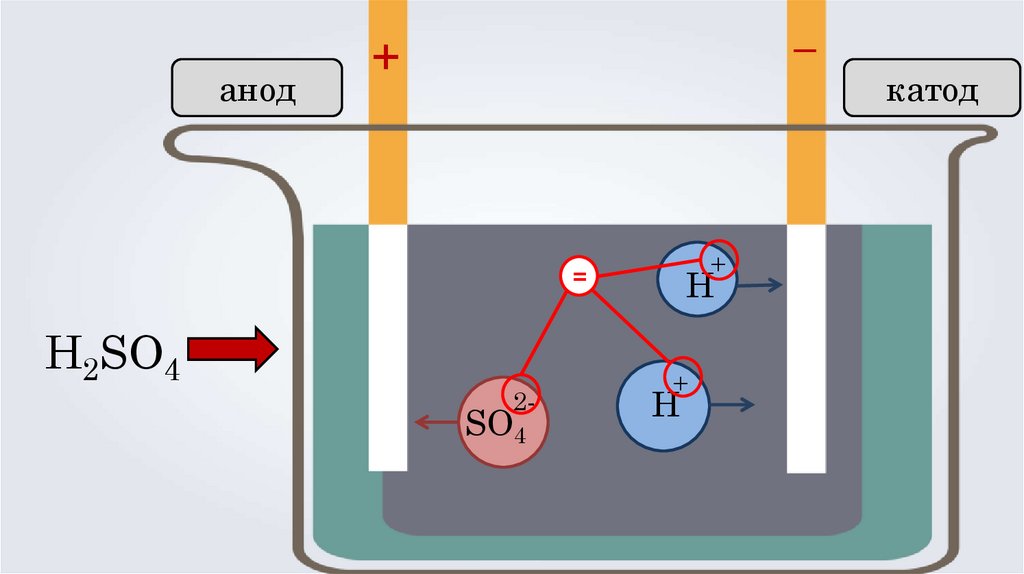
анод–
+
+
=
H2SO4
2-
SO4
Н
+
Н
катод
20.
Основные положения теории электролитическойдиссоциации
4. Электролитическая диссоциация — процесс
обратимый для слабых электролитов.
Н2СО3
+
2Н +
2СО3
5. Ионы отличаются от атомов как по строению так и
по свойствам.
21.
nДa = nр
Степень диссоциации (α) — это
отношение количества вещества
электролита, распавшегося на ионы
(nД), к общему количеству
растворённого вещества (nр).
22.
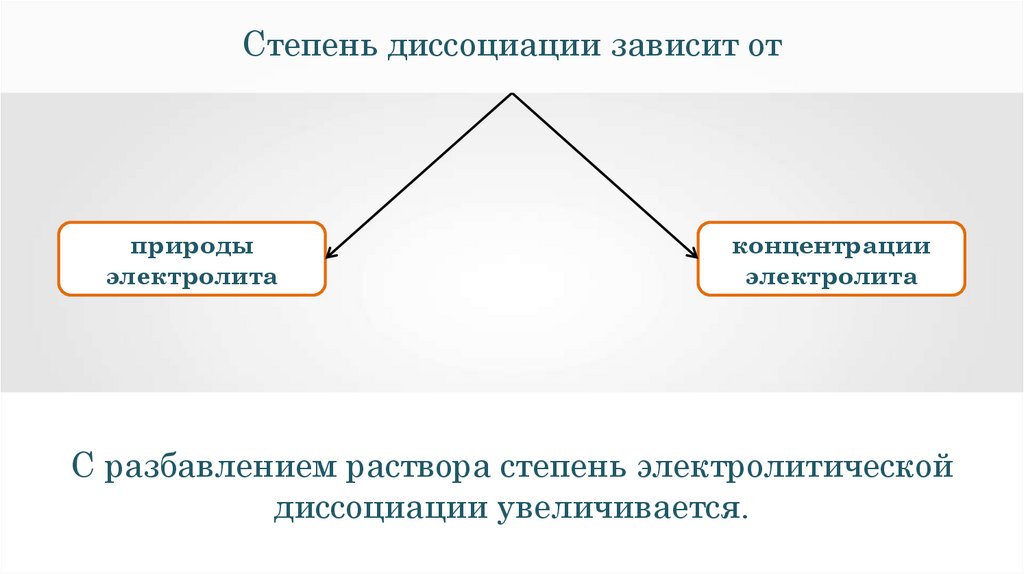
Степень диссоциации зависит отприроды
электролита
концентрации
электролита
С разбавлением раствора степень электролитической
диссоциации увеличивается.
23.
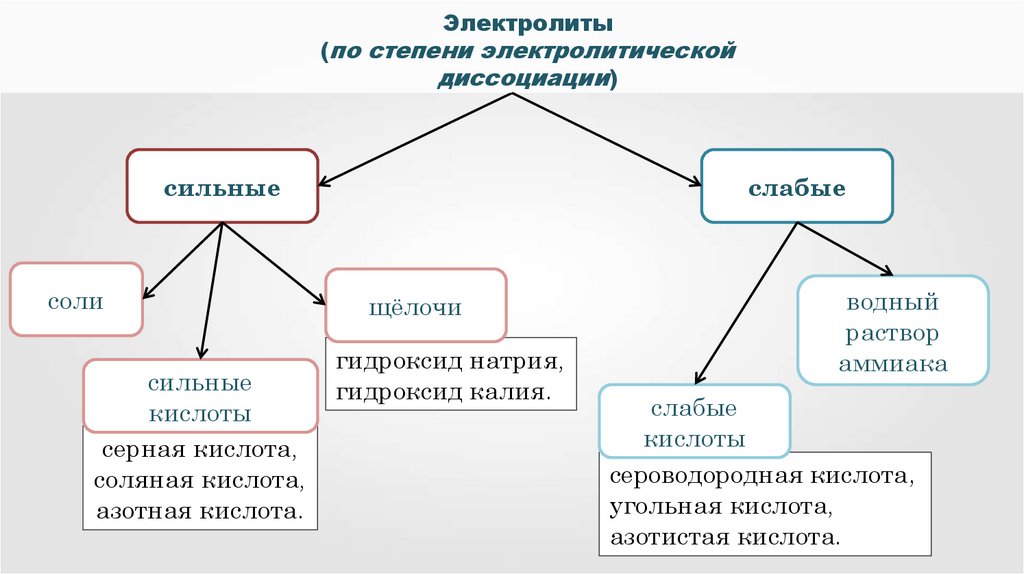
Электролиты(по степени электролитической
диссоциации)
сильные
соли
сильные
кислоты
серная кислота,
соляная кислота,
азотная кислота.
слабые
щёлочи
гидроксид натрия,
гидроксид калия.
водный
раствор
аммиака
слабые
кислоты
сероводородная кислота,
угольная кислота,
азотистая кислота.

















 chemistry
chemistry








