Similar presentations:
Алкадиены. Диолефины
1.
АлкадиеныДиолефины
Диеновые углеводороды
CnH2n-2
2.
Алкадиеныс изолированными
двойными связями :
с сопряжёнными или
конъюгированными
двойными связями
СН2=СН- СН2-СН2-СН=СН2
СН2=СН- СН=СН2
гексадиен-1,5
бутадиен- 1,3
с кумулированными или
алленовыми
двойными связями
СН2=С=СН2
пропадиен или аллен
дивинил
3.
дивинилизопрен
аллен
4.
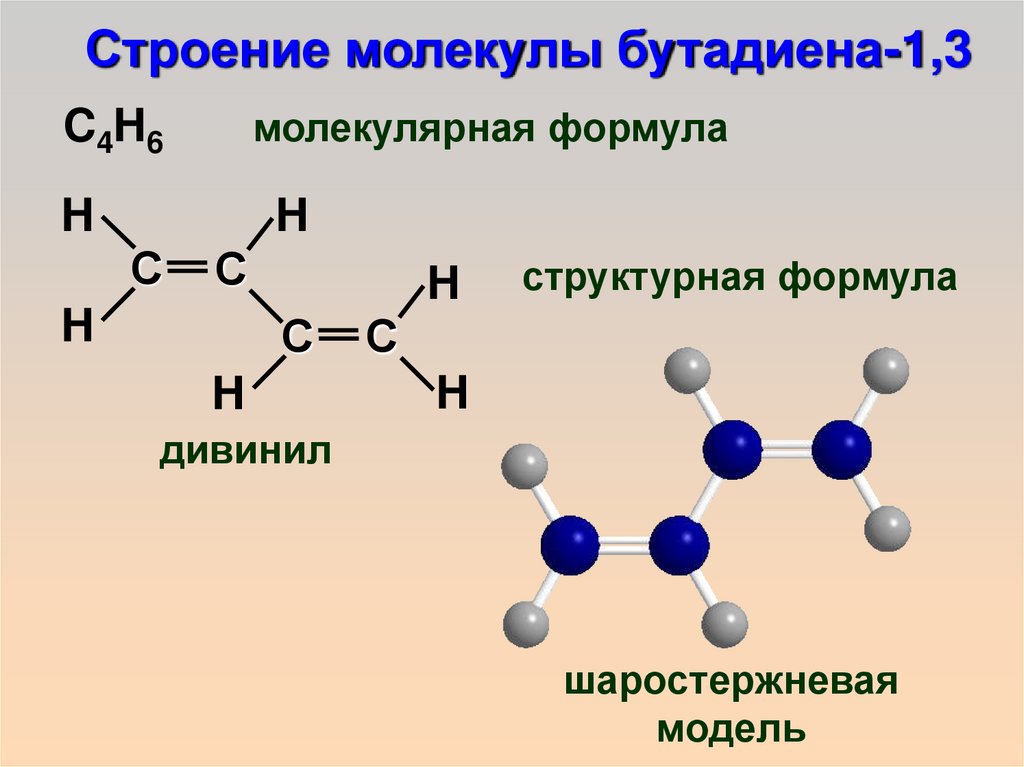
Строение молекулы бутадиена-1,3C 4H 6
молекулярная формула
H
H
С
С
H
H
С
H
структурная формула
С
H
дивинил
шаростержневая
модель
5.
2p*
С
П
Л
О
С
К
О
С
Т
Н
О
Е
С
Т
Р
О
Е
Н
И
Е
H
2S
sp2
H
- гибрид.,
валентный угол 120 о
=>
120o
0,136 нм
С С
0,146 нм
120o
Образование σ-связи
H
С С
H
H
H
6.
Образование π-связиCH2 CH CH CH2
неточно
CH2 CH CH CH2
более точно
В молекуле бутадиена единая 4-х электронная
полностью делокализованная π-связь. Это
называет-ся системой сопряжения.
7.
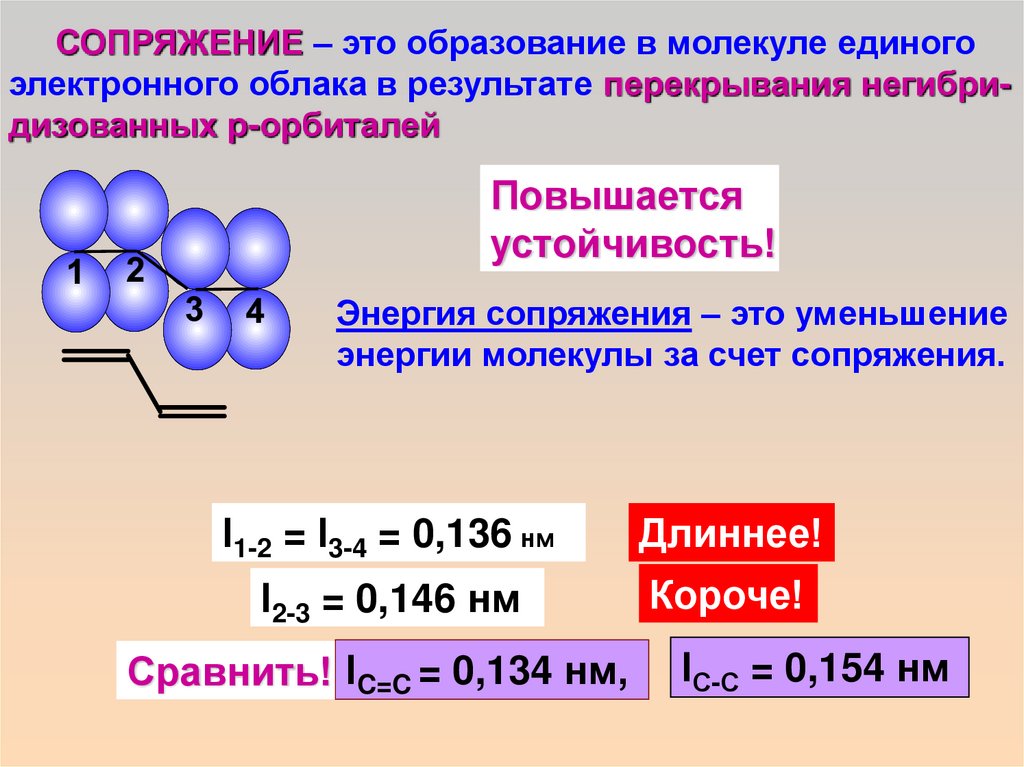
СОПРЯЖЕНИЕ – это образование в молекуле единогоэлектронного облака в результате перекрывания негибридизованных р-орбиталей
Повышается
устойчивость!
Энергия сопряжения – это уменьшение
энергии молекулы за счет сопряжения.
l1-2 = l3-4 = 0,136 нм
Длиннее!
l2-3 = 0,146 нм
Короче!
Сравнить! lC=C = 0,134 нм,
lС-С = 0,154 нм
8.
Гомологический ряд,номенклатура, изомерия
Гомологи - это вещества с одинаковыми химическими
свойствами, но отличающиеся друг от друга по составу на одну
или несколько групп СН2, т.е. на гомологическую разность.
C 4H 6
CH2
CH
CH
C5H8 CH2
CH
CH
CH2
C
изомеры
CH2
CH
CH2 бутадиен-1,3
дивинил
CH
CH2
CH3
пентадиен-1,3
CH3
2-метилбутадиен-1,3
изопрен
CH
CH2 CH
CH2
пентадиен-1,4
9.
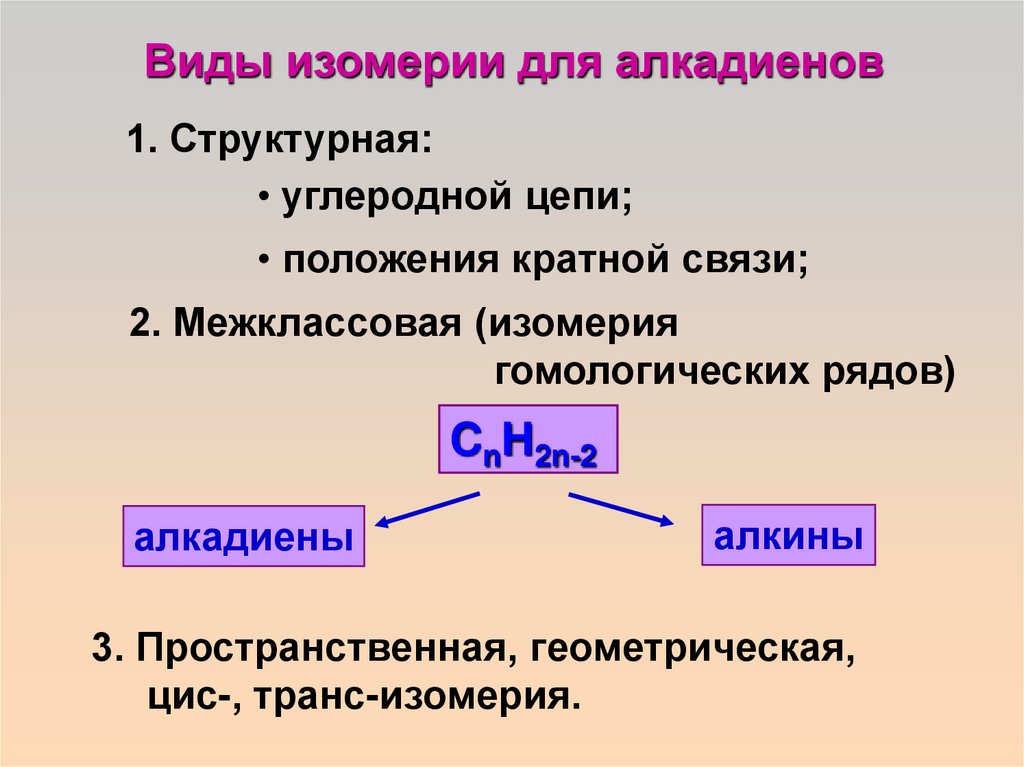
Виды изомерии для алкадиенов1. Структурная:
• углеродной цепи;
• положения кратной связи;
2. Межклассовая (изомерия
гомологических рядов)
CnH2n-2
алкадиены
алкины
3. Пространственная, геометрическая,
цис-, транс-изомерия.
10.
Геометрическая изомерия алкадиеновH
H
С
С
H
С
H 3С
H
цис-изомер
гексадиена-2,4
С
СH3
H 3С
транс-изомер
гексадиена-2,4
H
С
С
H
H
С
H
С
СH3
11.
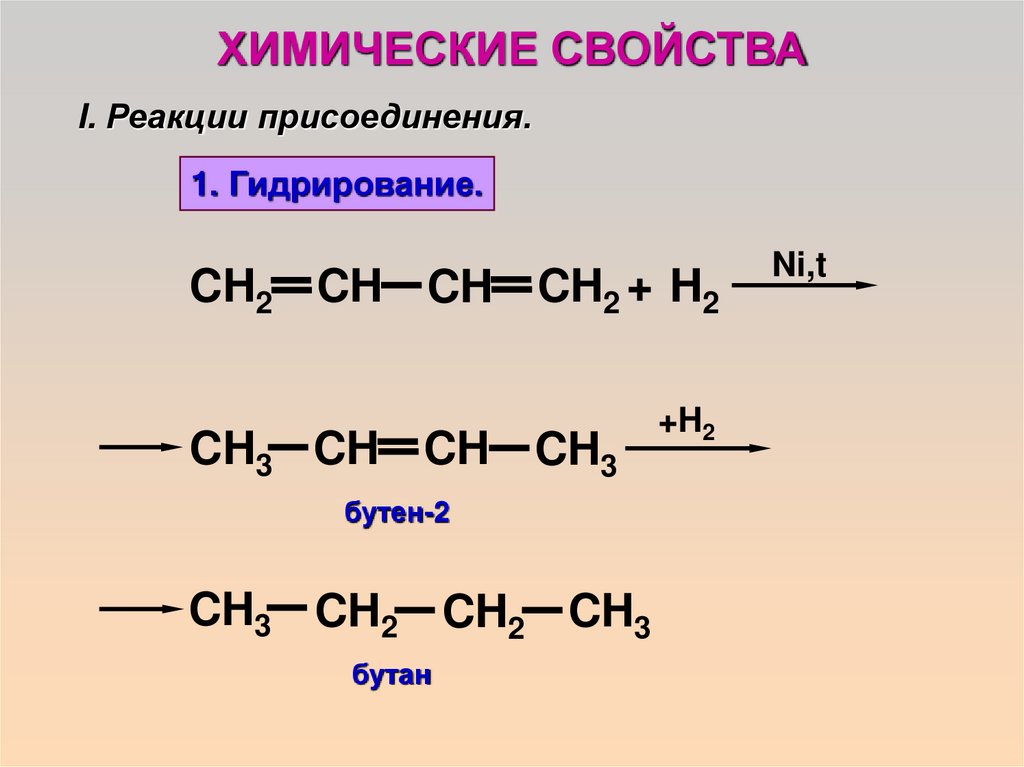
ХИМИЧЕСКИЕ СВОЙСТВАI. Реакции присоединения.
1. Гидрирование.
CH2 CH CH CH2 + H2
CH3 CH CH CH3
бутен-2
CH3 CH2 CH2 CH3
бутан
+H2
Ni,t
12.
Электрофильное присоединение ( АЕ )2. Галогенирование.
CH2 CH CH CH2 + Br2
aq
CH2Br CH CH CH2Br
+Br2
1,4-дибромбутен-2
CH2Br CHBr CHBr
CH2Br
1,2,3,4-тетрабромбутан
!
бромная вода обесцвечивается
13.
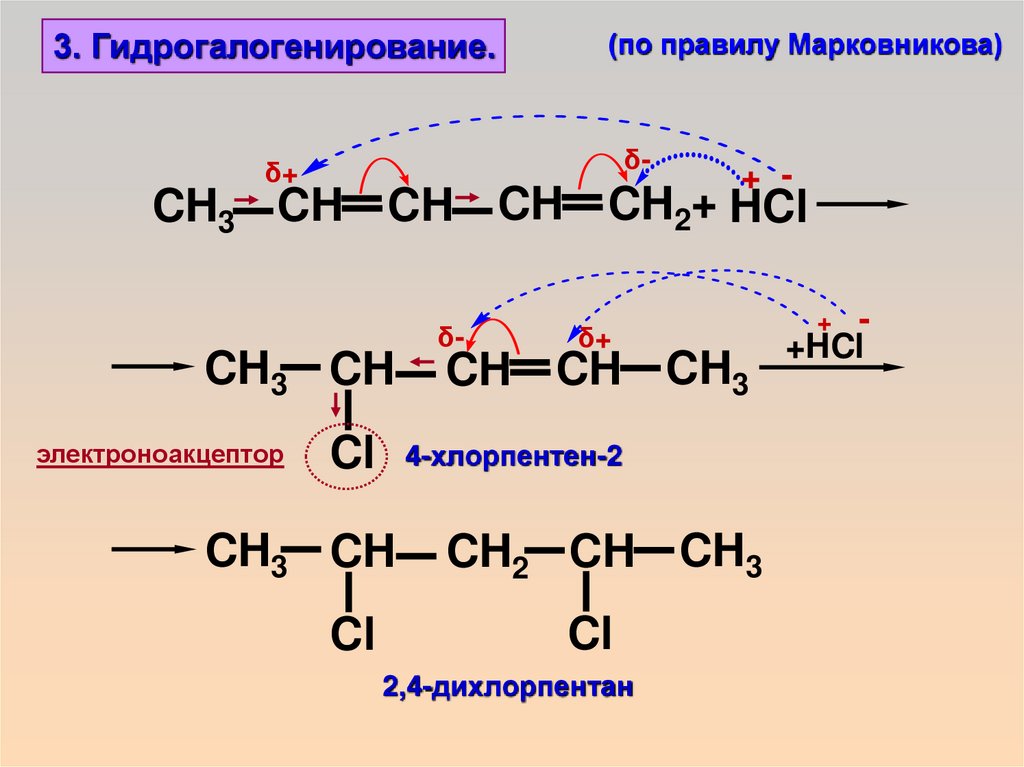
3. Гидрогалогенирование.(по правилу Марковникова)
δ-
δ+
+ -
CH3 CH CH CH CH2+ HCl
CH3 CH
электроноакцептор
δ-
δ+
CH CH CH3
Cl 4-хлорпентен-2
CH3 CH
Cl
CH2 CH CH3
Cl
2,4-дихлорпентан
+HCl
+
14.
3. Гидратация.(по правилу Марковникова)
CH2 CH CH CH2+ HОН
H2SO4,t
симметричный
CH2
электроноакцептор
OH
δ-
δ+
CH CH CH3
бутен-2-ол-1
CH2
CH2 CH CH3
ОН
ОН
бутандиол-1,3
+ +HOH
15.
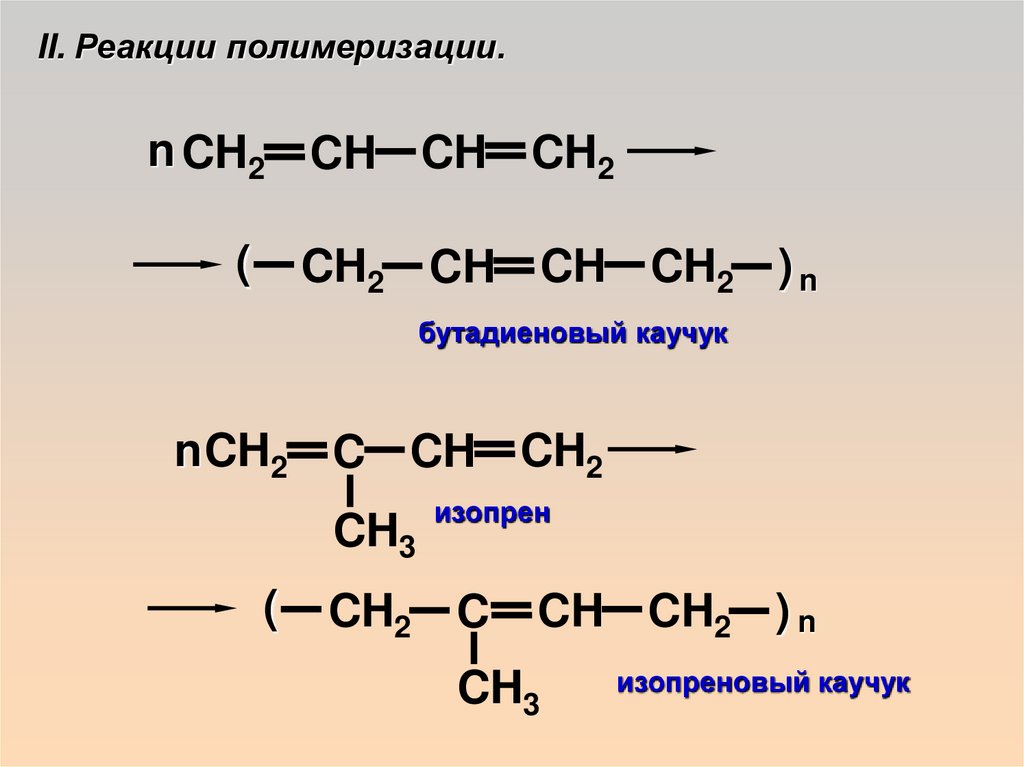
II. Реакции полимеризации.n CH2 CH CH CH2
(
CH2 CH CH CH2 ) n
бутадиеновый каучук
n CH2 C CH CH2
CH3
(
изопрен
CH2 C
CH CH2 ) n
CH3
изопреновый каучук
16.
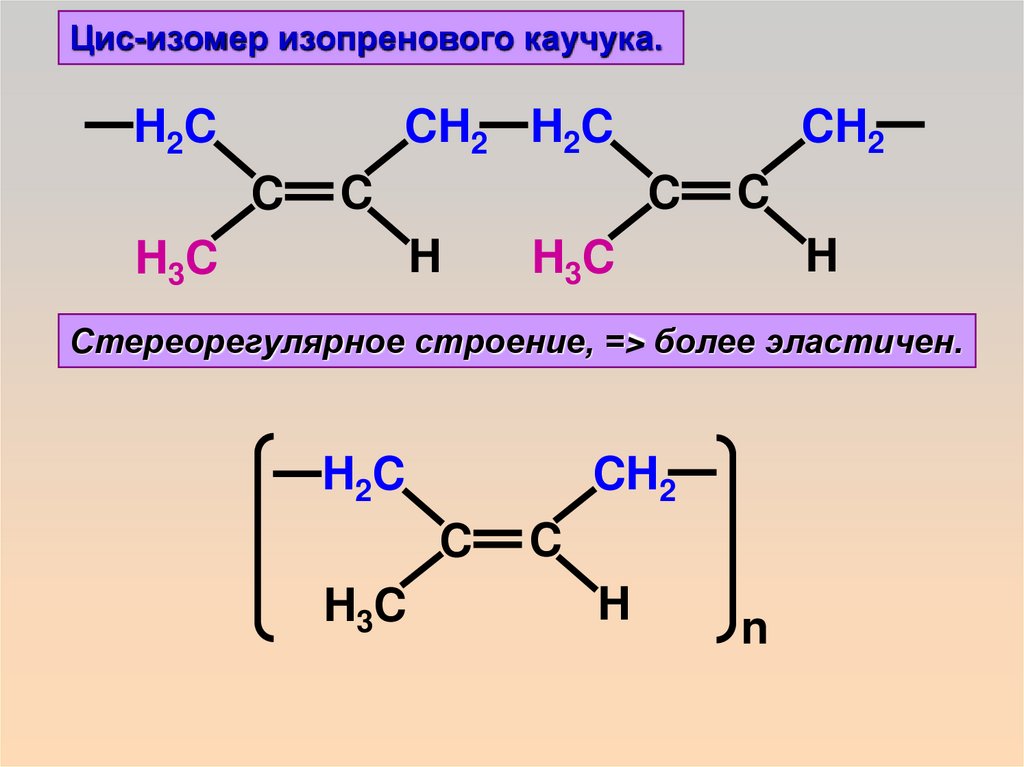
Цис-изомер изопренового каучука.CH2 H2C
H2C
C
C
C
H
H 3C
CH2
C
H
H 3C
Стереорегулярное строение, => более эластичен.
H2C
CH2
C
H3C
C
H
n
17.
III. Реакции окисления.а) Горение
2 С4Н6 + 11 О2
8 СО2+ 6 Н2О
б) Каталитическое окисление
1. Окисление пероксидом водорода.
CH2 CH CH CH2 + Н2О2
CH2 CH CH CH2
OH
OH
OsO4
+H2O2
бутен-2-диол-1,4
CH2 CH CH CH2
OH
OH OH OH
бутантетраол
18.
2. Окисление раствором KMnO4CH2 CH CH CH2 + KMnO4 + Н2О
CH2 CH CH CH2 + MnO2 + KОН
OH
OH OH OH
CH2 CH CH CH2 + KMnO4 + Н2SО4
CО2+ НОOC
CОOН + K2SO4+
+ MnSO4 + Н2О
Расставить коэффициенты!
19.
Получение алкадиенов.1) Дегидрирование алканов, алкенов
CH3 CH2 CH2
CH3
Cr2O3,t
CH2 CH CH CH2+ 2 Н2
2) Дегалогенирование тетрагалогеналканов
CH2 CH CH CH2 + 2 Zn
Cl
Cl
Cl
Cl
CH2 CH CH CH2 + 2 ZnCl2
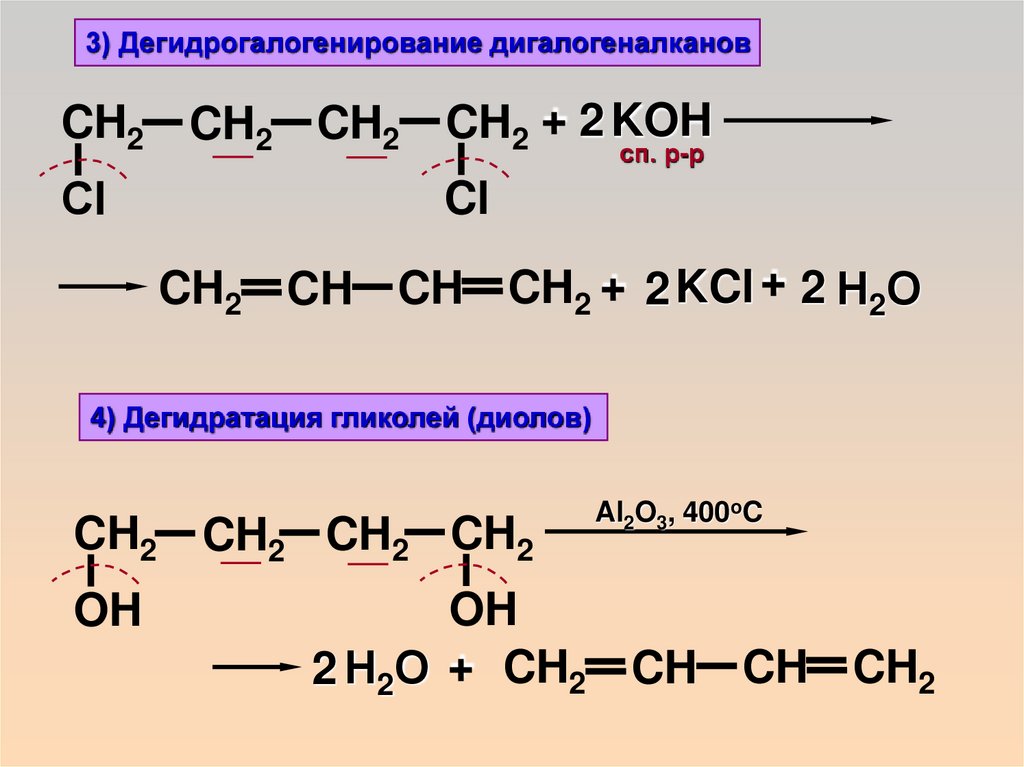
20.
3) Дегидрогалогенирование дигалогеналкановCH2 CH2 CH2
CH2 + 2 KOH
Сl
Cl
сп. р-р
CH2 CH CH CH2 + 2 KCl + 2 Н2О
4) Дегидратация гликолей (диолов)
CH2 CH2 CH2 CH2
OH
Al2O3, 400oC
OH
2 Н2О + CH2 CH CH CH2
21.
Реакция Лебедева – промышленный способ получения дивинила.H
H
H
H
H
C
C H + H
C
H
OH
OH H
C H
Al2O3, Cr2O3
ZnO, t
2 Н2О + Н2 + CH2 CH CH CH2
Внутримолекулярная дегидратация с одновременным
межмолеулярным дегидрированием
2 CH3
CH2OH
Al2O3, Cr2O3, ZnO, t
2 Н2О + Н2 + CH2 CH CH CH2













 chemistry
chemistry








