Similar presentations:
Ионная хроматография (ИХ)
1. Ионная хроматография (ИХ) является высокоэффективным вариантом ионообменной хроматографии (ИОХ), в которой разделяемые ионы
определяются в проточном, как правило,кондуктометрическом детекторе.
Метод основан на элюентном ионообменном
разделении катионов или анионов в разделяющей
колонке, подавлении фонового сигнала элюента в
подавляющей колонке и детектировании ионов после
разделения
Качественный анализ в ИХ осуществляется по времени
удерживания ионов, количественный – по площади или
высоте хроматографических пиков.
Специфическое строение ионита и высокое (до 10 МПа)
давление в системе обеспечивают высокую
эффективность разделения ионов.
1
2. План
1. Значение и области применения ионнойхроматографии (ИХ)
2. Принцип метода. Качественный и
количественный анализ
3. Блок-схема хроматографа. Одноколоночная
схема. Двухколоночная схема
4. Разделение катионов и анионов
5. Элюенты в ИХ
6. Детекторы в ИХ
7. Примеры практического применения
2
3. Литература: 1. Основы аналитической химии. В 2 кн. Кн. 1. Общие вопросы. Методы разделения. Под ред. Ю.А. Золотова. – М.: Высш.
шк., 2004. – С.316.2. О.М. Лисенко, Б.Й. Набиванец. Вступ до
хромаграфічного аналізу. Навчальний посібник. – К.:
Корвін-прес, 2005. – 187 с.
3. Ионная хроматография и ее применение в анализе
вод. О.А. Шпигун, Ю.А. Золотов. – М.: МГУ, 1990.
4.
В основу классического варианта метода положено:● элюентное ионообменное разделение катионов или
анионов в разделяющей колонке (заполнена
ионообменником низкой емкости);
● подавление фонового сигнала элюента в
подавляющей (компенсационной) колонке,
(заполнена ионообменником с высокой емкостью);
● кондуктометрическое детектирование ионов после
разделения (двухколоночный вариант).
Вторая колонка с ионитом высокой емкости
обеспечивает резкое снижение фоновой
электропроводности вследствие его химической
модификации.
F < OH < Cl < Br < NO < I < SCN < ClO
3
4
4
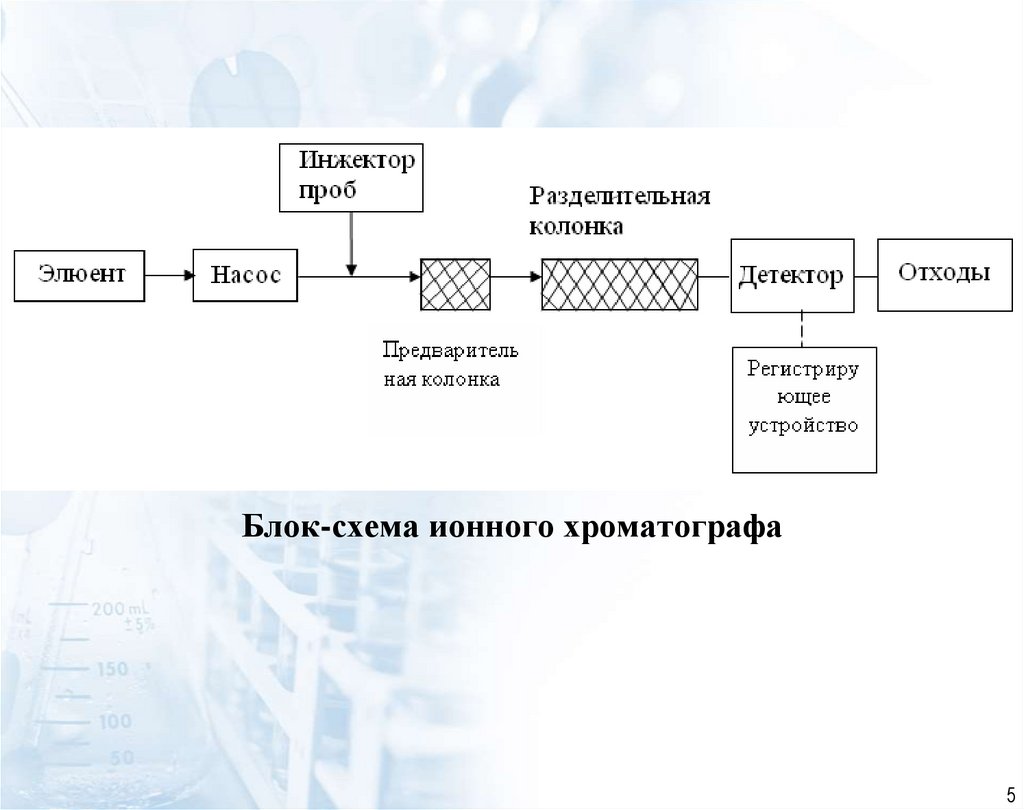
5.
Блок-схема ионного хроматографа5
6. Преимущества ионной хроматографии: • возможность одновременного определения большого числа неорганических и органических ионов.
А такжеодновременного определения катионов и анионов
• низкий предел обнаружения
• высокая эксперессность определения
• малый объем анализируемой пробы (0,1 – 0,5 мл)
• широкий диапазон определяемых концентраций (от 0,01
до 100 мкг/мл)
• простота подготовки пробы к анализу
• возможность использования различных детекторов и их
комбинаций
• линейная зависимость кондуктометрического сигнала от
концентрации ионов
6
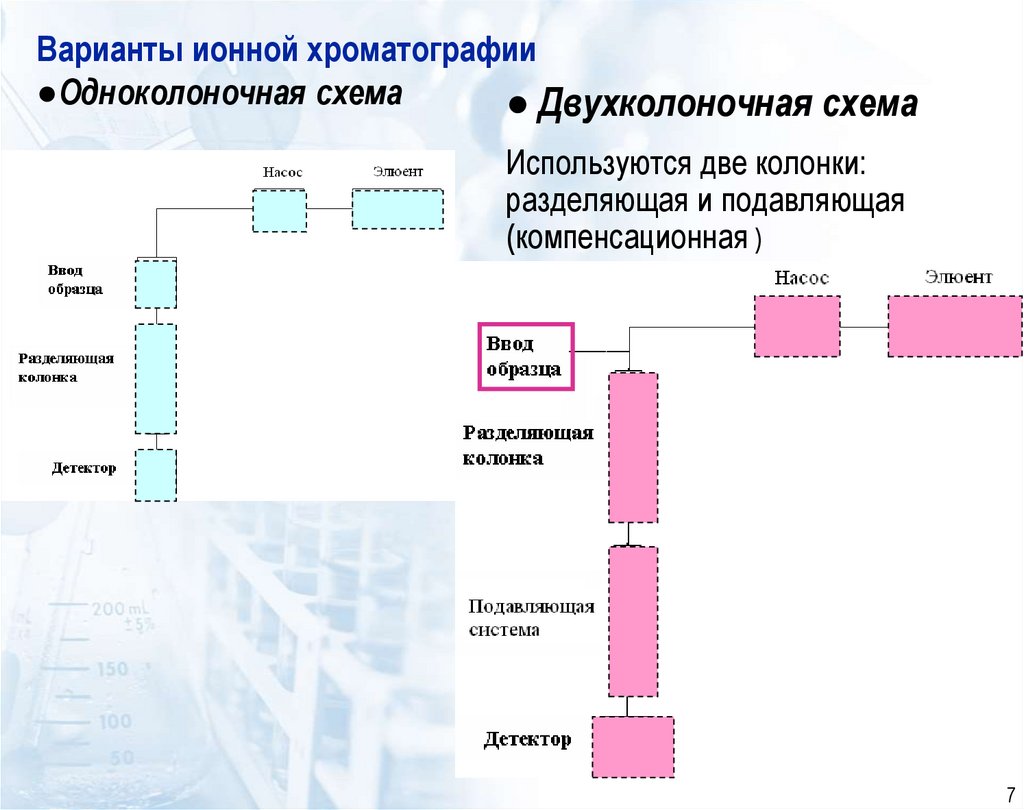
7. Варианты ионной хроматографии ●Одноколоночная схема
● Двухколоночная схемаИспользуются две колонки:
разделяющая и подавляющая
(компенсационная )
7
8. Элюент: 0,001 М HCl Происходит ионный обмен:
Разделение катионовЭлюент: 0,001 М HCl
Происходит ионный обмен:
и разделение катионов.
RH MCl RM HCl
В подавляющей колонке на анионообменнике в ОНформе происходит обмен анионов элюента и анионов
разделяемых солей на ОН-группы анионообменника
ROH HCl RCl H 2O
ROH MCl RCl MOH
Элюент преобразуется в воду, а разделяемые ионы
кондуктометрически детектируются в виде
гидроксидов (сильные электролиты).
8
9. Разделение анионов
Элюент 0,001 М NaOHПроисходит анионный обмен и разделение анионов:
RH NaOH RNa H 2O
RH MA RM HA
При разделении анионов в качестве элюентов
используют:
● карбонат натрия
● гидрокарбонат натрия
● гидроксид натрия
9
10.
Реакция в подавляющей колонке (анионы элюентареагируют со смолой):
2 RSO3 H Na2CO3 2 RSO3 Na H 2O CO2
RSO3 H NaHCO3 RSO3 Na H 2 O CO2
RSO3 H NaOH RSO3 Na H 2 O
В каждом случае ионы натрия обмениваются с
протонами смолы подавляющей колонки.
Элюирующий анион превращается в слабый
электролит с низкой электропроводностью H O
2
или H 2 CO3.
Вторая реакция – конверсия анионных групп
в единую высокопроводящую форму:
3
3
SO H Na An SO Na An H
10
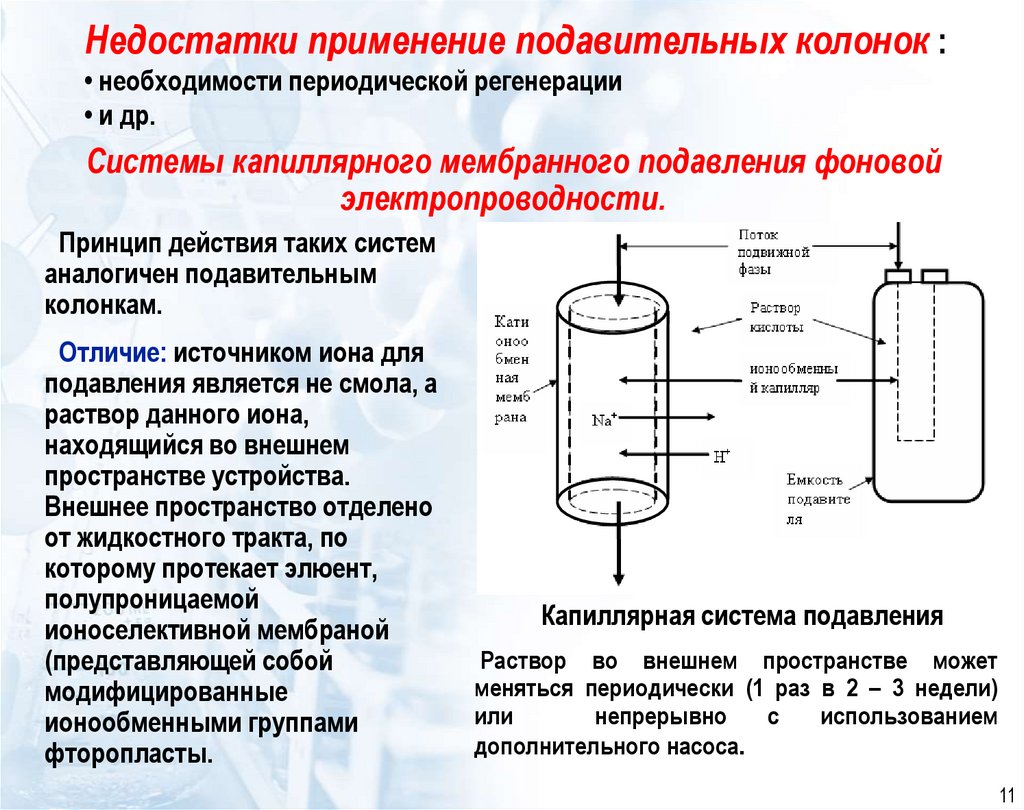
11. Недостатки применение подавительных колонок : • необходимости периодической регенерации • и др.
Системы капиллярного мембранного подавления фоновойэлектропроводности.
Принцип действия таких систем
аналогичен подавительным
колонкам.
Отличие: источником иона для
подавления является не смола, а
раствор данного иона,
находящийся во внешнем
пространстве устройства.
Внешнее пространство отделено
от жидкостного тракта, по
которому протекает элюент,
полупроницаемой
ионоселективной мембраной
(представляющей собой
модифицированные
ионообменными группами
фторопласты.
Капиллярная система подавления
Раствор во внешнем пространстве может
меняться периодически (1 раз в 2 – 3 недели)
или
непрерывно
с
использованием
дополнительного насоса.
11
12. Детекторы
● кондуктометрические● спектрофотометрические
● по ионной проводимости
● электрохимические
● атомно-абсорбционный
● масс-спектрометрический
● и др
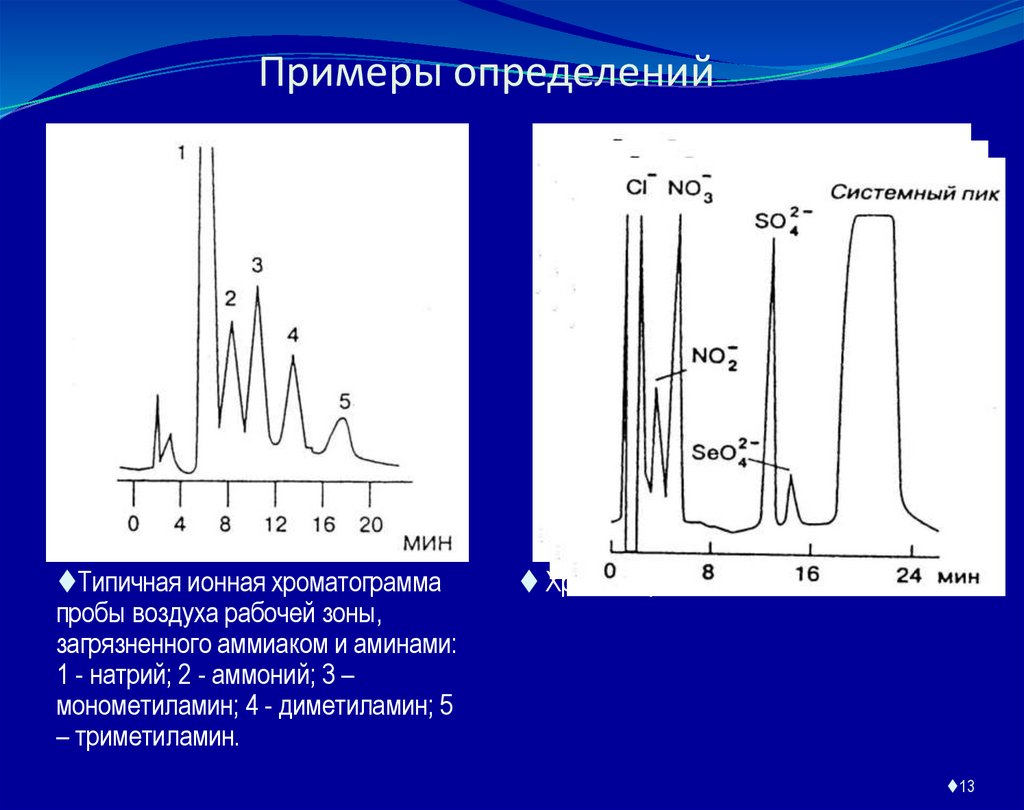
13. Примеры определений
Типичная ионная хроматограммапробы воздуха рабочей зоны,
загрязненного аммиаком и аминами:
1 - натрий; 2 - аммоний; 3 –
монометиламин; 4 - диметиламин; 5
– триметиламин.
Хроматограмма водной вытяжки почвы
13
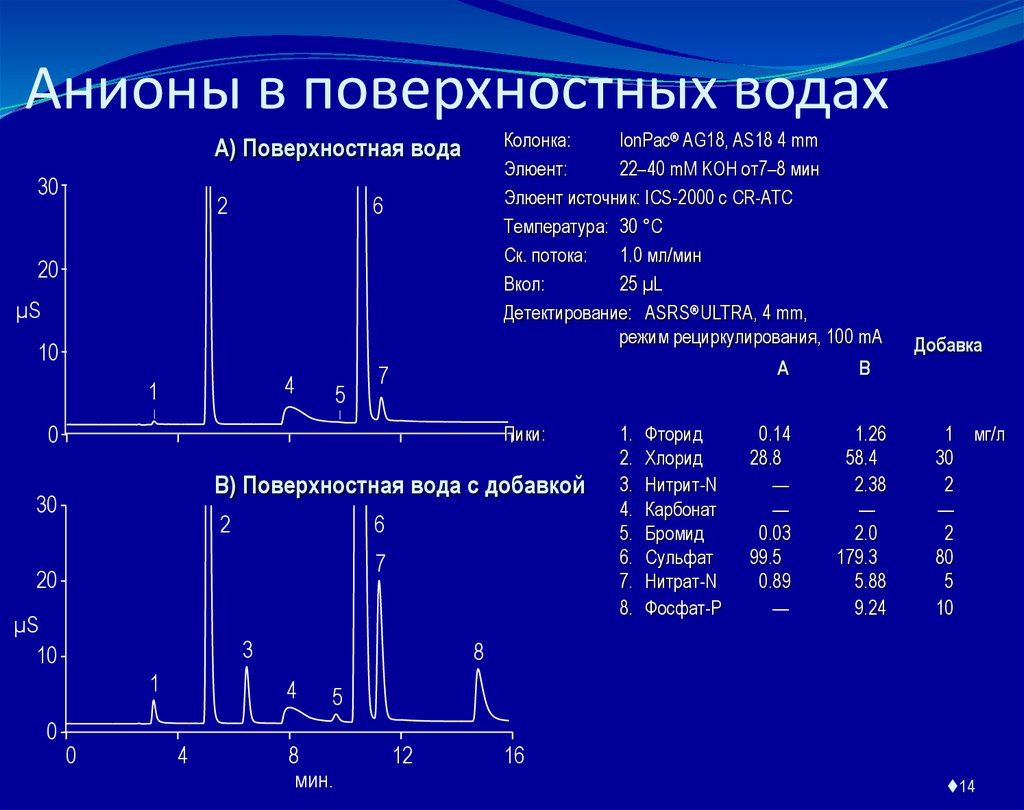
14. Анионы в поверхностных водах
Колонка:IonPac® AG18, AS18 4 mm
Элюент:
22–40 mM KOH от7–8 мин
Элюент источник: ICS-2000 с CR-ATC
Температура: 30 °C
Ск. потока:
1.0 мл/мин
Вкол:
25 µL
Детектирование: ASRS® ULTRA, 4 mm,
режим рециркулирования, 100 mA
A) Поверхностная вода
30
2
6
20
µS
10
4
1
5
A
7
0
Пики:
B) Поверхностная вода с добавкой
30
2
6
7
20
µS
10
3
1
0
0
Фторид
Хлорид
Нитрит-N
Карбонат
Бромид
Сульфат
Нитрат-N
Фосфат-P
0.14
28.8
—
—
0.03
99.5
0.89
—
1.26
58.4
2.38
—
2.0
179.3
5.88
9.24
1 мг/л
30
2
—
2
80
5
10
8
4
4
1.
2.
3.
4.
5.
6.
7.
8.
B
Добавка
5
8
мин.
12
16
14
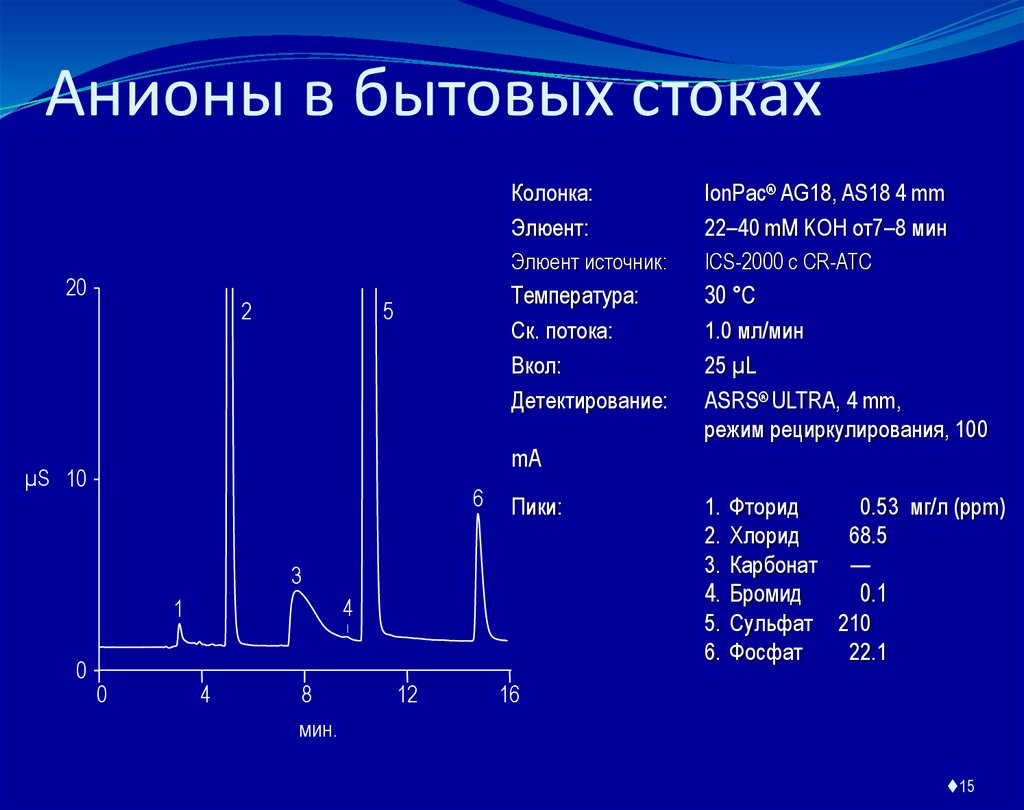
15. Анионы в бытовых стоках
202
5
Колонка:
Элюент:
IonPac® AG18, AS18 4 mm
22–40 mM KOH от7–8 мин
Элюент источник:
ICS-2000 с CR-ATC
Температура:
Ск. потока:
Вкол:
Детектирование:
30 °C
1.0 мл/мин
25 µL
ASRS® ULTRA, 4 mm,
режим рециркулирования, 100
mA
µS 10
6
Пики:
3
4
1
0
0
4
8
мин.
12
1.
2.
3.
4.
5.
6.
Фторид
0.53 мг/л (ppm)
Хлорид
68.5
Карбонат —
Бромид
0.1
Сульфат 210
Фосфат
22.1
16
15
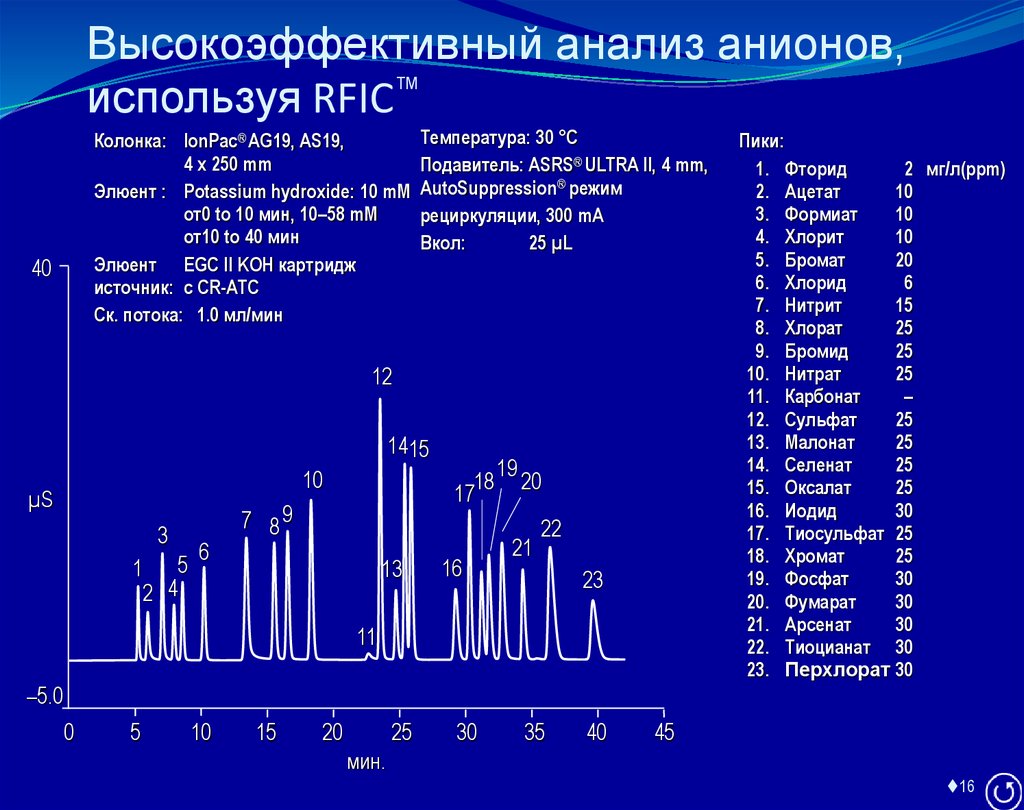
16. Высокоэффективный анализ анионов, используя RFIC™
Колонка: IonPac® AG19, AS19,4 x 250 mm
Элюент : Potassium hydroxide: 10 mM
от0 to 10 мин, 10–58 mM
от10 to 40 мин
Элюент EGC II KOH картридж
источник: с CR-ATC
Ск. потока: 1.0 мл/мин
40
Температура: 30 °C
Подавитель: ASRS® ULTRA II, 4 mm,
AutoSuppression® режим
рециркуляции, 300 mA
Вкол:
25 µL
12
1415
10
µS
3
5
1
2 4
6
18
17
7 89
13
16
19
20
21
22
23
11
Пики:
1. Фторид
2 мг/л(ppm)
2. Ацетат
10
3. Формиат
10
4. Хлорит
10
5. Бромат
20
6. Хлорид
6
7. Нитрит
15
8. Хлорат
25
9. Бромид
25
10. Нитрат
25
11. Карбонат
–
12. Сульфат
25
13. Малонат
25
14. Селенат
25
15. Оксалат
25
16. Иодид
30
17. Тиосульфат 25
18. Хромат
25
19. Фосфат
30
20. Фумарат
30
21. Арсенат
30
22. Тиоцианат 30
23. Перхлорат 30
–5.0
0
5
10
15
20
25
30
35
40
45
мин.
16
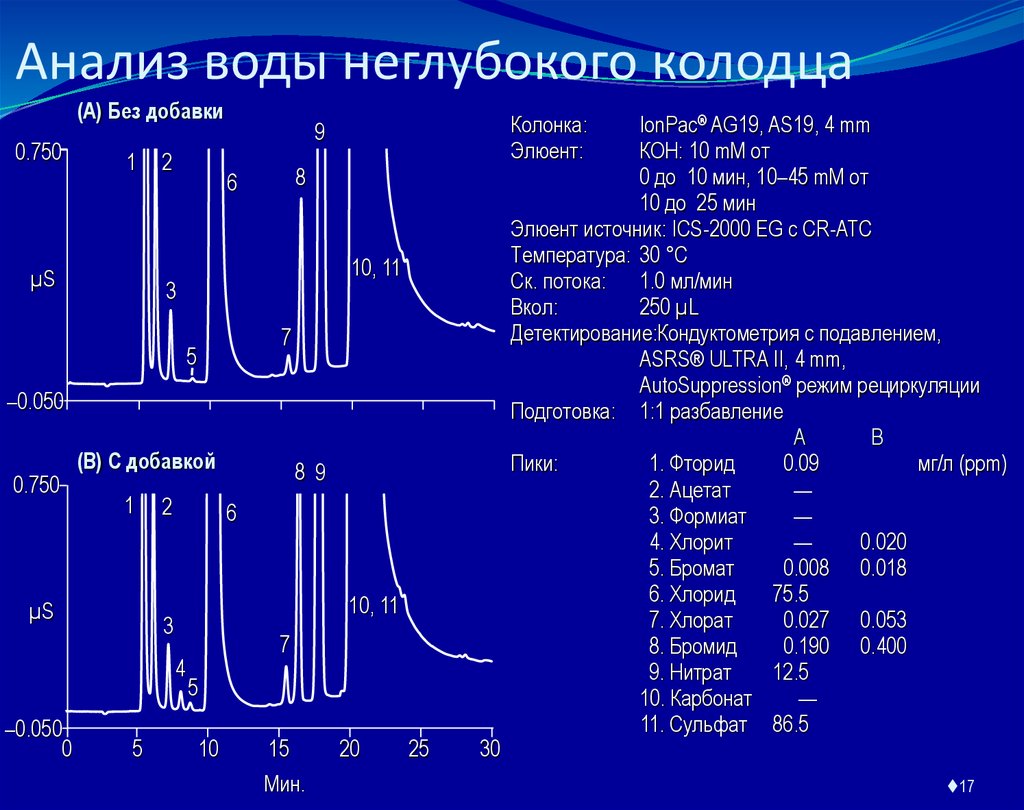
17. Анализ воды неглубокого колодца
(A) Без добавки0.750
1
µS
2
Колонка:
Элюент:
9
8
6
10, 11
3
7
5
–0.050
0.750
(B) С добавкой
1
µS
2
6
10, 11
3
4
–0.050
0
5
8 9
7
5
10
15
Мин.
20
25
30
IonPac® AG19, AS19, 4 mm
КОН: 10 mM от
0 до 10 мин, 10–45 mM от
10 до 25 мин
Элюент источник: ICS-2000 EG с CR-ATC
Температура: 30 °C
Ск. потока: 1.0 мл/мин
Вкол:
250 µL
Детектирование:Кондуктометрия с подавлением,
ASRS® ULTRA II, 4 mm,
AutoSuppression® режим рециркуляции
Подготовка: 1:1 разбавление
A
B
Пики:
1. Фторид
0.09
мг/л (ppm)
2. Ацетат
—
3. Формиат
—
4. Хлорит
—
0.020
5. Бромат
0.008 0.018
6. Хлорид
75.5
7. Хлорат
0.027 0.053
8. Бромид
0.190 0.400
9. Нитрат
12.5
10. Карбонат
—
11. Сульфат 86.5
17
18.
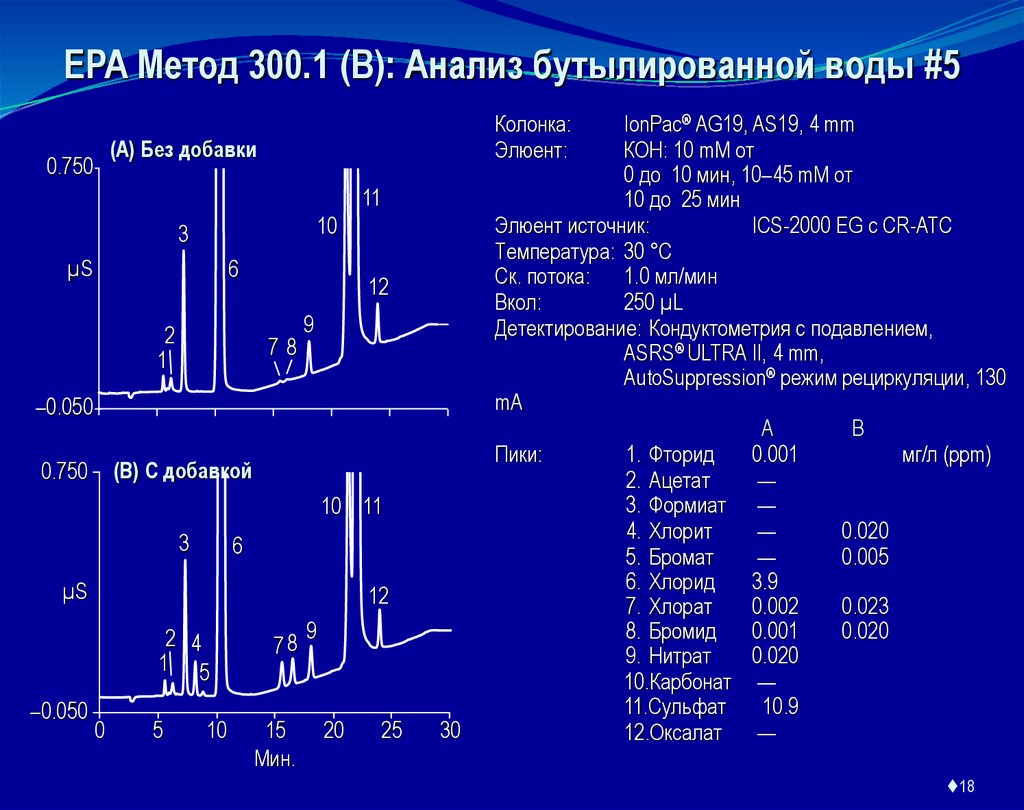
EPA Метод 300.1 (B): Анализ бутылированной воды #5Колонка:
Элюент:
(A) Без добавки
0.750
11
10
3
µS
6
2
1
12
78
9
–0.050
(B) С добавкой
0.750
10 11
3
6
µS
12
2 4
1 5
–0.050
0
5
10
78
15
Мин.
9
20
25
30
IonPac® AG19, AS19, 4 mm
КОН: 10 mM от
0 до 10 мин, 10–45 mM от
10 до 25 мин
Элюент источник:
ICS-2000 EG с CR-ATC
Температура: 30 °C
Ск. потока: 1.0 мл/мин
Вкол:
250 µL
Детектирование: Кондуктометрия с подавлением,
ASRS® ULTRA II, 4 mm,
AutoSuppression® режим рециркуляции, 130
mA
A
B
Пики:
1. Фторид
0.001
мг/л (ppm)
2. Ацетат
—
3. Формиат —
4. Хлорит
—
0.020
5. Бромат
—
0.005
6. Хлорид
3.9
7. Хлорат
0.002
0.023
8. Бромид
0.001
0.020
9. Нитрат
0.020
10.Карбонат —
11.Сульфат
10.9
12.Оксалат
—
18
19.
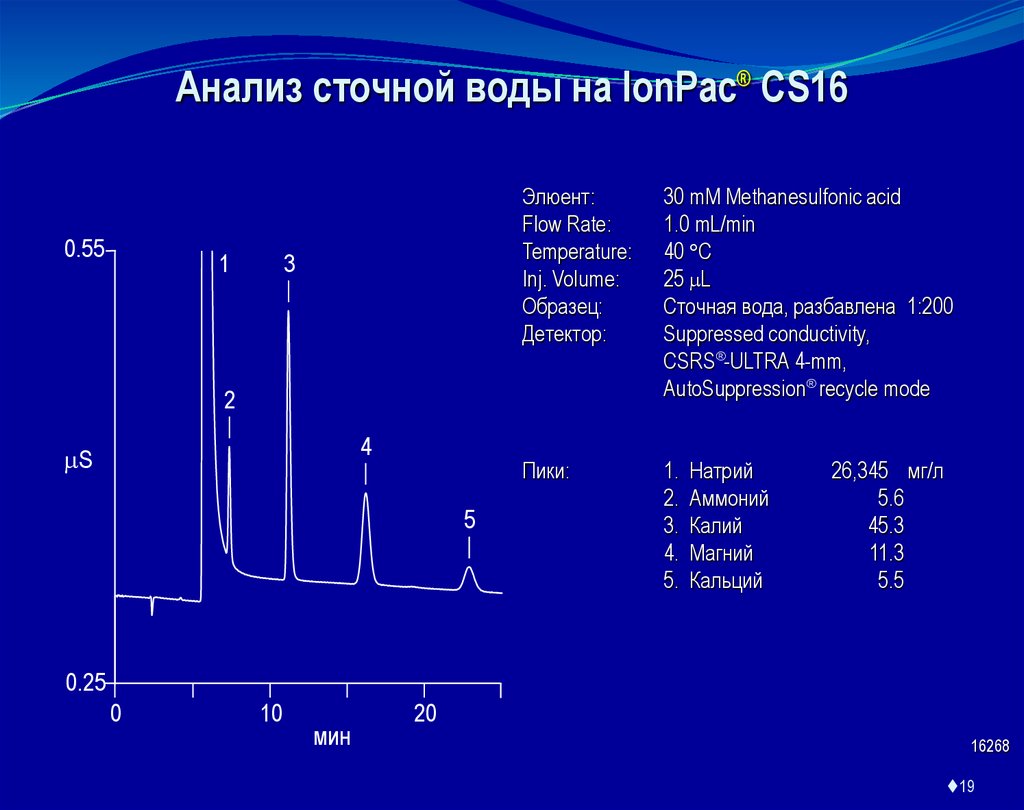
Анализ сточной воды на IonPac® CS160.55
1
3
Элюент:
Flow Rate:
Temperature:
Inj. Volume:
Образец:
Детектор:
30 mM Methanesulfonic acid
1.0 mL/min
40 C
25 L
Сточная вода, разбавлена 1:200
Suppressed conductivity,
CSRS -ULTRA 4-mm,
AutoSuppression recycle mode
Пики:
1.
2.
3.
4.
5.
2
4
S
5
Натрий
Аммоний
Калий
Магний
Кальций
26,345 мг/л
5.6
45.3
11.3
5.5
0.25
0
10
мин
20
16268
19
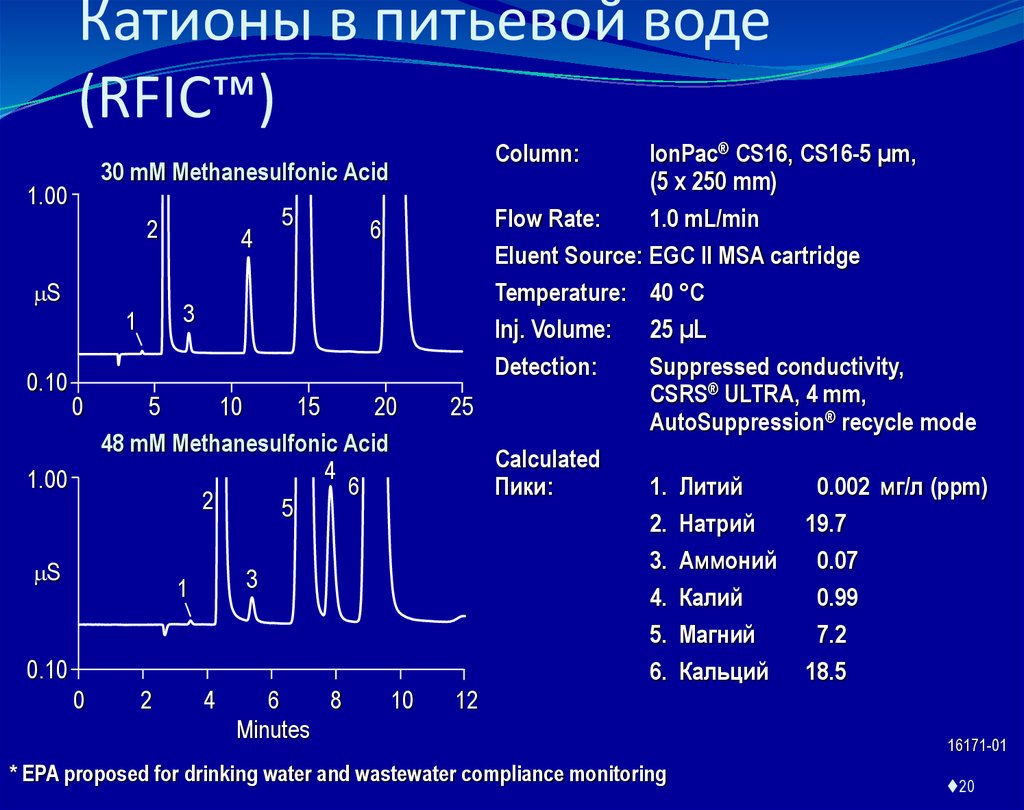
20. Катионы в питьевой воде (RFIC™)
30 mM Methanesulfonic Acid1.00
2
S
0.10
Column:
1.00
6
3
1
0
4
5
5
10
15
20
48 mM Methanesulfonic Acid
4
6
2
5
S
3
1
0.10
0
2
4
6
8
Minutes
10
IonPac® CS16, CS16-5 µm,
(5 x 250 mm)
Flow Rate:
1.0 mL/min
Eluent Source: EGC ll MSA cartridge
Temperature: 40 °C
Inj. Volume: 25 µL
Detection:
Suppressed conductivity,
CSRS® ULTRA, 4 mm,
25
AutoSuppression® recycle mode
Calculated
Пики:
1. Литий
0.002 мг/л (ppm)
2. Натрий
19.7
3. Аммоний
0.07
4. Калий
0.99
5. Магний
7.2
6. Кальций 18.5
12
* EPA proposed for drinking water and wastewater compliance monitoring
16171-01
20
21.
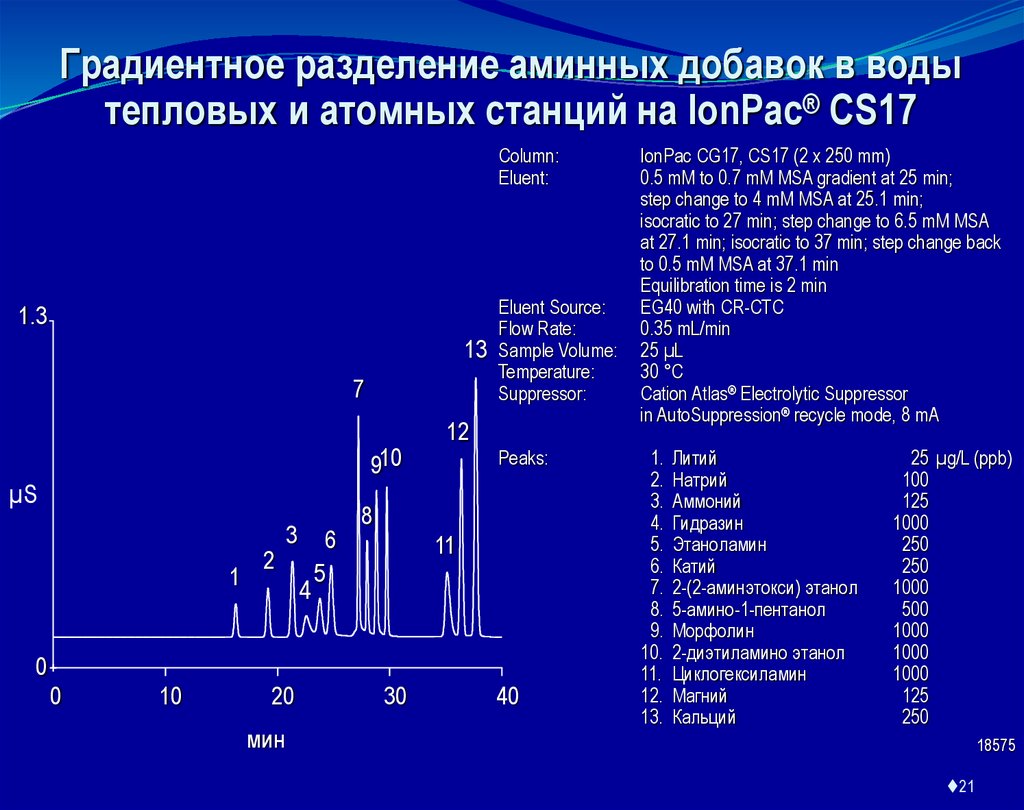
Градиентное разделение аминных добавок в водытепловых и атомных станций на IonPac® CS17
Column:
Eluent:
1.3
13
7
910
µS
1
0
0
10
2
3
4
20
мин
6
5
Eluent Source:
Flow Rate:
Sample Volume:
Temperature:
Suppressor:
12
Peaks:
8
11
30
40
IonPac CG17, CS17 (2 x 250 mm)
0.5 mM to 0.7 mM MSA gradient at 25 min;
step change to 4 mM MSA at 25.1 min;
isocratic to 27 min; step change to 6.5 mM MSA
at 27.1 min; isocratic to 37 min; step change back
to 0.5 mM MSA at 37.1 min
Equilibration time is 2 min
EG40 with CR-CTC
0.35 mL/min
25 µL
30 °C
Cation Atlas® Electrolytic Suppressor
in AutoSuppression® recycle mode, 8 mA
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
Литий
Натрий
Аммоний
Гидразин
Этаноламин
Катий
2-(2-аминэтокси) этанол
5-амино-1-пентанол
Морфолин
2-диэтиламино этанол
Циклогексиламин
Магний
Кальций
25 µg/L (ppb)
100
125
1000
250
250
1000
500
1000
1000
1000
125
250
18575
21
22.
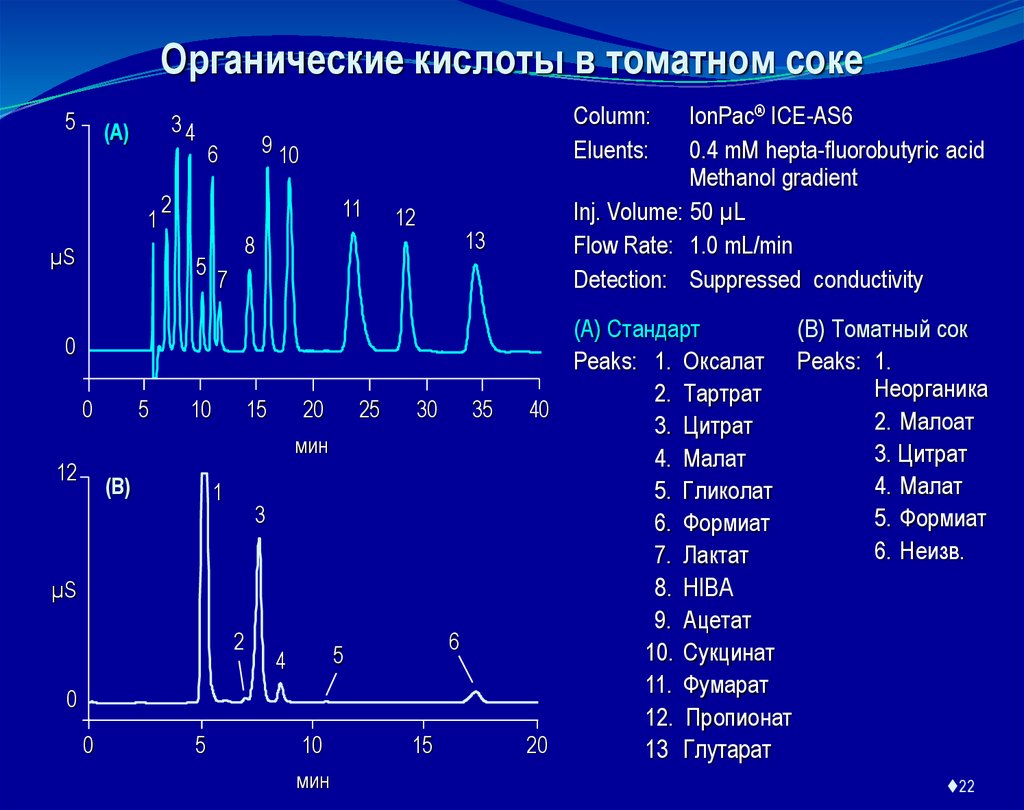
Органические кислоты в томатном соке5
34
(A)
1
µS
Column:
Eluents:
9 10
6
2
11
5
12
13
8
7
0
0
5
10
15
20
25
30
35
мин
12
(B)
1
3
µS
2
6
5
4
0
0
5
10
мин
15
IonPac® ICE-AS6
0.4 mM hepta-fluorobutyric acid
Methanol gradient
Inj. Volume: 50 µL
Flow Rate: 1.0 mL/min
Detection: Suppressed conductivity
(A) Стандарт
(B) Томатный сок
Peaks: 1. Оксалат Peaks: 1.
Неорганика
2. Тартрат
40
2. Малоат
3. Цитрат
3. Цитрат
4. Малат
4. Малат
5. Гликолат
5. Формиат
6. Формиат
6. Неизв.
7. Лактат
8. HIBA
9. Ацетат
10. Сукцинат
11. Фумарат
12. Пропионат
20
13 Глутарат
22
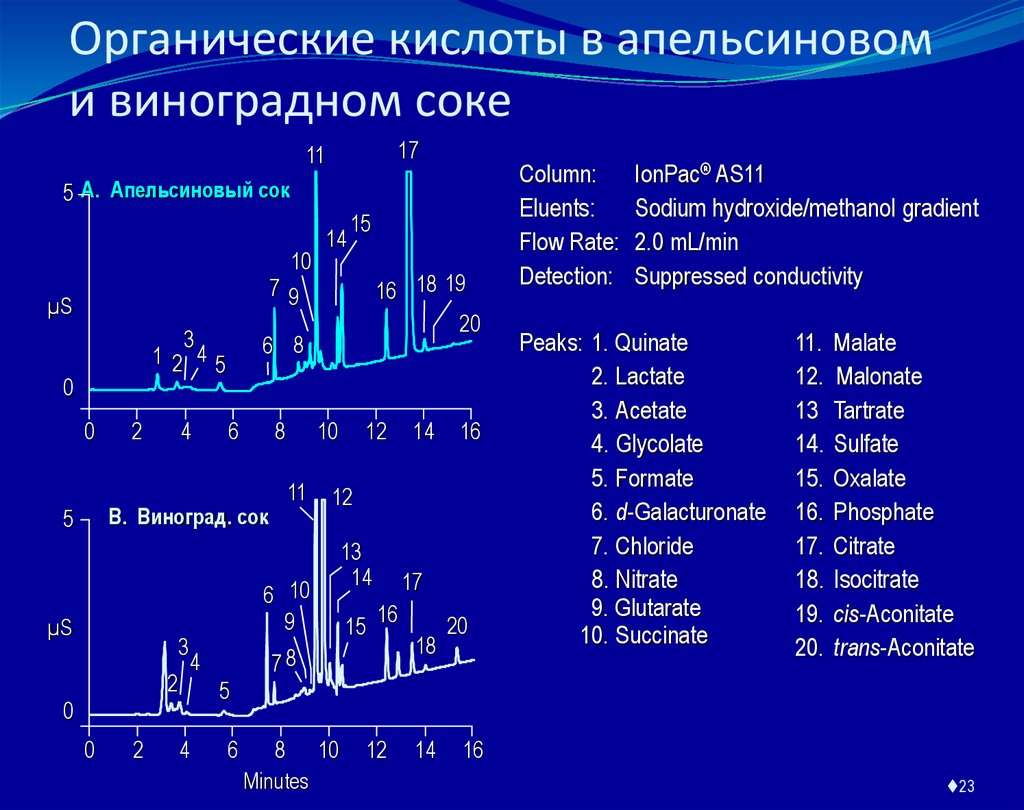
23. Органические кислоты в апельсиновом и виноградном соке
1711
5 A. Апельсиновый сок
10
14
15
16 18 19
20
79
µS
3
1 2 45
0
0
2
4
6 8
6
8
B. Виноград. сок
5
µS
3
2
2
11
12
13
14
16
15
17
16
18
78
4
14
12
6 10
9
20
IonPac® AS11
Sodium hydroxide/methanol gradient
2.0 mL/min
Suppressed conductivity
Peaks: 1. Quinate
2. Lactate
3. Acetate
4. Glycolate
5. Formate
6. d-Galacturonate
7. Chloride
8. Nitrate
9. Glutarate
10. Succinate
11.
12.
13
14.
15.
16.
17.
18.
19.
20.
Malate
Malonate
Tartrate
Sulfate
Oxalate
Phosphate
Citrate
Isocitrate
cis-Aconitate
trans-Aconitate
5
0
0
10
Column:
Eluents:
Flow Rate:
Detection:
4
6
8 10
Minutes
12
14
16
23
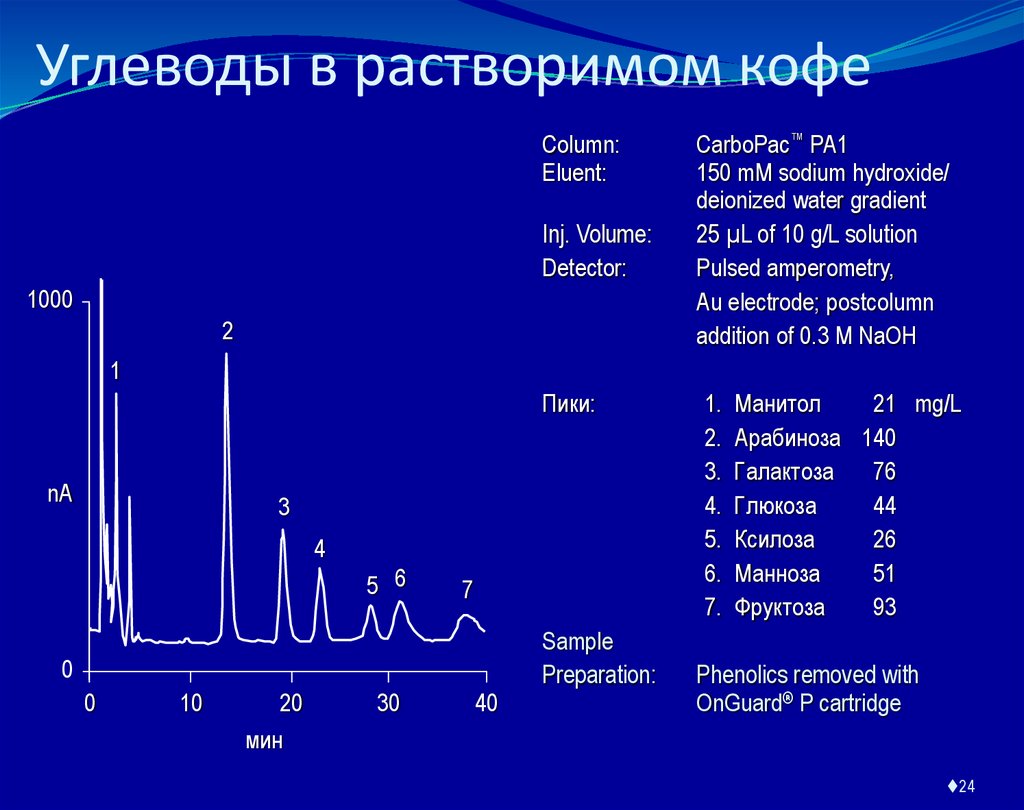
24. Углеводы в растворимом кофе
Column:Eluent:
Inj. Volume:
Detector:
1000
2
CarboPac™ PA1
150 mM sodium hydroxide/
deionized water gradient
25 µL of 10 g/L solution
Pulsed amperometry,
Au electrode; postcolumn
addition of 0.3 M NaOH
1
Пики:
nA
3
4
5 6
7
0
0
10
20
мин
30
40
Sample
Preparation:
1.
2.
3.
4.
5.
6.
7.
Манитол
21 mg/L
Арабиноза 140
Галактоза
76
Глюкоза
44
Ксилоза
26
Манноза
51
Фруктоза
93
Phenolics removed with
OnGuard® P cartridge
24
25.
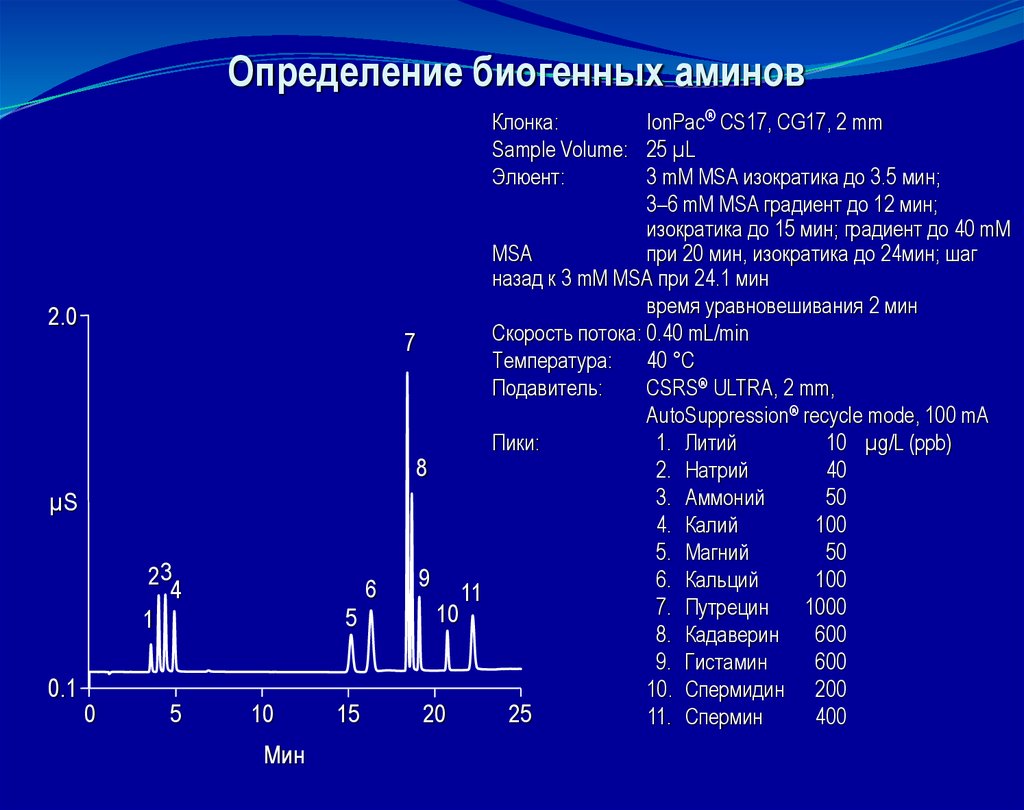
Определение биогенных аминов2.0
µS
23
4
1
0.1
0
5
5
10
Мин
15
6
Клонка:
IonPac® CS17, CG17, 2 mm
Sample Volume: 25 µL
Элюент:
3 mM MSA изократика до 3.5 мин;
3–6 mM MSA градиент до 12 мин;
изократика до 15 мин; градиент до 40 mM
MSA
при 20 мин, изократика до 24мин; шаг
назад к 3 mM MSA при 24.1 мин
время уравновешивания 2 мин
Скорость потока: 0.40 mL/min
7
Температура: 40 °C
Подавитель:
CSRS® ULTRA, 2 mm,
AutoSuppression® recycle mode, 100 mA
Пики:
1. Литий
10 µg/L (ppb)
8
2. Натрий
40
3. Аммоний
50
4. Калий
100
5. Магний
50
9
6. Кальций
100
11
7. Путрецин
1000
10
8. Кадаверин
600
9. Гистамин
600
10. Спермидин 200
20
25
11. Спермин
400
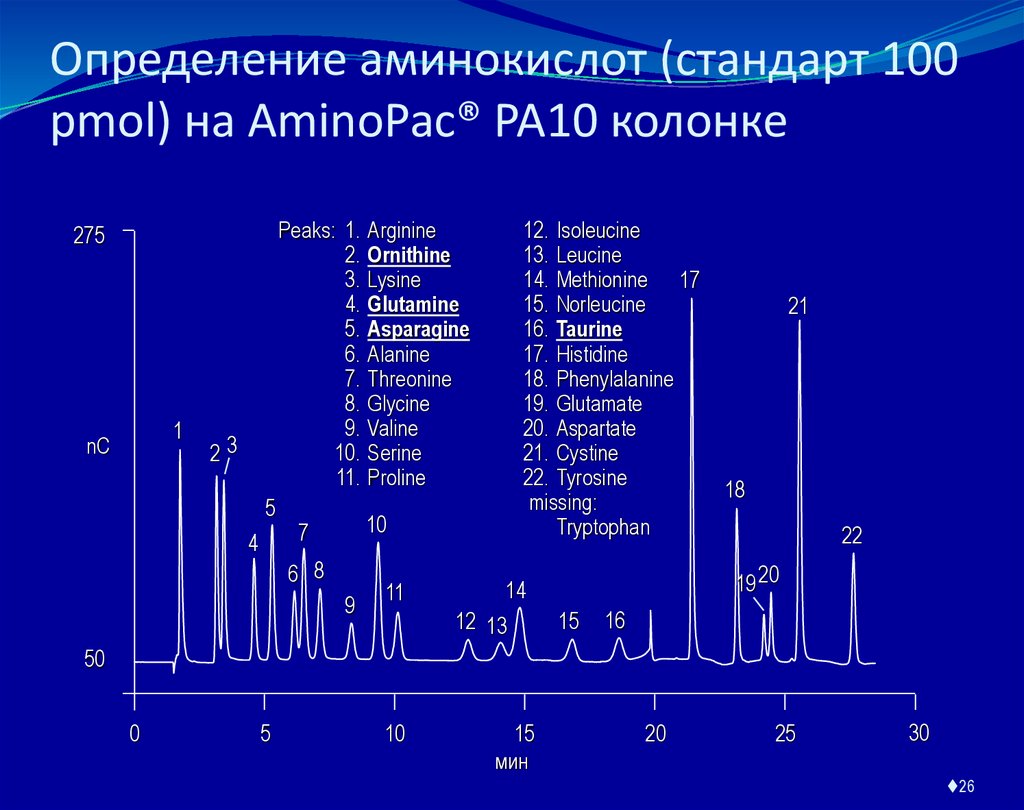
26. Определение аминокислот (стандарт 100 pmol) на AminoPac® PA10 колонке
Peaks: 1.2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
275
1
nC
23
5
4
Arginine
Ornithine
Lysine
Glutamine
Asparagine
Alanine
Threonine
Glycine
Valine
Serine
Proline
12. Isoleucine
13. Leucine
14. Methionine 17
15. Norleucine
16. Taurine
17. Histidine
18. Phenylalanine
19. Glutamate
20. Aspartate
21. Cystine
22. Tyrosine
missing:
Tryptophan
10
7
6 8
9
11
18
22
19 20
14
12 13
21
15
16
50
0
5
10
15
мин
20
25
30
26
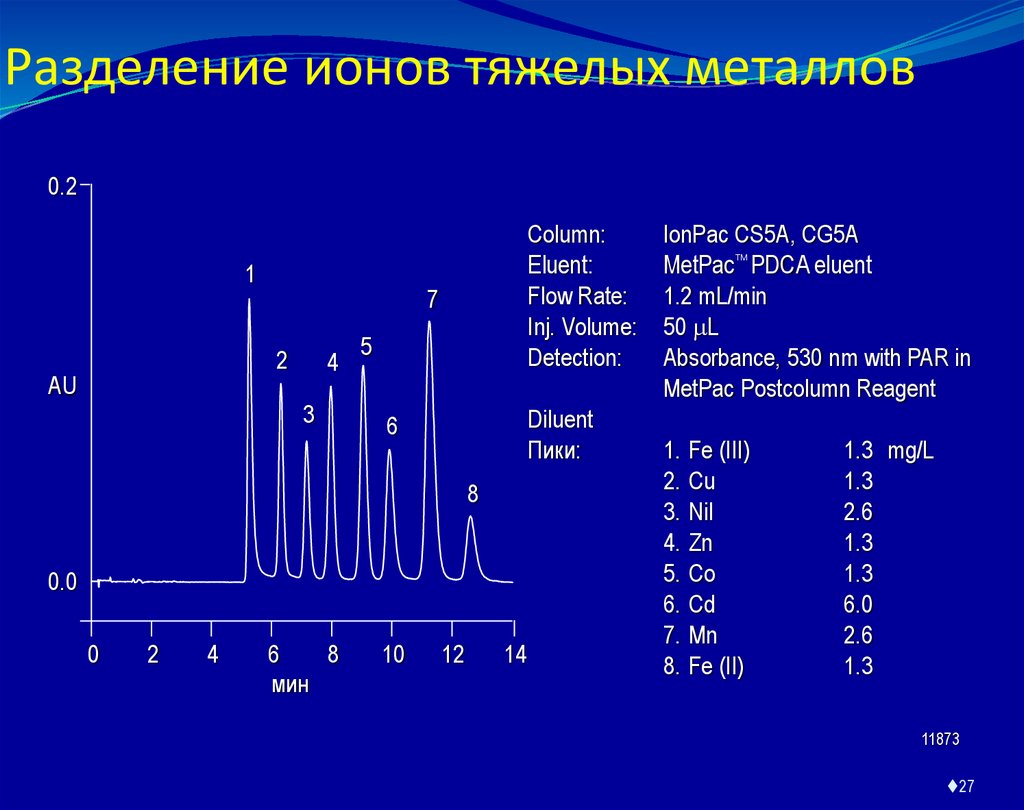
27. Разделение ионов тяжелых металлов
0.21
7
2
AU
Column:
Eluent:
Flow Rate:
Inj. Volume:
Detection:
4
3
5
Diluent
Пики:
6
8
0.0
0
2
4
6
8
мин
10
12
14
IonPac CS5A, CG5A
MetPac PDCA eluent
1.2 mL/min
50 L
Absorbance, 530 nm with PAR in
MetPac Postcolumn Reagent
1.
2.
3.
4.
5.
6.
7.
8.
Fe (III)
Cu
Nil
Zn
Co
Cd
Mn
Fe (II)
1.3 mg/L
1.3
2.6
1.3
1.3
6.0
2.6
1.3
11873
27