Similar presentations:
Халькогены. Кислород в природе
1. Самый распространённый элемент земной коры и человеческого организма, в атмосфере содержится 21% этого простого вещества.
2.
Около 8 века в Китае стали использоватьэтот неметалл в пиротехнических целях.
Древнерусское название происходит от
санскритского слова «Сира», что означает
светло-желтый.
3.
Этот микроэлемент в организмечеловека, способствует усваиванию
йода. Все его соединения и
модификации ядовиты.
4.
Относится к семейству металлоидов.Внешне похож на металл, но таковым
не является. Применяется как
легирующая добавка к свинцу,
улучшающая его механические
свойства.
5.
До сих пор ведутся споры опринадлежности этого элемента.
Одни причисляют его к
металлоидам, а другие — к
металлам.
6.
Халькогены(«Образующие руды»)
7. Элементы VI – А группы
1S11 H
2
3
4
5
6
2S22P1 nS2nP2
B
C*
Si*
nS2nP3
nS2nP4
nS2nP5
N
P*
As*
O*
S*
Se*
Te*
Ро
F
Cl
Br
I
At
Атомы этих элементов содержат на внешнем уровне 6
электронов
8.
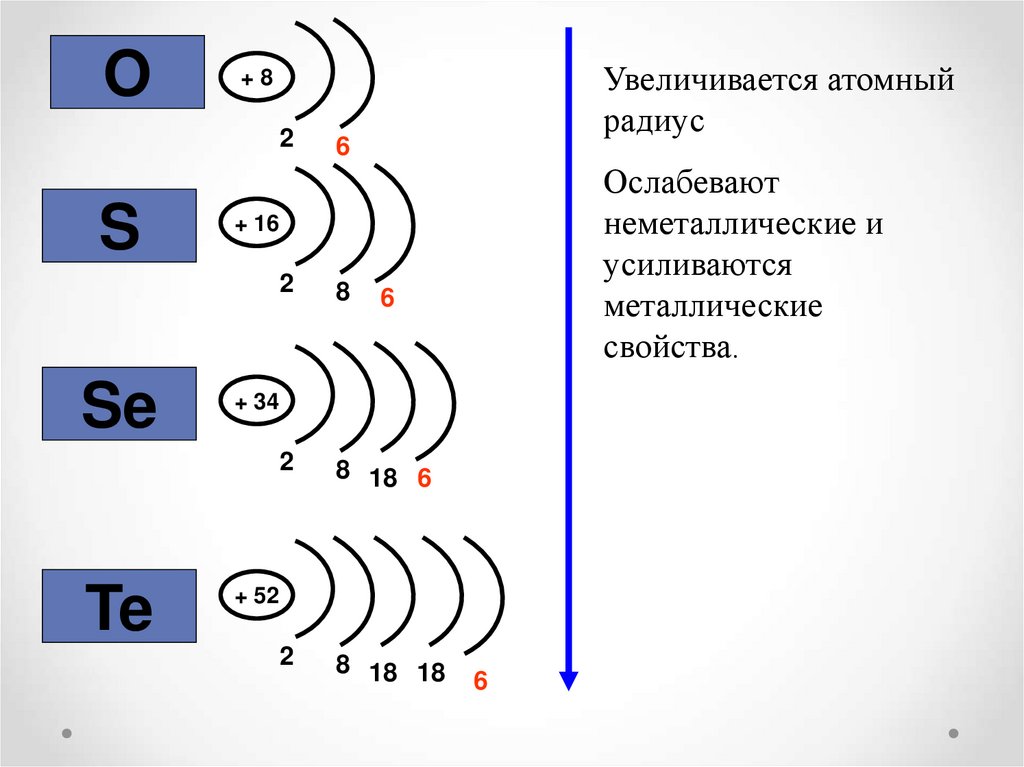
O2
S
Se
Te
Увеличивается атомный
радиус
+8
6
Ослабевают
неметаллические и
усиливаются
металлические
свойства.
+ 16
2
8
2
8 18 6
2
8 18 18
6
+ 34
+ 52
6
9. Аллотропия серы. Кристаллическая, пластическая и моноклинная
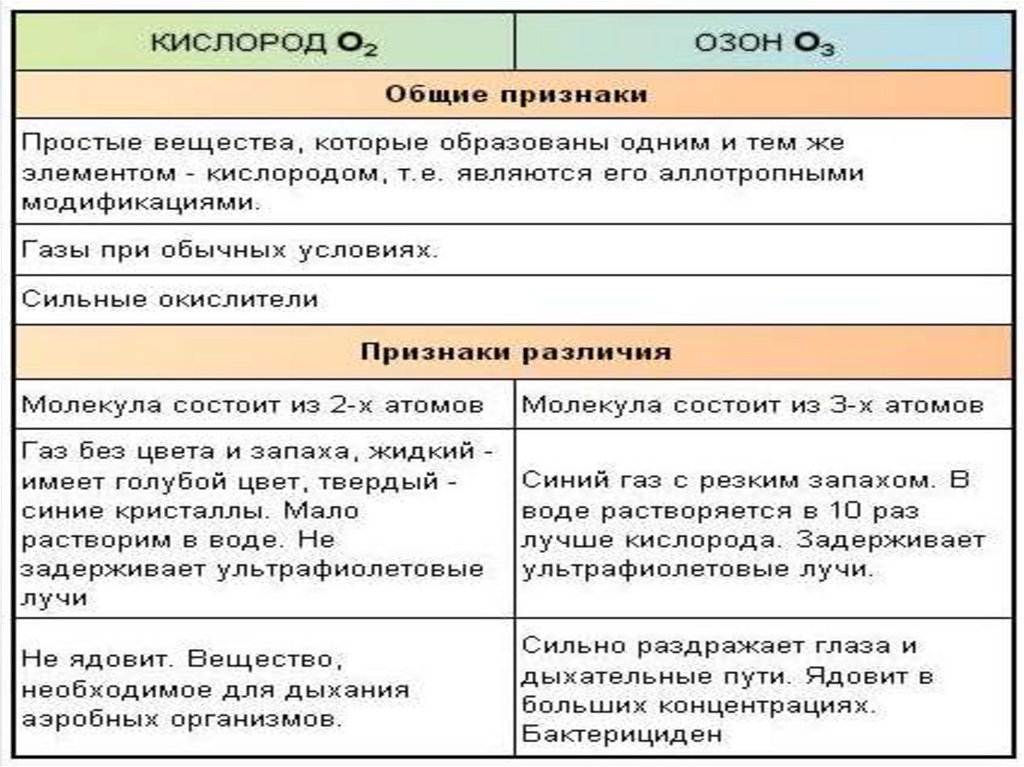
10. Аллотропия кислорода. Кислород и озон
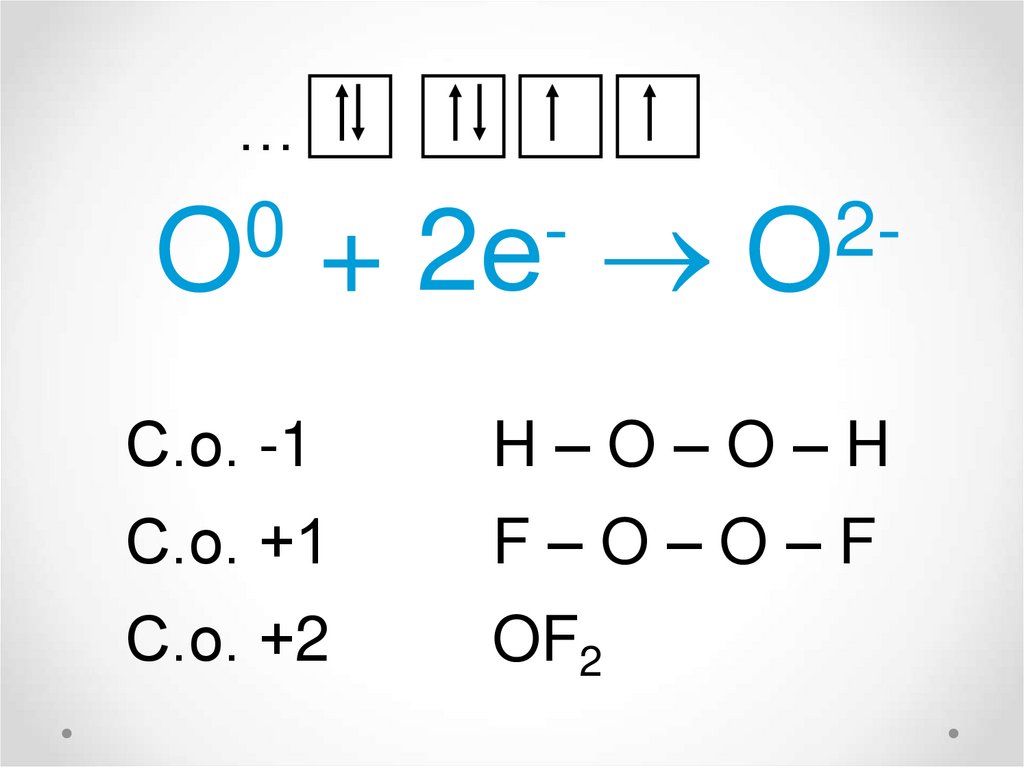
11.
…0
O
+
2е
2O
С.о. -1
H–O–O–H
С.о. +1
F–O–O–F
С.о. +2
OF2
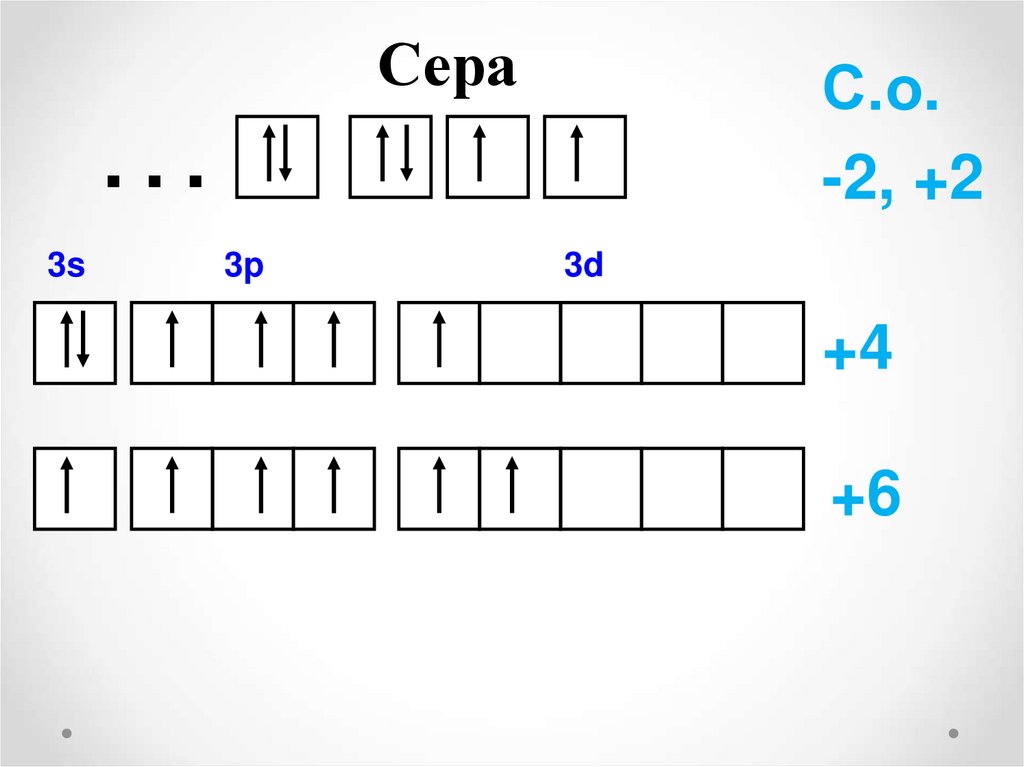
12.
Сера…
3s
3p
С.о.
-2, +2
3d
+4
+6
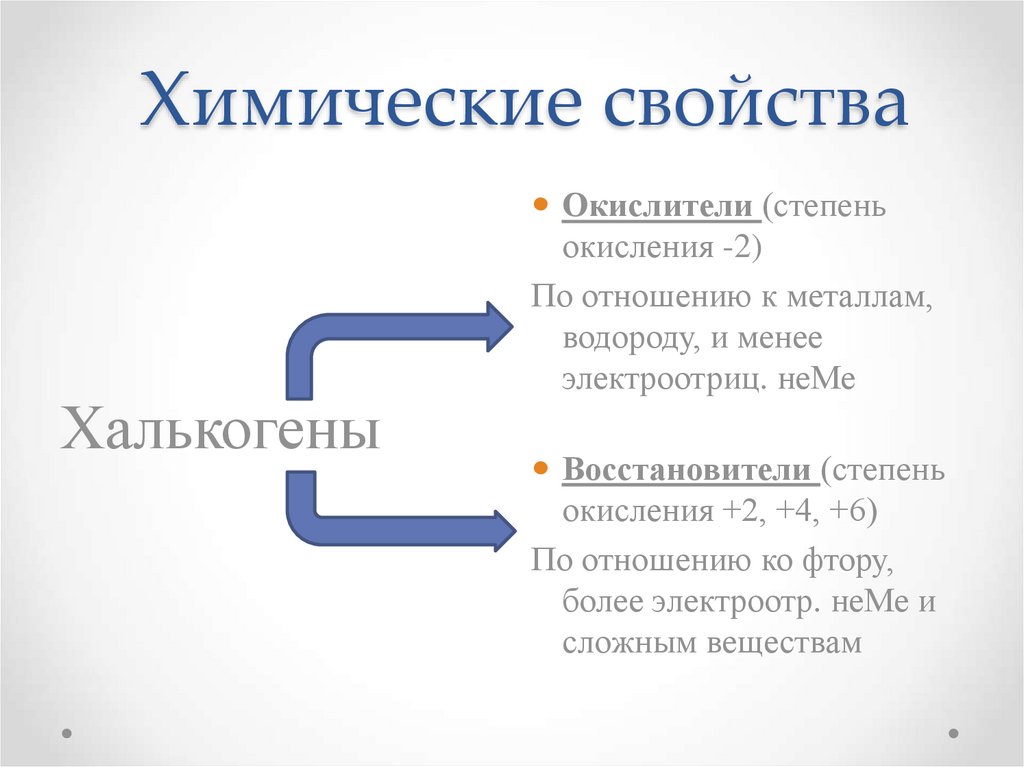
13. Химические свойства
ХалькогеныОкислители (степень
окисления -2)
По отношению к металлам,
водороду, и менее
электроотриц. неМе
Восстановители (степень
окисления +2, +4, +6)
По отношению ко фтору,
более электроотр. неМе и
сложным веществам
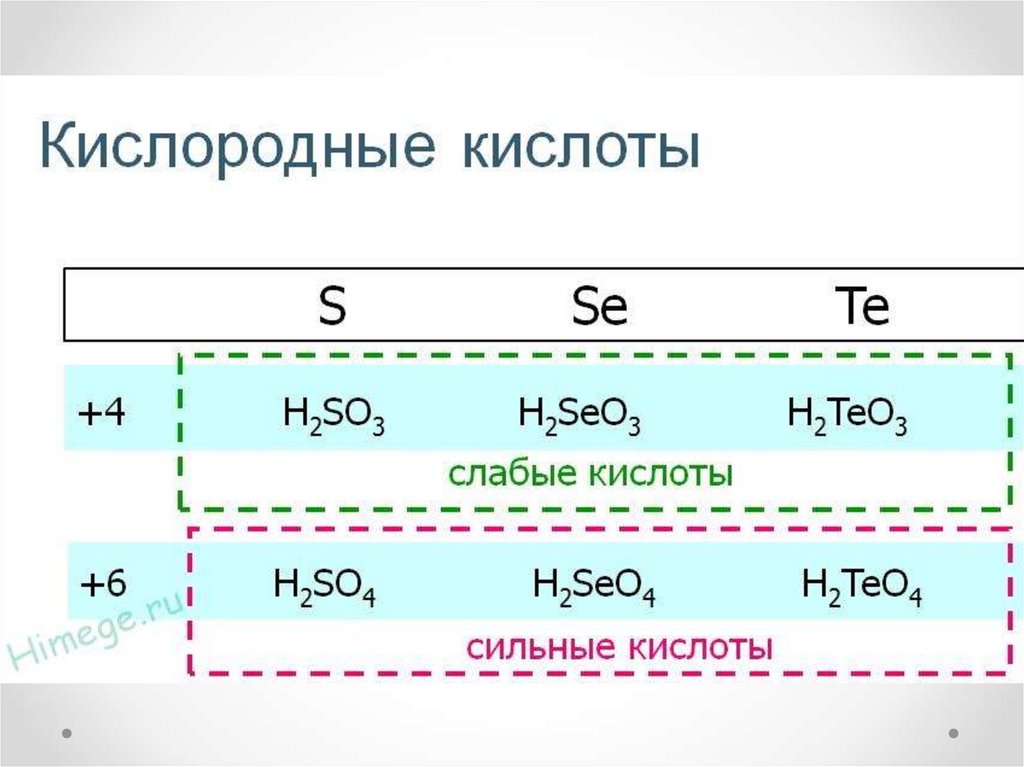
14. Химические свойства серы и кислорода
ОкислительСо всеми Ме, кроме Au и Pt
А) S + Cu→
Б) S + Zn→
В) S + Na →
Г) S + H2 →
Д) О2 + H2 →
Е) S + C →
Восстановитель
А) S + O2→
Б) O2+ F →
В) S + F2 →
Г) 2S + Cl2 →









 chemistry
chemistry








