Similar presentations:
Производство сульфата аммония (лекция)
1. ЛЕКЦИЯ
ПРОИЗВОДСТВО СУЛЬФАТААММОНИЯ
2. Свойства сульфата аммония Физические свойства
• Сульфат аммония (NH4)2SO4 – бесцветноекристаллическое вещество плотностью 1769
кг/м3, содержит 21,21% азота. При нагревании
выше 200 °С разлагается с выделением аммиака и
образованием кислых сульфатов аммония.
• Полная диссоциация сульфата аммония на
аммиак и серную кислоту происходит при 513 °С.
Зависимость растворимости сульфата аммонияв
воде от температуры
3.
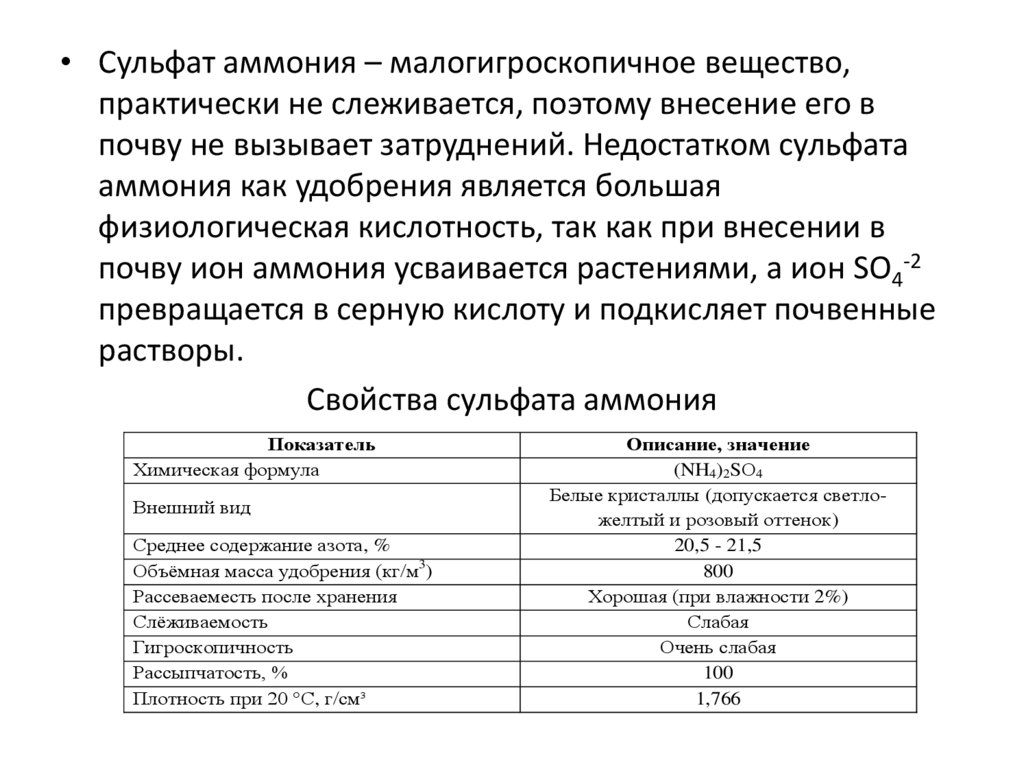
• Сульфат аммония – малогигроскопичное вещество,практически не слеживается, поэтому внесение его в
почву не вызывает затруднений. Недостатком сульфата
аммония как удобрения является большая
физиологическая кислотность, так как при внесении в
почву ион аммония усваивается растениями, а ион SO4-2
превращается в серную кислоту и подкисляет почвенные
растворы.
Свойства сульфата аммония
Показатель
Химическая формула
Внешний вид
Среднее содержание азота, %
Объёмная масса удобрения (кг/м3)
Рассеваеместь после хранения
Слёживаемость
Гигроскопичность
Рассыпчатость, %
Плотность при 20 °С, г/см³
Описание, значение
(NH4)2SО4
Белые кристаллы (допускается светложелтый и розовый оттенок)
20,5 - 21,5
800
Хорошая (при влажности 2%)
Слабая
Очень слабая
100
1,766
4. Химические свойства
• При нагревании до 147 °С сульфат аммонияразлагается на соответствующий гидросульфат
NH4HSO4 и аммиак по схеме:
(NH4)2SО4 → NH4HSO4 + NH3
• При повышении температуры выше 500 °С
гидросульфат аммония кипит с разложением
на серный ангидрид, аммиак и воду:
NH4HSO4 → NH3 + SO2 + H2O
• Сульфат аммония окисляется до
молекулярного азота сильными окислителями,
например перманганатом калия.
5. Области применения сульфата аммония
Сульфат аммония – одно из широкоприменяемых в сельском хозяйстве
минеральных удобрений. Удобрение обладает ценным качеством – низкой
миграционной способностью, так как катион аммония активно поглощается
почвой и это предохраняет его от вымывания.
Сульфат аммония применяют в производстве вискозного волокна.
В биохимии переосаждение сульфатом аммония является общим методом
очистки белков.
В пищевой промышленности зарегистрирован в качестве пищевой добавки
E517.
Используется в технологии хлорирования воды с аммонизацией.
В средствах тушения пожаров сульфат аммония применяется в качестве
антипирена, в горной промышленности - как гелеобразующий компонент при
профилактической обработке выработанного пространства, в состав
взрывчатого вещества сульфат аммония вводится для снижения горючести и
устранения опасности самопроизвольного воспламенения
Также сульфат аммония применяется для производства гербицидов, кормов для
животных, выделки кож, строительной изоляции.
6. Сорта сульфата аммония, выпускаемого промышленностью
• Качество сульфата аммония как удобрениярегламентируется ГОСТом 9097-82, который
предусматривает выпуск продукта 3-х сортов:
высшего, первого и второго.
• При несоответствии или отклонениях от ГОСТ
сернокислый аммоний относят к категории ТУ
113-03.
• Сульфат аммония упаковывают в мешки и
отгружают в крытых железнодорожных
вагонах; допускается (по согласованию с
потребителем) отгрузка навалом в крытых
железнодорожных вагонах.
7.
• Продукт высшего сорта в гранулированноми и кристаллических видах должен
содержать не менее 21% азота, и не более
0,025% свободной серной кислоты при
влажности не более 0,2 - 0,6%. Количество
частиц размером 1 – 4 мм должно быть не
менее 90% для гранулированного продукта
и не менее 95% для кристаллической
формы. Содержание частиц величиной 6
мм не допустимо.
8.
• Продукт 1 и 2 сортов должен содержать неменее 20,8% азота и не более 0,05%
свободной серной кислоты. Влажность
кристаллического сульфата аммония не
должна превышать 0,3%. Для
граннулированного продукта влажность не
нормируется. Содержание частиц
размером свыше 0,25% продукта 1-го сорта
должно быть не менее 70%. Размер частиц
для 2-го сорта не нормируется.
9. Способы получения сульфата аммония
• Основным способом получения сульфата аммонияявляется нейтрализация серной кислоты аммиаком
по реакции
2NH3 + H2SO4 = (NH4)2SO4 + 274 кДж.
• Эта реакция относится к числу реакций
нейтрализации. Она практически необратима и
сопровождается выделением большого количества
тепла.
• Однако этот метод не нашел промышленного
применения из-за низкого содержания азота в
сульфате аммония и большого расхода серной
кислоты, которая входит в состав удобрения в виде
балласта и не усваивается растениями, а подкисляет
почву.
10.
• Для производства сульфата аммонияиспользуют аммиаксодержащие газы,
являющиеся побочными продуктами других
производств, в частности коксовый газ,
который содержит от 6– 14 г/м3 NH3.
Выделение аммиака из коксового газа
осуществля ется путем абсорбции
разбавленными растворами серной кислоты в
барботажных или распыливающих аппаратах с
получением растворов сульфата аммония и
последующей выпаркой, и кристаллизацией
продукта.
11. Диаграмма растворимости в системе (NH4)2SO4 – H2SO4 – Н2О
12.
• Поле кристаллизации средней соли(NH4)2SO4 лежит в области a1E1c при 10 °С и
a2E2c при 90 °С. Поэтому во избежание
образования кислых солей содержание
H2SO4 в жидкой фазе должно быть меньше,
чем в точках Е, т. е. меньше 11,08% при 10
°С и 19,77% при 90 °С.
13.
• Процесс нейтрализации необходимопроводить полностью. Однако техническая
серная кислота содержит в своем составе
примеси, в частности сульфаты железа и
алюминия. При полной нейтрализации
серной кислоты будут происходить
следующие реакции:
Fe2(SO4)3 + 6NH3 + 6H2O = 2Fe(OH)3 + 3(NH4)2SO4;
Al2(SO4)3 + 6NH3 + 6H2O = 2Al(OH)3 + 3(NH4)2SO4.
14.
• В результате этих реакций образуютсяколлоидные гидроксиды железа и алюминия,
которые осаждаются на поверхности
кристаллов сульфата аммония и тормозят их
рост. Эти факты необходимо учитывать при
выборе условий нейтрализации. В
практических условиях концентрацию серной
кислоты в конечных растворах поддерживают
на уровне от 4 до 10% мас. Поглощение
аммиака из коксового газа можно
осуществлять в сатураторах барботажного
типа или в скрубберах распыливающего типа.














 chemistry
chemistry industry
industry








