Similar presentations:
Соли азотной кислоты
1.
Проверочная работа«Соли азотной кислоты»
2.
1. Соли азотной кислотыназываются_____________________
2. Физические свойства солей_________________________________________.
2. Дайте названия следующим солям:
KNO3_______________________________,
Ba(NO3)2________________________________,
Zn (NO3)2
_________________________________________.
3. Взаимодействие медной стружки с
разбавленной азотной кислотой приводит к
образованию газа:
1.NO2 2. N2O3. NO4. NH3
3.
1. Соли азотной кислотыназываются_____________________
2. _Физические свойства солей.
3. Укажите степень окисления азота в следующих
веществах:
1. NH3OH2. LiNO3 3. KNO2 4. NO
4. Допишите уравнения реакции. Расставьте
коэффициенты. Укажите степени окисления азота и
кислорода:
Ca(NO3)2 = ________ + O2 , где
______ -восстановитель, _____ -окислитель
5. Напишите уравнение реакции разложения нитрата
цинка. Расставьте коэффициенты с помощью
электронного баланса. Укажите окислитель и
восстановитель.
______________________________________
4. СОЛИ АММОНИЯ
Решите альтернативный тест –выбор правильного ответа из
множества.
I вариант выбирает правильные ответы
для азота,
II вариант - для аммиака:
5. Цели урока:
1. Газообразный при обычных условиях.2.Не имеет запаха.
3.Бесцветный.
4.Степень окисления азота -3
5. Взаимодействует с кислотами с образованием солей
6. В молекуле между атомами ковалентная полярная связь
7. Взаимодействует с водородом в присутствии катализатора
8. Он является важнейшим биогенным элементом.
9. Он проявляет только восстановительные свойства
10. В атмосфере этого газа хранят рукописи
11. Жидкий … прекрасное азотное удобрение.
12. Легче воздуха.
13. Используют в медицине.
14. Хорошо растворим в воде.
15. Инертный газ.
6. Задачи урока:
Взаимопроверкаазот
1,2,3,7,8,10,12,13,15
аммиак
1,3,4,5,6,9,11,12,13,14
7.
Девиз урока :«Можно не любить химию,
но прожить без неё
сегодня и завтра
нельзя»
(О.М. Нефёдов)
«Просто знать – еще не
все, знания нужно уметь
использовать»
(И.В.Гете)
8. II. Повторение и контроль.
Первая мировая война.Морское сражение немцев с англичанами.
9.
Тема урока «Соли аммония»Во время I мировой войны английский крейсер вел
преследование поврежденного в бою немецкого
эсминца. Цель была почти достигнута, как вдруг
между кораблями появилось плотное белое облако
дыма. Экипаж крейсера почувствовал удушливый
запах, раздражающий горло и легкие. Крейсер был
вынужден дать задний ход и выйти из дымового
облака. Уже после обнаружили, что пострадали не
только люди, но и металлические части корабля.
Что это было за вещество?
10.
Тема урока«Соли аммония»
11. Взаимопроверка
Этимология – происхождениеназвания.
Название «аммоний» предложил в
1808 году знаменитый английский
химик Хэмфри Дэви. Латинское
слово ammonium когда-то
означало: соль из Аммонии.
Аммония — область в Ливии. Там
находился храм египетского бога
Амона, по имени которого и
называли всю область. В Аммонии
издавна получали аммонийные
соли (в первую очередь
нашатырь), сжигая верблюжий
навоз. При распаде солей
получался газ, который сейчас
называют аммиаком.
12. III. Изучение нового материала.
1787 год - комиссия по химическойноменклатуре дала этому газу имя
ammoniaque (аммониак).
1801 год - русский химик Я. Д. Захаров
исключил из него две буквы. Так
получился аммиак.
13.
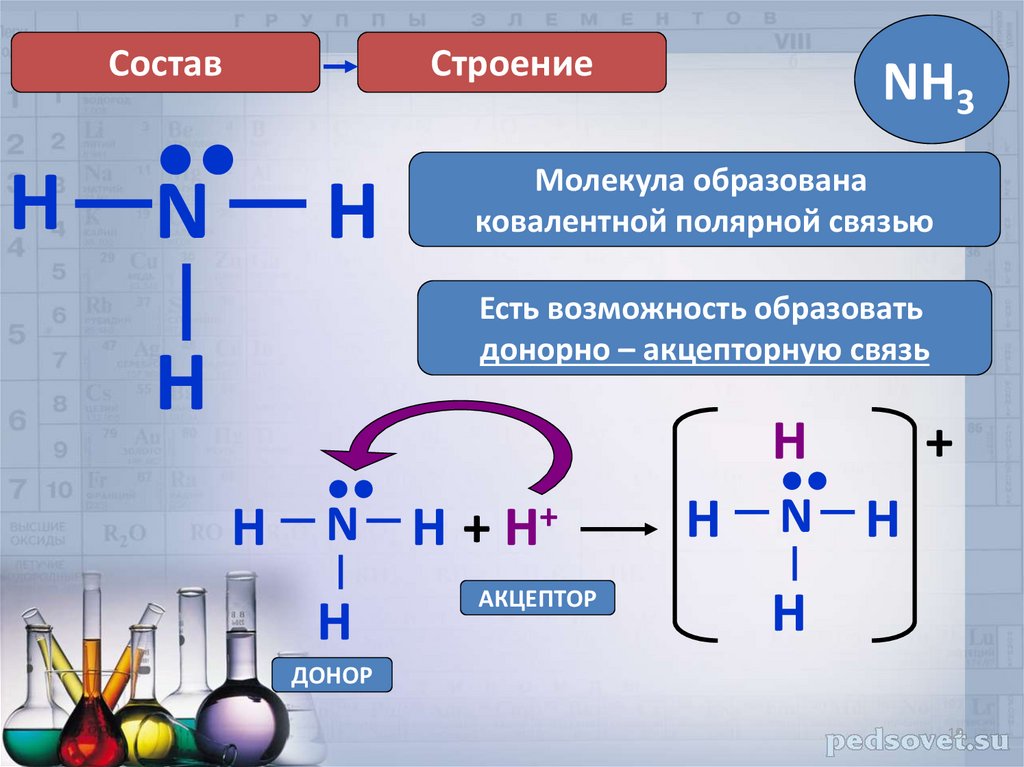
СоставH
Строение
•
N
H
NH3
Молекула образована
ковалентной полярной связью
Есть возможность образовать
донорно – акцепторную связь
H
H
•
N H + H+
H
АКЦЕПТОР
H
H
•
N H
+
H
ДОНОР
19
14.
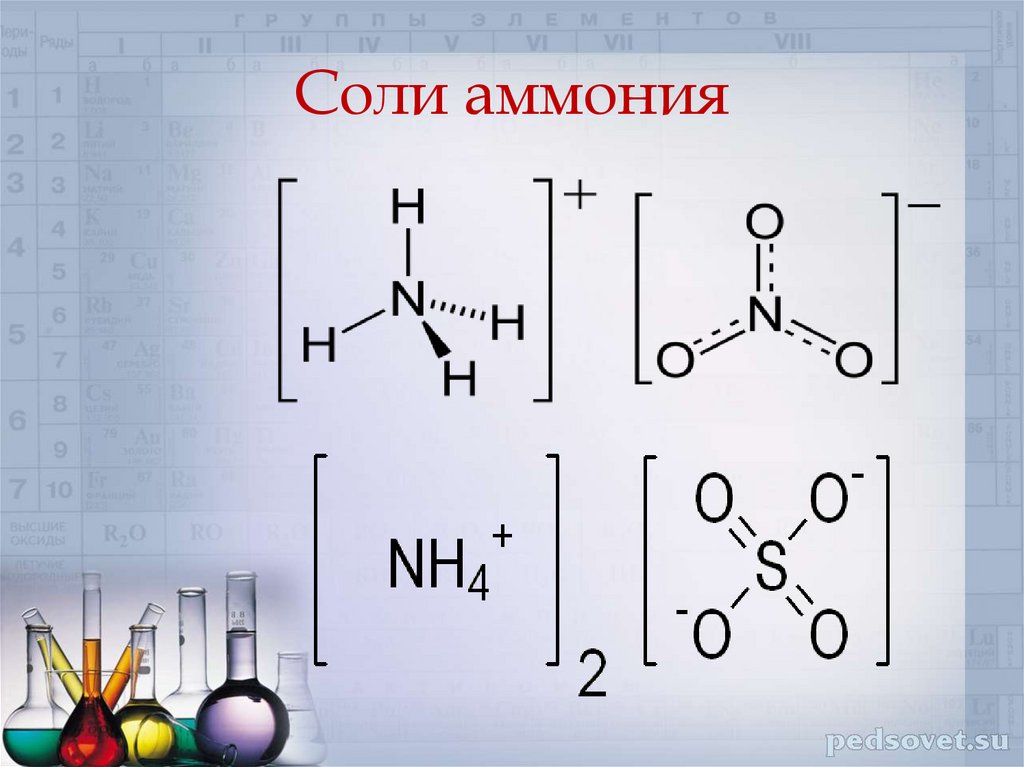
Соли аммония15. Тема урока «Соли аммония»
Физические свойства солейаммония.
а) твёрдые вещества;
б) имеют кристаллическое строение (ионные
кристаллические решётки);
в) хорошо растворимые в воде.
16. Тема урока «Соли аммония»
Химические свойства солейаммония
Вспомните правила Т/Б!
17. Этимология – происхождение названия.
Химические свойства солейаммония.
1. Взаимодействие с солями.
хлорид аммония + нитрат серебра
NH4Cl + AgNO3 NH4NO3 + AgCl
NH4+ + Cl- + Ag+ + NO3- NH4+ + NO3- + AgCl
Cl- + Ag+ AgCl
18.
Сульфат аммония + хлорид бария(NH4)2SO4 + BaCl2 2NH4Cl + BaSO4
2NH4 ++SO42- + Ba2+ +2Cl - 2NH4 + +2Cl - + BaSO4
Ba2+ + SO42- BaSO4
19.
2. Взаимодействие с кислотами.Карбонат аммония + соляная кислота
(NH4 )2СО3 + 2HCl 2NH4Cl + CO2 + H2O
2NH4 + + СО32- + 2H ++2Cl- 2NH4 + + 2Cl- + CO2 + H2O
СО32- + 2H + CO2 + H2O
20. Соли аммония
ФИЗКУЛЬТМИНУТКА21. Физические свойства солей аммония.
3. Взаимодействие с щелочами.NH4Cl+ NaOH NH3 + H2O + NaCl
Взаимодействие с щелочами – это
качественная реакция на соли аммония
(признак реакции: выделение газа с характерным
запахом, окрашивающий влажную лакмусовую
бумажку в синий цвет)
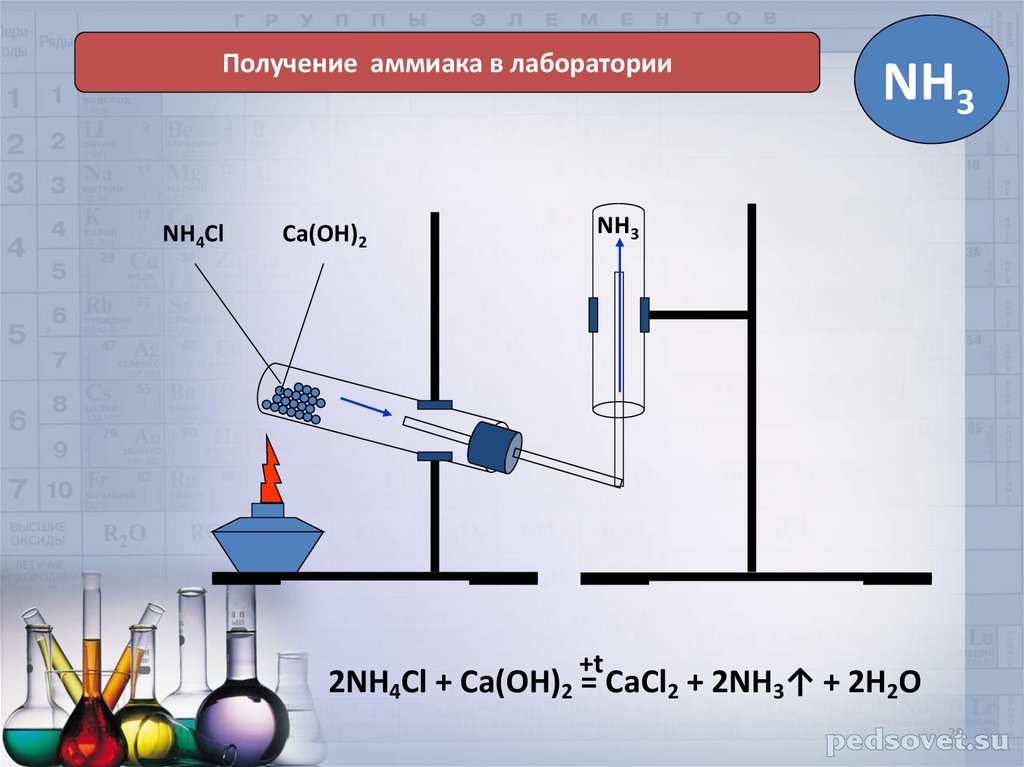
22. Химические свойства солей аммония
Получение аммиака в лабораторииNH4Cl
Ca(OH)2
NH3
NH3
+t
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑ + 2H2O
29
23. Химические свойства солей аммония.
4. Термическое разложение.Все аммонийные соли при нагревании разлагаются.
(NH4)2CO3 = 2NH3 + H2O + CO2
NH4Cl
NH3 + HCl
NH4NO2 = 2H2O + N2
(NH4)2Cr2O7 = Cr2O3 + 4H2O + N2
соли летучих
кислот
соли
кислот
окислителей
24.
Получение солей аммония• Получают их при взаимодействии NH3 или
NH4 OH с кислотами:
NH3 + HCl = NH4 Сl
NH3+HNO3→NH4 NO3
2NH4 OH+H2 SO4→(NH4)2 SO4+2Н2O
25.
Применение солейаммония.
26. ФИЗКУЛЬТМИНУТКА
Русский химик Д.Н ПрянишниковСоли аммония
Азотные удобрения
27.
Аммиачная селитра(нитрат аммония)
- прекрасное азотное удобрение.
NH4NO3
28.
Аммиачная селитра(нитрат аммония)
– взрывчатое вещество.
29.
Смесь нитрата аммония с алюминием иуглем - аммонал (взрывные работы, в
пиротехнике)
30.
Нашатырь (хлорид аммония)• Паяние, лужение
металлов
Хлорид аммония NH4Cl
используют при паянии, так как
он очищает поверхность
металла от оксидной плёнки и
к ней хорошо пристаёт припой.
• Изготовление
гальванических
элементов
31. Получение солей аммония
Гидрокарбонат аммонияNH4HCO3 и карбонат
аммония (NH4)2CO3
применяют в кондитерском деле,
так как они легко разлагаются при
нагревании и образуют газы,
разрыхляющие тесто и делающие
его пышным, например:
NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
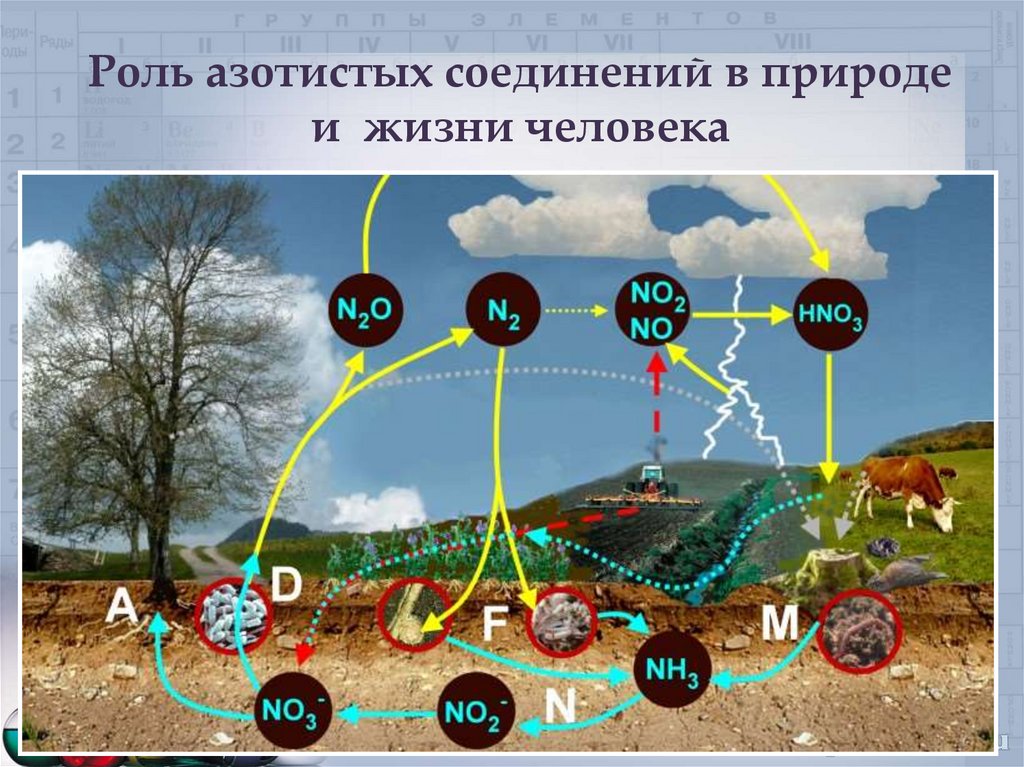
32. Применение солей аммония.
Роль азотистых соединений в природеи жизни человека
33.
Знаете ли вы...Теннисные мячи не надувают, а вводят в
них
«вздуватели»
специальные
вещества, которые при нагревании
разлагаются
с
образованием
газообразных продуктов. В теннисные
мячи (заготовки которых в виде двух
полусфер изготовлены предварительно и
смазаны
клеем)
кладут
таблетки,
содержащие смесь нитрита натрия и
хлорида аммония. Склеенные половинки
мяча
помещают
в
форму
для
вулканизации и нагревают. Выделившийся
азот создает в мяче повышенное
давление.
34. Аммиачная селитра (нитрат аммония) - прекрасное азотное удобрение.
Задания на развитие творческогомышления
•Предложите способ очистки поваренной
соли от содержащейся в ней примеси
хлорида аммония.
•Объясните, можно ли смешивать
аммиачную селитру (нитрат аммония) с
известью?
35. Аммиачная селитра (нитрат аммония) – взрывчатое вещество.
Повторим:1.Выбрать и назвать соли аммония
NaNO3
H2SO4
K2CО3
(NH4)2CО3
NaCL
NH4Cl
NH4HSO4
H3PО4
AgNO3
Ca(OH)2
HNO3
NH4H2PО4
CaCl2
(NH4)2SO4
NH4NO3
H2SiO3
H2S
(NH4)2S
2. Перечислите химические свойства
солей аммония.
3. Назовите физические свойства
солей аммония.
36.
V. Домашнее задание.Выучить параграф 18.
Составить уравнения реакций, с помощью которых можно
осуществить превращения:
N2 NH3 (NH4)3РO4 NH4Cl NH4NO3
Составьте полное и краткое ионные уравнения для
превращений 3 и 4.
Для превращения 1 (окислительно–восстановительная
реакция)
расставьте
коэффициенты
методом
электронного баланса.
37. Нашатырь (хлорид аммония)
РЕФЛЕКСИЯ1) Больше всего мне
понравилось...
2) Самым интересным
сегодня на уроке было...
3) Сегодня на уроке я
почувствовал…
4) Сегодня я понял...
5) Сегодня я научился...
6) Сегодня я задумался....
7) Я не узнал сегодня ничего
нового
8) Мне сегодня было скучно
на уроке
38.
СПАСИБО ВСЕМ ЗАУРОК!


































 chemistry
chemistry








