Similar presentations:
Кинетические методы анализа
1. Кинетические методы анализа
Кинетические методы анализа основаны назависимости скорости химической реакции от
концентраций реагирующих веществ.
Реакция, скорость которой измеряется, называется
индикаторной.
Вещество, по изменению концентрации которого
судят
о
скорости
реакции
называется
индикаторным.
2.
Для индикаторной реакции nA + mB AnBmсвязь между скоростью реакции и концентрацией реагирующих веществ
выражается в виде:
d A
k A n B m
d
Где: k – наблюдаемая скорость реакции, - время, [A], [B] – концентрации
реагентов А и В; n, m – стехиометрические коэффициенты.
Внимание! Перед производной ставится знак «+», если индикаторное
вещество образуется в ходе реакции, а « », если оно расходуется.
Обычно используются уравнения первого порядка (n=1).
Если [B]>>[A] , то [B]=const, тогда
Интегрируем:
A
A0
0
d A
A k ' d
A A0 e k '
d A
k ' A
d
где k’=k [B].
ln A A
k '
A
0
A0
ln
k '
A
- Основное уравнение кинетических методов.
3. Каталиметрия
При измерении следовых количеств веществ используютсякаталитические реакции, а сам метод носит название
каталиметрии
Каталиметрия в анализе ОЧВ используется, в основном, для
определения переходных металлов (Fe, Co, Pt, Pd, Rd и др. ),
которые чаще всего являются катализаторами.
В основе каталиметрии лежит какая-либо каталитическая
реакция, а целью – определение концентрации катализатора.
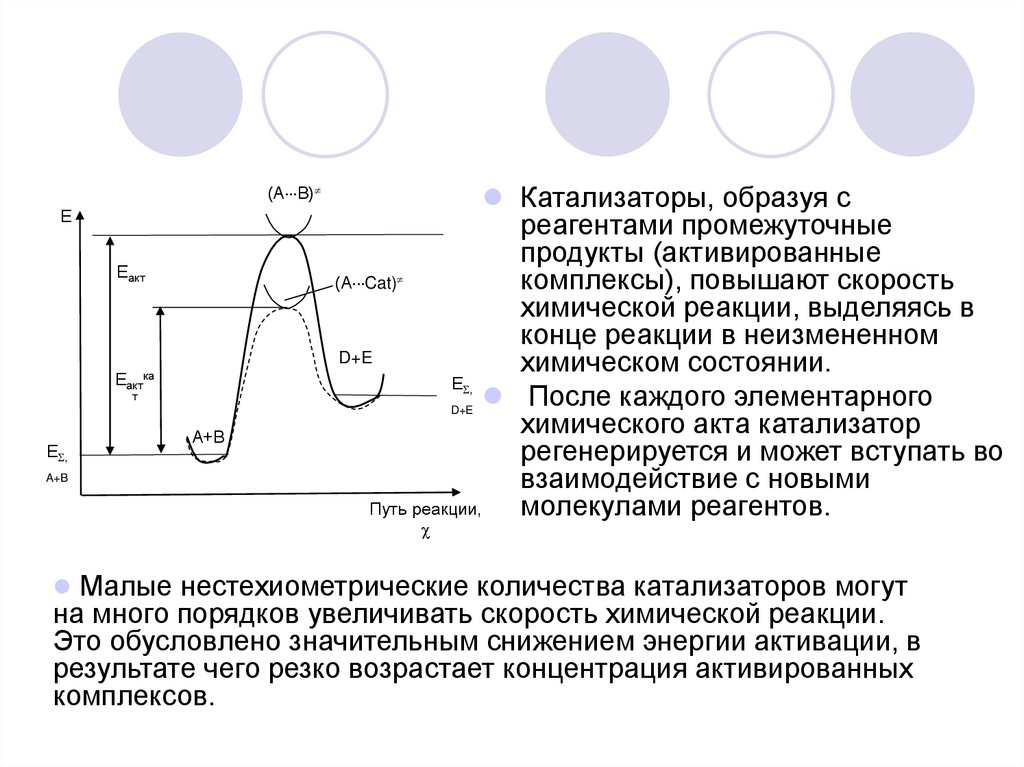
4.
(А В)Е
Еакт
Еактка
т
Е ,
A+B
А+В
Катализаторы, образуя с
реагентами промежуточные
продукты (активированные
(А Cat)
комплексы), повышают скорость
химической реакции, выделяясь в
конце реакции в неизмененном
D+E
химическом состоянии.
Е ,
После каждого элементарного
D+E
химического акта катализатор
регенерируется и может вступать во
взаимодействие с новыми
Путь реакции,
молекулами реагентов.
Малые нестехиометрические количества катализаторов могут
на много порядков увеличивать скорость химической реакции.
Это обусловлено значительным снижением энергии активации, в
результате чего резко возрастает концентрация активированных
комплексов.
5.
Достоинства:Метод каталиметрии применяется для определения концентрации
следовых количеств более 40 элементов.
Предел обнаружения:
для примесей Fe, Ni, Cr, Ti, Cu - 10-6 – 10-7 масс. %,
Mn в пробе при его концентрации 10-9 масс. %,
Со – 10-10 масс.%.
Чувствительность
методик
каталиметрии
превышает
чувствительность спектрального анализа.
Недостаток:
Недостаточная избирательность, т.к. одну и ту же реакцию могут
катализировать ионы различных металлов. Поэтому очень важен
правильный выбор каталитической реакции.
Иногда определяемую примесь предварительно выделяют из
пробы, например, за счет экстракции (экстракционнокаталитический метод).
6.
В каталитиметрии:Реакция, скорость которой определяется концентрацией определяемого иона
металла, называется индикаторной.
Вещества, по изменению концентрации которых во времени проводят анализ
– индикаторные вещества.
Внимание! Определяемый ион не является индикаторным веществом!
Чаще всего индикаторная реакция – ОВР с участием окрашенных
соединений. Для определения концентрации – спектрофотомерия.
Пример:
Предел обнаружения меди при реакции окисления гидрохинона Н2О2
[CCu]min=10-6 – 10-7 масс. %.
7.
● Кинетическое уравнение для каталитических гомогенных реакций :dx
k C k0 П c
d
х – концентрация индикаторного вещества,
- время,
k – наблюдаемая константа скорости реакции,
Сk0– концентрация катализатора,
Пс – произведение концентрации реагирующих веществ.
● Кругооборотное число - число циклов, в которых участвует одна частица
катализатора в единицу времени:
Nk
N k k Пc
x
C k0
С k0
x
x
N k k П с
8.
Пример: Определение примеси ионов меди:Гидрохинон + Н2О2
бесцветный
Cu2+
гидрохинон
бесцветный
окрашен
Cпектрофотометрическое определение концентрации окрашенных частиц
радикала гидрохинона: УФ области ( =500 нм), тогда =105 л/(моль см),
Пусть l=10 см, A =0,1, тогда
A = c l
концентрация радикала гидрохинона с= х=10-7 моль/л.
Если время наблюдения =10 мин, Пс=0,1 моль/л и k=108 , то
предел обнаружения равен:
10 7
0
С kmin
10 16 моль / л
10 10 8 1
Если М=100 г/моль и =1 г/мл, то
(Ck0 )min 10 16
моль
г
л
г
100
10 3
10 17
10 15 масс .%
л
моль
мл
мл







 chemistry
chemistry








