Similar presentations:
Спирты. Предельные одноатомные спирты
1.
Тема урока:Спирты.
Предельные одноатомные
спирты.
2. Физические свойства
1.2.
3.
4.
5.
6.
Агрегатное состояние:
С1- С11- жидкости
С12 - С…- твердые вещества
Запах
С1 - С3 - «спиртовой» запах,
жгучий вкус
С4 – С5 - «сивушный» запах
С6 – С11 - неприятный запах
С12 - С…- запаха нет
С1 - С3 – Р, с С4 – Р
уменьшается, с С8 – Н
Бесцветны
CH3OH- сильный яд!
C2H5 OH- слабый наркотик
3. Водородная связь - связь между атомами водорода одной молекулы и атомами сильно электроотрицательных элементов (кислорода,
азота,фтора) другой молекулы.
…О - Н … О - Н … О - Н…
│
│
│
R
R
R
Образование
ассоциатов
…О - Н …О - Н …О - Н …
│
│
│
С2Н5
Н
С2Н5
4. Влияние водородной связи на физические свойства соединений
ЭтанТ кип = -89°С
Этанол
Ткип = 78 °С
Пропан
Т кип = - 42 °С
Пропанол - 1
Т кип = 97°С
[ УВ и УВНаl]
Одноатомные
спирты
Этиленгликоль
Т кип = 189°С
Глицерин
Т кип = 290°С
Многоатомные
спирты
5.
Химические свойства спиртовI. Реакции замещения
Реакции, идущие с участием атома водорода
гидроксильной группы
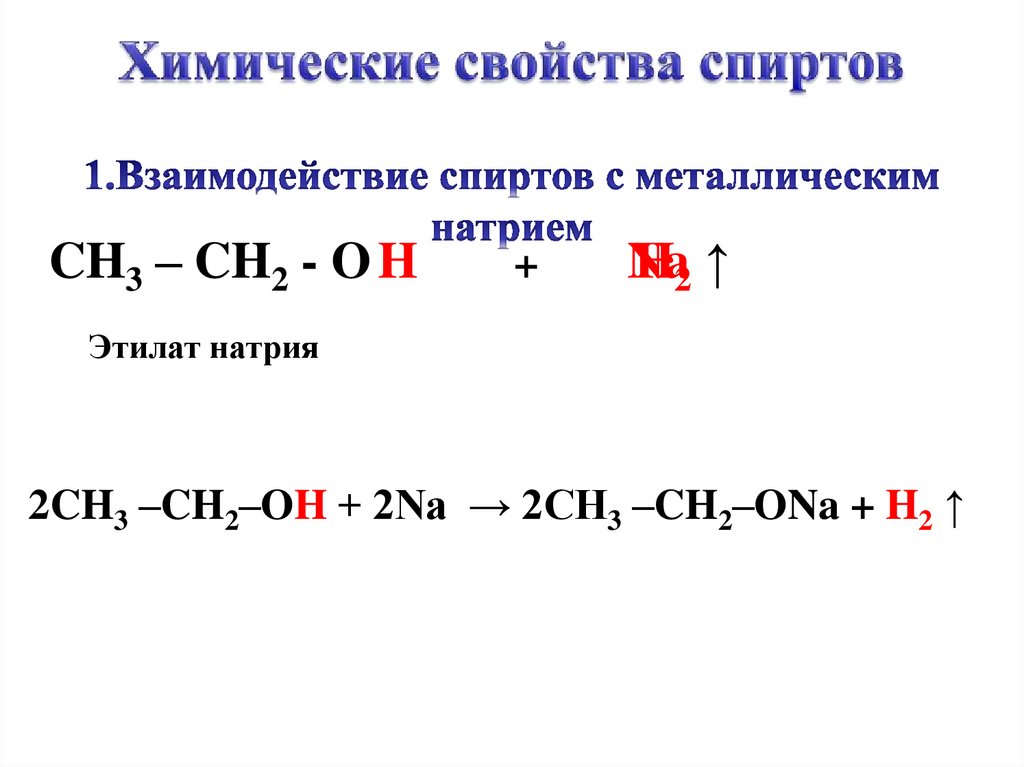
6.
CH3 – CH2 - O H+
Na
H2 ↑
Этилат натрия
2CH3 –CH2–OH + 2Na → 2CH3 –CH2–ONa + H2 ↑
7.
OR–C +
H2SO4 ,t0
HO
H -R
O
+ R–C
OH
ОH
Кислота
О-R
Спирт
Сложный эфир
CH3–CОOH + HОC2H5 ↔ CH3–СОО–C2H5 +
H2О
уксусная
кислота
этиловый
спирт
этиловый эфир
уксусной кислоты
8.
Реакции, идущие с участием гидроксильнойгруппы
3.Взаимодействие с галогеноводородами
C2H5OH+HBr →C2H5Br +HOH
9.
II. Реакцииотщепления
1. Дегидрирование(стр.146)
Составьте уравнения реакций, заменив
радикал R на СН3.
Назовите продукты реакций.
2. Дегидрирование и дегидратация(стр.110) –
реакция Лебедева
10.
А)ВнутримолекулярнаяH2SO4, t>140
СН
Н3 - СН2 - ОН
+ СН2 = СН2
Этилен
Б)Межмолекулярная
H2SO4, t<140
ОН + Н
С2Н5 -ОН
НО- С2Н5
избыток
+ С2Н5 -О-С2Н5
Диэтиловый
эфир
11.
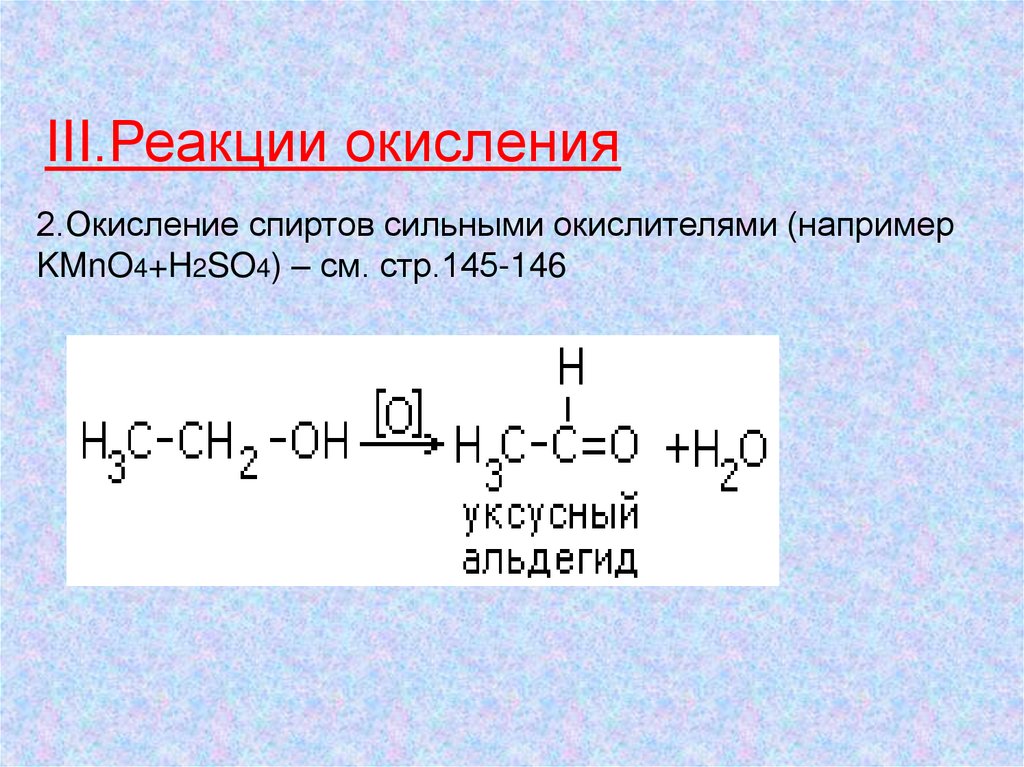
III.Реакции окисления1.Горение
С2Н5ОН + 3О2 → 2СО2 + 3Н2О +1374 кДЖ
12.
III.Реакции окисления2.Окисление спиртов сильными окислителями (например
KMnO4+H2SO4) – см. стр.145-146
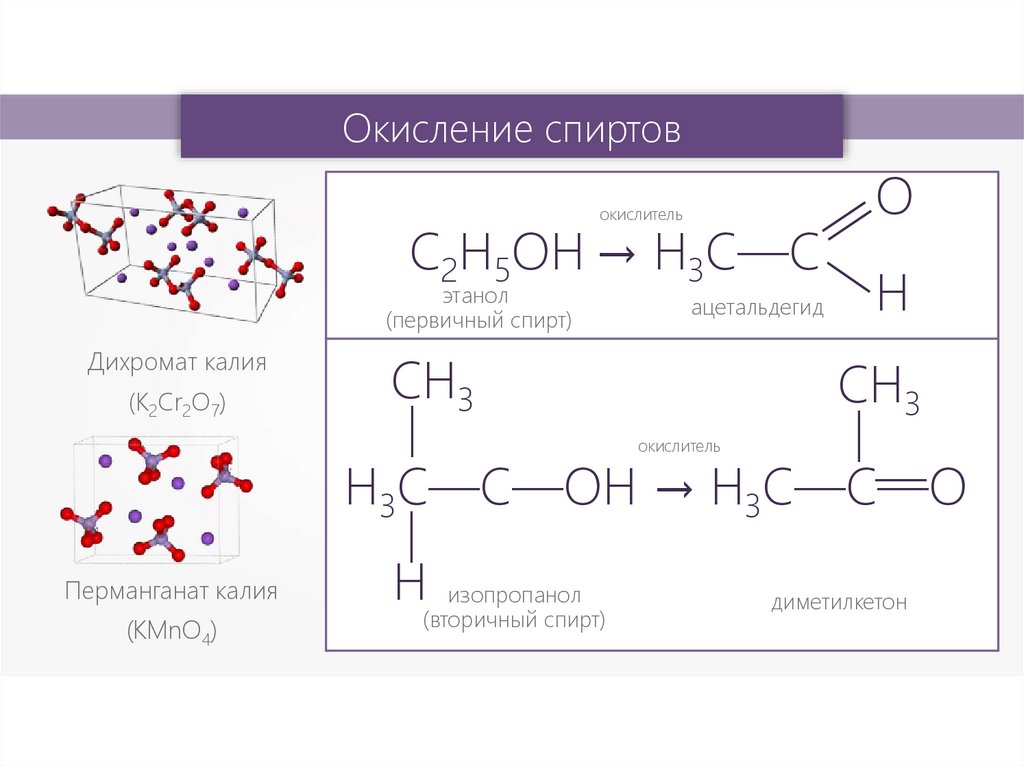
13.
Окисление спиртовокислитель
С2Н5ОH → H3C—C
этанол
(первичный спирт)
Дихромат калия
СН3
H
СН3
окислитель
—
—
(K2Cr2O7)
ацетальдегид
О
—
—
H3C—C—OH → H3C—C—O
Перманганат калия
(КМnО4)
Н
изопропанол
(вторичный спирт)
диметилкетон
14.
3. Окисление оксидом меди(II) – качественная реакцияна метиловый и этиловый спирты.
t
CH3 –OH + CuO → H–COH
H2O
чёрный цвет
+ Cu +
муравьиный альдегид
красный цвет
запах формалин
t
CH3 – CH2 – OH + CuO → CH3–COH
H2O
чёрный цвет
уксусный альдегид
запах зелёного яблока
+ Cu +
красный цвет
15.
0t
CH3 –CH2–OH + CuO → CH3–C
O
+ Cu + H2O
H
16.
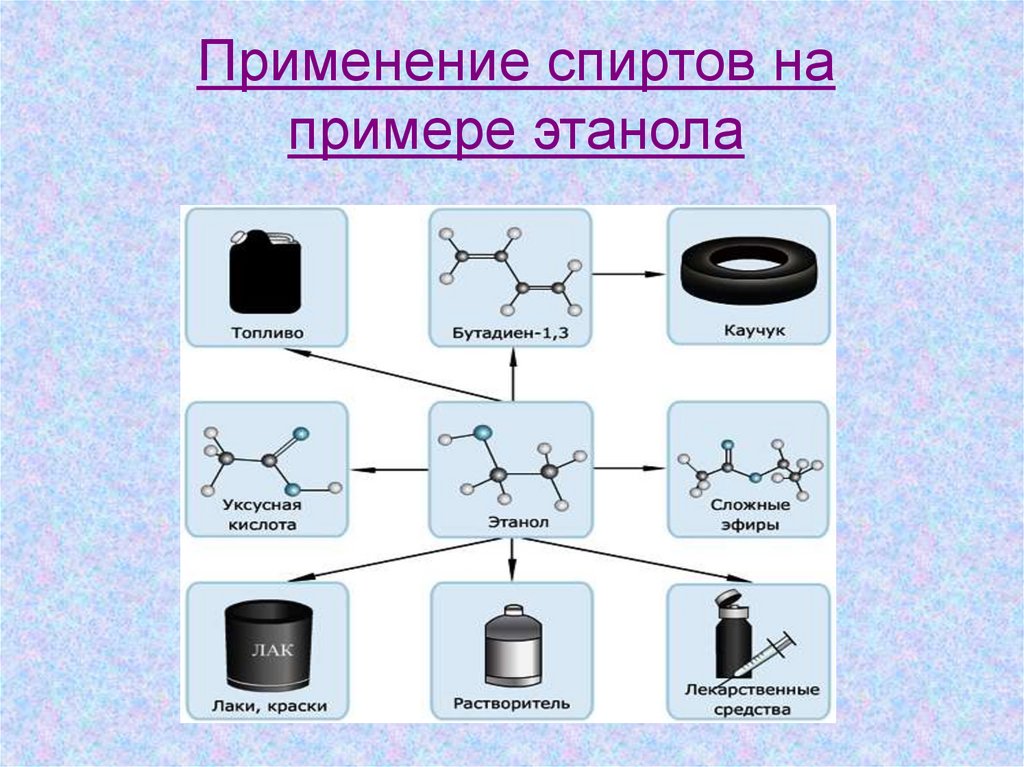
Применение спиртов напримере этанола
17.
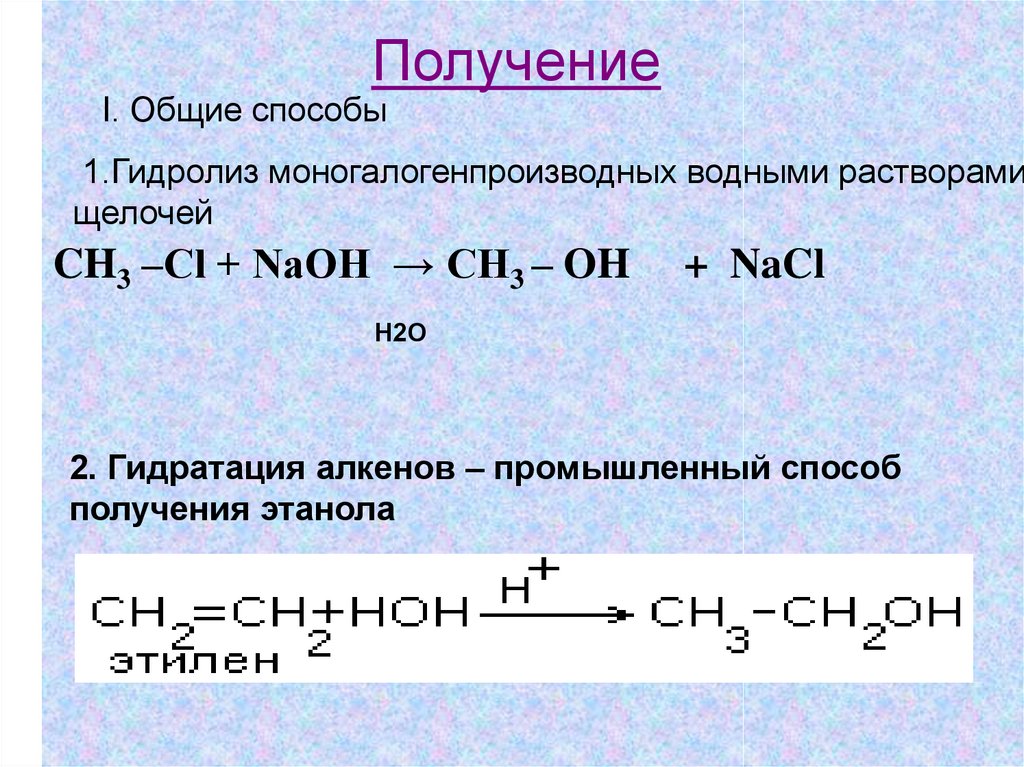
ПолучениеI. Общие способы
1.Гидролиз моногалогенпроизводных водными растворами
щелочей
CH3 –Сl + NaOH → CH3 – OH
+ NaCl
Н2О
2. Гидратация алкенов – промышленный способ
получения этанола
18.
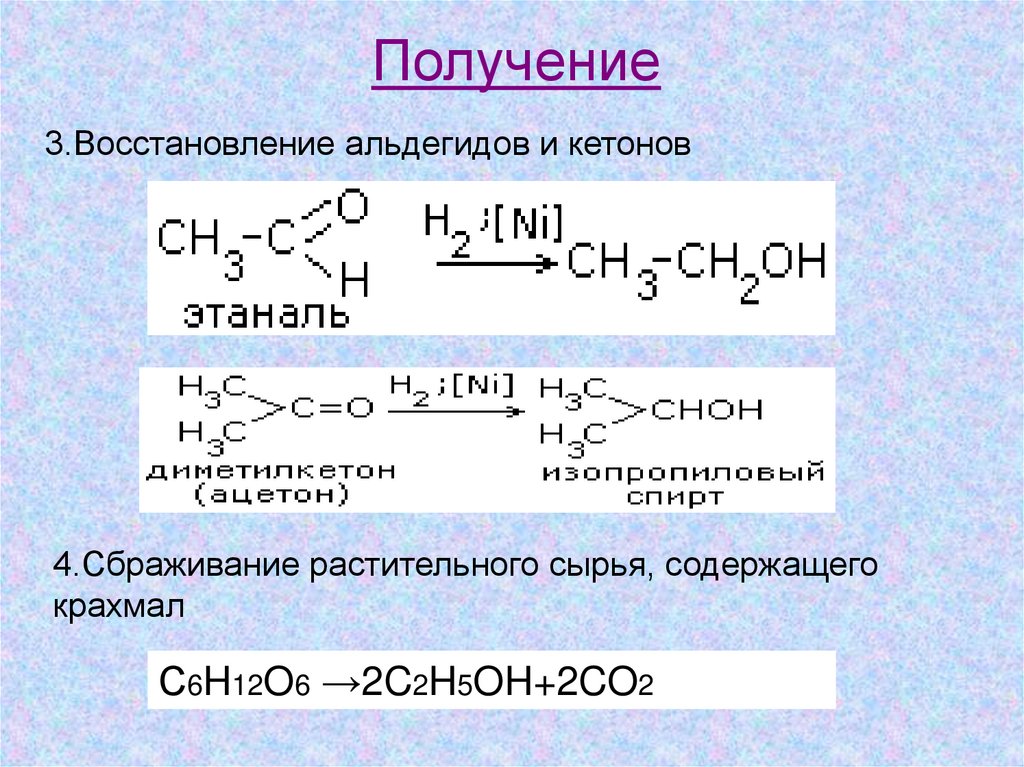
Получение3.Восстановление альдегидов и кетонов
4.Сбраживание растительного сырья, содержащего
крахмал
С6H12O6 →2C2H5OH+2CO2
19.
ПолучениеII. Специфические способы
1. Синтез метанола из синтез – газа.
см. уравнение стр.149.
2. Сбраживание растительного сырья, содержащего
крахмал и целлюлозу.
→ глюкоза → этиловый
спирт(пищевой)
Крахмал + Н2О
→ глюкоза → этиловый
спирт(гидролизный)
Целлюлоза + Н2О
Брожение глюкозы
см. уравнение стр.149.
20.
Д.з.: п.17, № 10,11,задача:
Вычислите объём
водорода,выделившегося при
взаимодействии 4,6 г натрия этиловым
спиртом массой 30 г.














 chemistry
chemistry








