Similar presentations:
Закон сохранения массы веществ. Химические уравнения
1. Закон сохранения массы веществ. Химические уравнения
2. Закон сохранения массы
1748 г. М.В. Ломоносов1756 г. – подтвердил
экспериментально
«Все перемены, в натуре
случающиеся, такого
суть состояния, что,
сколько чего у одного
тела отнимется, столько
присовокупится к
другому, так ежели где
убудет несколько
материи, то умножится
в другом месте»
3.
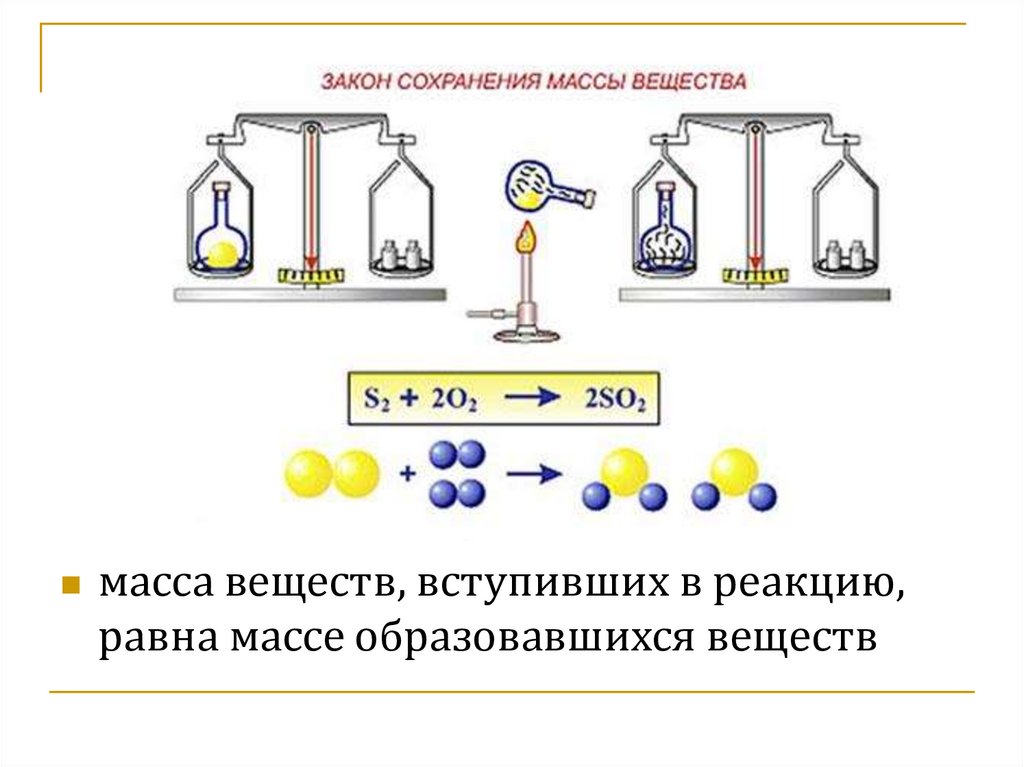
масса веществ, вступивших в реакцию,равна массе образовавшихся веществ
4.
оксид ртути → ртуть + кислород2,17 г
2,01 г
?
m(O2) =
нитрат меди → оксид меди + оксид азота + кислород
?
1,6 г
1,84 г
0,32 г
m(Cu(NO3)2) =
5.
Химическое уравнение – это условнаязапись химической реакции с помощью
химических формул и (если нужно)
коэффициентов.
Алгоритм составления уравнения реакции
1. Составить формулы всех вступающих в
реакцию веществ, разделив их знаком (+).
2. Поставить стрелку и составить формулы всех
продуктов реакции, разделив их знаком (+).
3. Уравнять количество атомов каждого
элемента, используя коэффициенты и «правило
чётности».
6. Составьте уравнения реакций
Zn + O2 →Fe + ? → FeCl3
Al + O2 →
ZnS + ? → SO2 + ZnO
Ag2S + O2 → SO2 + ?
Na + Cl2 →
Mg + O2 →
Al + Cl2 →
Al + S →
7.
Антуан ЛоранЛавуазье
1789 г. - закон
сохранения
массы
Сохранение
массы и
количества
атомов каждого
элемента







 chemistry
chemistry








