Similar presentations:
Основные законы и понятия химии. Тема №10
1. «Химия»
Тема №10 «Основные законы и понятияхимии».
2.
Химия – это наука о веществах, их строении,свойствах и превращениях.
Главная задача химии – получение веществ с
необходимыми свойствами.
В широком понимании, вещество — это любой
вид материи, обладающий собственной
массой, например элементарные частицы. В
химии понятие вещества более узкое, а
именно: вещество — это любая
совокупность атомов и молекул.
3. История развития химии
• Атомно-молекулярное учение – ДревняяГреция (Атомистика)
• XVII век, Пьера Гассенди-возрождение
атомистики
• Р. Бойль- «если газ имеет дискретное
строение, т.е. состоит из атомов и
пустоты, то легкость его сжатия
обусловлена сближением атомов в
результате уменьшения свободного
пространства между ними».
4. Законы химии
Закон сохранения массы сформулирован М. В. Ломоносовым в 1748 году и А.
Лавуазье в 1777 году. Он гласит: масса веществ, вступающих в химическую
реакцию, равна массе веществ, образующихся в результате реакции.
Закон постоянства состава установил в 1801 году Ж. Пруст, согласно которому
каждое химически чистое соединение независимо от способа его получения
имеет вполне определенный состав.
Закон эквивалентов был сформулирован В. Рихтером в 1794 году. Он гласит:
во всех химических реакциях взаимодействие различных веществ друг с другом
происходит в соответствии с их эквивалентами, независимо от того, являются ли
эти вещества простыми или сложными.
Закон кратких отношений открыл в 1803 году Д. Дальтон. Если два элемента
образуют друг с другом несколько химических соединений, то на одну и ту же
массу одного из них приходятся такие массы другого, которые соотносятся
между собой как простые целые числа.
Закон объемных отношений открыт в 1805 г. Ж. Гей-Люссаком, согласно
которому объемы вступающих в реакцию газов относятся друг к другу, а также к
объему получающихся газообразных продуктов как простые целые числа.
Закон А. Авогадро высказанное в 1811, гласит в равных объемах различных
газов при одинаковой температуре и давлении содержится одинаковое число
молекул.
5. Основные положения атомно-молекулярного учения:
Основные положения атомномолекулярного учения:В сентябре 1860 года на I Международном съезде химиков в
Германии, в г. Карлсруэ
1. Все вещества состоят из атомов.
2. Атомы каждого вида (элемента) одинаковы между собой,
но отличаются от атомов другого вида (элемента).
3. При взаимодействии атомов образуются молекулы:
гомоядерные (при взаимодействии атомов одного
элемента) или гетероядерные (при взаимодействии атомов
разных элементов).
4. При физических явлениях молекулы сохраняются, а при
химических – разрушаются. При химических реакциях
атомы в отличие от молекул сохраняются.
5. Химические реакции заключаются в образовании новых
веществ из тех же самых, из которых состоят
первоначальные вещества.
6. Периодический закон.
• Д. И. Менделеев в 1869 году периодическогозакона химических элементов и создания его
табличного выражения – периодической
системы.
• Формулировка закона - свойства химических
элементов (т.е. свойства и форма образуемых
ими соединений) находятся в периодической
зависимости от заряда ядра атомов
химических элементов.
7.
8. Химическая связь.
Химическая связь - это взаимодействие двух атомов,осуществляемое путем обмена электронами.
Основные характеристики химической связи −
прочность, длина, полярность.
• Энергия связи является важнейшей характеристикой
химической связи, определяющей ее прочность.
• Количественно она оценивается при помощи энергии,
которая затрачивается на ее разрыв.
Различают следующие виды химической связи:
1. Ковалентная (полярная и неполярная; обменная и
донорно-акцепторная),
2. Ионная,
3. Водородная
4. Металлическая.
9. Ковалентная связь
- это связь, возникающая междуатомами за счет образования
общих электронных пар
(Например, H2, HCl, H2O, O2).
1)Обменный механизм. Каждый атом
дает по одному неспаренному
электрону в общую электронную
пару.
а) Неполярная - связь возникает
между атомами двух одинаковых
неметаллов.
б)Полярная - связь возникает между
двумя разными неметаллами за
счет образования общих
электронных пар.
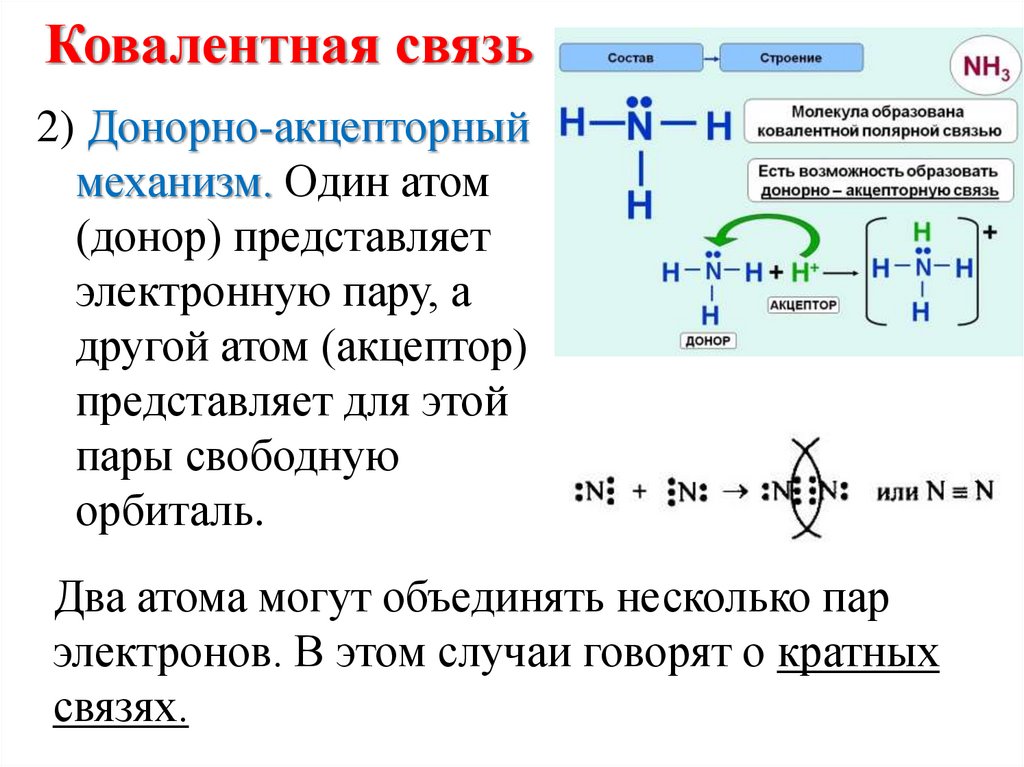
10. Ковалентная связь
2) Донорно-акцепторныймеханизм. Один атом
(донор) представляет
электронную пару, а
другой атом (акцептор)
представляет для этой
пары свободную
орбиталь.
Два атома могут объединять несколько пар
электронов. В этом случаи говорят о кратных
связях.
11. Ионная связь
• Образуется между атомами металлов и неметаллов,т.е. между атомами резко отличающихся друг от друга
электроотрицательностью. Химическая связь между
ионами осуществляемая за счёт электростатического
притяжения.
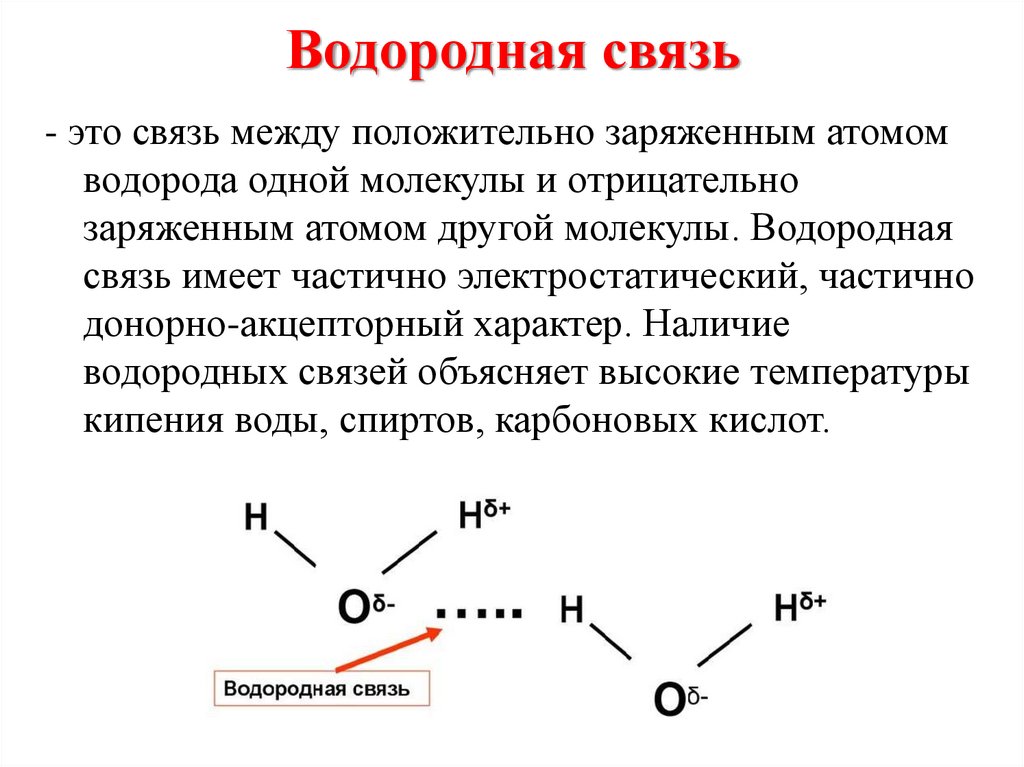
12. Водородная связь
- это связь между положительно заряженным атомомводорода одной молекулы и отрицательно
заряженным атомом другой молекулы. Водородная
связь имеет частично электростатический, частично
донорно-акцепторный характер. Наличие
водородных связей объясняет высокие температуры
кипения воды, спиртов, карбоновых кислот.
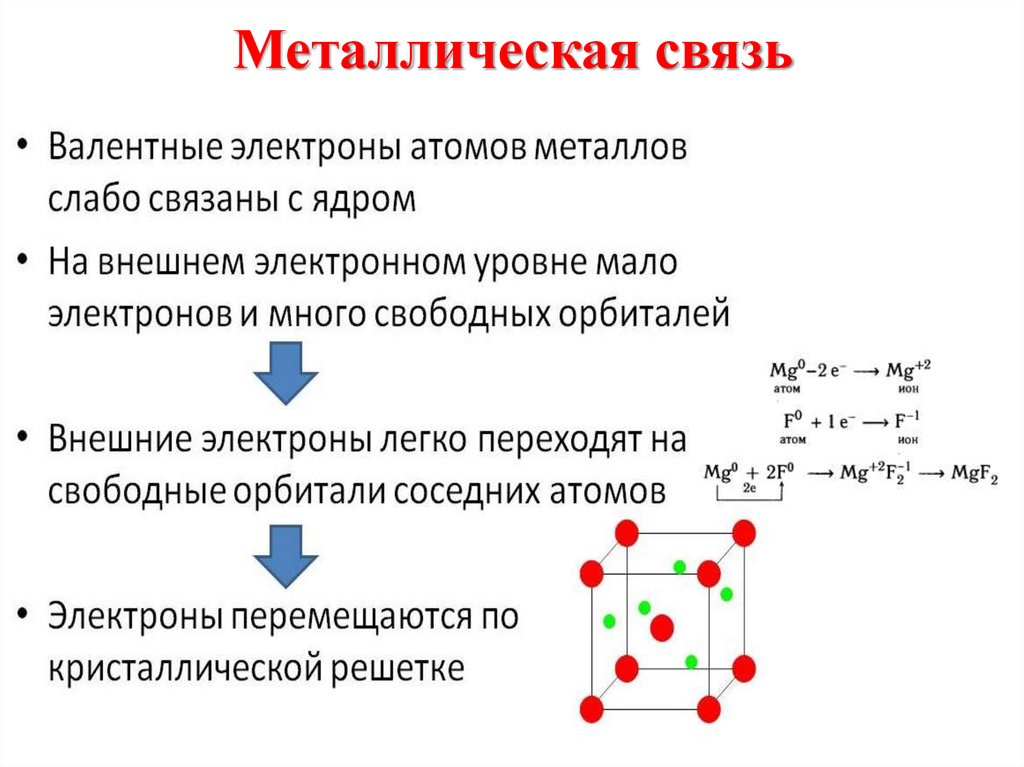
13. Металлическая связь
14. Химические реакции
Химическими реакциями называются явления, прикоторых одни вещества, обладающие определенным
составом и свойствами, превращаются в другие
вещества - с другим составом и другими свойствами.
Вещества, вступающие в химическую реакцию,
называются – реагентами.
Вещества, образующиеся в результате реакции –
продукты реакции.
Типы химических реакций
1. реакции соединения,
2. реакции разложения,
3. реакции обмена,
4. реакции замещения.
15. Типы химических реакций
1. Обратимые − протекают только в одном направлении (хотя быодно из исходных веществ превращается в продукты реакции:
осадок, или газ)
2. Необратимые − при данных условиях протекают в
противоположных направлениях, прямом и обратном.
В результате химической реакции выделяется или поглощается
теплота (тепловой эффект реакции Q).
1. Экзотермические- р-ция происходит с выделением тепла (Q > 0)
2. Эндотермические- поглощением тепла (Q < 0).
Некоторые реакции протекают (1.) без степеней окисления, либо (2.)
с изменением степени окисления всех или некоторых элементов
– окислительно-восстановительные реакции.
По наличию или отсутствию поверхностей раздела между
реагентами, химические реакции делятся
1. гомогенные (нет поверхности раздела)
2. гетерогенные (вещества отделены друг от друга поверхностью
раздела).
16. Скорость реакции и факторы
Скорость химической реакции – число элементарных актовхимического взаимодействия, протекающих в единицу времени в
единицу объема (гомогенные) или на единице поверхности
(гетерогенные).
Истинная скорость реакции:
Факторы влияющие на скорость реакции.
Для гомогенных, гетерогенных реакций:
1) концентрация реагирующих веществ − чем выше концентрация, тем
скорость выше;
2) температура − При увеличении температуры скорость большинства
химических реакций повышается. Эта зависимость описана
правилом Вант-Гоффа: «При повышении температуры на каждые 10
°C скорость химических реакций увеличивается в 2 – 4 раза».
3) катализатор – вещество увеличивающее скорость реакции;
4) ингибитор – вещество замедляющее скорость реакции.
Только для гетерогенных:
1) скорость подвода реагирующих веществ к поверхности раздела фаз;
2) площадь поверхности – чем больше площадь, тем выше скорость.
17. Тепловой эффект и химическое равновесие химической реакции
Тепловым эффектом химической реакции называется количествотеплоты, выделившееся (или поглотившееся) в ходе реакции и
относимое к 1 моль прореагировавшего (или образовавшегося)
вещества.
Тепловой эффект обозначается буквой Q и, как правило, измеряется в
кДж/моль или в ккал/моль.
Термохимическое уравнение – это уравнение химической реакции, в
котором указаны агрегатное состояние компонентов реакционной
смеси (реагентов и продуктов) и тепловой эффект реакции.
Например:
CuO (тв.) + H2 (г.) = Cu (тв.) + H2O (г.) +79 кДж
Химическое равновесие - это такое состояние системы, при
котором скорости прямой и обратной реакций становятся
одинаковыми (vпр..= vобр.). Количественной характеристикой
химического равновесия является ее константа.
Принцип Ле Шателье: если на систему, находящуюся в состоянии
равновесия, подействовать извне, то в системе будут происходить
изменения, которые ослабляют внешнее воздействие.














 chemistry
chemistry








