Similar presentations:
Рецепторы гормонов и передача сигналов: рецепторы клеточной поверхности, внутриклеточные рецепторы
1. Рецепторы гормонов и передача сигналов: рецепторы клеточной поверхности, внутриклеточные рецепторы (Инсулин. ГКС. Тиреоидные
гормоны)Доц., к.б.н И.В. Карнаухова ОрГМУ
2.
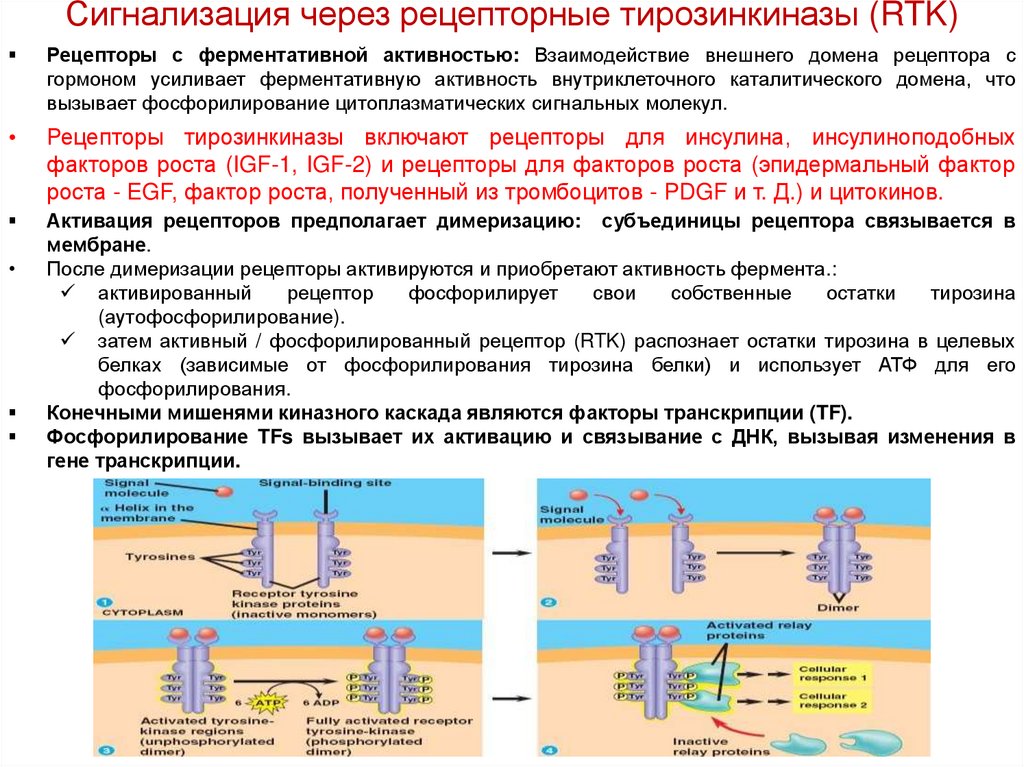
Сигнализация через рецепторные тирозинкиназы (RTK)Рецепторы с ферментативной активностью: Взаимодействие внешнего домена рецептора с
гормоном усиливает ферментативную активность внутриклеточного каталитического домена, что
вызывает фосфорилирование цитоплазматических сигнальных молекул.
Рецепторы тирозинкиназы включают рецепторы для инсулина, инсулиноподобных
факторов роста (IGF-1, IGF-2) и рецепторы для факторов роста (эпидермальный фактор
роста - EGF, фактор роста, полученный из тромбоцитов - PDGF и т. Д.) и цитокинов.
Активация рецепторов предполагает димеризацию: субъединицы рецептора связывается в
мембране.
После димеризации рецепторы активируются и приобретают активность фермента.:
активированный
рецептор
фосфорилирует
свои
собственные
остатки
тирозина
(аутофосфорилирование).
затем активный / фосфорилированный рецептор (RTK) распознает остатки тирозина в целевых
белках (зависимые от фосфорилирования тирозина белки) и использует АТФ для его
фосфорилирования.
Конечными мишенями киназного каскада являются факторы транскрипции (TF).
Фосфорилирование TFs вызывает их активацию и связывание с ДНК, вызывая изменения в
гене транскрипции.
3.
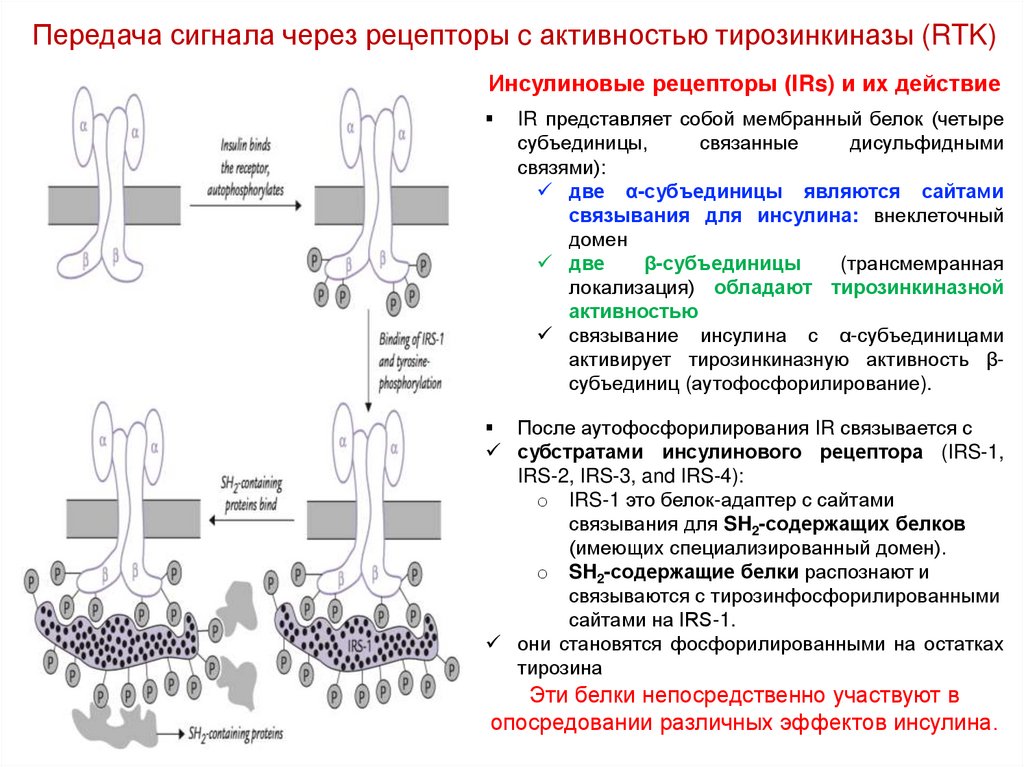
Передача сигнала через рецепторы c активностью тирозинкиназы (RTK)Инсулиновые рецепторы (IRs) и их действие
IR представляет собой мембранный белок (четыре
субъединицы,
связанные
дисульфидными
связями):
две α-субъединицы являются сайтами
связывания для инсулина: внеклеточный
домен
две
β-субъединицы
(трансмемранная
локализация) обладают тирозинкиназной
активностью
связывание инсулина с α-субъединицами
активирует тирозинкиназную активность βсубъединиц (аутофосфорилирование).
После аутофосфорилирования IR связывается с
субстратами инсулинового рецептора (IRS-1,
IRS-2, IRS-3, and IRS-4):
o IRS-1 это белок-адаптер с сайтами
связывания для SH2-содержащих белков
(имеющих специализированный домен).
o SH2-содержащие белки распознают и
связываются с тирозинфосфорилированными
сайтами на IRS-1.
они становятся фосфорилированными на остатках
тирозина
Эти белки непосредственно участвуют в
опосредовании различных эффектов инсулина.
4.
Передача сигнала через рецепторы c активностью тирозинкиназыИнсулиновые рецепторы (IRs) и их действие
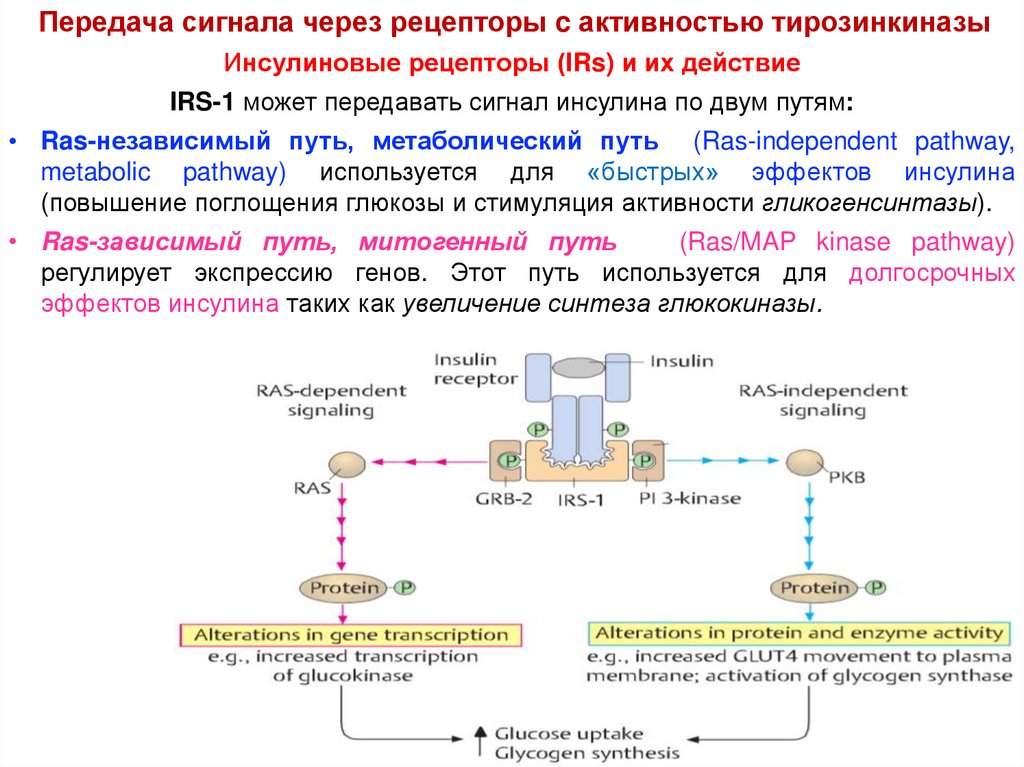
IRS-1 может передавать сигнал инсулина по двум путям:
• Ras-независимый путь, метаболический путь (Ras-independent pathway,
metabolic pathway) используется для «быстрых» эффектов инсулина
(повышение поглощения глюкозы и стимуляция активности гликогенсинтазы).
• Ras-зависимый путь, митогенный путь
(Ras/MAP kinase pathway)
регулирует экспрессию генов. Этот путь используется для долгосрочных
эффектов инсулина таких как увеличение синтеза глюкокиназы.
5.
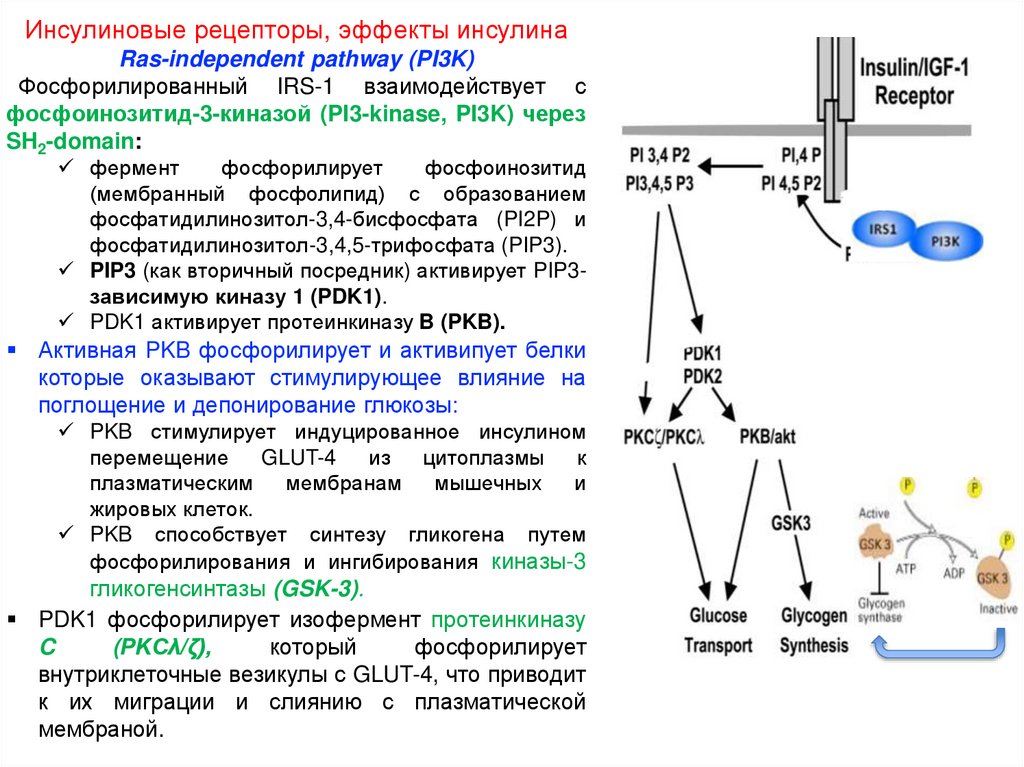
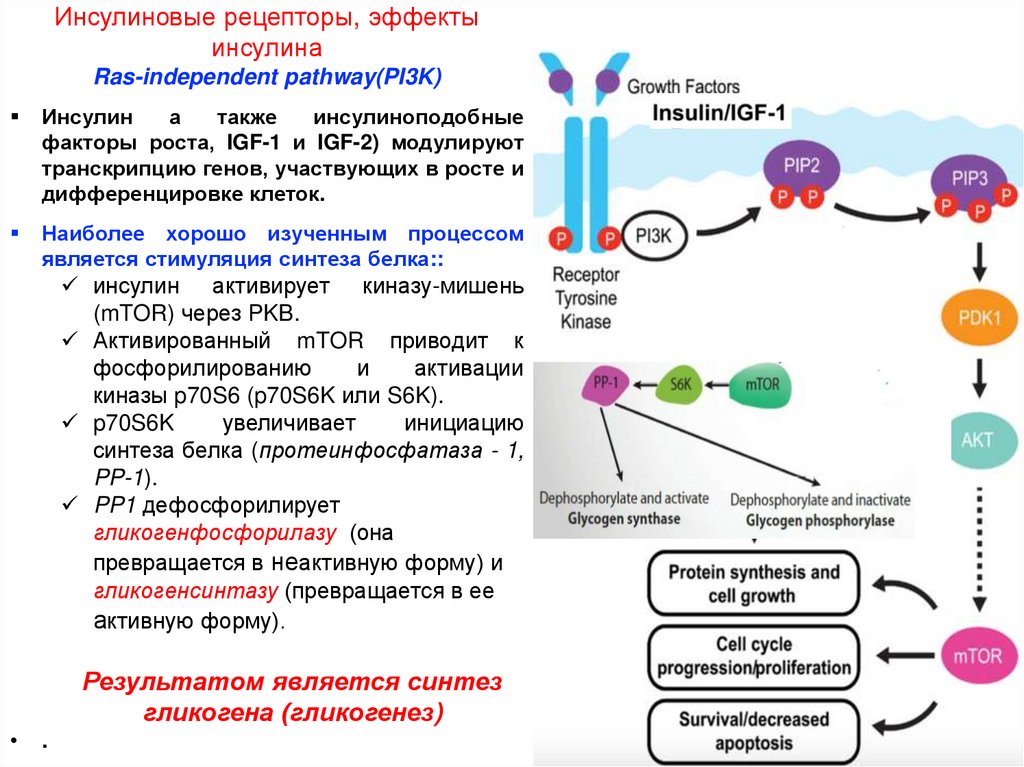
Инсулиновые рецепторы, эффекты инсулинаRas-independent pathway (PI3K)
Фосфорилированный IRS-1 взаимодействует с
фосфоинозитид-3-киназой (PI3-kinase, PI3K) через
SH2-domain:
фермент
фосфорилирует
фосфоинозитид
(мембранный фосфолипид) с образованием
фосфатидилинозитол-3,4-бисфосфата (PI2P) и
фосфатидилинозитол-3,4,5-трифосфата (PIP3).
PIP3 (как вторичный посредник) активирует PIP3зависимую киназу 1 (PDK1).
PDK1 активирует протеинкиназу B (PKB).
Активная PKB фосфорилирует и активипует белки
которые оказывают стимулирующее влияние на
поглощение и депонирование глюкозы:
PKB стимулирует индуцированное инсулином
перемещение
GLUT-4
из
цитоплазмы
к
плазматическим
мембранам
мышечных
и
жировых клеток.
PKB способствует синтезу гликогена путем
фосфорилирования и ингибирования киназы-3
гликогенсинтазы (GSK-3).
PDK1 фосфорилирует изофермент протеинкиназу
C
(PKCλ/ζ),
который
фосфорилирует
внутриклеточные везикулы с GLUT-4, что приводит
к их миграции и слиянию с плазматической
мембраной.
6.
Инсулиновые рецепторы, эффектыинсулина
Ras-independent pathway(PI3K)
Инсулин
а
также
инсулиноподобные
факторы роста, IGF-1 и IGF-2) модулируют
транскрипцию генов, участвующих в росте и
дифференцировке клеток.
Наиболее хорошо изученным процессом
является стимуляция синтеза белка::
инсулин активирует киназу-мишень
(mTOR) через PKB.
Активированный mTOR приводит к
фосфорилированию
и
активации
киназы p70S6 (p70S6K или S6K).
p70S6K
увеличивает
инициацию
синтеза белка (протеинфосфатаза - 1,
PP-1).
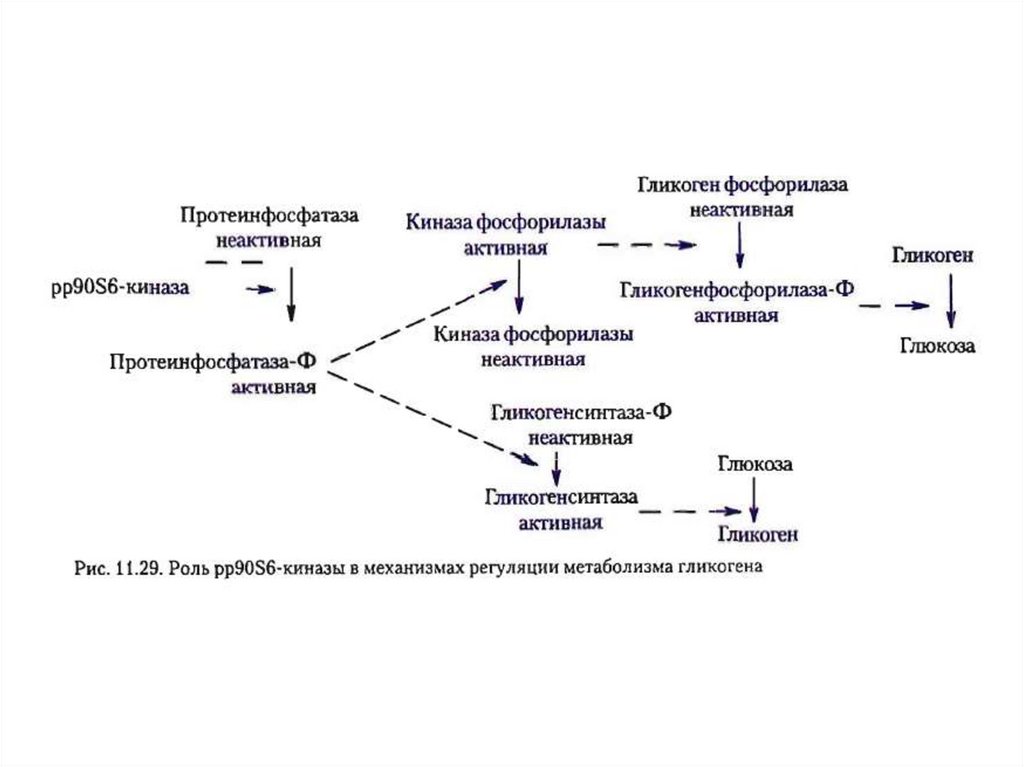
PP1 дефосфорилирует
гликогенфосфорилазу (она
превращается в неактивную форму) и
гликогенсинтазу (превращается в ее
активную форму).
Результатом является синтез
гликогена (гликогенез)
.
7.
8.
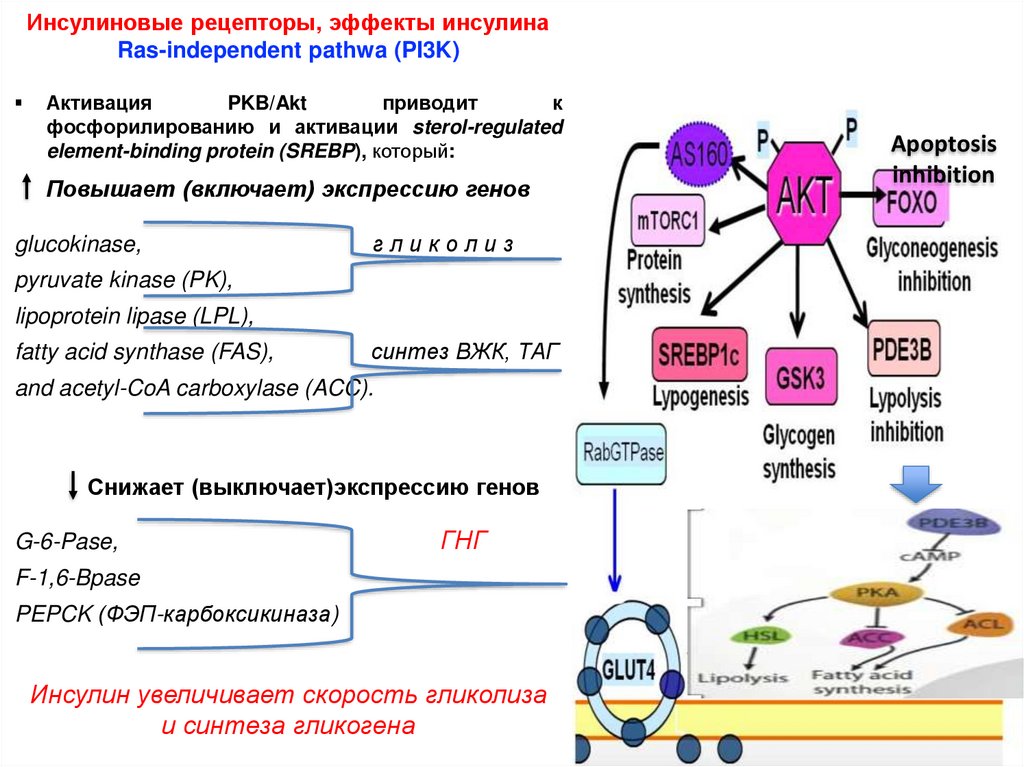
Инсулиновые рецепторы, эффекты инсулинаRas-independent pathwa (PI3K)
Активация
PKB/Akt
приводит
к
фосфорилированию и активации sterol-regulated
element-binding protein (SREBP), который:
Повышает (включает) экспрессию генов
glucokinase,
гликолиз
pyruvate kinase (PK),
lipoprotein lipase (LPL),
fatty acid synthase (FAS),
синтез ВЖК, ТАГ
and acetyl-CoA carboxylase (ACC).
Снижает (выключает)экспрессию генов
G-6-Pase,
ГНГ
F-1,6-Bpase
PEPCK (ФЭП-карбоксикиназа)
Инсулин увеличивает скорость гликолиза
и синтеза гликогена
Apoptosis
inhibition
9.
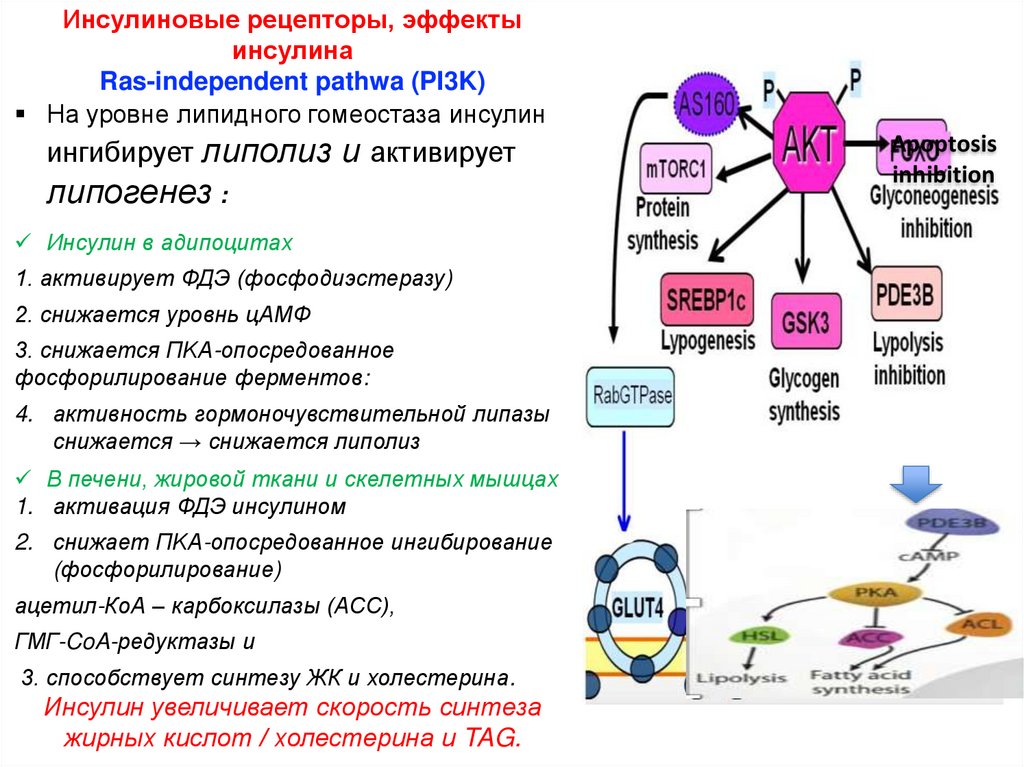
Инсулиновые рецепторы, эффектыинсулина
Ras-independent pathwa (PI3K)
На уровне липидного гомеостаза инсулин
ингибирует липолиз и активирует
липогенез :
Инсулин в адипоцитах
1. активирует ФДЭ (фосфодиэстеразу)
2. снижается уровнь цАМФ
3. снижается ПKA-опосредованное
фосфорилирование ферментов:
4. активность гормоночувствительной липазы
снижается → снижается липолиз
В печени, жировой ткани и скелетных мышцах
1. активация ФДЭ инсулином
2. снижает ПKA-опосредованное ингибирование
(фосфорилирование)
ацетил-КоА – карбоксилазы (ACC),
ГМГ-CoA-редуктазы и
3. способствует синтезу ЖК и холестерина.
Инсулин увеличивает скорость синтеза
жирных кислот / холестерина и TAG.
Apoptosis
inhibition
10.
Insulin receptors, IR and insulin actionRas-зависимый путь (Ras/MAPK pathway):
Фосфорилированный IRS-1 распознается и связывается с рецептор-связывающим
белком фактора роста 2 (GRB-2), инициируя активацию RAS и каскада MAPK
(митоген-активируемый протеинкиназный каскад).
Результатом является фосфорилирование ядерных белков, которые
увеличивают транскрипцию белков (глюкокиназа)
Ras-зависимый
путь (Ras/MAPK
pathway)
Ras-независимый
путь (PI3K pathway)
11.
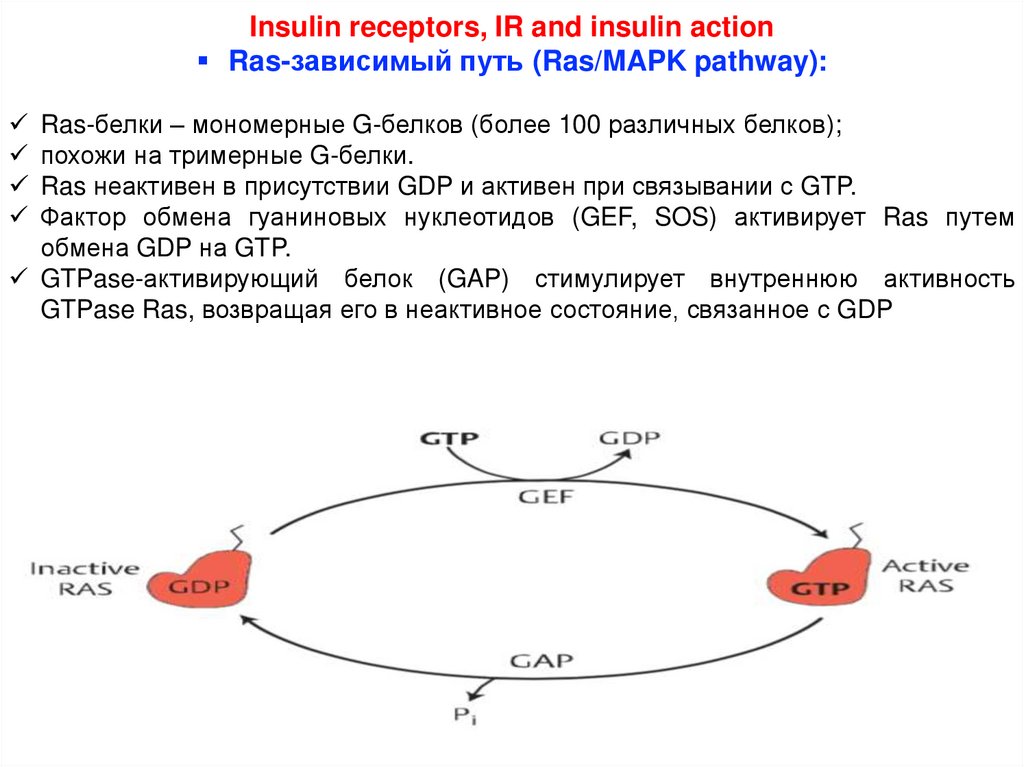
Insulin receptors, IR and insulin actionRas-зависимый путь (Ras/MAPK pathway):
Ras-белки – мономерные G-белков (более 100 различных белков);
похожи на тримерные G-белки.
Ras неактивен в присутствии GDP и активен при связывании с GTP.
Фактор обмена гуаниновых нуклеотидов (GEF, SOS) активирует Ras путем
обмена GDP на GTP.
GTPase-активирующий белок (GAP) стимулирует внутреннюю активность
GTPase Ras, возвращая его в неактивное состояние, связанное с GDP
12.
Insulin receptors, IR and insulin actionRas-зависимый путь (Ras/MAPK pathway):
Чрезмерная передача сигналов от мутированных или
сверхэкспрессированных рецепторов с тирозинкиназной активностью (RTKs)
связана с раком человека.
Мутантные формы Ras или его GEFs и GAPs вызывают широкий спектр
раковых заболеваний человека:
30-50% случаев рака легких и толстой кишки и почти 90% случаев рака
поджелудочной железы связаны с активацией точечных мутаций в Ras.
Мутации уменьшают внутреннюю активность GTPase (мутация GAP) Ras и
блокируют ее в положении «включено» (состояние, связанное с GTP).
Увеличение роста клеток.
Нейрофиброматоз - это рост опухолей из нервной ткани, вызванный
инактивирующей мутацией в гене нейрофибромина (NF-1), который кодирует
белок, активирующий GTPase (GAP) для Ras.
Отсутствие NF-1 позволяет Ras бесконтрольно активировать пути, которые
способствуют росту нервной ткани.
13.
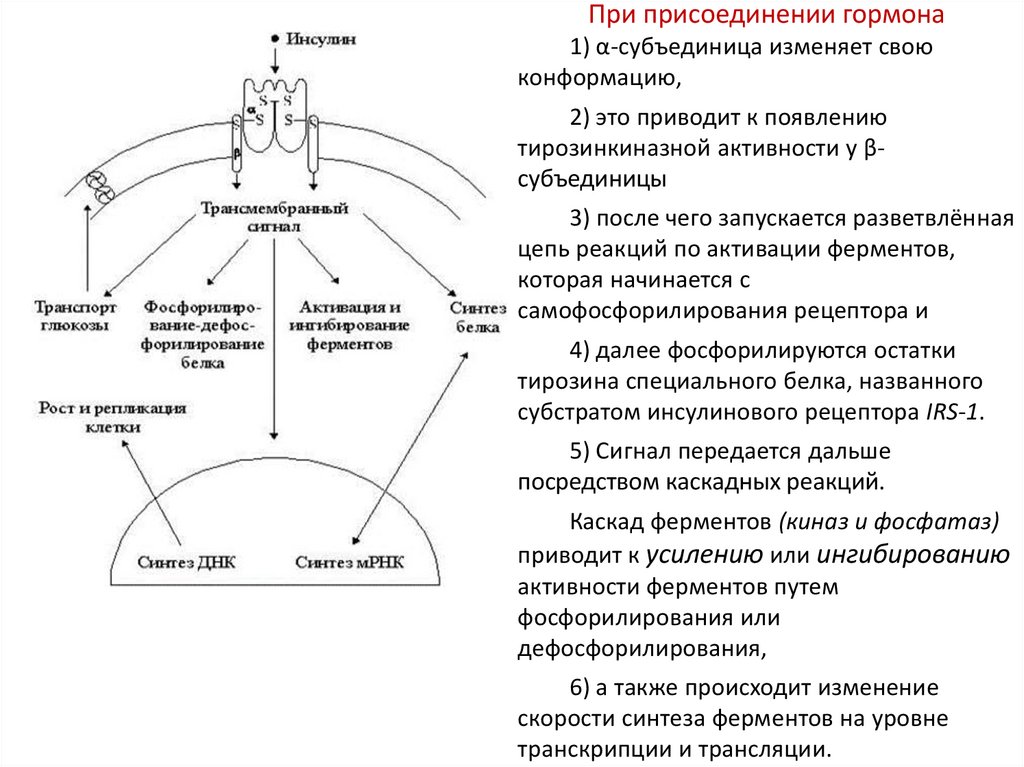
При присоединении гормона1) α-субъединица изменяет свою
конформацию,
2) это приводит к появлению
тирозинкиназной активности у βсубъединицы
3) после чего запускается разветвлённая
цепь реакций по активации ферментов,
которая начинается с
самофосфорилирования рецептора и
4) далее фосфорилируются остатки
тирозина специального белка, названного
субстратом инсулинового рецептора IRS-1.
5) Сигнал передается дальше
посредством каскадных реакций.
Каскад ферментов (киназ и фосфатаз)
приводит к усилению или ингибированию
активности ферментов путем
фосфорилирования или
дефосфорилирования,
6) а также происходит изменение
скорости синтеза ферментов на уровне
транскрипции и трансляции.
14.
Инсулин активирует использование клетками глюкозы путем:Активирования ключевых ферментов гликолиза (глюкокиназы,
фосфофруктокиназы, пируваткиназы);
2. Увеличения включения глюкозы в ПФЦ (активирование глюкозо-6фосфатдегидрогеназы и 6 - фосфоглюконатдегидрогеназы)
3. Повышения синтеза гликогена (активирование гликогенсинтазы и
одновременное ингибирование гликогенфосфорилазы);
4. Торможения активности ключевых ферментов глюконеогенеза
(пируваткарбоксилазы, фосфоенолпируваткарбоксилазы, фруктозо1,6-бисфофатазы и глюкозо - 6 - фосфатазы)
1.
Влияние на обмен липидов и белков:
1.
2.
3.
4.
Активирует биосинтез ТАГ и синтез жирных кислот;
Ингибирует распад жирных кислот в процессе β-окисления и синтез ТАГ;
Снижает биосинтез кетоновых тел.
Усиливает биосинтез белков в клетках.
15. Эффекты инсулина
16. Эффекты инсулина
17.
18.
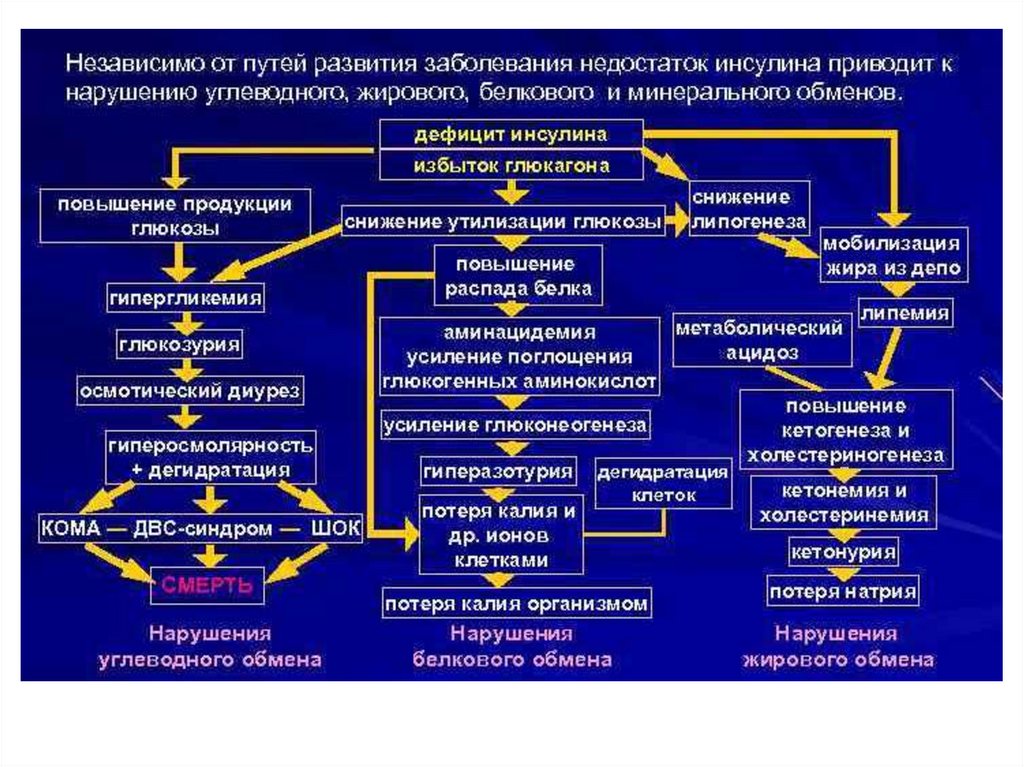
Сахарный диабет развивается при нарушении функции инсулинаВыделяют два типа сахарного диабета:
Тип I – инсулинзависимый (у 10% больных) – вызывается разрушением β-клеток
островков Лангерганса в поджелудочной железе. При введении инсулина уровень
глюкозы в крови снижается;
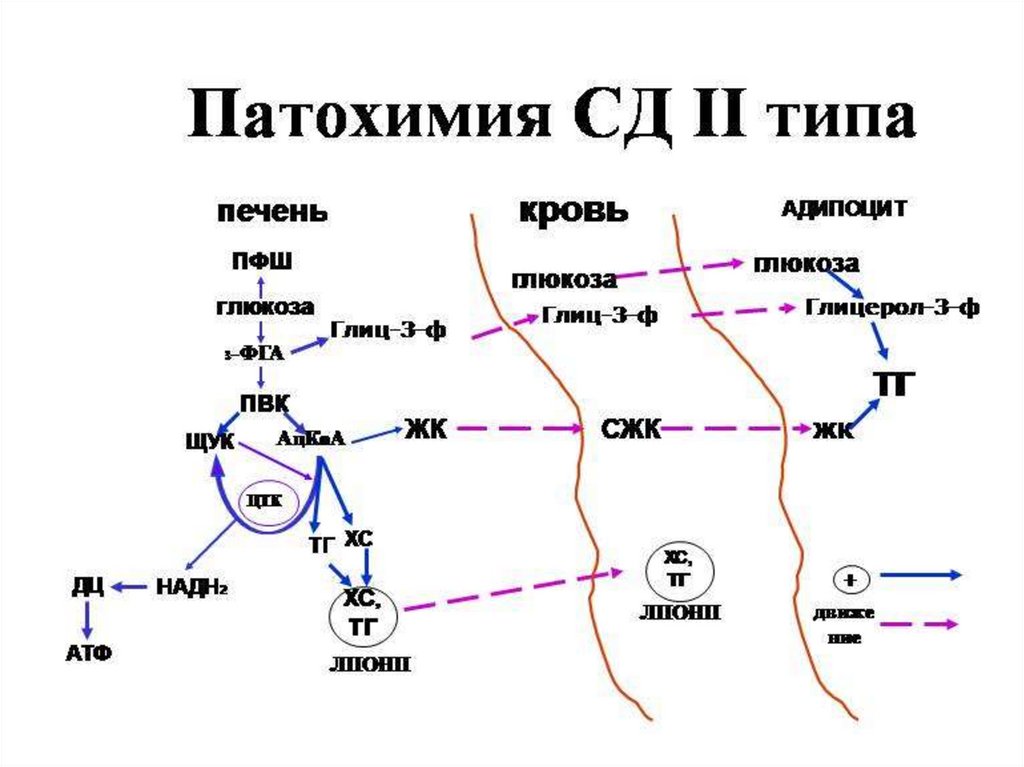
Тип II – инсулиннезависимый (у 90% больных) – развивается вследствие снижения
чувствительности рецепторов к инсулину, повышенной скорости распада
инсулина, нарушения регуляции секреции инсулина. При этом уровень инсулина в
крови в норме. При введении инсулина уровень глюкозы в крови не снижается.
Факторы риска заболевания сахарным диабетом:
генетическая предрасположенность,
ожирение,
гиподинамия,
стресс.
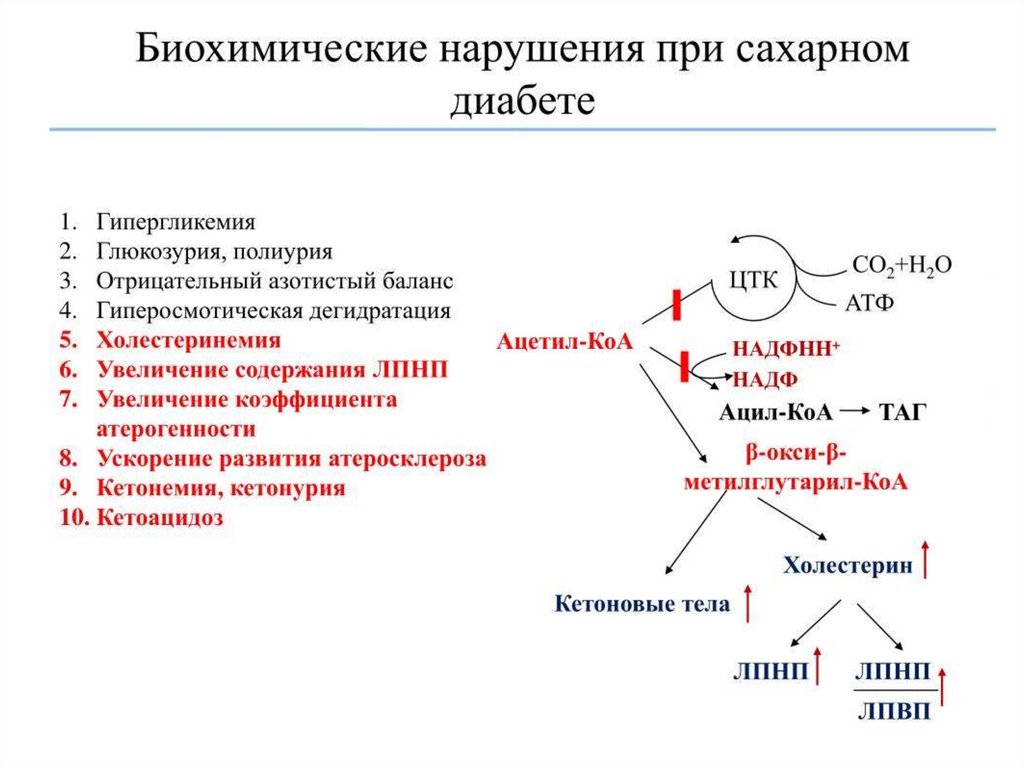
Симптомы сахарного диабета:
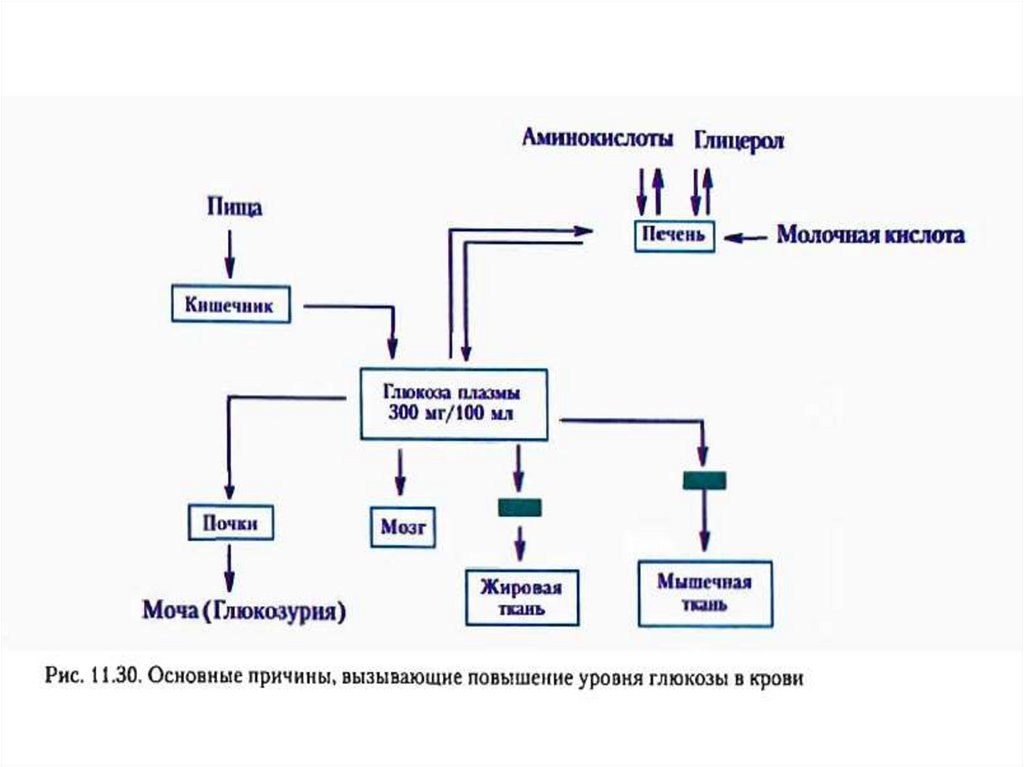
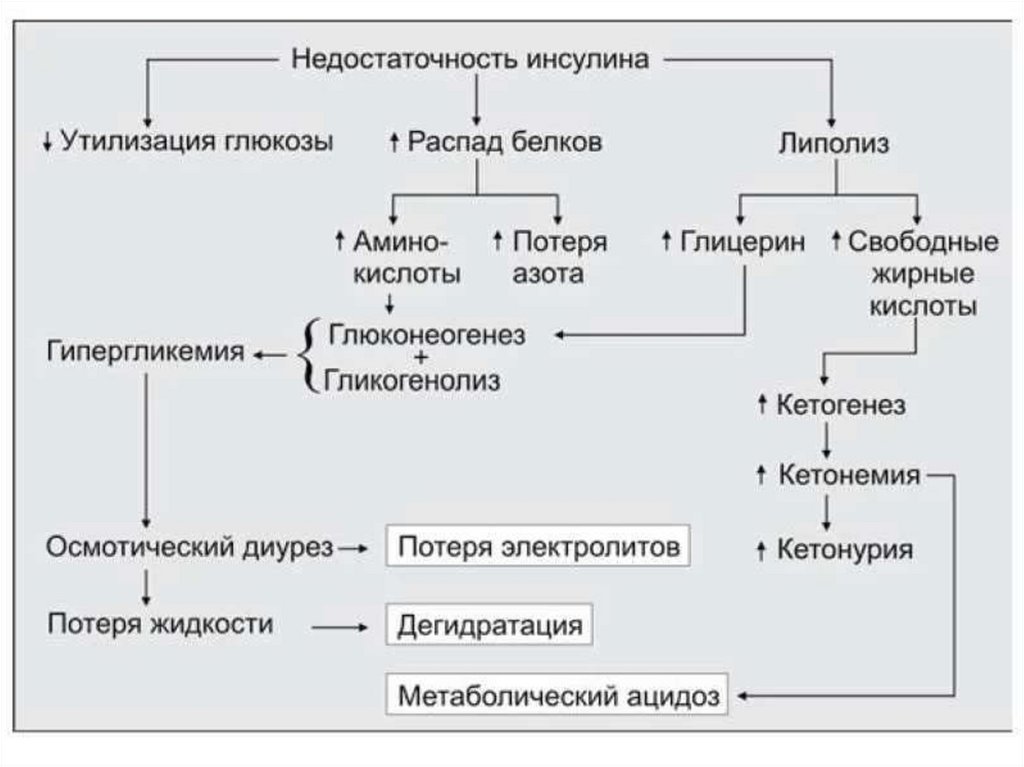
гипергликемия – повышение концентрации глюкозы в крови выше нормы (3,3–6,4
мМ/л);
глюкозурия – выведение глюкозы с мочой при достижении почечного порога (10
мМ глюкозы в крови);
кетонемия – повышение концентрации кетоновых тел в крови;
кетонурия – выведение кетоновых тел с мочой;
полиурия – увеличение суточного диуреза (до 3–4 л/сут).
19.
20.
21.
22.
23.
24.
25.
26.
27.
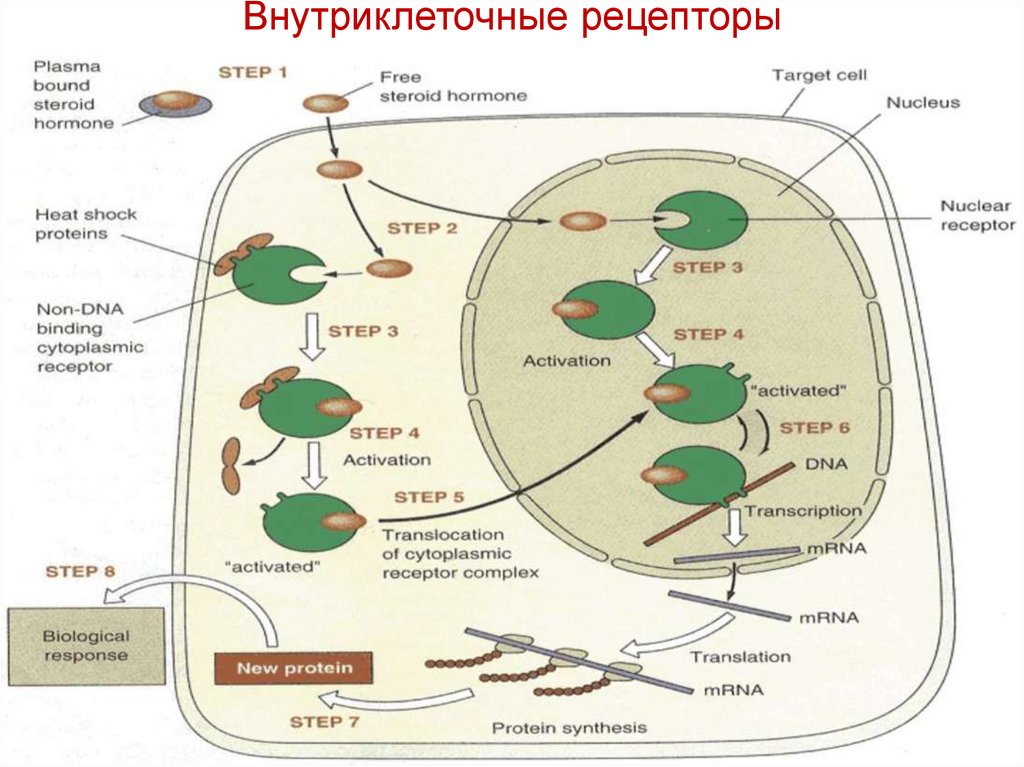
28. Внутриклеточные рецепторы
Гормон / сигнал проникает через мембрану и активирует транскрипцию генов.рецепторы стероидных гормонов (рецепторы глюкокортикоидов (кортизол) - GR,
рецепторы минералокортикоидов (альдостерон) - MR, рецепторы эстрогена, рецепторы
прогестерона, рецепторы ретиноевой кислоты (RAR, RXR)
receptors for Vitamin D
thyroid hormone receptors
Рецепторы I типа (цитоплазматические) представляют собой белки, которые образуют
гомодимеры и специфически связываются с элементами ответа на стероидный гормон
(HRE) только в присутствии их лиганда / гормона (SHR).T
Рецепторы II типа (ядерные) рецепторы включают R гормонов щитовидной железы,
витамина D и рецепторы ретиноевой кислоты
Гормоны транспортируются в крови с помощью специфических связывающих белков:
Они отделяются от транспортного белка, проникают через мембрану и находят свои
рецепторы..
29. Внутриклеточные рецепторы
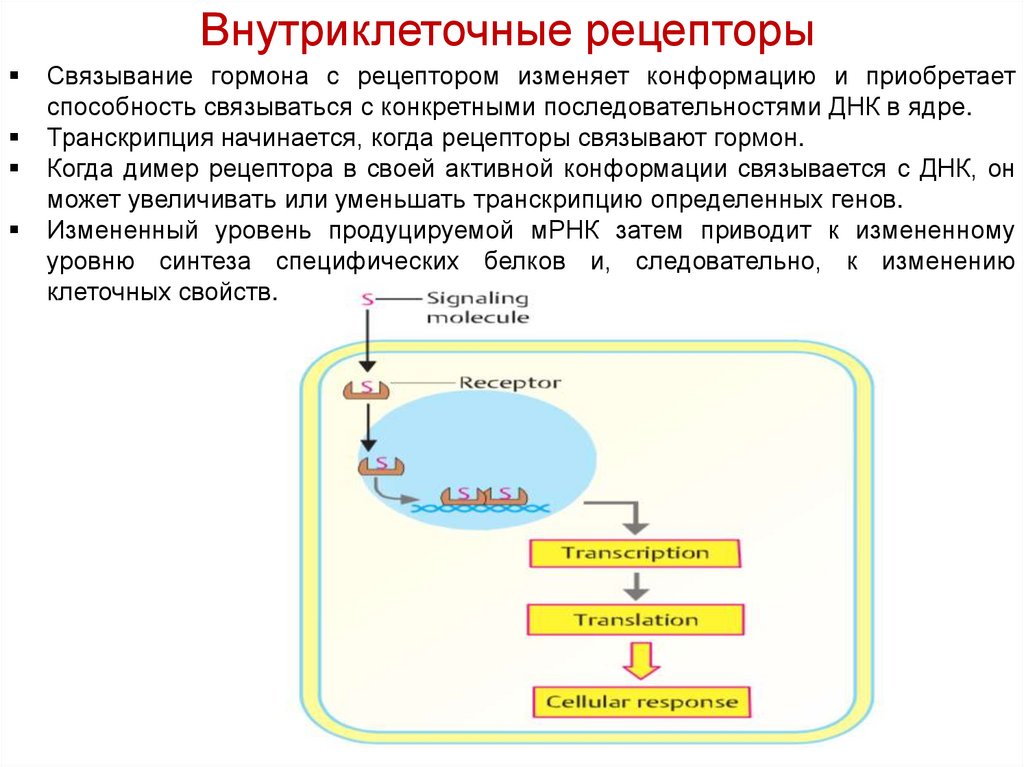
Связывание гормона с рецептором изменяет конформацию и приобретаетспособность связываться с конкретными последовательностями ДНК в ядре.
Транскрипция начинается, когда рецепторы связывают гормон.
Когда димер рецептора в своей активной конформации связывается с ДНК, он
может увеличивать или уменьшать транскрипцию определенных генов.
Измененный уровень продуцируемой мРНК затем приводит к измененному
уровню синтеза специфических белков и, следовательно, к изменению
клеточных свойств.
30.
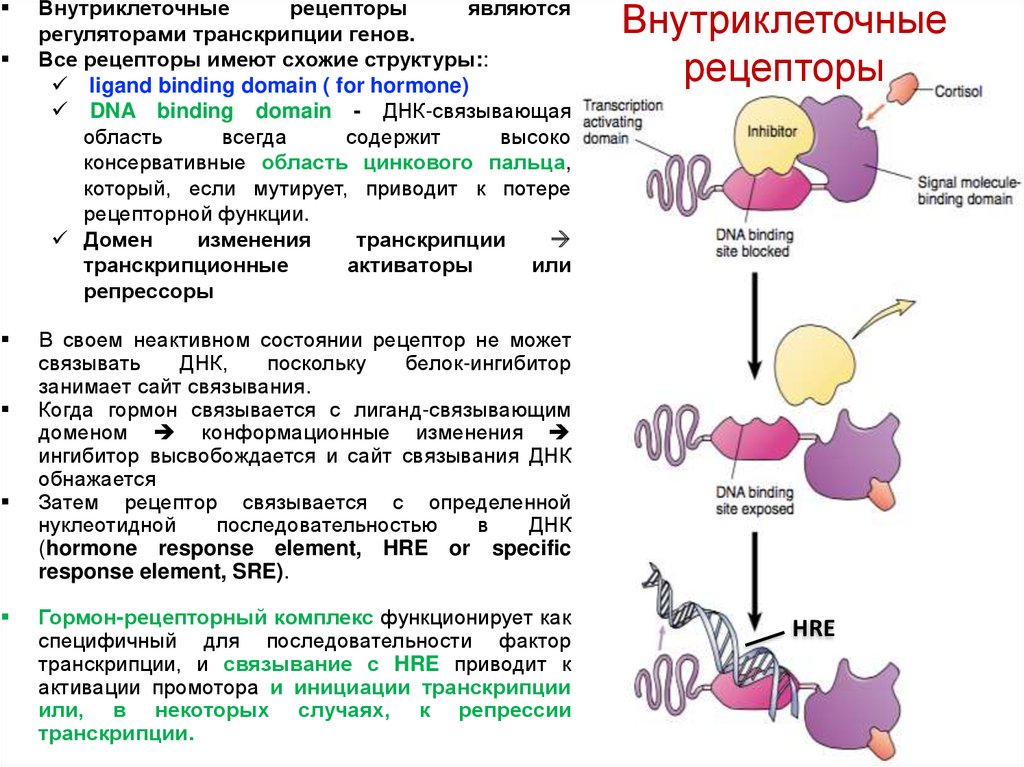
Внутриклеточныерецепторы
являются
регуляторами транскрипции генов.
Все рецепторы имеют схожие структуры::
ligand binding domain ( for hormone)
DNA binding domain - ДНК-связывающая
область
всегда
содержит
высоко
консервативные область цинкового пальца,
который, если мутирует, приводит к потере
рецепторной функции.
Домен
изменения
транскрипции
транскрипционные
активаторы
или
репрессоры
Внутриклеточные
рецепторы
В своем неактивном состоянии рецептор не может
связывать
ДНК,
поскольку
белок-ингибитор
занимает сайт связывания.
Когда гормон связывается с лиганд-связывающим
доменом конформационные изменения
ингибитор высвобождается и сайт связывания ДНК
обнажается
Затем рецептор связывается с определенной
нуклеотидной
последовательностью
в
ДНК
(hormone response element, HRE or specific
response element, SRE).
Гормон-рецепторный комплекс функционирует как
специфичный для последовательности фактор
транскрипции, и связывание с HRE приводит к
активации промотора и инициации транскрипции
или, в некоторых случаях, к репрессии
транскрипции.
HRE
31. Кортикостероиды
32.
33.
34. Глюкокортикоиды
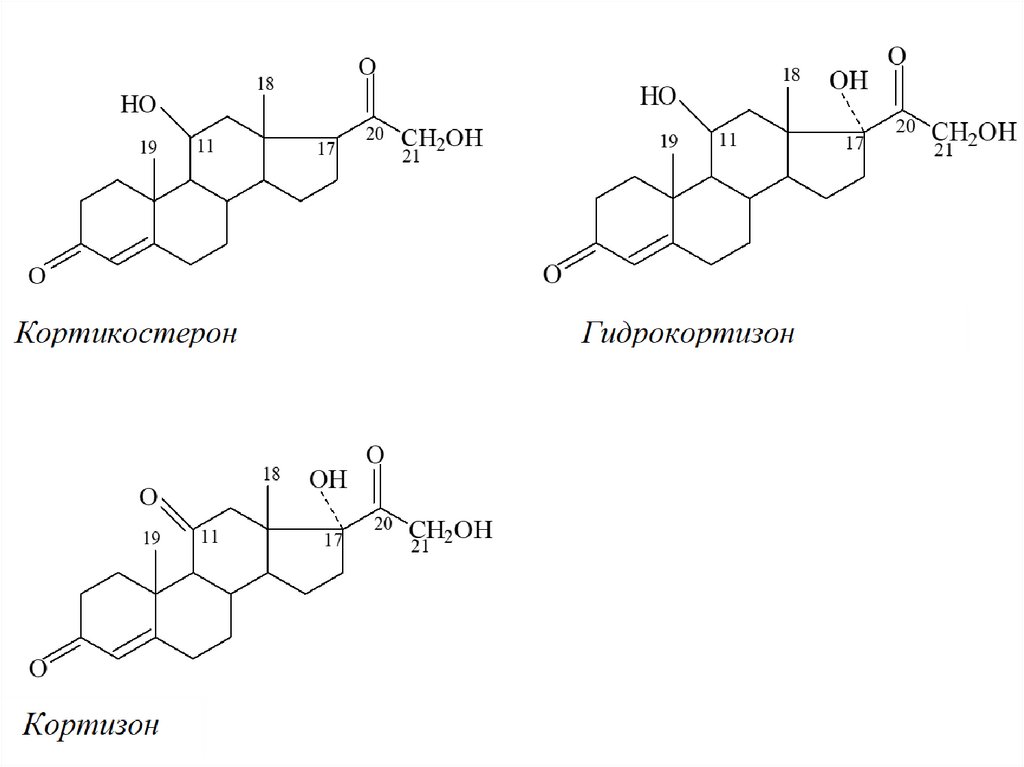
• Надпочечники человека скретируют глюкокортикоиды:кортизол (гидрокортизон), кортизон и кортикостерон.
• Ткани-мишени: печень, почки, лимфоидная, соединительная и
жировая ткани, мышцы.
• Секреция глюкокортикоидов находится под контролем АКТГ.
Скорость синтеза и секреции гормонов стимулируются в ответ
на стресс, травму, инфекцию, понижение уровня глюкозы в
крови.
• Биологическое действие
• Влияние глюкокортикоидов на метаболизм связано с их
способностью координированно воздействовать на разные
ткани и разные процессы как анаболические (в печени), так и
катаболические (в других тканях-мишенях).
35.
• Влияние на углеводный обмен:• 1. в печени стимулируют синтез гликогена и глюконеогенез (синтез
глюкозы из аминокислот);
• 2. в почках стимулируют глюконеогенез;
• 3. в периферических тканях тормозят потребление глюкозы и гликолиз.
• Влияние на обмен липидов:
• 1. активируют синтез триацилглицеролов в печени;
• 2. стимулируют распад жира на конечностях и отложение жира в
других частях тела (лицо, туловище). При избытке глюкокортикоидов
развивается «паукообразное» ожирение;
• 3. образующийся при распаде жира глицерол используется в
глюконеогенезе, а жирные кислоты – для синтеза кетоновых тел.
• Влияние на обмен белков и нуклеиновых кислот:
• 1. в печени глюкокортикоиды стимулируют синтез белков и
нуклеиновых кислот;
• 2. в мышцах, лимфоидной и жировой ткани, коже и костях тормозят
синтез белков, РНК и ДНК, стимулируют распад РНК и белков.
36. Глюкокортикоиды
кортизон37.
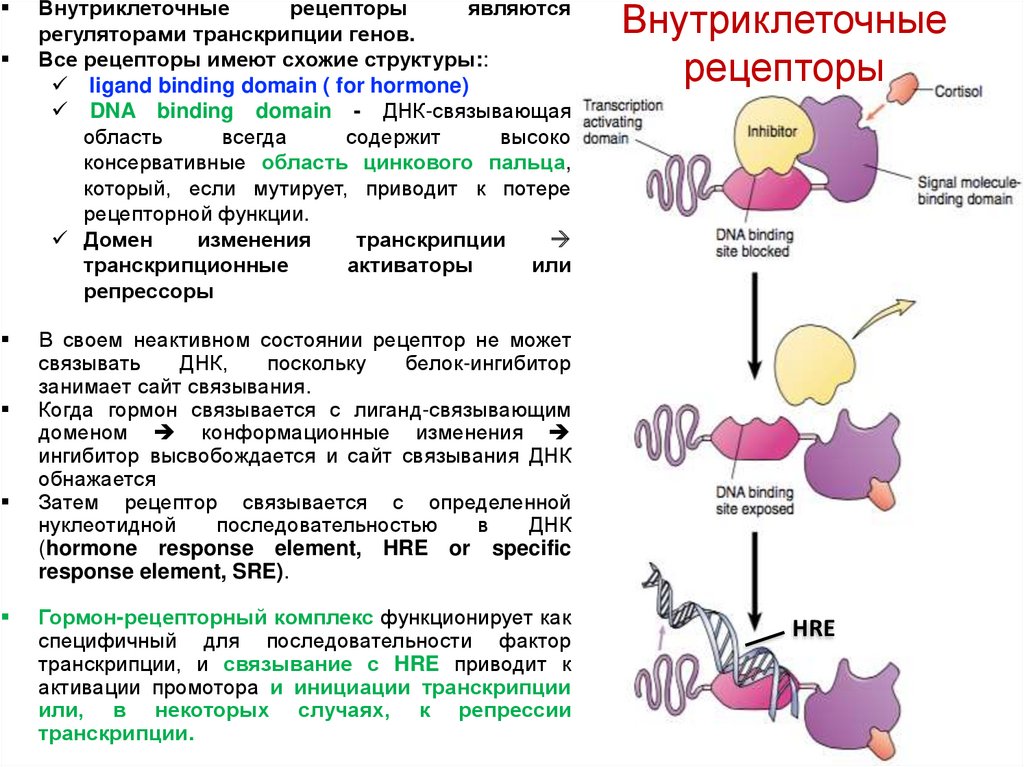
Внутриклеточныерецепторы
являются
регуляторами транскрипции генов.
Все рецепторы имеют схожие структуры::
ligand binding domain ( for hormone)
DNA binding domain - ДНК-связывающая
область
всегда
содержит
высоко
консервативные область цинкового пальца,
который, если мутирует, приводит к потере
рецепторной функции.
Домен
изменения
транскрипции
транскрипционные
активаторы
или
репрессоры
Внутриклеточные
рецепторы
В своем неактивном состоянии рецептор не может
связывать
ДНК,
поскольку
белок-ингибитор
занимает сайт связывания.
Когда гормон связывается с лиганд-связывающим
доменом конформационные изменения
ингибитор высвобождается и сайт связывания ДНК
обнажается
Затем рецептор связывается с определенной
нуклеотидной
последовательностью
в
ДНК
(hormone response element, HRE or specific
response element, SRE).
Гормон-рецепторный комплекс функционирует как
специфичный для последовательности фактор
транскрипции, и связывание с HRE приводит к
активации промотора и инициации транскрипции
или, в некоторых случаях, к репрессии
транскрипции.
HRE
38.
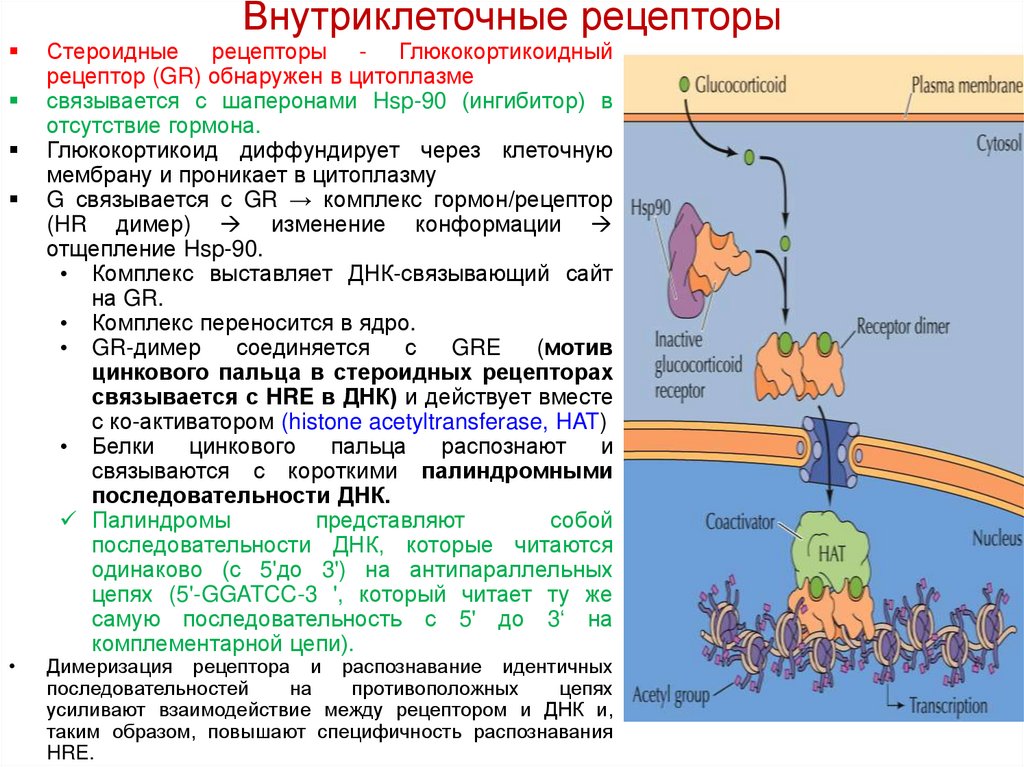
Внутриклеточные рецепторыСтероидные рецепторы - Глюкокортикоидный
рецептор (GR) обнаружен в цитоплазме
связывается с шаперонами Hsp-90 (ингибитор) в
отсутствие гормона.
Глюкокортикоид диффундирует через клеточную
мембрану и проникает в цитоплазму
G связывается с GR → комплекс гормон/рецептор
(HR димер) изменение конформации
отщепление Hsp-90.
• Комплекс выставляет ДНК-связывающий сайт
на GR.
• Комплекс переносится в ядро.
• GR-димер
соединяется
с
GRE
(мотив
цинкового пальца в стероидных рецепторах
связывается с HRE в ДНК) и действует вместе
с ко-активатором (histone acetyltransferase, HAT)
• Белки
цинкового
пальца
распознают
и
связываются с короткими палиндромными
последовательности ДНК.
Палиндромы
представляют
собой
последовательности ДНК, которые читаются
одинаково (с 5'до 3') на антипараллельных
цепях (5'-GGATCC-3 ', который читает ту же
самую последовательность с 5' до 3‘ на
комплементарной цепи).
Димеризация рецептора и распознавание идентичных
последовательностей
на
противоположных
цепях
усиливают взаимодействие между рецептором и ДНК и,
таким образом, повышают специфичность распознавания
HRE.
39.
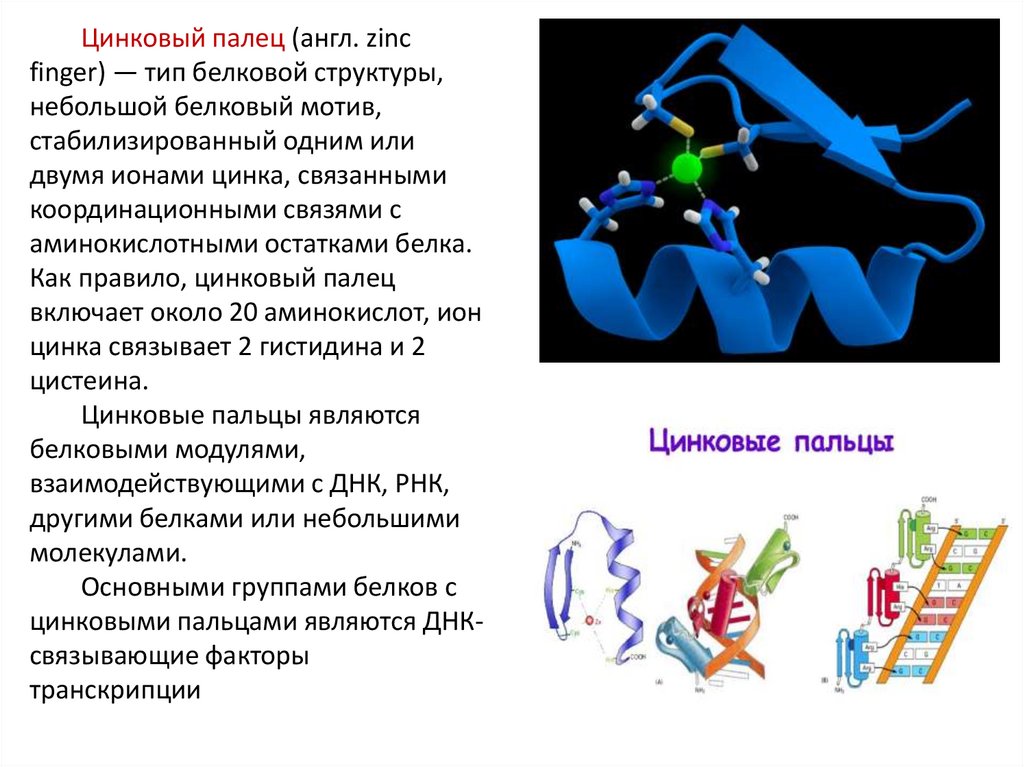
Цинковый палец (англ. zincfinger) — тип белковой структуры,
небольшой белковый мотив,
стабилизированный одним или
двумя ионами цинка, связанными
координационными связями с
аминокислотными остатками белка.
Как правило, цинковый палец
включает около 20 аминокислот, ион
цинка связывает 2 гистидина и 2
цистеина.
Цинковые пальцы являются
белковыми модулями,
взаимодействующими с ДНК, РНК,
другими белками или небольшими
молекулами.
Основными группами белков с
цинковыми пальцами являются ДНКсвязывающие факторы
транскрипции
40.
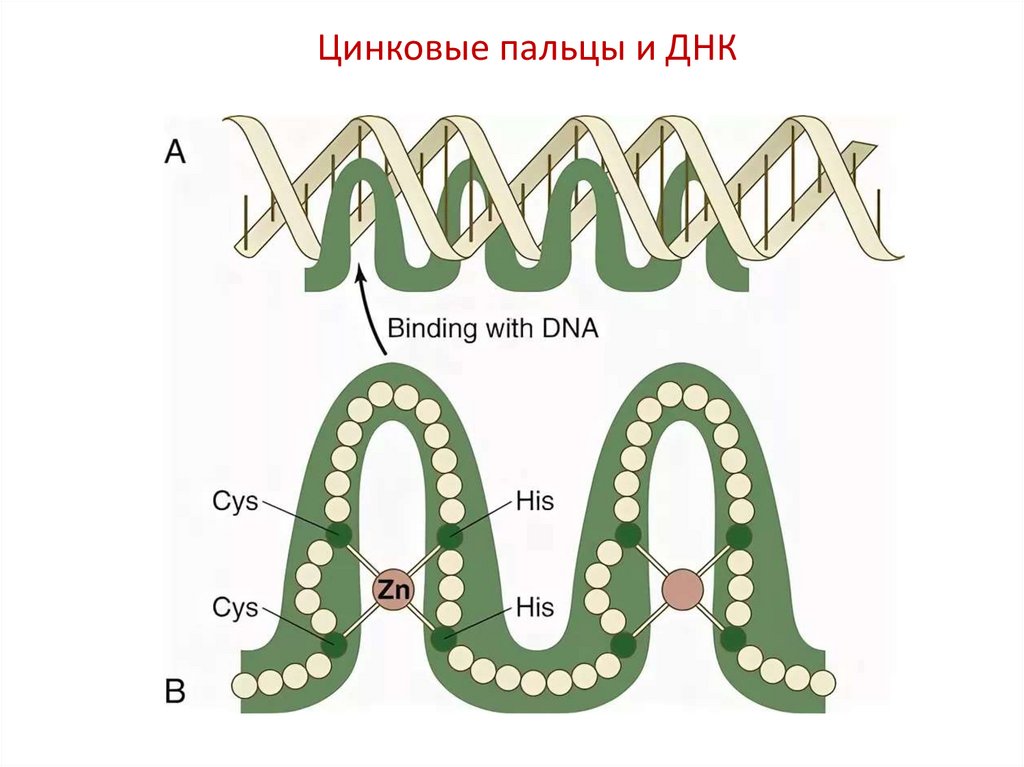
Цинковые пальцы и ДНК41.
Внутриклеточные рецепторы42.
Органы-мишени:Печень
АНАБОЛИЧЕСКОЕ ДЕЙСТВИЕ
Мышцы
Кожа
КАТАБОЛИЧЕСКОЕ
Жировая ткань
ДЕЙСТВИЕ
Лимфатическая ткань,
Соединительная ткань
Данные гормоны оказывают разностороннее действие:
в печени – анаболическое,
в других тканях – катаболическое.
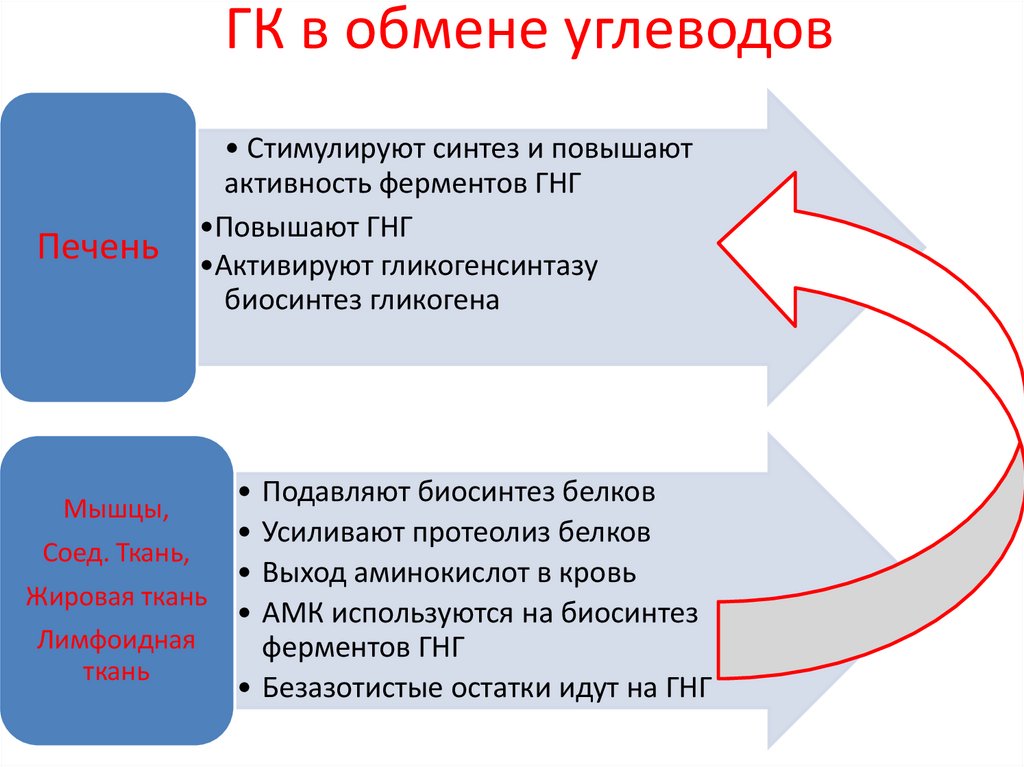
43. ГК в обмене углеводов
Печень• Стимулируют синтез и повышают
активность ферментов ГНГ
•Повышают ГНГ
•Активируют гликогенсинтазу
биосинтез гликогена
Соед. Ткань,
Жировая ткань
Мышцы,
Лимфоидная
ткань
Подавляют биосинтез белков
Усиливают протеолиз белков
Выход аминокислот в кровь
АМК используются на биосинтез
ферментов ГНГ
• Безазотистые остатки идут на ГНГ
44. Результативные эффекты
1. Уровень глюкозы повышен2. Синтез белков снижен
3. Снижение биосинтеза γ-глобулинов приводит к
снижению иммунитета в организме человека
4. В соединительной и костной тканях ГК тормозят
биосинтез коллагена и фибронектина, что является причиной
сморщивания кожи и одной из причин усиления резорбции
кости – остеопороза
5.Кортикостероиды обладают противовоспалительным
действием
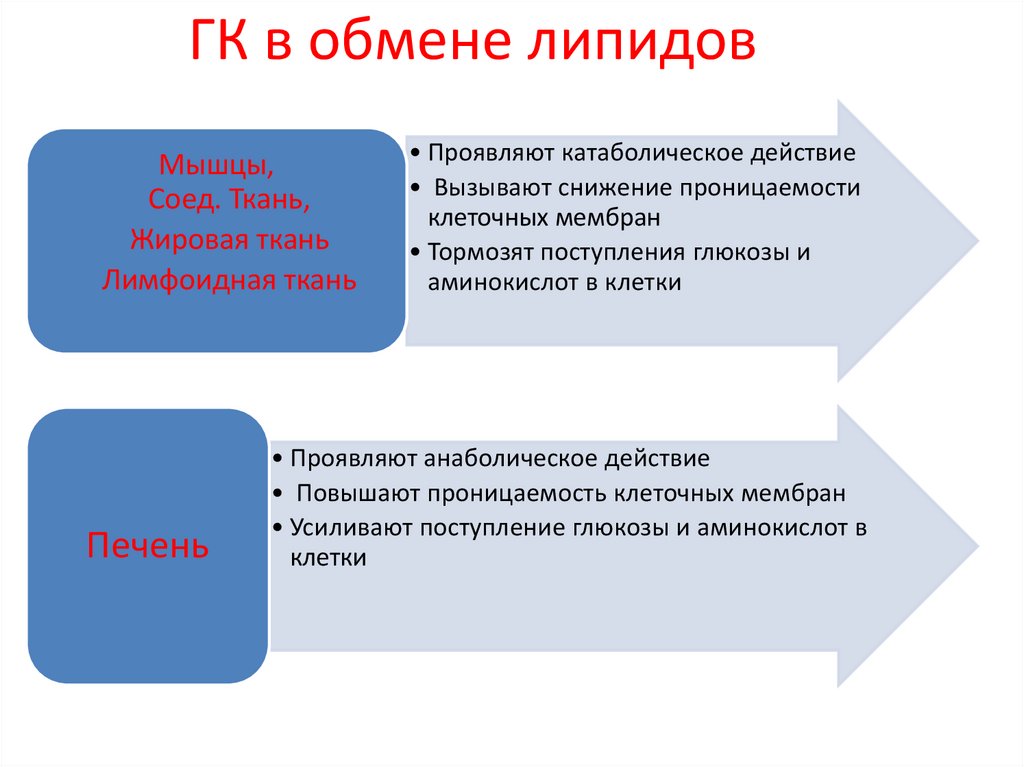
45. ГК в обмене липидов
Мышцы,Соед. Ткань,
Жировая ткань
Лимфоидная ткань
Печень
• Проявляют катаболическое действие
• Вызывают снижение проницаемости
клеточных мембран
• Тормозят поступления глюкозы и
аминокислот в клетки
• Проявляют анаболическое действие
• Повышают проницаемость клеточных мембран
• Усиливают поступление глюкозы и аминокислот в
клетки
46. Результативные эффекты
1.Биосинтез ТАГ в жировых депо снижен
2. Концентрация жирных кислот в крови увеличивается
3. Увеличивается окисление жирных кислот
4. Увеличивается синтез кетоновых тел в печени и выход их в
кровь
5. В конечностях человека активируется липолиз
6. В верхней части туловища и на лице активируется липогенез
7. Уровень глюкозы повышен
8. Синтез белков снижен
9. Снижение биосинтеза γ-глобулинов приводит к снижению
иммунитета в организме человека.
10.Кортикостероиды обладают противовоспалительным
действием
47.
При высокой концентрации глюкокортикоиды оказываютследующие эффекты:
1.В лимфоидной ткани подавляют иммунные реакции,
вызывая гибель лимфоцитов и инволюцию лимфоидной ткани;
2. Уменьшают состояние сенсибилизации (повышенной
чувствительности) к чужеродным веществам, препятствуют
развитию последующих аллергических реакций;
3. Подавляют воспалительную реакцию, уменьшая число
лейкоцитов и снижая синтез медиаторов воспаления
(простагландинов и лейкотриенов);
4. Вызывают торможение роста и деления фибробластов,
синтеза коллагена в соединительной ткани.
Глюкокортикоиды участвуют в физиологическом ответе на стресс,
связанный с травмой, инфекцией или хирургическим вмешательством. В
этом ответе в первую очередь участвуют катехоламины, и для
проявления их максимальной активности необходимо участие
глюкокортикоидов.
48. Гиперкортицизм
Поражениегипофиза
Опухоль
надпочечников или
Длительный прием
ГК
49. Гиперкортицизм
• Встречается гиперкортицизм,сопровождающейся избыточной секрецией
преимущественно минералкортикоидов
(альдостерона) –гиперальдостеронизм, или
болезнь Конна.
• При этом заболевании наблюдаются
симптомы нарушения водно-солевого
обмена: отеки, повышение артериального
давления, повышенная возбудимость
миокарда.
50.
Гипокортицизм51.
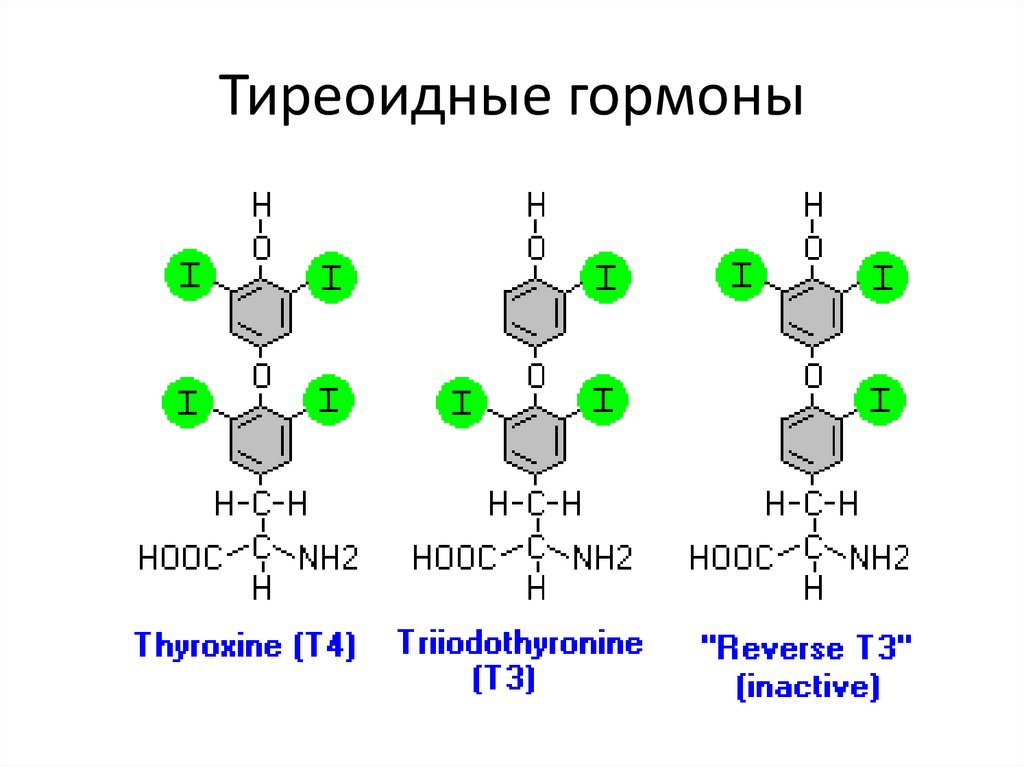
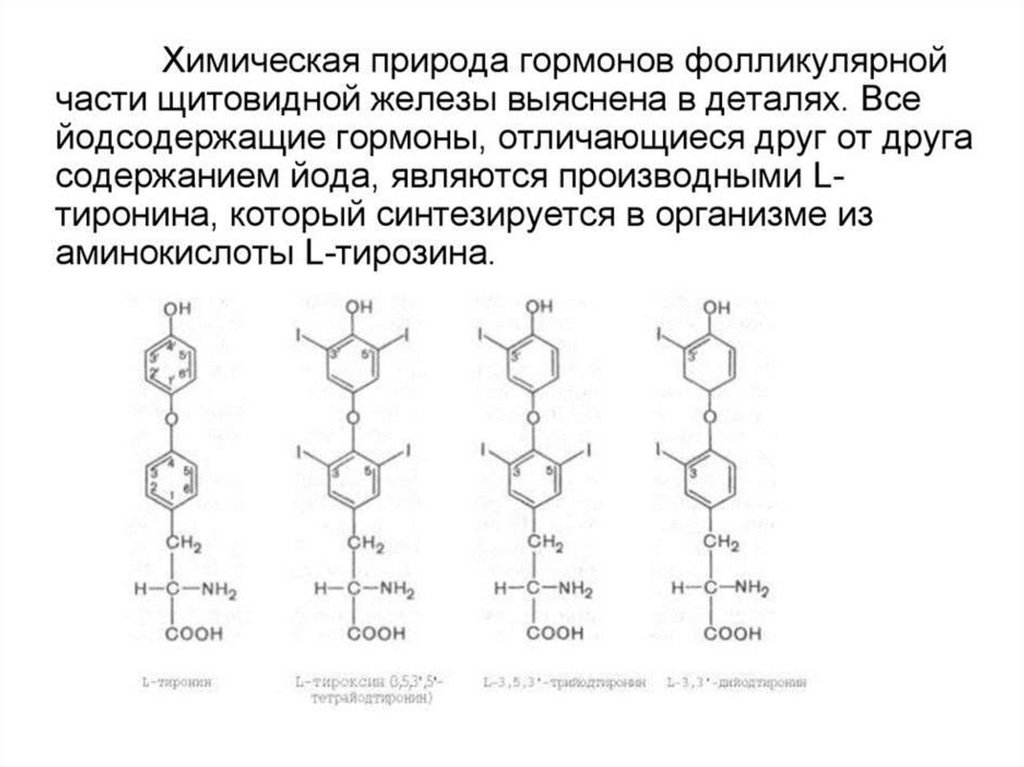
52. Тиреоидные гормоны
53.
54.
55.
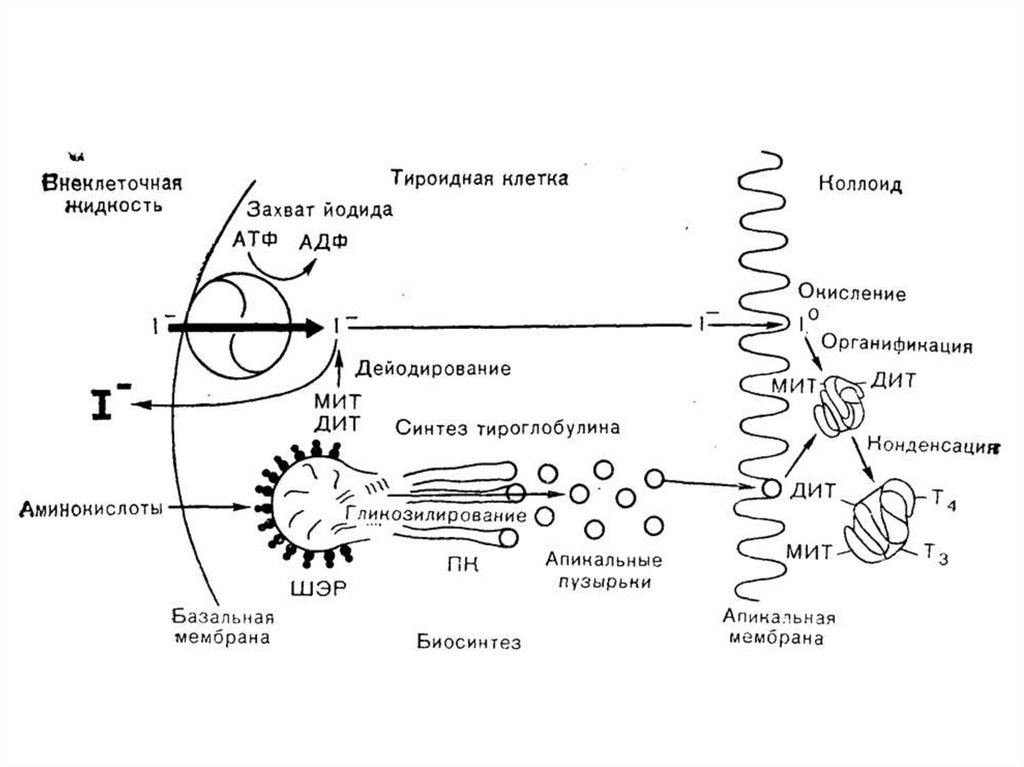
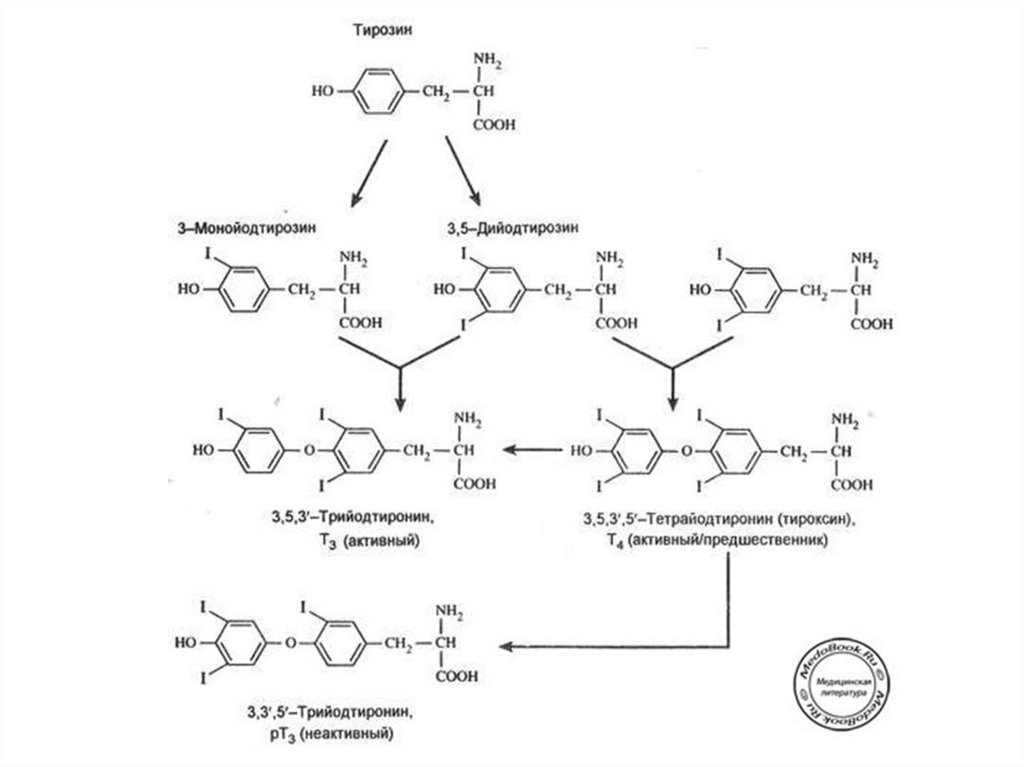
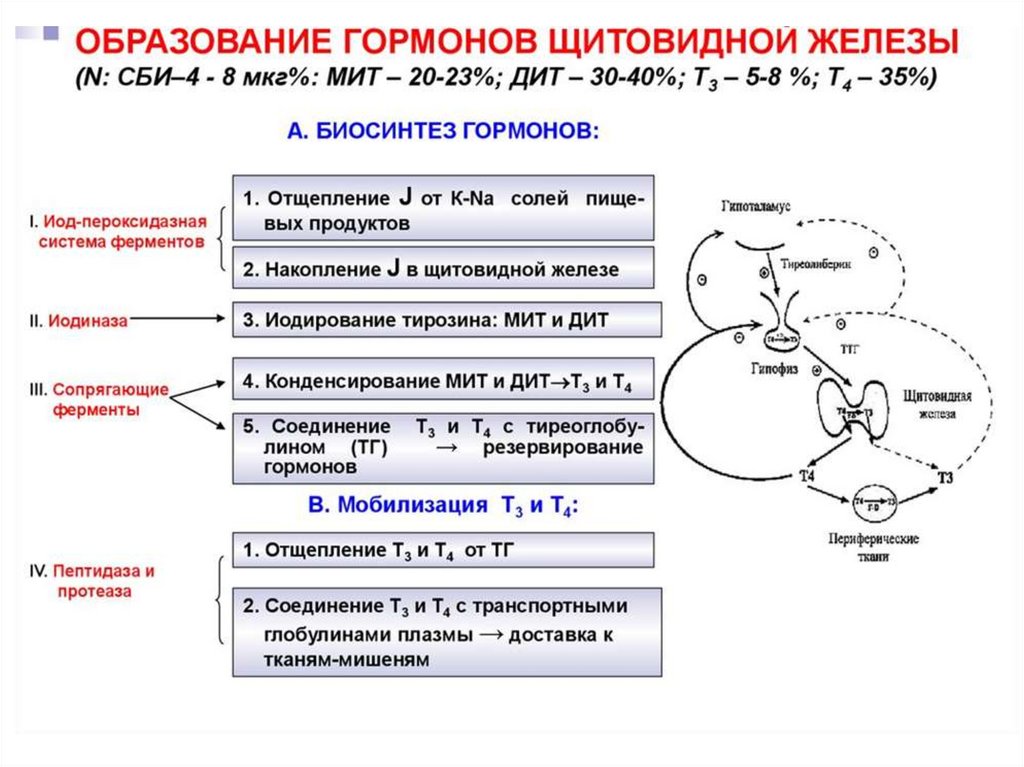
56. Этапы биосинтеза тиреоидных гормонов
I. Поступение «йода» (иодид-ионы) из крови в ЩЖII. Окисление иодид-ионов под действием
пероскидазной системы (активирование
йода)
III. Йодироваие тиреоглобулина (ТГ) – органификация
йода
IV. Стадия конденсации ДИТ и ДИТ или ДИТ и МИТ
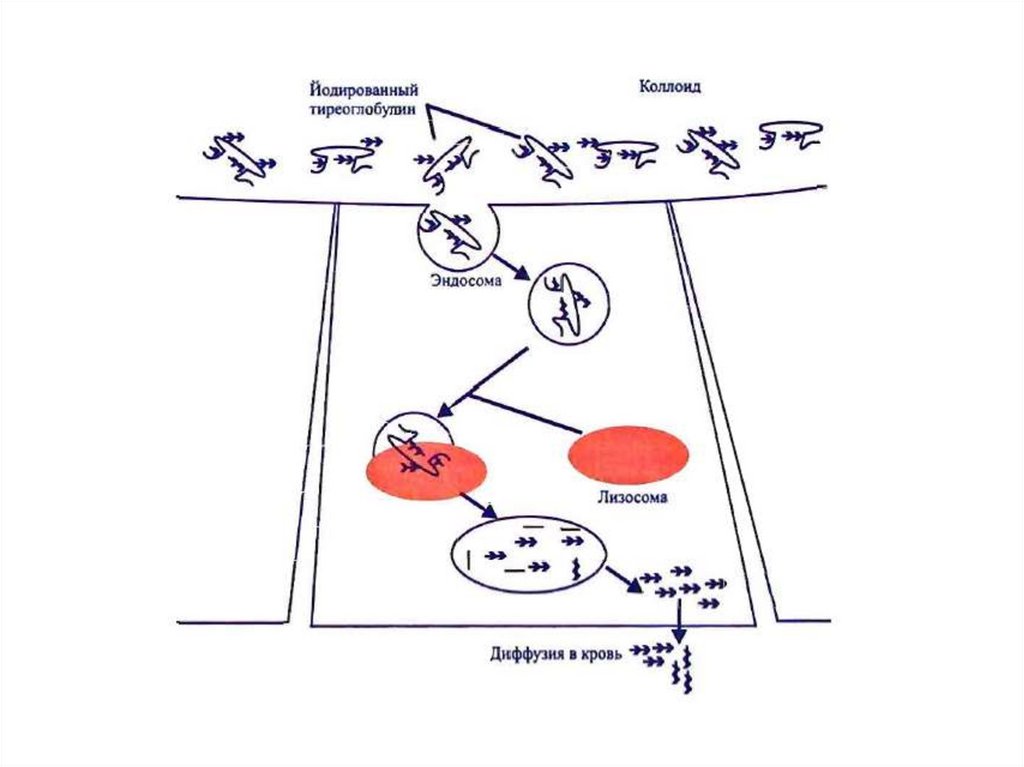
V. Стадия поступления коллоида в фолликулярные
клетки и высвобождение Т3 и Т4 из ТГ (протеолиз ТГ).
VI. Секреция гормонов в кровь
57.
58.
59.
60.
61.
62. Траспорт тиреоидных гормонов: ТСГ- тиреоид связывающий глобулин ТСПА - тиреосвязывающий преальбумин
63.
64.
65.
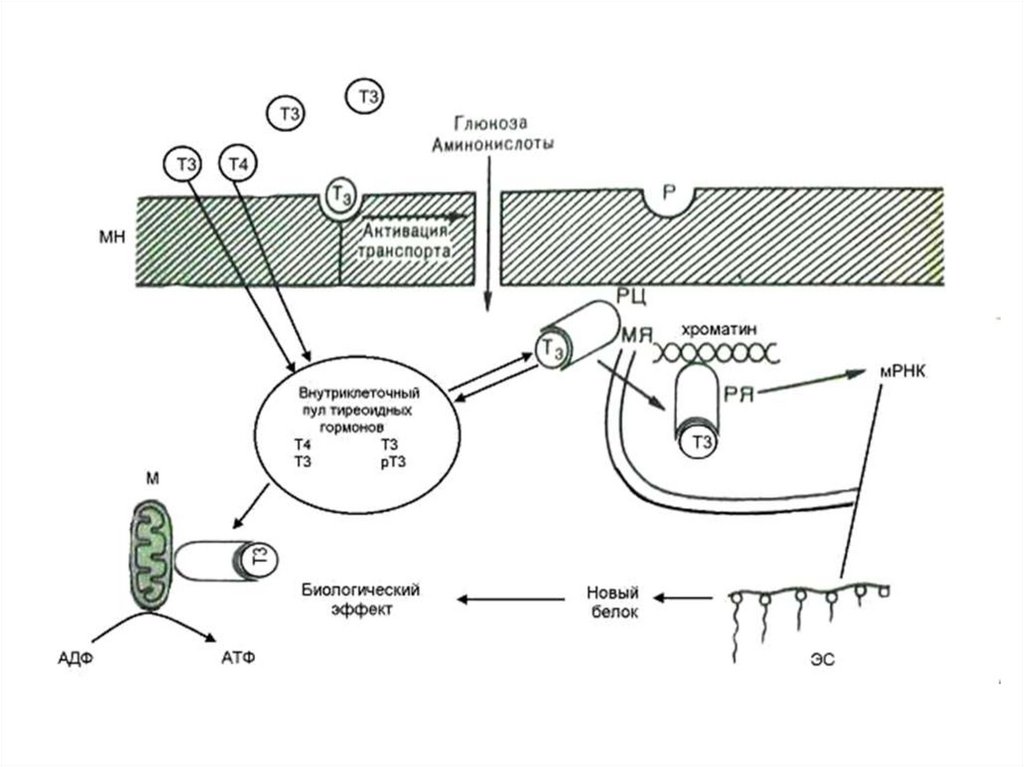
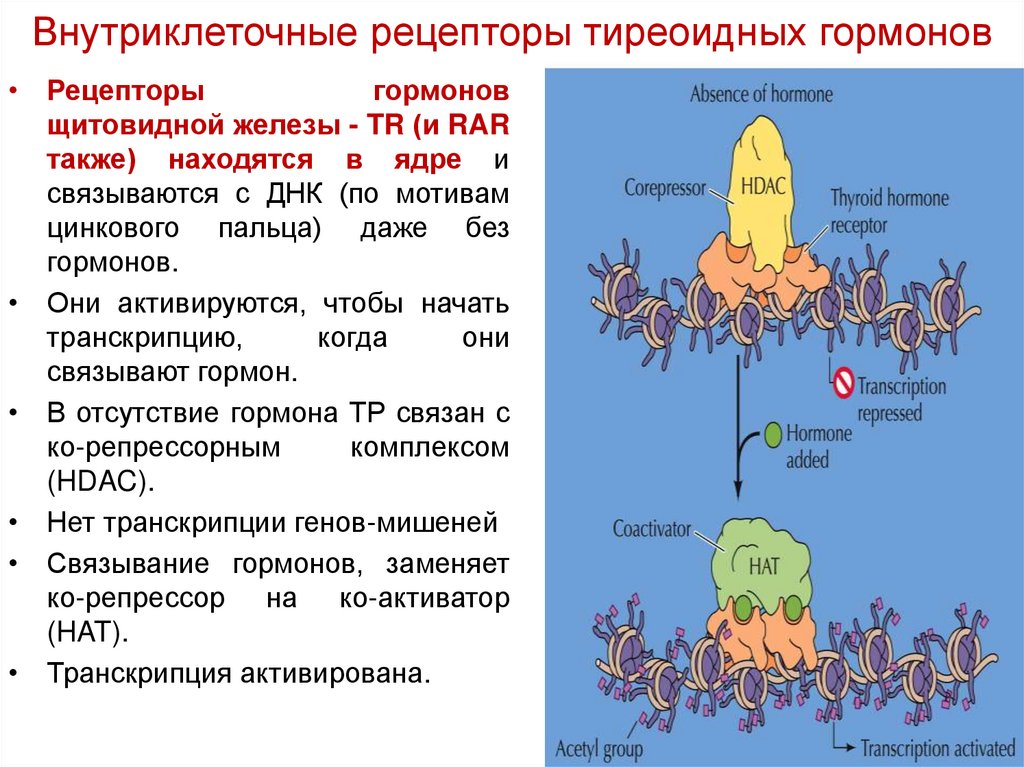
Внутриклеточные рецепторы тиреоидных гормонов• Рецепторы
гормонов
щитовидной железы - TR (и RAR
также) находятся в ядре и
связываются с ДНК (по мотивам
цинкового пальца) даже без
гормонов.
• Они активируются, чтобы начать
транскрипцию,
когда
они
связывают гормон.
• В отсутствие гормона ТР связан с
ко-репрессорным
комплексом
(HDAC).
• Нет транскрипции генов-мишеней
• Связывание гормонов, заменяет
ко-репрессор на ко-активатор
(HAT).
• Транскрипция активирована.
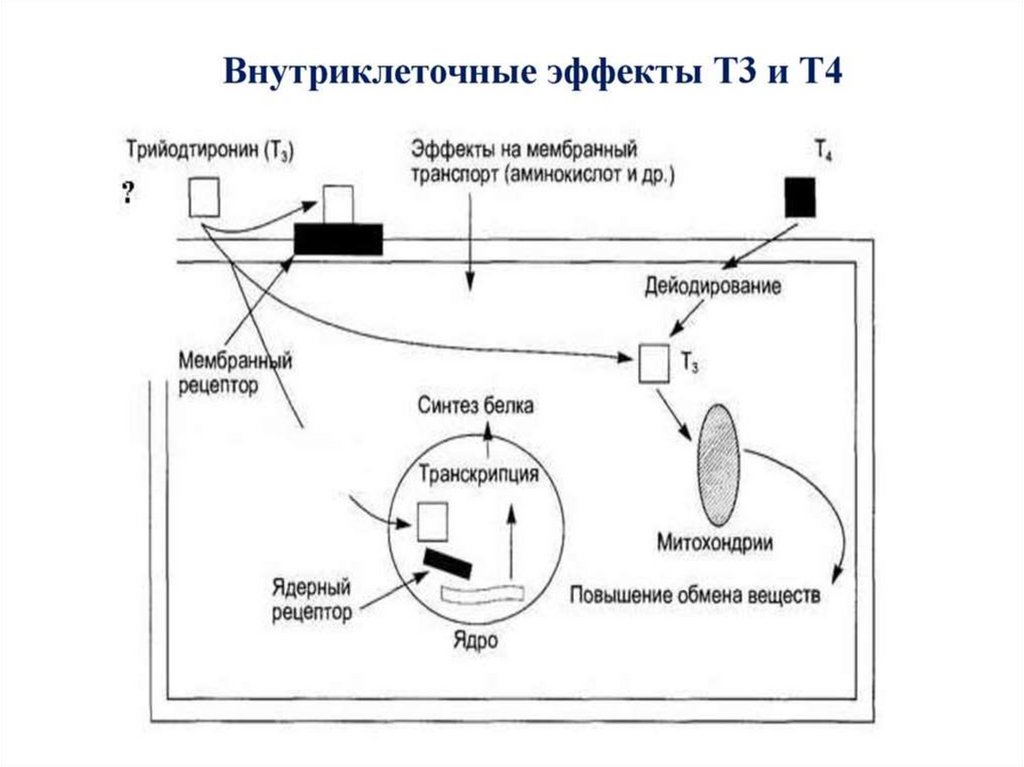
66. Метаболические эффекты
Т3В ядре
↑транскрипцию и
трансляцию белков –
ферментов ОВР
В костной ткани
активирует синтез
коллагена
Т4 (Т2)
В мтх
↑потребление О2 за счет
↑б/с ферментов ЦТК,
окисления ВЖК, ПВК,
↑скорость БО,
↑Образование АТФ,
↑температура тела
- Увеличение биосинтеза белка
- Увеличение потребления кислорода
-Калоригенный эффект (повышение
теплопродукции)
67. Гормон Т2
• Рецепторы для этогогормона находятся в
митохондриях.
• По силе своего
биологического действия
этот гормон не уступает Т3,
но скорость его действия
значительно выше.
• Т2 образуется из Т3 при
дейодировании
последнего в
периферических клетках.
• Т2 увеличивает скорость βокисления высших жирных
кислот,
• повышает активность
ферментов дыхательных цепей:
цитохрома с,
цитохромоксидазы,
• Повышает активность
ключевого фермента
пентозофосфатного пути –
глюкозо-6фосфатдегидрогеназы,
• Т2 стимулирует секрецию
гормона роста,
• активирует фермент
малатдегидрогеназу.
68.
69.
70.
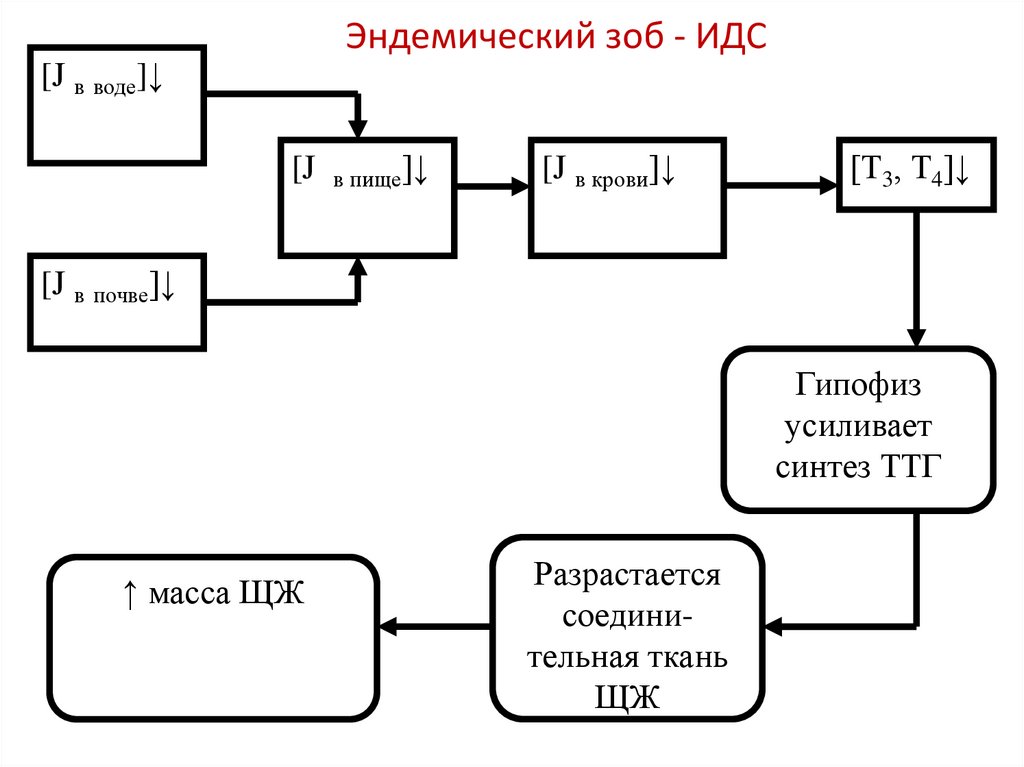
Эндемический зоб - ИДС[J в воде]↓
[J
в пище]↓
[J в крови]↓
[Т3, Т4]↓
[J в почве]↓
Гипофиз
усиливает
синтез ТТГ
↑ масса ЩЖ
Разрастается
соединительная ткань
ЩЖ
71.
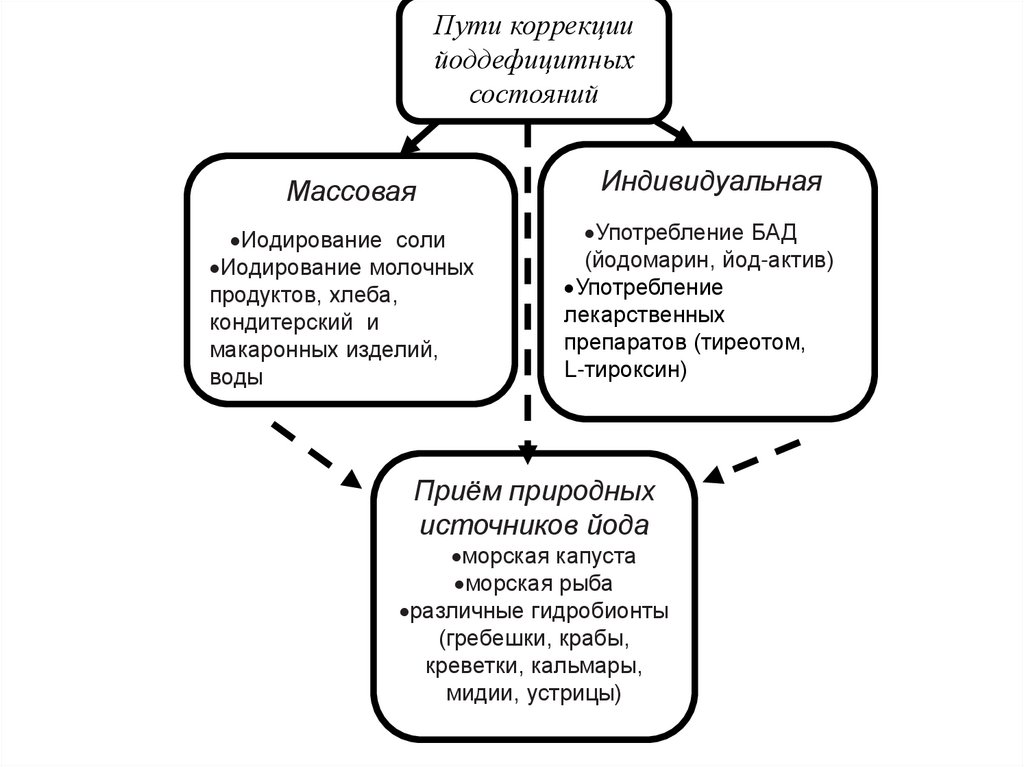
Пути коррекциийоддефицитных
состояний
Массовая
Иодирование соли
Иодирование молочных
продуктов, хлеба,
кондитерский и
макаронных изделий,
воды
Индивидуальная
Употребление БАД
(йодомарин, йод-актив)
Употребление
лекарственных
препаратов (тиреотом,
L-тироксин)
Приём природных
источников йода
морская капуста
морская рыба
различные гидробионты
(гребешки, крабы,
креветки, кальмары,
мидии, устрицы)
72. Пути коррекции йоддефицитных состояний
• Областная программа «Профилактикаэндемического зоба и других
йоддефицитных заболеваний на 1999 2000 годы». Постановление
Законодательного Собрания Оренбургской
области от 27.04.1999 N 235/44-ПЗС




































 biology
biology








