Similar presentations:
Основы квантовой химии
1.
Основы квантовой химии2.
Преподаватель – Терехова Екатерина ОлеговнаKaterin.terekhova@gmail.com
terekhova.e.o@muctr.ru
https://vk.com/terekhova_kate
8-906-758-54-10 (Telegram, What’s app)
Каб. 523 5 этаж
2
3.
Наш курс предполагает использованиераздаточных материалов (конспектов) в процессе
изучения материалов. Вы можете делать в них
пометки во время лекци и т.д.
Конспекты лекций размещены на сайте (*.pdf):
http://quant.hostronavt.ru/
Внимание!
На экзамене/зачете можно пользоваться
распечатками конспектов лекций,
своими конспектами
По согласованию с преподавателем можно
использовать планшет
3
4.
Учебные пособия:1. Цирельсон В.Г., Бобров М.Ф. «Многоэлектронный
атом».
2. Цирельсон В.Г. , Бобров М.Ф. «Квантовая химия
молекул».
3. Цирельсон В.Г. «Химическая связь и
межмолекулярное взаимодействие».
4. Венер М.В.
«Строение молекул и основы квантовой химии».
Книга:
Цирельсон В.Г. «Квантовая химия»
4
5. Организационные моменты
Рейтинговая система.Максимальное количество баллов:
весь курс – 100.
экзамен или зачет – 40
работа в семестре – 60 (минимум 30)
60 баллов включают в себя:
2 домашние к/р на 15 баллов
2 лабораторные работы на 15 баллов, из них 5
баллов за выполнение/отчет, 10 баллов за защиту
6.
Часть 1. Что такое квантовая химия и в чемее особенности?
Физика, немного математики и капелька химии.
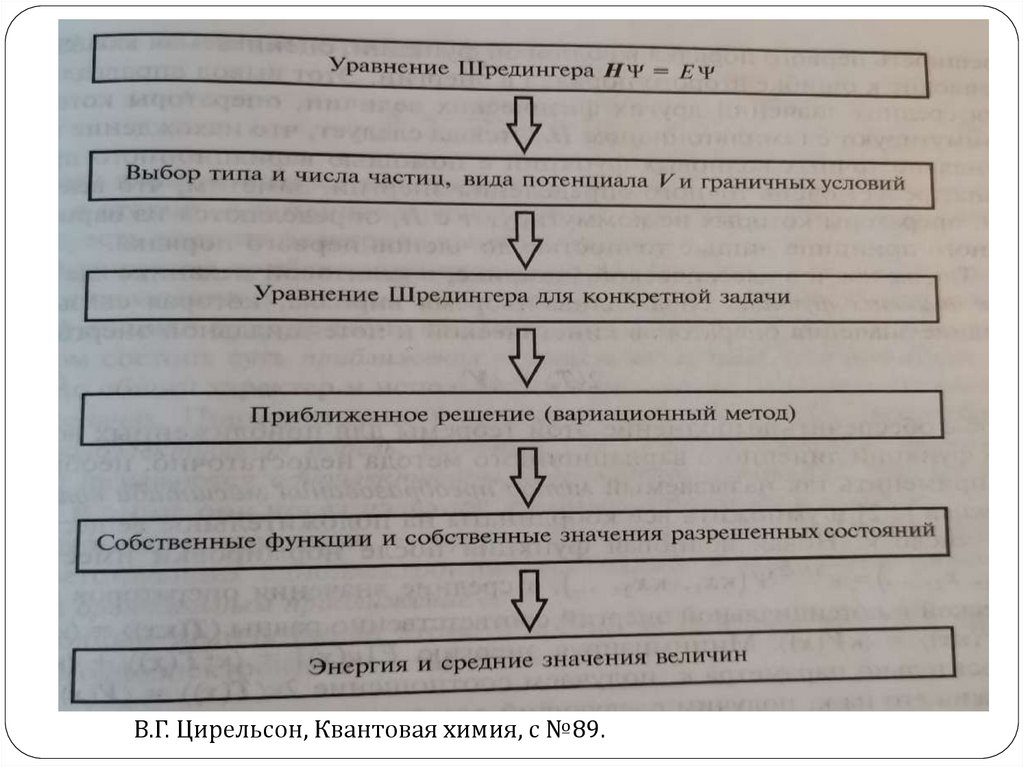
7. Зачем изучать квантовую химию?
Квантовая химия – наука, использующая методыквантовой механики для описания химических
явлений.
Корректное теоретическое описание строения
вещества, его спектральных свойств и
химического поведения невозможно без
привлечения квантовой химии.
8.
Что такое химический элемент?совокупность атомов с одинаковым зарядом ядра и
числом протонов, совпадающим с порядковым номером
в таблице Менделеева.
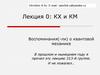
Атом - частица вещества микроскопических размеров и
массы, наименьшая часть химического элемента,
являющаяся носителем его свойств.
Электрон-отрицательно заряженная частица.
Протон- положительно заряженная частица.
Нейтрон-нейтральная частица
Ядро-центральная часть атома, в которой
сосредоточена основная его масса.
Кварк-фундаментальная частица, обладающая зарядом
e/3
9. Иерархия эленментов химической системы
10. Квантово-волновой дуализм материальных объектов природы
М. Планк вывел формулу для энергииизлучения абсолютно черного тела: E=h .
Данная формула была выведена
теоретически и впоследствии было
показано, что она работает только в том
случае, если энергия излучается и
поглощается не непрерывно, а некоторыми
целочисленными порциями, называемыми
квантами.
ЭНЕРГИЯ*ВРЕМЯ=ДЕЙСТВИЕ
Макс Планк
Планк показал ограниченность применения законов классической
физики. Именно он стал основоположником квантовой физики.
11.
В свое время, Де Бройль высказалидею о двойственной природе всех
объектов природы.
Так, при явлениях дифракции,
дисперсии и интерференции мы
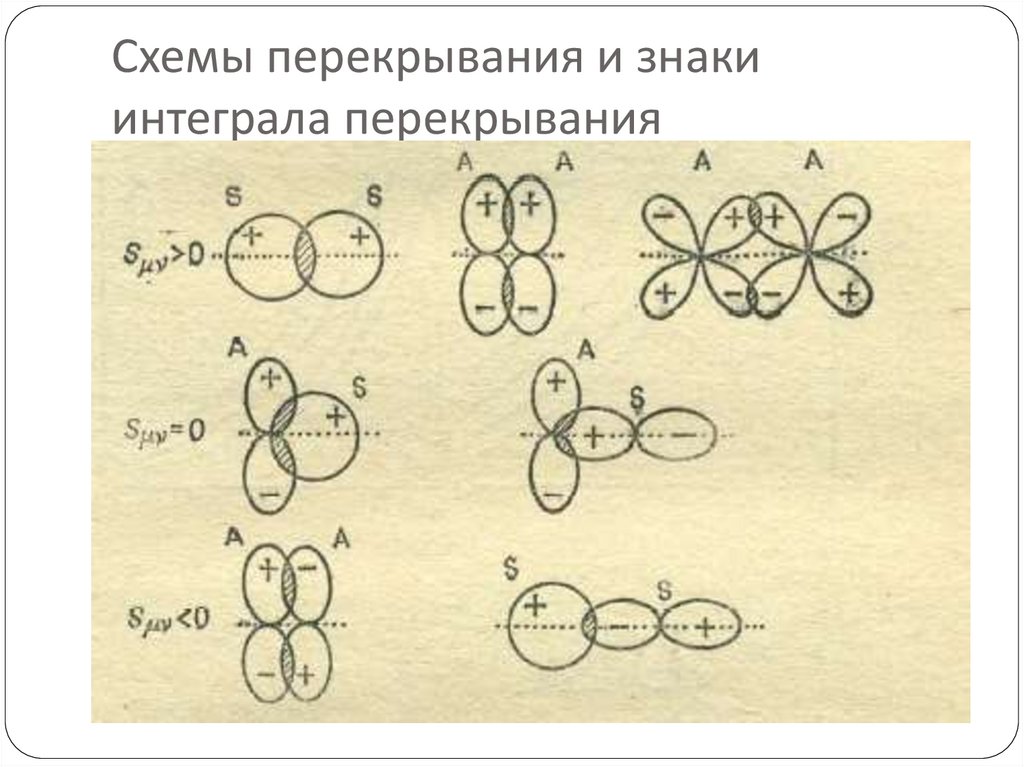
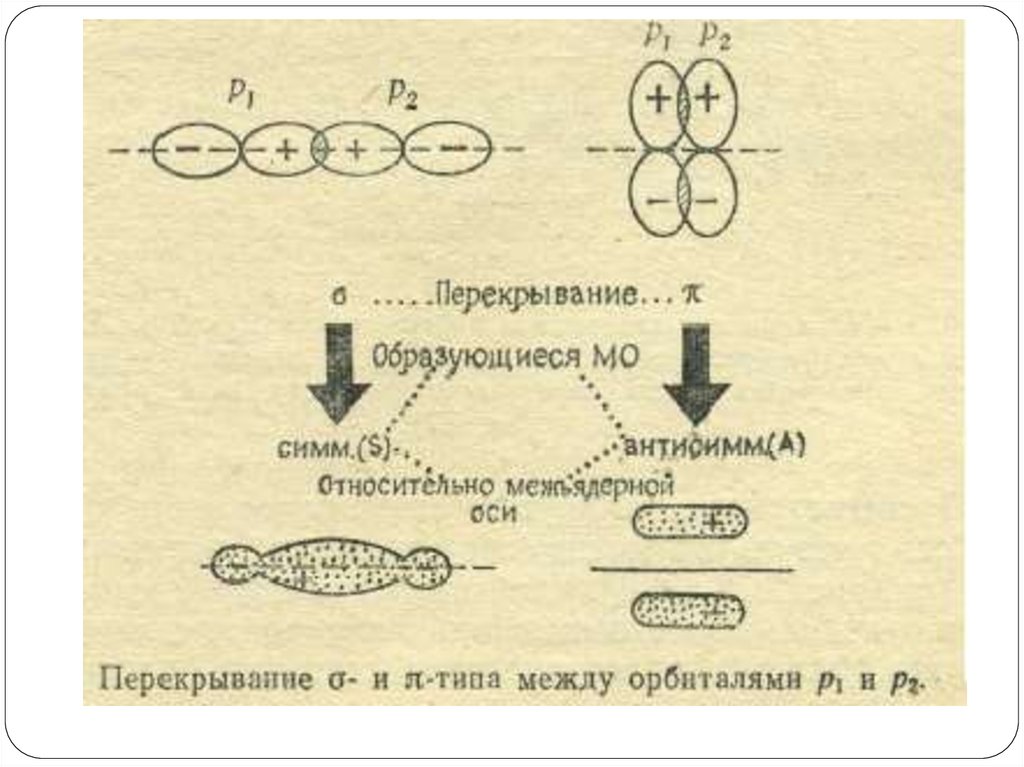
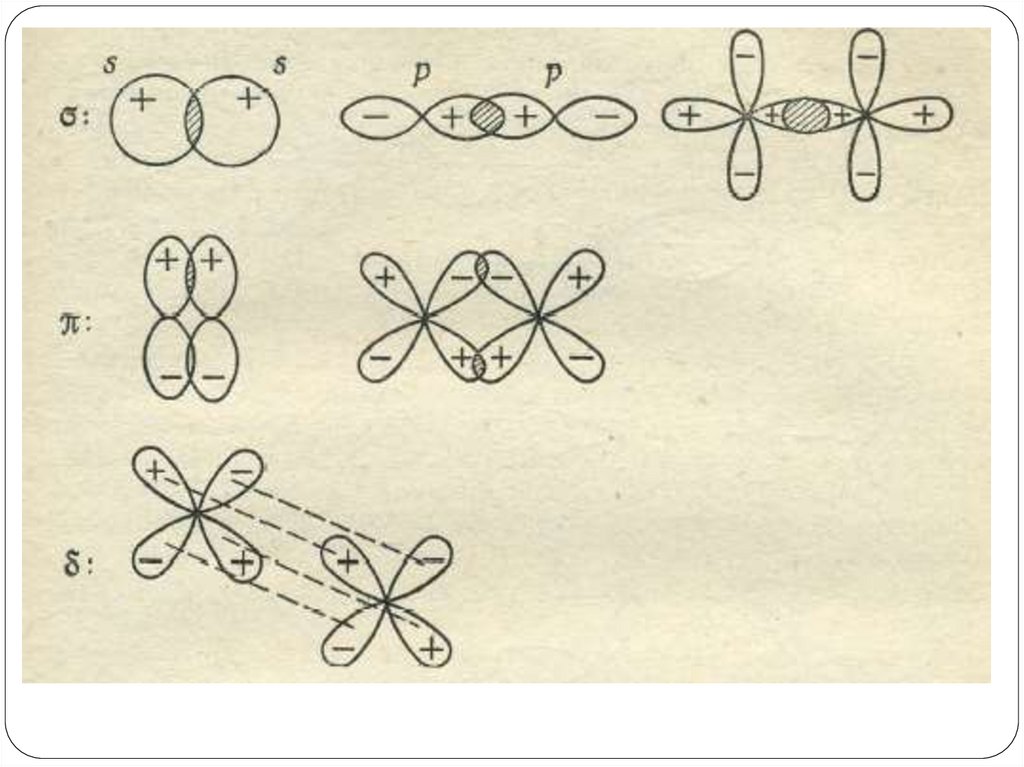
трактуем свет как волны(Э/М
колебания с определенной
длиной волны).
Однако, при изучении явления
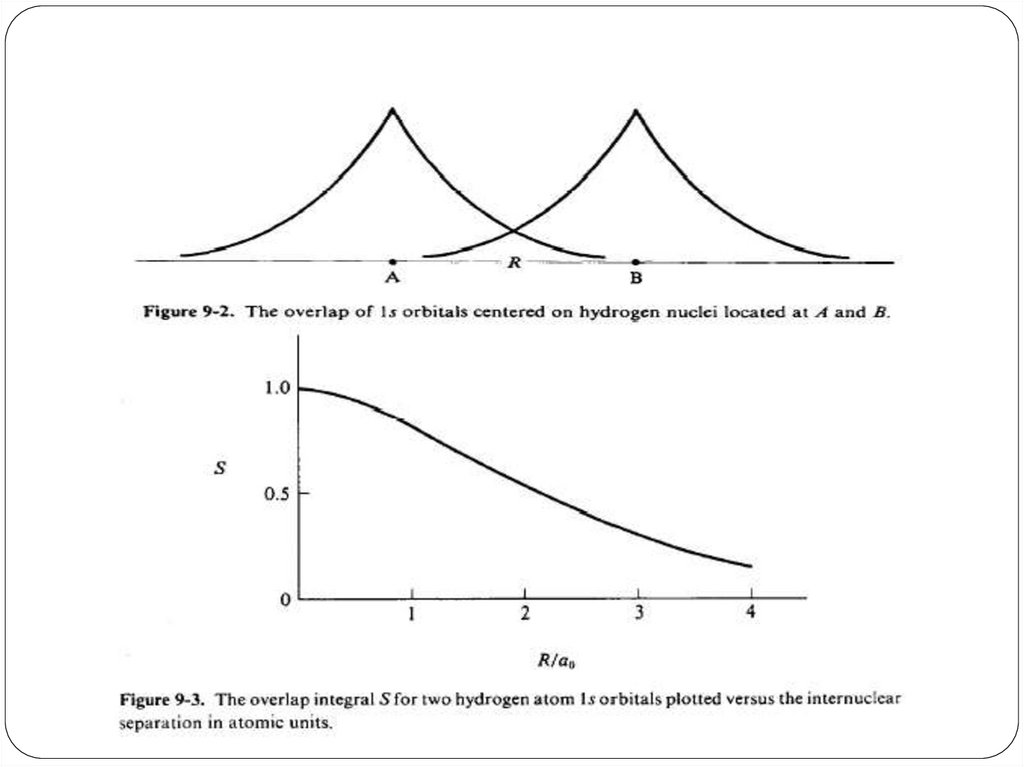
фотоэффекта свет ведет себя не
как волны, а как частицы,
обладающие определенной
скоростью, массой и импульсом.
Луи Де Бройль
Формула де Бройля:
=h/mv
НО ЭТО ПРИМЕНИМО ЛИШЬ ДЛЯ МИКРОЧАСТИЦ!!! ДЛЯ МАКРОМИРА
НЕВОЗМОЖНО ПОДОБРАТЬ ПОДХОДЯЩУЮ ДИФРАКЦИОННУЮ РЕШЕТКУ,
КОТОРАЯ ПОЗВОЛИЛА БЫ ИХ ОБНАРУЖИТЬ!
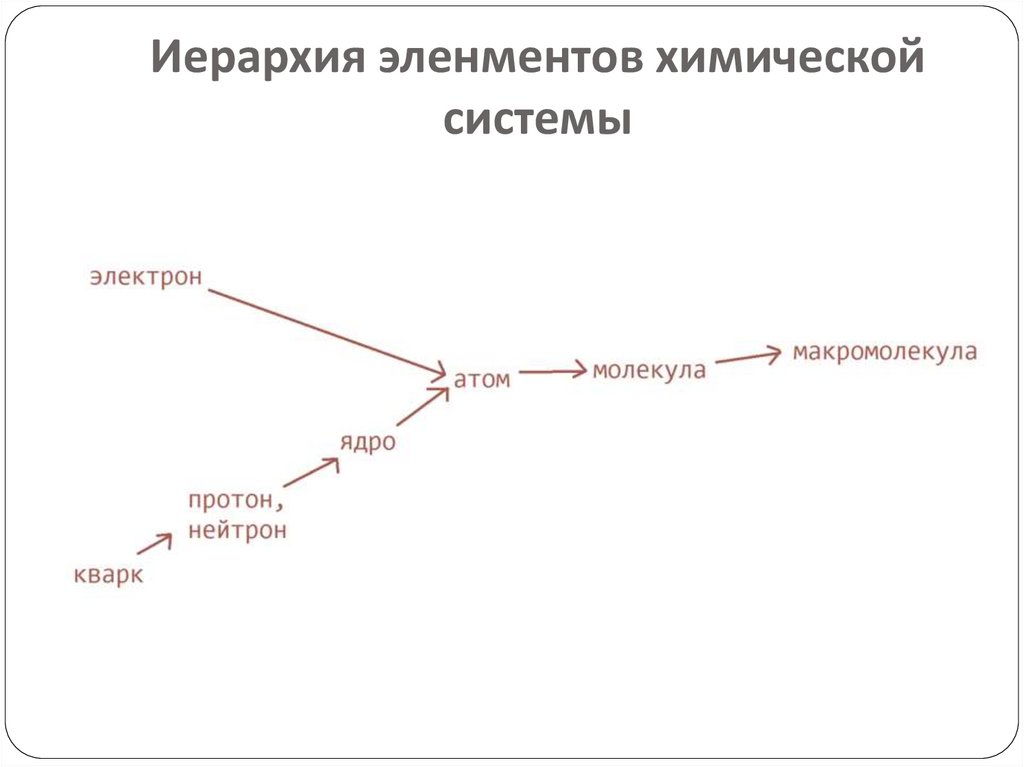
12. Волновая природа микрочастиц (прохождение пучка электронов через экран со щелью)
13.
МакромирКоординаты частиц, их скорости и законы их
изменения полностью определяет всю
эволюцию системы.
Микромир
Малые расстояния микрочастица не м.б.
описана как точка из-за ее волновых свойств.
Привычное нам описание невозможно, что
отражается в принципе неопределенности
Гейзенберга (1927). Траектории движения
частиц теряют смысл.
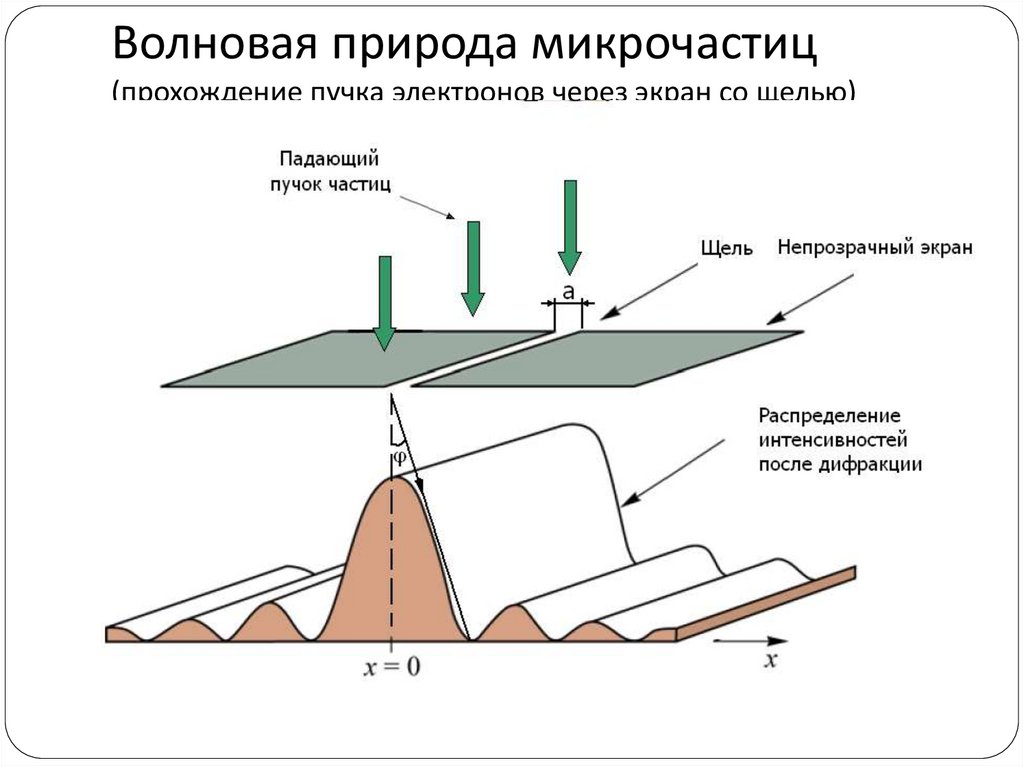
14. Где заканчивается классическая физика и начинается квантовая?
микромирмакромир
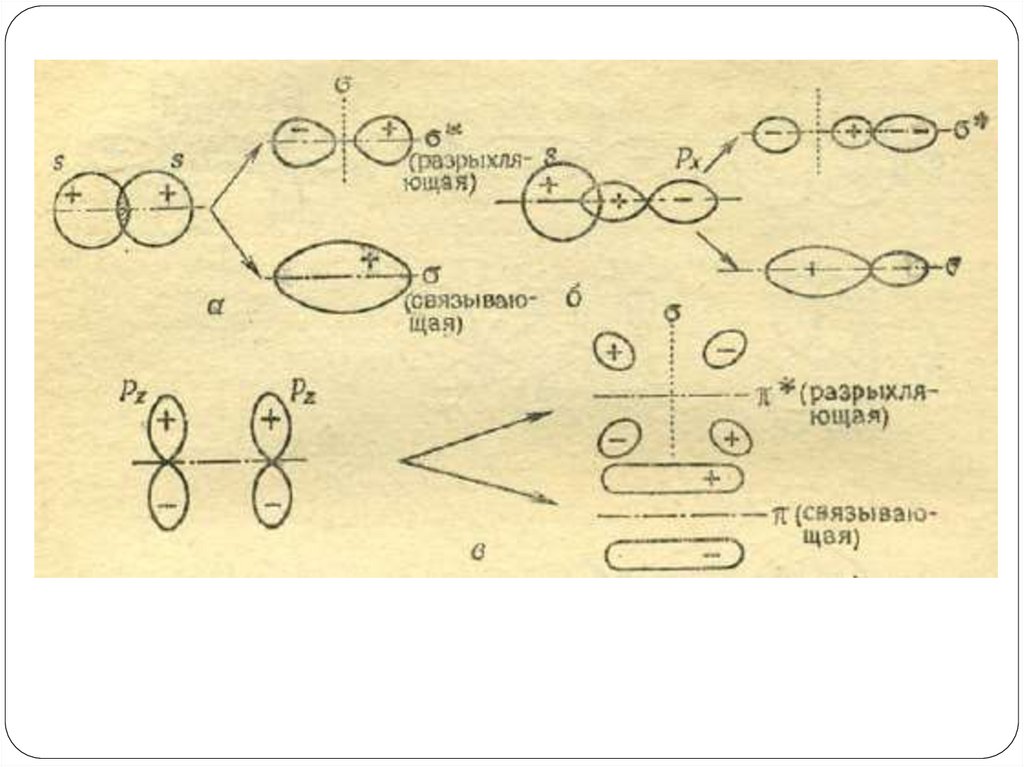
15.
Принцип неопределенности Гейзенберга гласит, что невозможноодновременно точно определить импульс (p) и положение (x)
частицы атомного масштаба в пространстве. Математически
этот
принцип записывается следующим образом:
x p / 2
(где ħ = h/2π – приведенная постоянная Планка, h - постоянная
Планка)
Руководствуясь этим принципом
можно провести следующие рассуждения:
при
падении электрона на ядро его
положение будет известно с точностью,
соответствующей размеру ядра.
Тогда неопределенность в импульсе
возросла бы
настолько, что увеличение кинетической
энергии E = p2/(2me) составило бы порядка
1010 раз (!) и просто разрушило бы ядро.
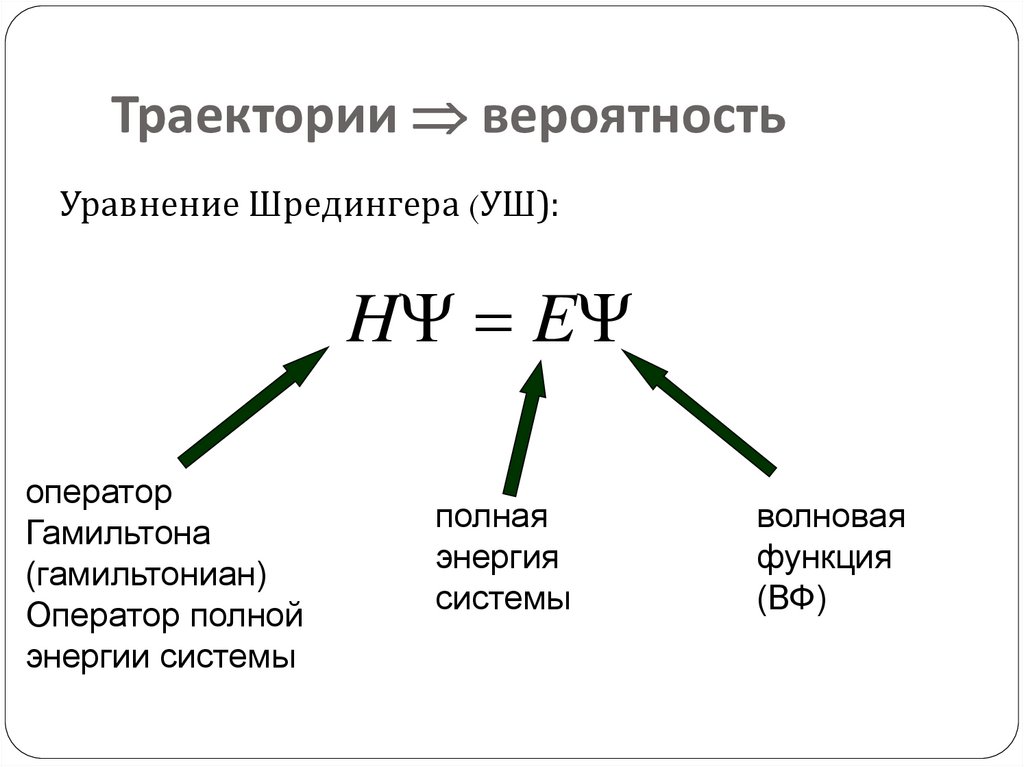
16. Траектории вероятность
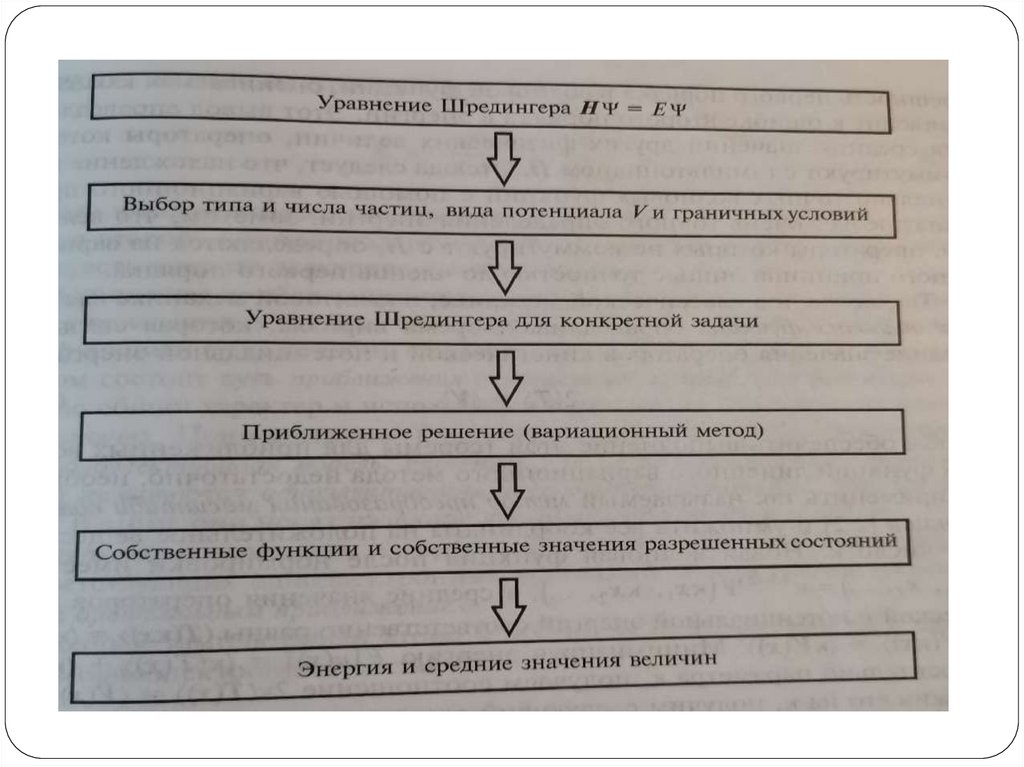
Траектории вероятностьУравнение Шредингера (УШ):
H E
оператор
Гамильтона
(гамильтониан)
Оператор полной
энергии системы
полная
энергия
системы
волновая
функция
(ВФ)
17.
Основные постулаты квантовой механики1.Каждое состояние системы n частиц
полностью описывается функцией координат
частиц xi и времени t - волновой функцией
(x1, x2, …, xn, t) ({x},t).
непрерывна, конечна, однозначна,
интегрируема и существует во всем
интервале изменения переменных.
18. Волновая функция (ВФ)
ВФ – функция координат всех частиц системы и времени:( x1 , y1 , z1 ,..., xn , yn , z n ,t ) (r1 ,..., rn ,t ) (r ,t )
Если временной зависимости нет:
( x1 , y1 , z1 ,..., xn , yn , z n ) (r1 ,..., rn ) (r )
В курсе будут рассматриваться независящие от
времени (стационарные) волновые функции
(r).
19. Требования к «идеальной» ВФ
Непрерывна -электрон всегда существует и не может вдругисчезнуть, затем вдруг появиться
Однозначна - электрон не может быть в двух местах
одновременно – условие однозначности;
Конечна -при бесконечном удалении от ядра вероятность
встретить электрон стремится к
нулю – условие конечности функции.
Нормирована на 1 – скалярное произведение ВФ равно 1 –
отсюда следует физ. смысл ВФ
* r r dr 1
Скобки Дирака:
,
*
Требования определяются физическим смыслом и видом
операторов.
20. Физический смысл ВФ
r 2dVr 2
вероятность найти частицу в объеме dV
вблизи точки r.
плотность вероятности найти частицу
вблизи точки r.
Физически наблюдаемая величина не r , а квадрат
её модуля | r |2. Поэтому ВФ может быть
комплексной (чтобы вероятность была
действительной, используют не квадрат ВФ, а квадрат
её модуля).
21.
2. Каждой доступной измерению величине Ав любом из возможных состояний
соответствует линейный эрмитов оператор А.
Оператор - символ, обозначающий
математическую операцию (правило), с
помощью которой из одной функции
получается другая.
Оператор обозначают полужирным
шрифтом или «крышкой»
22. Что такое оператор?
В квантовой механике и квантовой химии, оператор– это линейное отображение (математическое
правило), которое, действуя на функцию,
преобразует ее в другую.
Оператор действует на функцию, которая стоит
справа от него:
A a
Оператор – это аналог наблюдаемой величины в
классической физике
Оператор, действуя на функцию, переводит систему
в другое состояние
23.
В квантовой механике все операторы линейные,чтобы не нарушался принцип суперпозиции
состояний (чтобы не было такого, что система
находится одновременно в двух состояниях)
У каждого оператора есть набор собственных
значений – это те значения, которые может
принимать данная физическая величина. Так,
для оператора Гамильтона любое его
собственное значение – это энергия системы.
Совокупность всех собственных значений
оператора Гамильтона – это энергетический
спектр.
Все операторы в квантовой химии – эрмитовы.
24. Что это за эрмитовы операторы?
Такие операторы еще называютсамосопряженными. Т.е. выполняется
равенство:
Выражение выше значит, что действие такого
оператора на правую и левую функцию
одинаковы.
Собственные значения таких операторов – это
вещественные числа!
25. Эрмитовы операторы
1. Представляют собой квадратную матрицу –т.е. число строк всегда совпадает с числом
столбцов
2. Элементы главной диагонали –
действительные числа. Остальные элементы –
комплексные числа
26. Эрмитово сопряжение
Ранее было сказано, что для всех эрмитовыхоператоров выполняется равенство:
+ в данном случае обозначает операцию,
которая называется «эрмитово сопряжение».
Когда выполняется такая операция, происходит
2 действия:
а) у оператора меняются местами строки и
столбцы
б) знак мнимой единицы i меняется на
противоположный
27. Что это за скобки дирака?
В квантовой механике и в квантовой химии свой,достаточно специфичный математический аппарат.
В общем случае, этот раздел математики называется
«теория представлений».
Квантовая химия использует координатное
представление - это
такое представление операторов квантовой механики, в
котором операторы и волновая функция зависят от
пространственных координат.
28. Еще немного математики
Скобки дирака носят названия «бра» и «кет», отанглийского слова bracket – скобка.
Кет-вектор – вектор столбец
Бра-вектор – вектор-строка
29.
Скалярное произведение векторов30.
3. Независящая от времени волновая функцияудовлетворяет стационарному уравнению
Шредингера:
H = Е
H=T+V - эрмитов оператор полной энергии
системы (гамильтониан)
Т - оператор кинетической энергии всех частиц
(электронов, ядер) системы, V – оператор
потенциальной энергии всех частиц систем.
Е - полная энергия системы.
31. Оператор кинетической энергии частицы
22
mv
p
T
2 2 2m
pˆ
T
2m
кинетическая энергия
в классической механике
оператор кинетической энергии
в квантовой механике
pˆ i nx n y nz i
y
z
x
2 2 2
T
2m x y
z
2
2
2
2
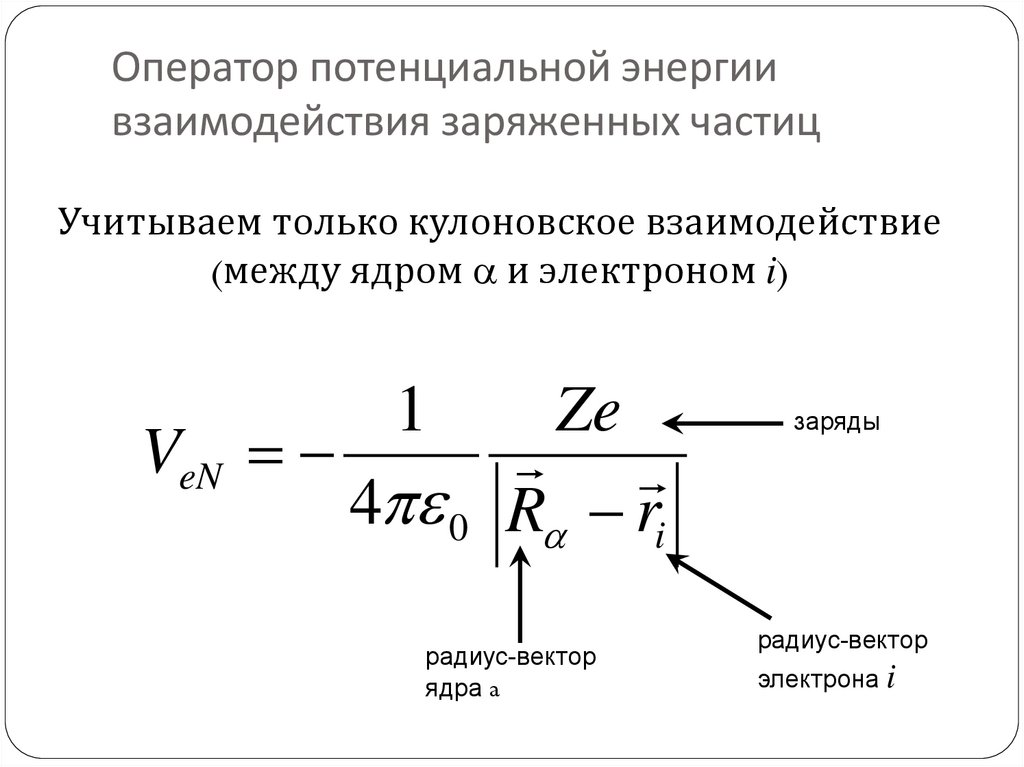
32. Оператор потенциальной энергии взаимодействия заряженных частиц
Учитываем только кулоновское взаимодействие(между ядром a и электроном i)
VeN
1
Ze
4 0 Ra ri
радиус-вектор
ядра a
заряды
радиус-вектор
электрона i
33.
4. Все одинаковые частицытождественны.
Именно поэтому можно говорить о
неразличимости электронов: замена
одного из них другим не может быть
обнаружена экспериментально.
34.
5. Значения величины А, которые могут бытьизмерены, являются собственными значениями аi
уравнения на собственные значения
А i = аi i ,
Собственные функции i есть волновые
функции, описывающие возможные состояния
системы, в которых проводятся измерения.
35.
Иначе: решение уравнения Шредингера есть нечто иное, как решение задачи на собственные
значения для оператора полной энергии системы
Н. Набор (спектр) собственных значений Еi и
набор собственных функций i гамильтониана
полностью характеризуют систему
H i E i i ,
E 0 E1 E 2 ... E n
36.
6. Среднее значение величины А длясистемы, находящейся в состоянии i,
определяется выражением
a i (x)A i (x)dx
*
i
(предполагается, что волновые функции
ортонормированы). Если же за время измерения
система успевает побывать в нескольких
состояниях, то справедлив принцип
суперпозиции состояний:
37.
a Wi *i (x)A i (x)dxi
где wi - вероятность пребывания системы в
состоянии i,
Wi 1
i
Принцип суперпозиции состояний дает рецепт
определения измеряемых характеристик
системы с помощью волновых функций.
38.
39.
Часть 2. Атом водородаУже больше химии с капелькой математики и физики.
40.
Уравнение ШредингераВолновая функция зависит от
координат электрона. Она не имеет
физического смысла
Эрвин Шредингер
Физический смысл имеет лишь квадрат
модуля волновой функции – это
вероятность обнаружения электрона в
определенной точке пространства
Волновая функция является решением
уравнения Шредингера для
рассматриваемой системы и содержит
полную информацию о системе,
позволяя определить
пространственное расположение
частиц, их импульсы, кинетическую
энергию и т.д.
41.
Глобально, в квантовой химии все методы и задачинаправлены на решение одной глобальной
проблемы – решить уравнение Шредингера.
Решим уравнение – получим всю необходимую
информацию о системе.
Естественно, задача нетривиальная, особенно, если
мы имеем дело с системой, которая даже немного
сложнее, чем атом водорода или гармонический
осциллятор.
Поэтому, для решения данной проблемы были
разработаны различные методы решения.
Один из самых «ранних» методов – вариационный
принцип.
42.
Вариационный принципКак решить уравнение Шредингера для всех возможных электронных
состояний ?
Любая система стремится занять состояние с минимальной энергией
(всякая система хочет быть стабильной)
Чтобы решить уравнение Шредингера, нужно минимизировать выражение для
энергии, т.е. подобрать такие волновые функции, для которых энергия будет
минимальна.
Вариационный принцип - среднее значение энергии Еi любого из возможных i
состояний системы, вычисленное с приближенной волновой функцией, не может
быть меньше нижнего собственного значения Е0 оператора Н.
Перевод: в ходе расчетов по вариационному принципу, мы не можем получить
энергию Е ниже, чем реальная энергия системы. Завысить – можем, а занизить –
нет.
43.
Док-во:Среднее значение оператора Н для
приближенной волновой функции ,
нормированной на 1 :
E * (x)H (x)dx | H |
(x) (x)dx 1
*
Разложим по собственным функциям оператора Н:
n
ci i
i
Функции i составляют полную ортонормированную систему, т.е.
n
=1
n
*
*
*
(
x
)
(
x
)
d
x
c
c
i i i i dx 1
i
i
n
E ( x ) H ( x ) dx c i
*
i
n
Заменим все Еi на E0 :
2
i
n
ci
n
=1
i
2
2
1
i
n
=1
2
*
i (x)H i (x)dx
ci E i
i
E ci E i E 0 ci E 0
2
c*ic i
Еi - энергия
i-го состояния
Е0 - нижнее (наименьшее)
собственное значение оператора Н Энергия основного состояния
44.
На языке вариационного исчисления условие минимума эквивалентнотребованию обращения в нуль первой вариации среднего значения Н:
* (x)H (x)dx 0
При минимизации с учетом ортонормированности функций
используют метод неопределенных множителей Лагранжа.
Введем такой множитель Е:
[ * (x)H (x)dx-E(
i
n
n
i
j
j
(x)
*
i
j
(x)dx-1)]
[ c*i c j i* ( x) H j ( x)dx - E(Sij -1)] 0
Теперь все параметры ci можно считать независимыми.
Матричные уравнения для определения параметров ci :
n
n
ñ ñ [H
*
i
i
j
j
ij
ESij ] 0,
n
n
ñ ñ [H
*
i
j
j
i
ij
ESij ]* 0,
i 1, 2, 3,..., n
45.
H ij *i (x)H i (x)dx -матричные элементы оператора Н в базисе функций
i ( x )
Sij - элементы матрицы интегралов перекрывания,
вычисленной c набором функций i ( x)
H11
H
H 21
.....
H n1
..... H1n
..... H 2n
..... .....
..... H nn
H12
H 22
.....
H n2
S11
S
S 21
.....
S n1
..... S1n
S 22 ..... S 2n
..... ..... .....
S n2 ..... S nn
S12
Матричные уравнения справедливы, если коэффициенты
при вариациях ñ j равны нулю:
n
с [H
j
ij
ESij ] 0,
i 1,2,3,..., n
ij
ESij ]* 0,
i 1,2,3,..., n
j
n
с [H
*
j
j
Каждое матричное уравнение получается из другого операцией комплексного
сопряжения, поэтому достаточно рассматривать только одно из них.
46.
Приравняем нулю определитель (детерминант) из коэффициентов при ci :или
H 11 ES11
H 12 ES12
.....
H 1n ES1n
H 21 ES 21
H 22 ES 22
..... H 2 n ES 2 n
.....
.....
H n1 ES n1
H n 2 ES n 2
.....
.....
0
..... H nn ES nn
H ij ES ij 0
-вековое или секулярное
уравнение
При разложении определителя получается многочлен n-ой степени по Е, т.е.
вековое уравнение имеет n корней n различных значений Е. Подставляя их в
секулярное уравнение, находим набор параметров ci .
Величины Е i играют роль энергий состояний системы.
n
Волновая функция системы
c i i
i
47.
В.Г. Цирельсон, Квантовая химия, с №89.48. Гамильтониан атома Н: движение электрона в поле протона
Уравнение Шредингера для атома водородаH n En n
Гамильтониан атома Н: движение электрона
в поле протона
H Te Vep
Состояние атома водорода полностью определяется
волновой функцией, зависящей только от
координат электрона.
49.
Операторы T и V: разные системы координат.Электрон в атоме Н – пример центрального поля, сила действия которого
зависит от расстояния до ядра r. При этом используется сферическая
система координат. Отметим, что переход из декартовой к сферическую
систему координат упрощает вид V:
V(x,y,z) V(r)
и делает выражение для T более громоздким:
~
T
2
h 1 2
,
=
2
2 r
2 r r r r
2
Оператор T действует на угловые переменные.
Таким образом, в сферический системе координат оператор T
представляется в виде суммы двух членов, один из которых зависит от r
(радиальная часть), а второй – от угловых переменных и .
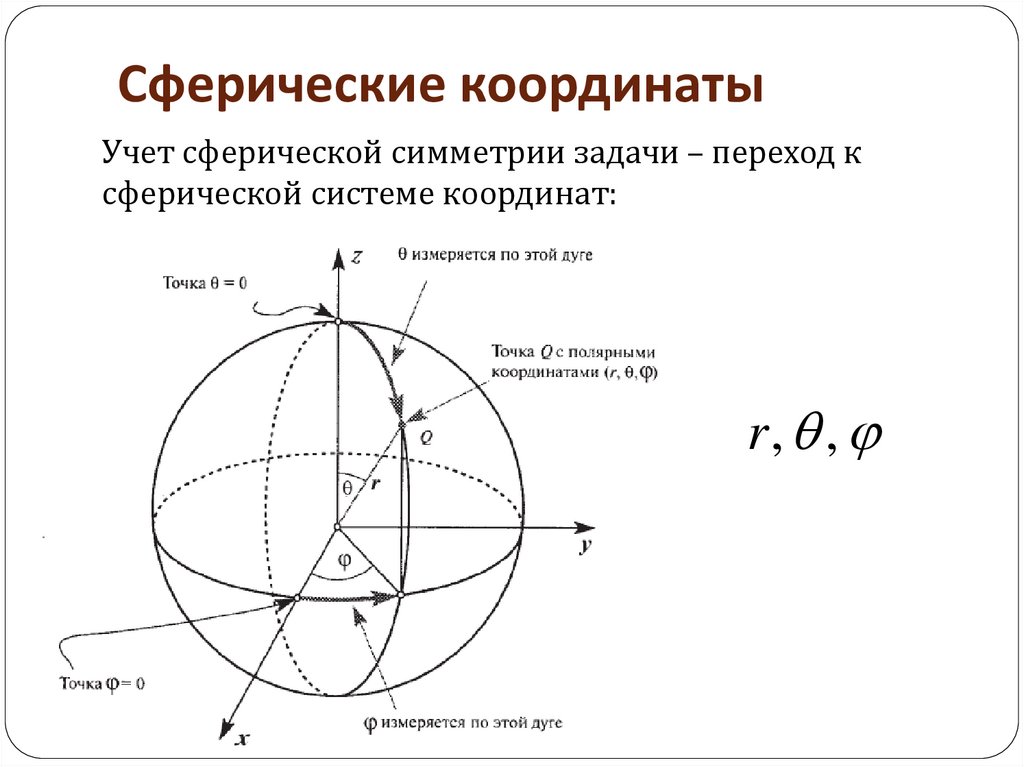
50. Сферические координаты
Учет сферической симметрии задачи – переход ксферической системе координат:
r, ,
51.
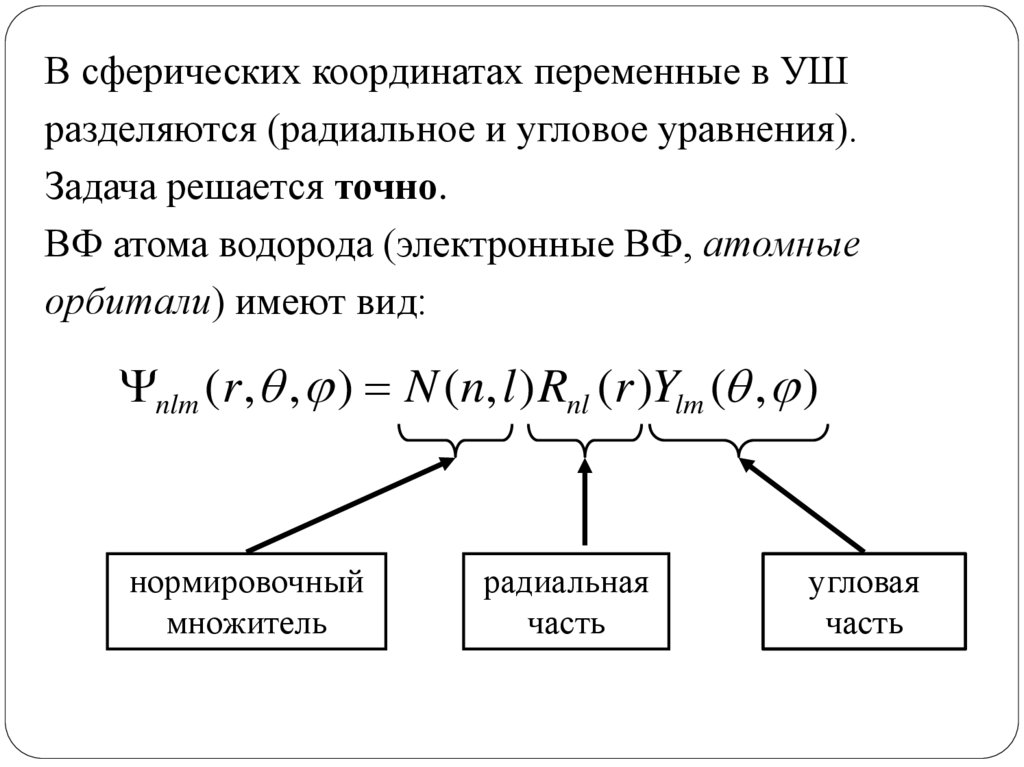
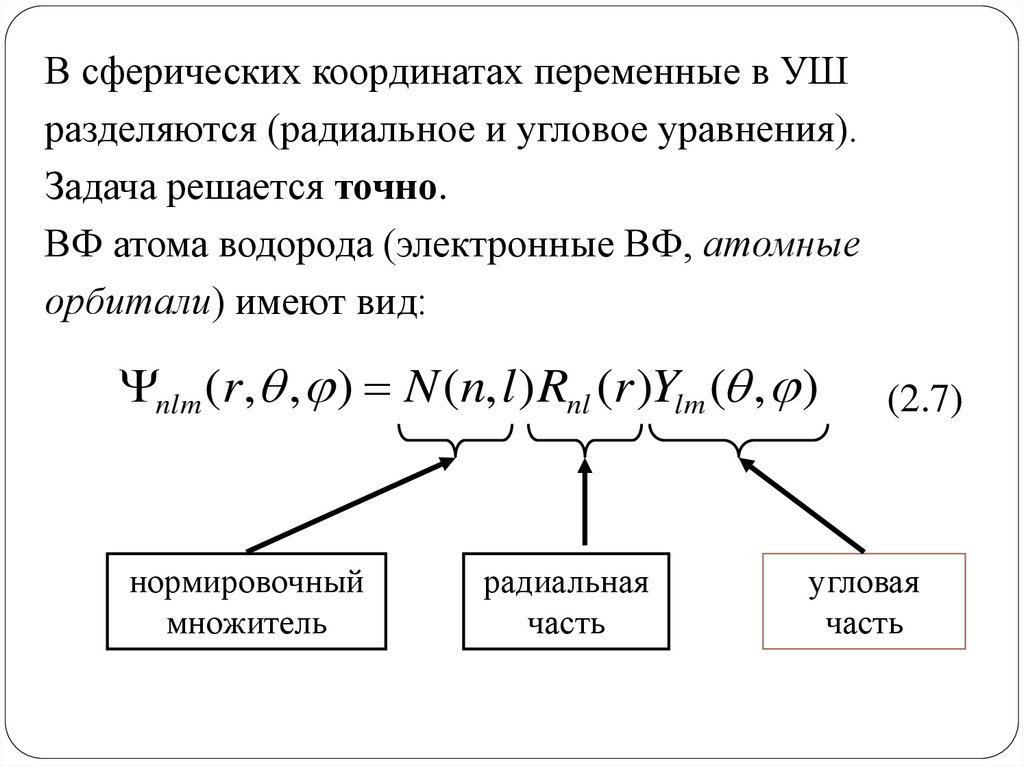
В сферических координатах переменные в УШразделяются (радиальное и угловое уравнения).
Задача решается точно.
ВФ атома водорода (электронные ВФ, атомные
орбитали) имеют вид:
nlm (r , , ) N (n, l ) Rnl (r )Ylm ( , )
нормировочный
множитель
радиальная
часть
угловая
часть
52. Радиальная часть ВФ водородоподобных атомов
l2 Zr
e
Rnl (r ) N Znl
na0
Zr
na0
2 l 1
n l
L
2 Zr
na0
N – нормировочный множитель,
L – присоединенные полиномы Лягерра,
Z – отношение заряда ядра атома к заряду электрона (Z = 1 для
атома водорода),
a0 = 0.529 10-10 м – радиус Бора (единица длины в системе Хартри)
53. Угловые функции
Угловые функции Ylm( , ) описывают всферических координатах ( , ) угловую
зависимость вероятностного распределения
электрона. Это комплексные ортонормированные
функции - сферические гармоники.
m m
Ylm ( , ) ( 1)
2
1
(2l 1) (l m )! 2 m
im
P
(cos
)
e
l
2 (l m )!
присоединенные
полиномы
Лежандра
54.
n – главное, l – орбитальное, m – магнитноеквантовые числа.
Уравнение Шредингера с гамильтонианом имеет
два разных решения:
(1) E > 0 электрон не задерживается вблизи ядра
(непрерывный спектр);
(2) E < 0 электрона не уходит далеко от ядра
(дискретные значения En):
e4 1
En =
2
2
2h n
при n = 1,2,3 …
55. Квантовые числа
Три квантовых числа согласно УШ определяютсостояние атома водорода:
1.
n =1, 2, 3...
–
главное
2.
l = 0, 1, 2, 3,..., n–1
–
орбитальное
3.
m = –l, –l+1, ..., +l
–
магнитное
4.
(s = –1/2, +1/2
–
спиновое)
У атома Н энергии состояний зависят только от
числа n.
ВФ, с одинаковыми n, но различными l и m (и s)
вырождены.
56.
n – главное квантовое число, характеризующееполную энергию электрона на n оболочке,
определяет размер орбитали
L-определяет момент импульса и номер
подоболочки,побочное квантовое число(еще его
называют орбитальное), которое определяет
форму атомной орбитали
ml –магнитное квантовое число, определяет
проекция момента импульса на внешнее
магнитное поле(ориентацию орбитали в
пространстве)
ms– спиновое квантовое число, задает проекцию
спина электрона на внешнее магнитное поле
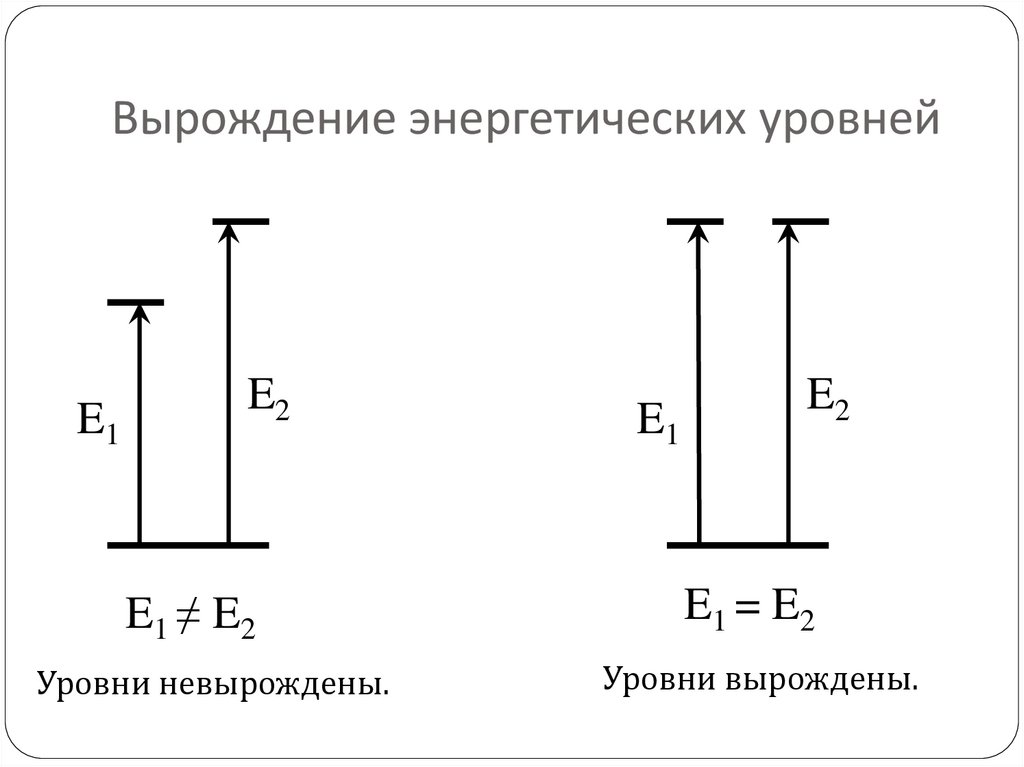
57. Вырождение энергетических уровней
E1E2
E1 ≠ E2
Уровни невырождены.
E1
E2
E1 = E2
Уровни вырождены.
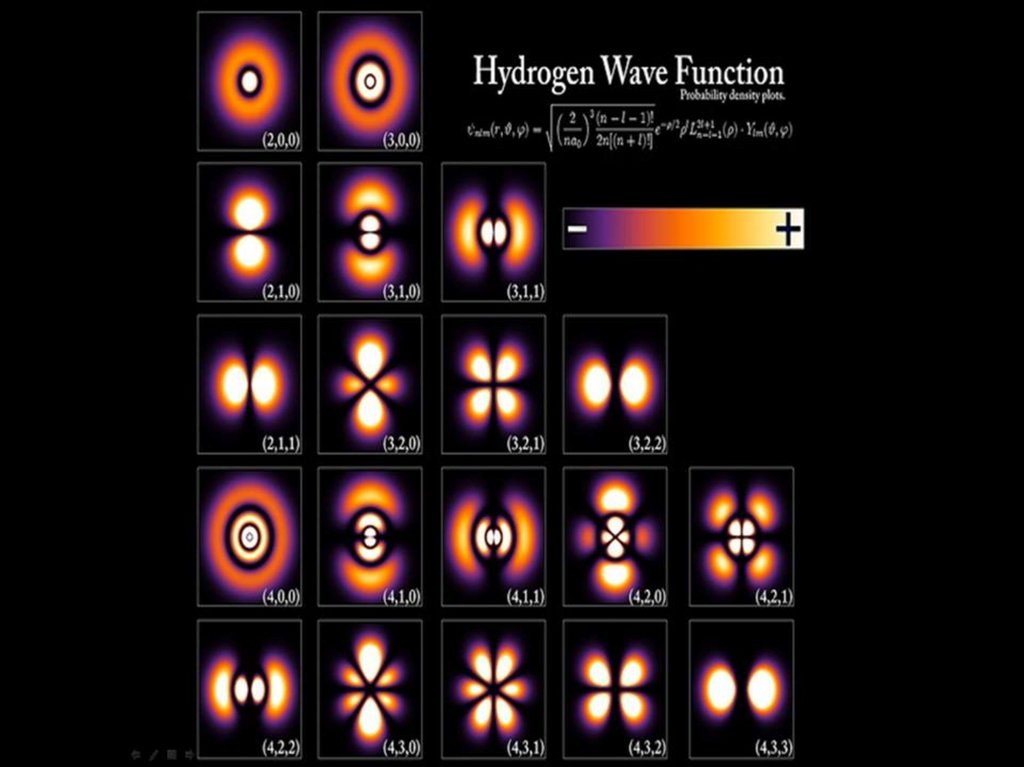
58. Атом водорода – простая реальная система
В результате решения уравненияШредингера для атома водорода
возникают квантовые числа
А при переходе из декартовой системы
координат к сферической получаются
привычные нам изображения атомных
орбиталей
59.
60. s- АО не так просты, как кажутся
1s2s
3s
61. Спектральные линии
Спектр поглощения водородаСпектр испускания водорода
62. Спектральные линии атома H
13.6En 2 (эВ)
n
63.
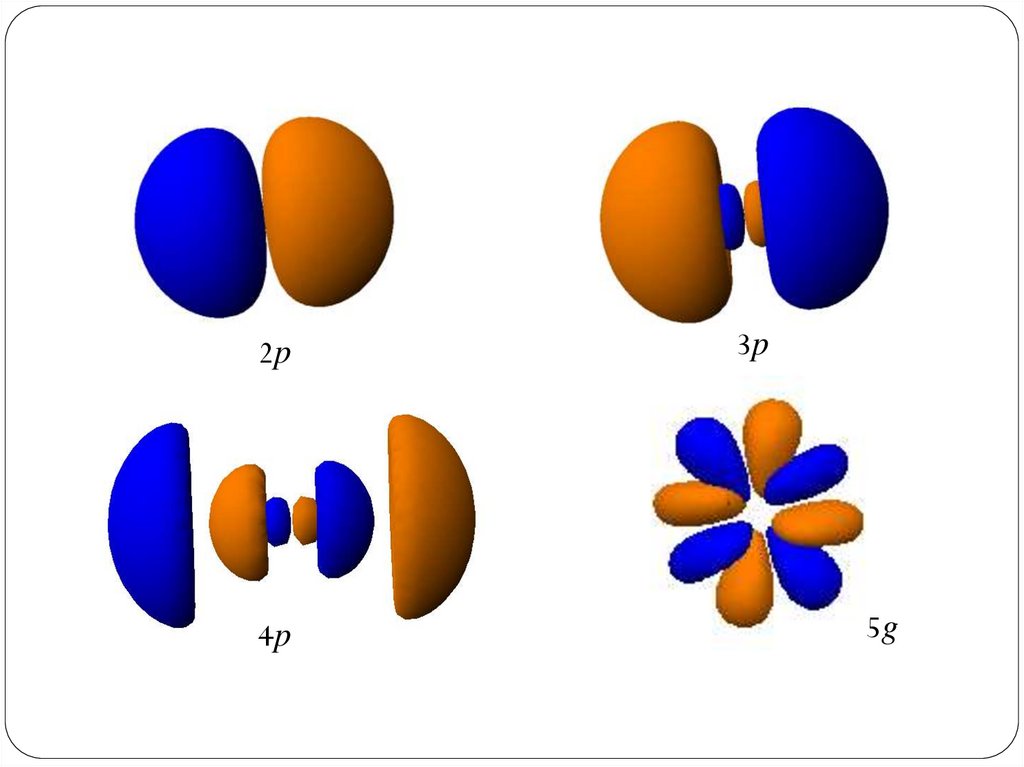
2p4p
3p
5g
64.
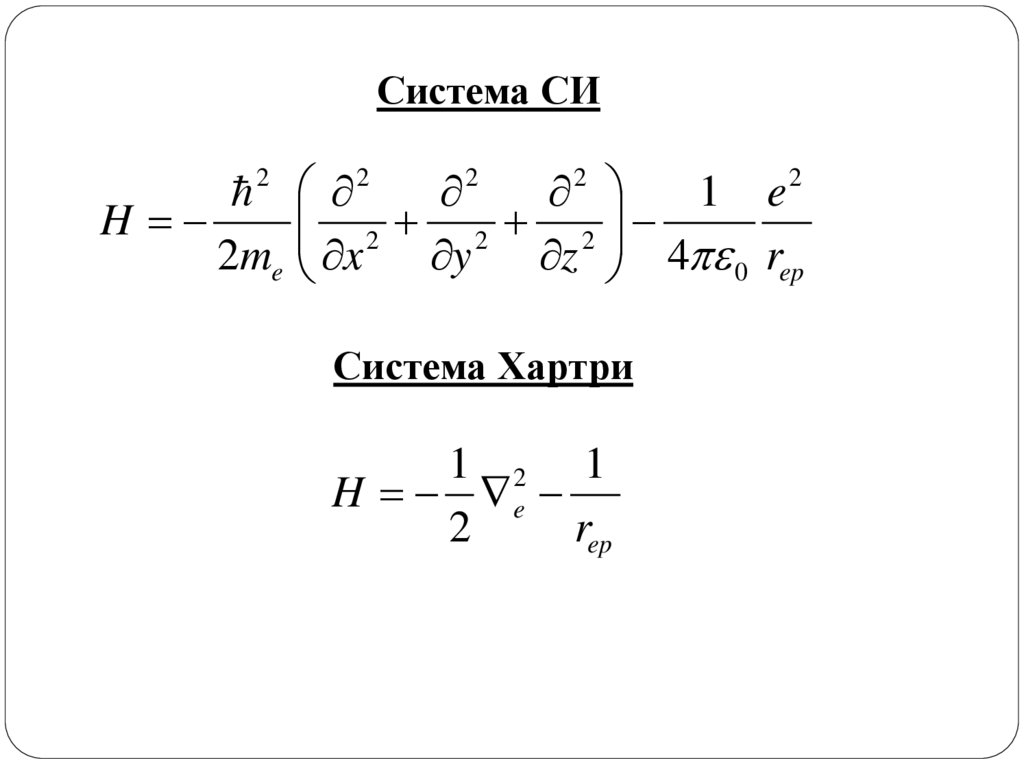
Система СИ2
2
2
2
1 e
2 2 2
H
2me x
y
z 4 0 rep
2
Система Хартри
1 2 1
H e
2
rep
65. Часть 3. Радиальная и угловая ВФ
Расчетные задания и примеры66.
В сферических координатах переменные в УШразделяются (радиальное и угловое уравнения).
Задача решается точно.
ВФ атома водорода (электронные ВФ, атомные
орбитали) имеют вид:
nlm (r , , ) N (n, l ) Rnl (r )Ylm ( , )
нормировочный
множитель
радиальная
часть
(2.7)
угловая
часть
67. Радиальная часть ВФ водородоподобных атомов
l2Zr
e
Rnl (r ) N Znl
na0
Zr
na0
2 l 1
n l
L
2Zr
na0
N – нормировочный множитель,
L – присоединенные полиномы Лягерра,
Z – отношение заряда ядра атома к заряду электрона (Z = 1 для
атома водорода),
a0 = 0.529 10-10 м – радиус Бора (единица длины в системе Хартри)
68. Нормированные радиальные функции атома водорода Rnl (Z = 1, система СИ)
R10 r2
a0
3/ 2
exp r / a0
1
1
R20 r
1
exp
r
/
2
a
0
3/ 2
2 a0 2a0
1
R21 r
r exp r / 2a0
5/ 2
2 6 a0
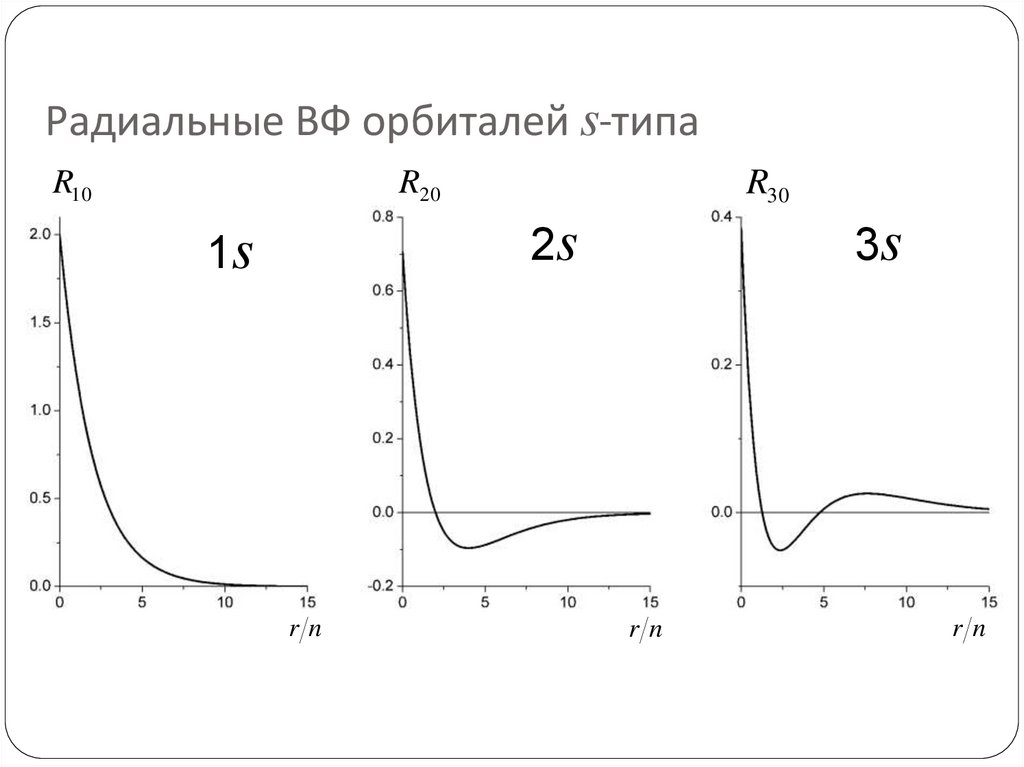
69. Радиальные ВФ орбиталей s-типа
R10R30
R20
2s
1s
rn
3s
rn
rn
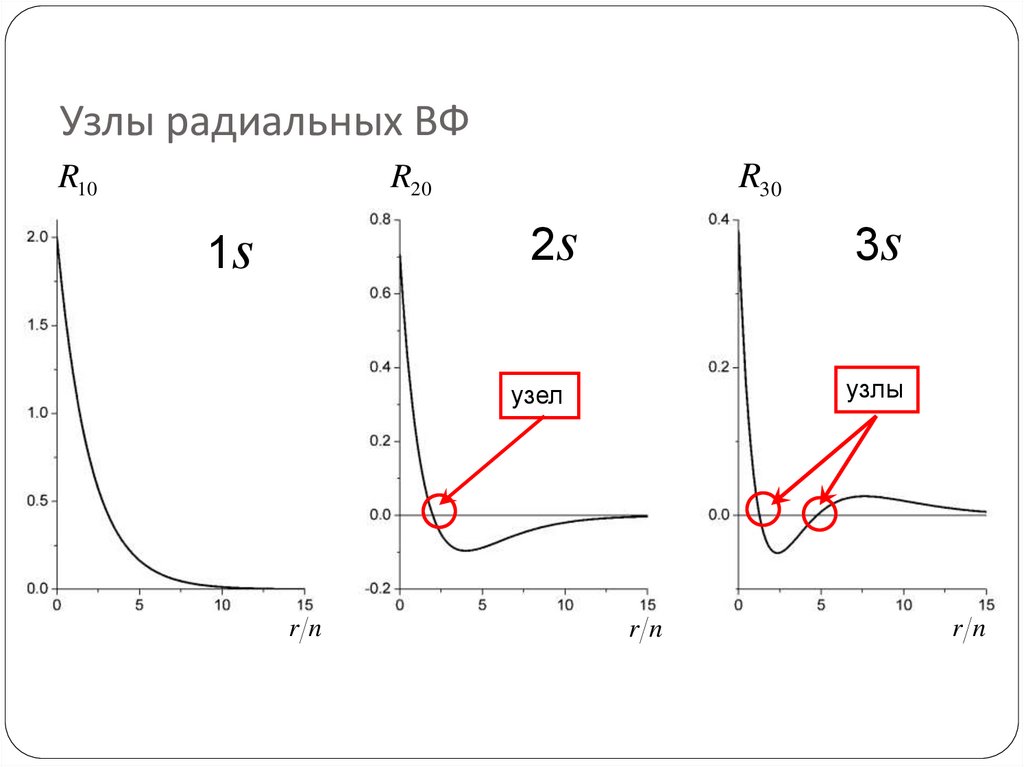
70. Узлы радиальных ВФ
R10R30
R20
2s
1s
3s
узлы
узел
rn
rn
rn
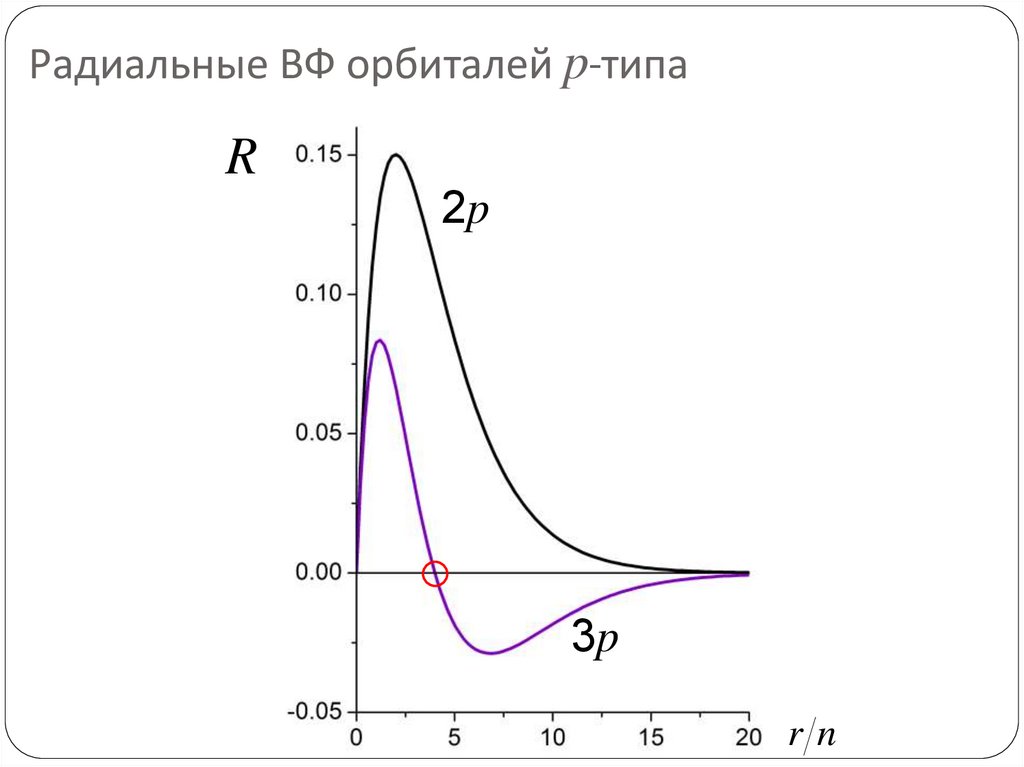
71. Радиальные ВФ орбиталей p-типа
R2p
3p
rn
72. Сколько узлов у радиальной части ВФ?
Число узлов = n – l –1
Откуда узлы появляются в s-орбиталях,
это же сфера?
Вспомним картинку из предыдущей части.
73. s- АО не так просты, как кажутся
1s2s
3s
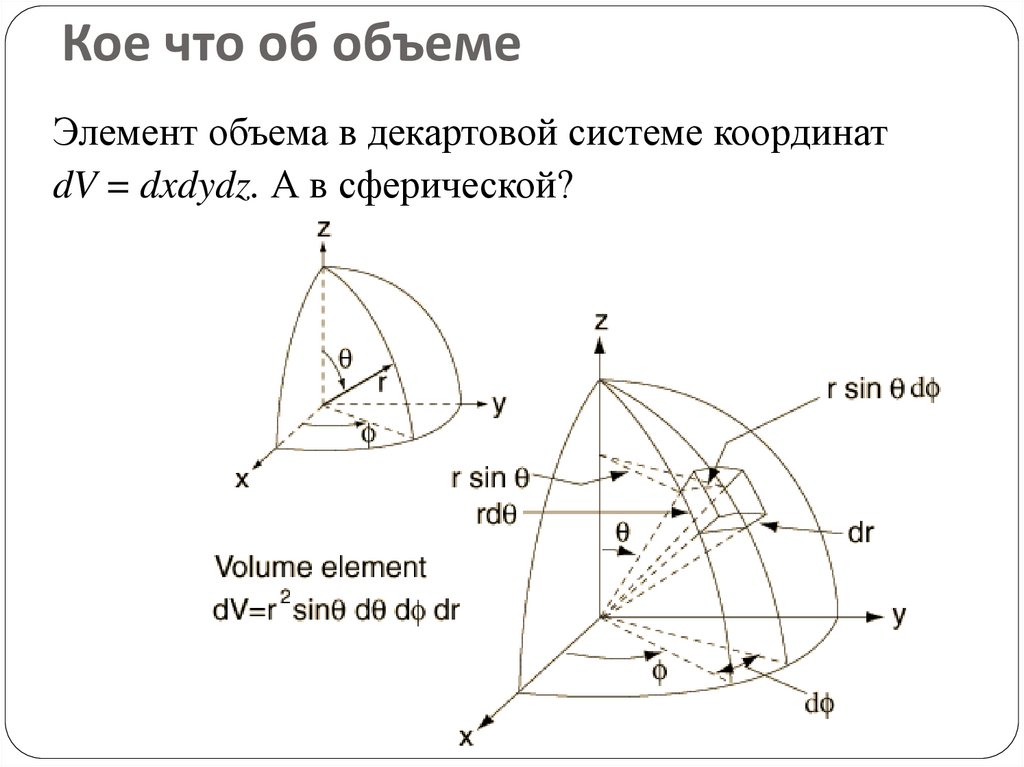
74. Кое что об объеме
Элемент объема в декартовой системе координатdV = dxdydz. А в сферической?
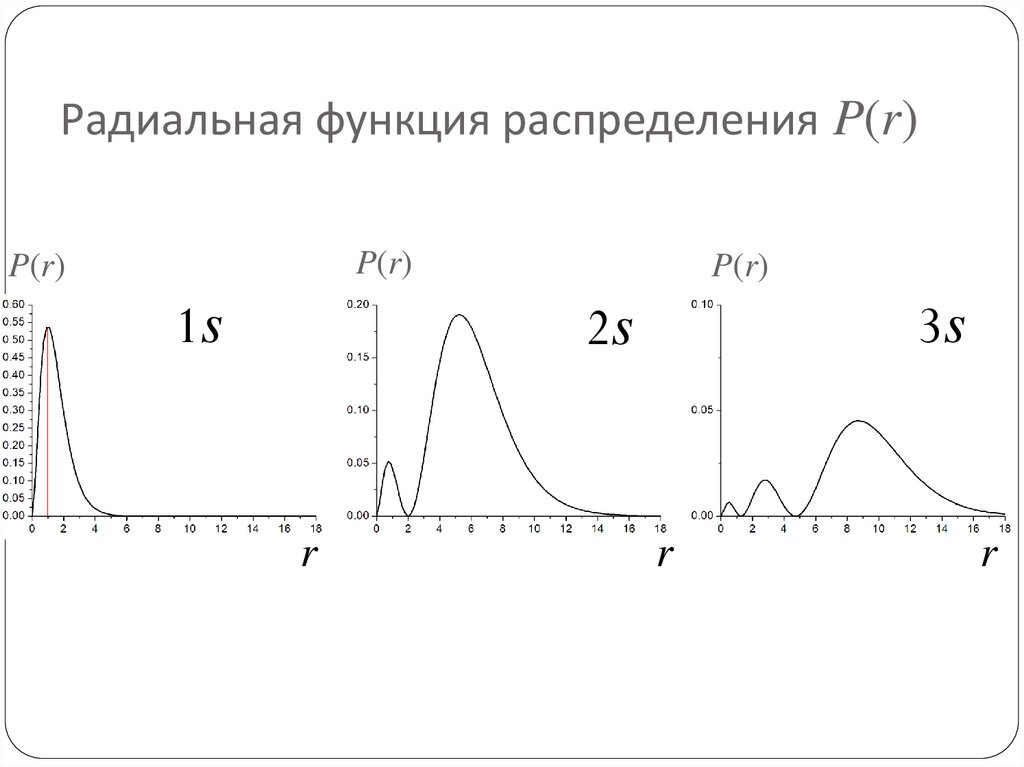
75. Радиальная функция распределения P(r)
Её можно получить, проинтегрировав по угловымпеременным и .
2
Rnl (r ) r dr Ylm , sin d d
2
2
2
0 0
Rnl (r ) r dr Pnl r dr
2
2
Отметим, что интегрируется нормированная функция
Ylm( , ). Например,
Y00 , 1 / 4
75
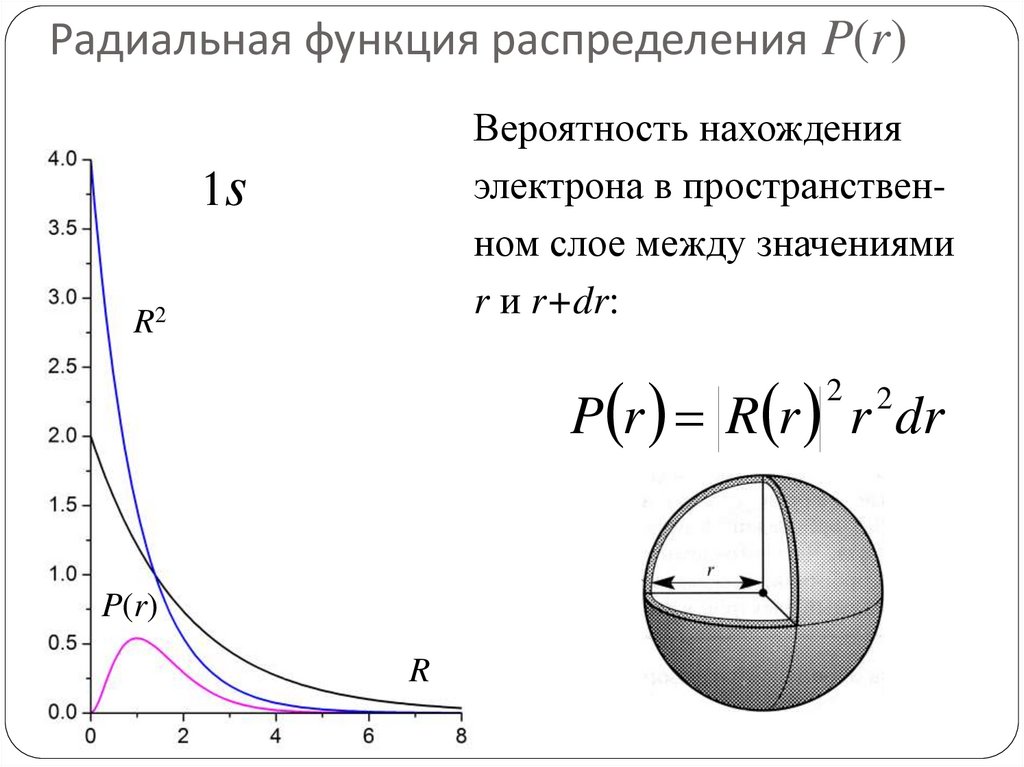
76. Радиальная функция распределения P(r)
Вероятность нахожденияэлектрона в пространственном слое между значениями
r и r+dr:
1s
R2
P r R r r dr
2
P(r)
R
2
77. Наиболее вероятное положение электрона на орбитали
Приравнивая нулю производную Pnl по r, можно найтинаиболее вероятное положение электрона на
соответствующей орбитали. Для основного состояния
атома водорода это расстояние равно радиусу Бора a0.
77
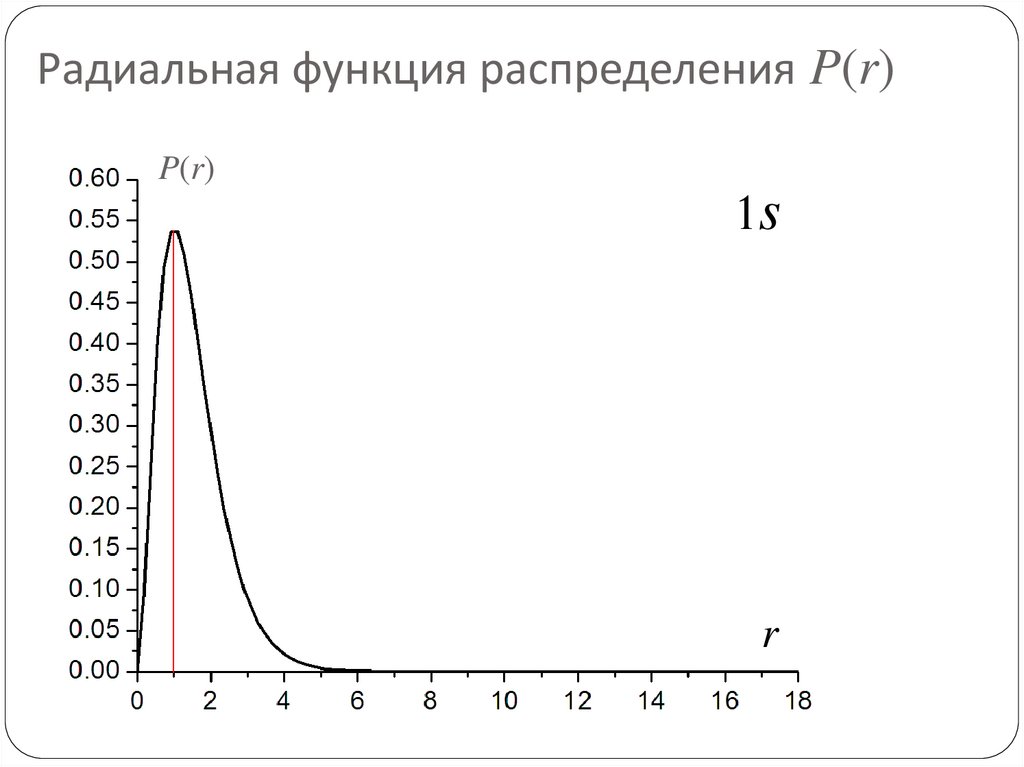
78. Радиальная функция распределения P(r)
P(r)1s
r
79. Радиальная функция распределения P(r)
P(r)P(r)
1s
P(r)
3s
2s
r
r
r
80. Угловые функции
Угловые функции Ylm( , ) описывают всферических координатах ( , ) угловую
зависимость вероятностного распределения
электрона. Это комплексные ортонормированные
функции - сферические гармоники.
m m
Ylm ( , ) ( 1)
2
1
(2l 1) (l m )! 2 m
im
P
(cos
)
e
l
2 (l m )!
присоединенные
полиномы
Лежандра
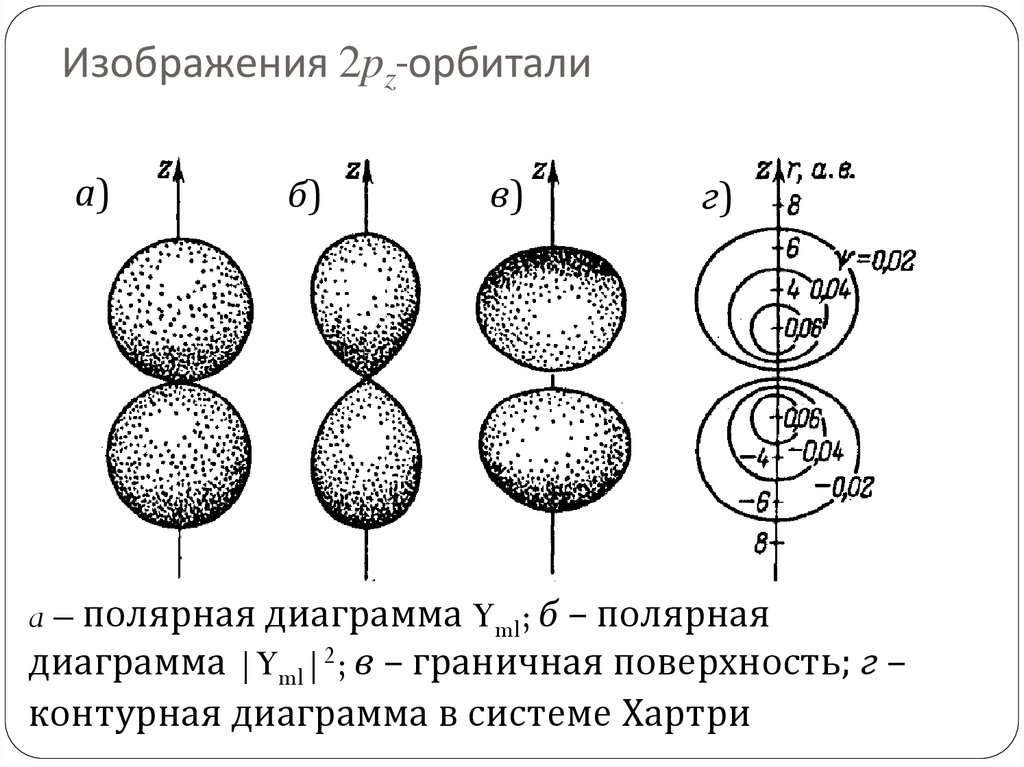
81. Изображения 2pz-орбитали
а)б)
в)
г)
a – полярная диаграмма Yml; б – полярная
диаграмма |Yml|2; в – граничная поверхность; г –
контурная диаграмма в системе Хартри
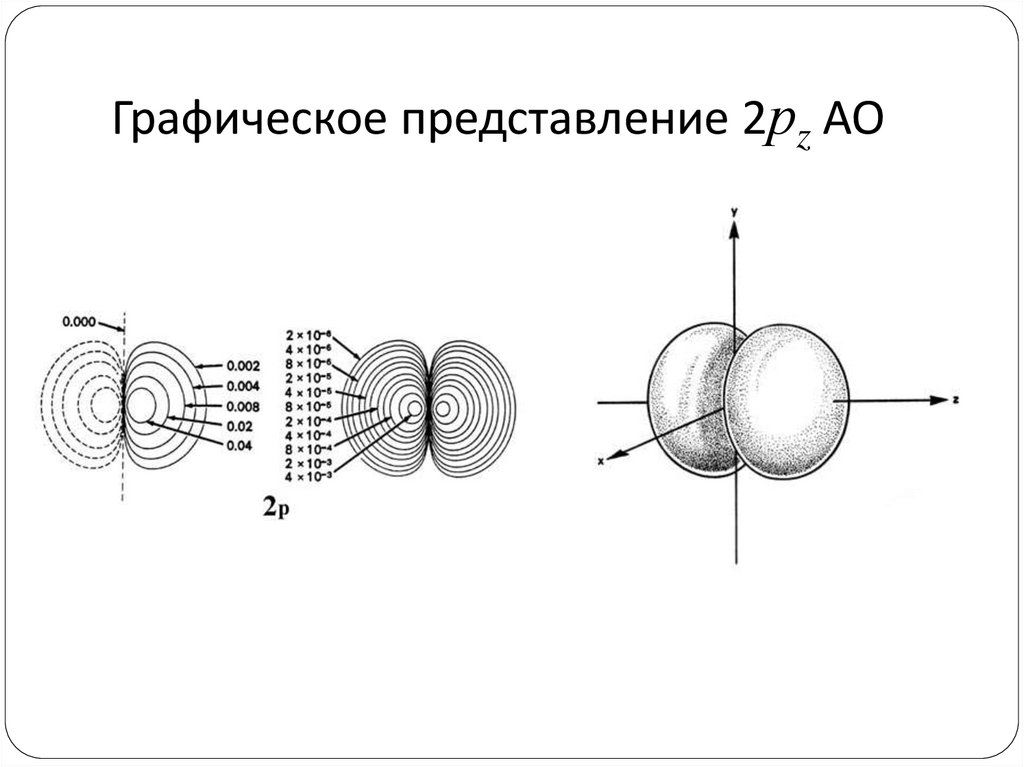
82. Графическое представление 2рz АО
83. Число узловых поверхностей у угловой составляющей ВФ
Число узловых поверхностей = l84.
2p4p
3p
5g
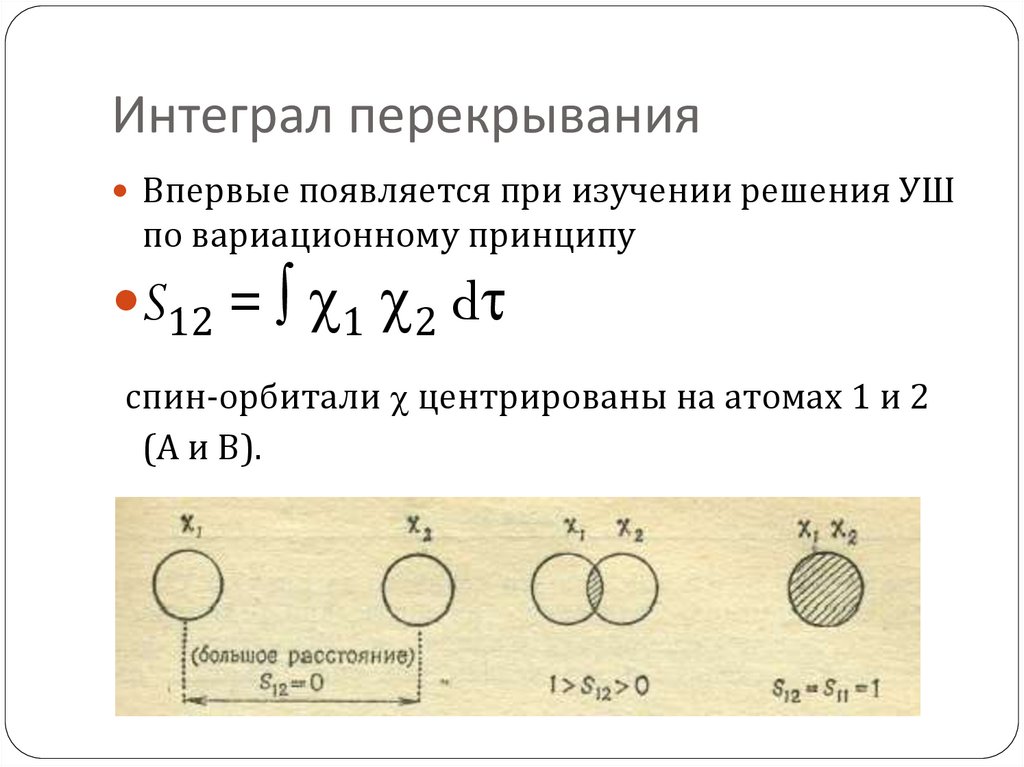
85. Интеграл перекрывания
Впервые появляется при изучении решения УШпо вариационному принципу
S12 = 1 2 d
спин-орбитали центрированы на атомах 1 и 2
(А и В).
86.
87. Схемы перекрывания и знаки интеграла перекрывания
88.
89.
90.
91. Зависимость интеграла перекрывания некоторых типов связи от межъядерного расстояния
92. Часть 4. Неэмпирические методы расчета. Основные приближения
Кратко93. Вариационный принцип
Приближенный метод решения УШМинимизация энергии
«Основа» для дальнейших методов решения УШ
94.
95. Одноэлектронное приближение (приближение независимых частиц)
Электроны неразличимыЭлектрон i имеет энергию ei и его состояние
описывается ВФ ψi(ri) – одноэлектронной ВФ
или орбиталью (АО)
Решения УШ для каждого электрона
Одноэлектронный оператор Гамильтона
ССП
hi
2
2
Ze
2
i
2m
4 0 ri
j
N
e2
4 r
0 ij
,
j
96.
Для того, чтобы провести усреднение <…>,надо уже знать функции, описывающие
электроны
j i! Как это сделать?
Задаются некоторым набором N
одноэлектронных функций 0j(rj),
максимально близких к правильным fj(rj).
С их помощью вычисляют интеграл
e
4 r
0 ij
2
2
(
r
)
j
j
2
dv j
e
4 0 rij
j
97.
и строят оператор (h0i)ССП. Затем решаютнабор одноэлектронных уравнений Хартри.
Полученные решения 1j(rj) используют,
чтобы построить "исправленный" оператор
(h1i)ССП, вновь решают систему уравнений, но
теперь – с (h1i)ССП и т.д.
Этот процесс называется самосогласованием,
а результирующее поле –
самосогласованным полем.
98. ССП (метод Хартри)
Межэлектронным отталкиванием непренебрегают, но действие на каждый
электрон всех остальных электронов
заменяют средним полем, создаваемым
ядром и остальными электронами.
Вводят эффективный
электронный потенциал.
Это сохраняет одноэлектронное приближение.
99. ЦП
Поправка на атом водорода«Форма» того самого поля
100. Детерминант Слейтера
Электроны обладают собственным моментомколичества движения (спином), который в
единицах ħ равен . Чтобы учесть наличие
спина, в аргумент одноэлектронных функций
вводят спиновую переменную s, а функцию i
(xi) называют спин-орбиталью (xi = ri | si).
Наличие
спина приводит к специальным
ограничениям на электронную волновую
функцию, известным как принцип Паули.
101.
Заполнение электронами состояний любого атомапроисходит в порядке возрастания их энергий согласно
принципа Паули и каждое состояние может быть
занято либо одним, либо двумя электронами. В
последнем случае электроны обязательно имеют
противоположные спины и называются спаренными.
Электронная волновая функция системы из нескольких
электронов должна быть антисимметричной (менять
знак) относительно обмена положениями и спинами
пары из любых двух электронов i и j:
(x1 ,...x i ,...x j ,...) (x1 ,...x j ,...x i ,...)
Никакие два электрона не могут быть в одном и том же
квантовом состоянии (принцип исключения).
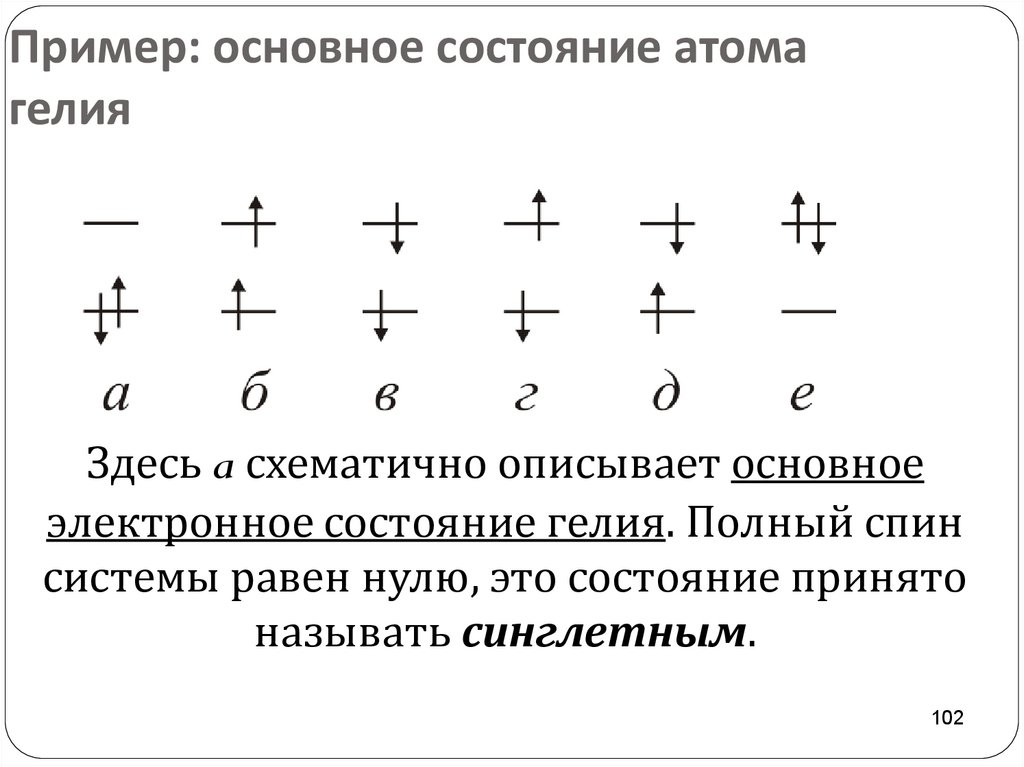
102. Пример: основное состояние атома гелия
Здесь a схематично описывает основноеэлектронное состояние гелия. Полный спин
системы равен нулю, это состояние принято
называть синглетным.
102
103.
Состояния и соответствующие им АО с одинаковымиквантовыми числами n и l заполняются так, чтобы
суммарный спин электронов был максимален (правило
Хунда); сначала заполняется максимальное число АО с
разными m.
Последовательность заполнения АО для нейтральных
атомов в основном состоянии:
1s < 2s < 2p < 3s < 3p < 4s ~ 3d < 4p < 5s ~ 4d
Порядок заполнения атомных орбиталей обусловлен не
отношением их энергий, а требованием минимума
полной энергии атома, которая отлична от суммы
одноэлектронных энергий.
104.
Пример: атом гелия (2 электрона). Двеэквивалентных волновых функции Хартри
для этой системы имеют вид:
1 1 ( x1 ) 2 ( x 2 )
2 1 ( x 2. ) 2 ( x1 )
Ни одна из них не является
антисимметричной. Однако связанная с
ними функция
1
2
[ 1 (x1 ) 2 (x 2 ) - 1 (x 2 ) 2 (x1 )]
105.
антисимметрична (коэффициент).
1
– нормировочный
2
Если мы
попытаемся
поместить электроны 1 и 2 на одну и ту
же спин-орбиталь i, то получим:
.
1
[ 1 (x1 ) 2 (x 2 ) - 2 (x 2 ) 1 (x1 )] 0
2
Значит, волновая функция в этом виде
удовлетворяет принципу исключения Паули.
106.
С математической точки зрения волноваяфункция есть детерминант из спинорбиталей i(х):
1 1 (x1 ) 2 (x1 )
2. 1 (x 2 ) 2 (x 2 )
Важным
свойством
детерминанта
является то, что он меняет знак при
перестановке двух любых его столбцов или
строк; величина его при этом остается
неизменной.
107.
Принцип Паули диктует, что две спинорбитали с одинаковымипространственными частями (т.е. с
одинаковыми n, l, m) отличаются только
спиновыми компонентами. Каждую спинорбиталь i(x) можно представить в виде
произведения пространственной орбитали
i(r) и спиновой функции (s):
i(x) = i(r) (s)
108.
Волновая функция основного состояния атомаHe:
1 1 (r1 )a( 1 ) 1 (r2 )a( 2 )
a
2 1 (r1 ) ( 1 ) 1 (r2 ) ( 2 )
a (1) a (2)
1
(r1 ) 1 (r2 )
(1) (2)
21
где функция
1 (r1 ) (1s).
Функция a имеет симметричную
пространственную часть и антисимметричную
спиновую.
109. Антисимметричная полная ВФ – детерминант Слэтера
(r1 , s1 , r2 , s2 , , rN , s N ) (1,2, , N )1
N!
1 1 1 1
1 2 1 2
2 1 2 1
2 2 2 2
N 1 N 1
N 2 N 2
1 N 1 N 2 N 2 N N N N N
электроны
Спин-орбитали
109
110.
Детерминант Слейтера - единственнаяфункция, обеспечивающая
антисимметричность волновой функции,
записанной через орбитали (орбитальное
приближение). Следовательно, он дает
.
только одно решение соответствующих
одноэлектронных уравнений. Каждый
электрон описывается "своей" волновой
функцией.
111.
Системы, в которых все электроны занимаюторбитали попарно, называются системами с
закрытыми (замкнутыми) электронными
оболочками. Для таких систем детерминант
Слейтера состоит из дважды занятых
электронами орбиталей, число которых равно
.
половине числа электронов.
Большинство органических молекул не заряжены
и имеют чётное число электронов, т.е. суммарный
спин всех электронов S = 0. Это т.н. основное
синглетное состояние.
Мультиплетность молекулы: 2S + 1.
112. Приближение Борна-Оппенгеймера
Решение стационарного уравнения Шредингера длямногоатомных молекул очень сложная задача. Поэтому
в квантовой химии широко применяется приближение
Борна-Оппенгеймера или адиабатическое приближение.
В его основе лежит предположение о том, что
зависимость электронной волновой функции эл от
координат ядер R параметрическая. Тогда
молекулярная волновая функция может быть записана:
(r,R)= эл(r,R) яд(R)
Это позволяет заменить стационарное уравнение
Шредингера (УШ) двумя другими уравнениями, которые
решаются последовательно.
113.
Это позволяет заменить стационарное уравнениеШредингера (УШ) двумя другими уравнениями,
которые решаются последовательно.
На первом этапе решают электронное УШ:
Нэ эл(r,R)= U(R) эл(r,R),
где
Нэ = Tэл + Vяя + Vяэ + Vээ
От молекулярного гамильтониана (4.2) НЭ
отличается отсутствием кинетической энергии ядер
TЯ. Электронная энергия U(R) в (4.4) зависит от
координат ядер, как от параметров.
114.
На втором этапе решают ядерное УШ:[Tя + U(R)] яд(R) = Е яд(R)
Tя - кинетическая энергия ядер. Электронная
энергия U(R) называется адиабатическим
потенциалом: она играет роль потенциальной
энергии.
Полученная в результате решени полная энергия Е
представляет собой весьма хорошее приближение к
энергии, получаемой при решении стационарного
уравнения Шредингера.
115. Метод Хартри-Фока
Вместо привычного нам оператора гамильтона Нпоявляется оператор Фока F (фокиан). Фокиан – это
Н с учетом ССП.
именно тут вводится атомная система единиц
Хартри для простоты записи
уравнения Хартри-Фока (см стр 109-112 и раздатки)
Важно: метод учитывает обменную корреляцию, но
не учитывает Кулоновскую (из-за ПНЧ). Важно
понимать, что корреляция имеет несколько
составляющих, поэтому говорить, что метод ХФ не
учитывает корреляцию вообще будет неправильно.
116. Недостатки метода Хартри-Фока-(Рутана)
Взаимодействие между электронамирассчитывается приближенно (вводится
эффективный потенциал). Электроны движутся
независимо друг от друга. Т.е. не учитывается
электронная корреляция (та, что есть на малых
расстояниях от ядра. Но учитываем ХФкорреляцию, т.к. есть детерминант Слейтера)
E = EHF + Ecorr
EHF обычно составляет ≈ 99 % от E.
Релятивистский характер движения электронов не
учитывается (важно для быстрых электронов
внутренних оболочек тяжелых атомов).
117. Метод Хартри-Фока для молекул
Приближение Борна-Оппенгеймера ядернаягеометрия фиксирована
Волновая функция – детерминант Слэтера,
составленный из занятых МО (φ1, ..., φN)
Уравнения Хартри-Фока:
Fφi = εi φi
Метод Хартри-Фока-Рутана.
Базисные функции, обычно центрированы на атомах
(Атомные Орбитали).
АО «образуют» базис для представления МО.
Из МО (а значит, из АО) строится полная электронная ВФ.
Все уравнения записываются с помощью базисных функций.
118. Приближение МО ЛКАО
Молекулярная Орбиталь –Линейная Комбинация Атомных Орбиталей:
M
φi r c μi μ r
1
M атомных орбиталей (АО) χμ называются
базисным набором (базисом),
сμi – коэффициент при АО χμ в i-й МО
119. Часть 5. Базисные наборы и базисные функции
Что это такое, зачем это нужно, как считать, а также,почем нельзя обойтись без них
120.
Мы много говорили об орбиталях и ВФ, которые ихописывают. Возникает вопрос: а как выглядят эти
самые функции?
Их вид НЕ ЗАДАЕТСЯ «по умолчанию», он не
определен методом и т.д.
Вид функций, по сути, определяем мы сами перед
началом расчета, выбирая, т.н. БАЗИС
БАЗИС – некоторый набор функций, линейная
комбинация которых между собой позволяет нам в
полной мере описать исследуемую систему
Что же это все значит?
Как понять, какой базис взять?
121. Выбор базисных АО χ
Mφi r c iμ μ r
1
Должны давать хорошее приближение к истинной
ВФ (например, возле ядер и на больших расстояниях
от них);
Должны допускать аналитическое вычисление
интегралов;
Полное число базисных функций не должно быть
слишком большим.
122.
АО состоит из угловой и радиальной частей.В качестве угловой части используются
сферические гармоники Ylm – они одинаковы для
каждого типа АО.
Поэтому задание базиса АО — задание радиальных
частей АО.
Традиционно используются 2 типа базисных наборов
АО:
ОСТ (STO) – орбитали слейтеровского типа
ОГТ (GTO) – орбитали гауссова типа
123. OCT (STO) – орбитали Слейтеровского типа
Функции STO – точные решения для радиальныхчастей орбиталей водородоподобного атома.
~e
a r
Имеют «правильное» поведение как вблизи ядра, так и на больших расстояниях
от него. Но не подходят для быстрого вычисления двухцентровых интегралов.
ОГТ (GTO) – орбитали Гауссового типа
~e
a r 2
•Допускают быстрое вычисление интегралов (более удобны в
вычислениях).
•Не имеют физического смысла.
•Неправильные асимптотики
(r→0 и r→∞).
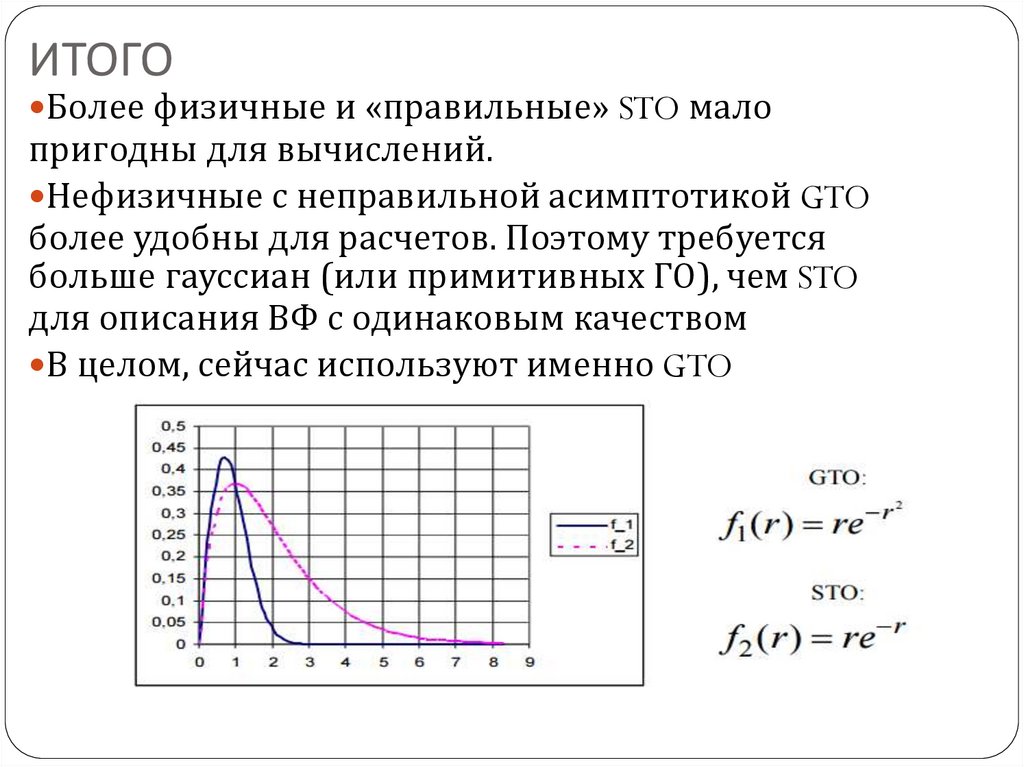
124. ИТОГО
Более физичные и «правильные» STO малопригодны для вычислений.
Нефизичные с неправильной асимптотикой GTO
более удобны для расчетов. Поэтому требуется
больше гауссиан (или примитивных ГО), чем STO
для описания ВФ с одинаковым качеством
В целом, сейчас используют именно GTO
125. Номенклатура базисных наборов
STO-nGПытаемся с помощью GTO описать STO.
Отсюда обозначения STO-nG.
n – число гауссиан (примитивов) в разложении
(экспоненты одинаковы для функций с одним и тем
же главным квантовым числом, т.е. для 2s и 2p)
Базисные наборы строим из линейных комбинаций
(т.е. из контрактированных) GTO
g i aij G j
Пытаемся с помощью GTO описать STO.
Отсюда обозначения STO-nG.
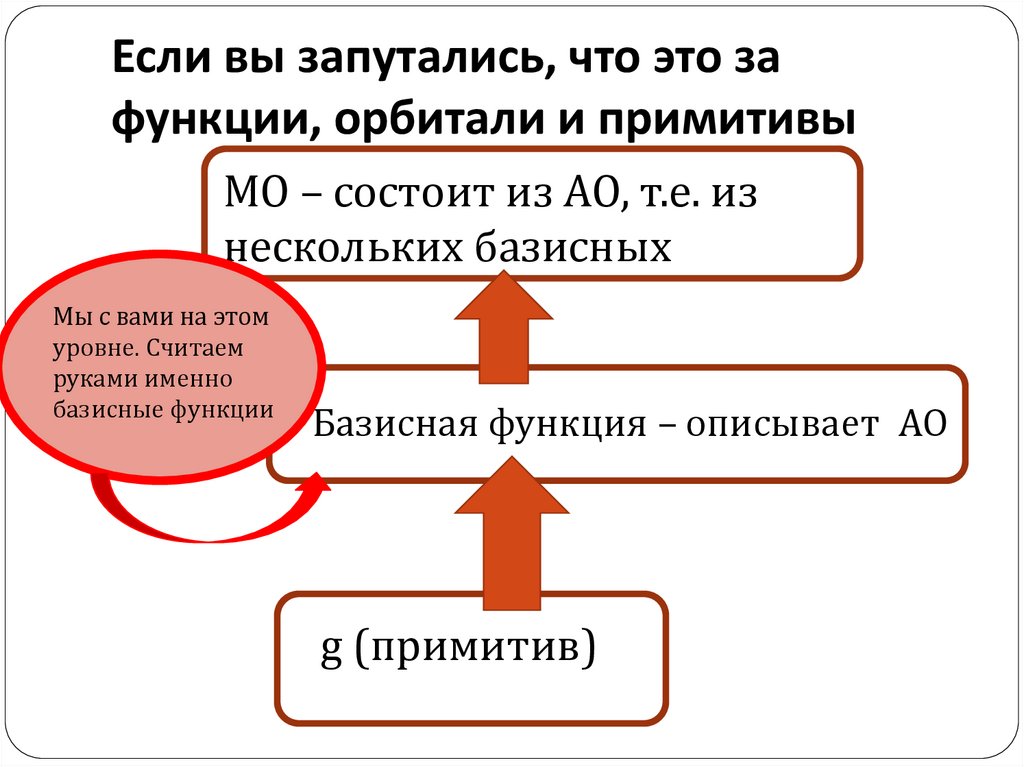
126. Если вы запутались, что это за функции, орбитали и примитивы
МО – состоит из АО, т.е. изнескольких базисных
Мы с вами на этом
уровне. Считаем
руками именно
базисные функции
Базисная функция – описывает АО
g (примитив)
127. Минимальный базисный набор
Тут все просто -одна функция на пару электроновостова и одна функцию на каждую валентную АО в
основном состоянии.
Н – 1s
1 АО/атом
Li-Ne – 1s, 2s, 2px, 2py, 2pz 5 АО/атом
Синоним – одноэкспонентный (SZ)
Такое же количество функций будет в любо базисе
типа STO-ng и GTO-ng.
Не важно, что стоит вместо n, потому что n
определяет число примитивов, а мы с вами
определяем число базисных фуункций
128. Расширенные базисные наборы
Используя две, три и т.д. функций на одну АО:можно добиться лучшего описания МО.
Соответственно, различают двух- (DZ),
трехэкспоненциальный (TZ) и т.д. базисы.
Простое удвоение/утроение от минимального
базисного набора для любого атома
•Валентно-расщепленные базисные наборы
•Добавление поляризационных и диффузных
функций
•Корреляционно-согласованные базсиные
наборы
•Плосковолновые базисные наборы































































































 chemistry
chemistry