Similar presentations:
Фазовые превращения
1. ФАЗО-ВЫЕ ПРЕВРА-ЩЕНИЯ
ФАЗОВЫЕПРЕВРАЩЕНИЯ
2. Домашнее задание
M M1 M 22.180. v N A a ,
v
v
2
4 cos 1 1
6.303. gh cos , h1
r
g d1 d2
2
2
2.189. gh , h
r
gr
3
3.
2p0
p gh,
r /
3
r 2
1
p0
p, 3
r
r /
2
1
3
r
1
p 1 3 gh
4.
1 21 1
h
3 p 1 3
g r
5. Внутренняя энергия
t Q TdS dU pV ; dU TdS pdV ; U S,VU
U
dU
dS
dV ;
S V
V S
U
U
T
, p
;
S V
V S
U S pdV A, UV TdS Q
6. Свободная энергия (потенциал Гельмгольца)
F U TS; d F pdV SdT ; F V,TF
dF
V
F
V
F
T
T
F
dV
T
T
F
p,
T
dT ;
V
S ;
V
pdV A
7. Свободная энергия (потенциал Гельмгольца)
• Функция состояния с размерностью энергии(термодинамический потенциал)
• Естественными переменными являются V и
T
• Изменение при постоянной температуре
равно работе над системой
• Минимум соответствует равновесному
состоянию при данных температуре и
объеме
8. Вводная информация
S площадь,поверхностное натяжение
9. Вводная информация
(2)F
T1
pdV A12 (T1 ) S ,
(1)
Qн q(T1 ) S
(4)
F
T2
pdV A34 (T2 ) S ,
(3)
A23 , A41
A34 , A12
T1 T2 A34 A12
T1
Qн
10.
T1 T2 (T2 ) S (T1 ) ST1
q S
q (T2 ) (T1 )
T1
T1 T2
q(T1 ) T1
11.
12.
Q q 2TQ
2T
S
2
T
T
U Q A Q F 2T 2 2 T
13. Агрегатные состояния
• Твердое телоАморфное состояние
(метастабильное состояние твердого тела
или жидкость с очень большой вязкостью)
• Жидкости
Жидкие кристаллы
• Газы
14. Агрегатные состояния II
• Пазма (99.9% массы вещества вовселенной)
15. Агрегатные состояния III
()
10 кг / м
18
3
16. Изотермы реальных газов
17. Фазовые диаграммы
18. Фазовая диаграмма воды
19. Фазы льда
http://4108.ru/u/led_-_fazyi_lda20. Диаграмма состояния железо - цементит
Диаграмма состояния железо цементит21.
22. Потенциал Гиббса
G F pV ; dG Vdp SdT ; G p,TG
G
dG
dp
dT ;
p T
T p
G
G
V,
S;
p T
T p
G
Q TdS Td
T
p
23. Потенциал Гиббса
• Функция состояния с размерностью энергии(термодинамический потенциал)
• Естественными переменными являются p и
T
• Минимум соответствует равновесному
состоянию при данных температуре и
давлении
24. Проверочная работа
Методом циклов получить уравнениеКлапейрона-Клаузиуса: наклон кривой
фазового перехода на pT-диаграмме
dp
q
,
dT T v
q – удельное тепло перехода, v – разность
удельных объемов.
25.
qжгdp
dT T vж vг
(2)
A12
dV
p
p(T1 ) vг vж , Qн qm
m (1) m
(4)
A12
dV
p
p(T2 ) vг vж , A23 , A41
m (3) m
A34 , A12
T1 T2 A34 A12 p(T1 ) p(T2 ) vг vж m
T1
Qн
Qн
p(T1 ) p(T2 )
q
T1 T2
T1 vг vж
26. Удельная теплота парообразования/конденсации
ВеществоТемпература кипения, С
кДж/кг
Вода
100
2260
Водород
−252,6
448
Азот
−195,8
199
Диэтиловый эфир
34,6
380
Этиловый спирт
78,4
837
Ртуть
357
282
Свинец
1740
855
Медь
2600
4820
Железо
3200
6120
Алюминий
2450
10900
27.
ВеществоУдельная теплота плавления (кДж/кг)
Алюминий
390
Железо
247
Золото
67
Лёд
330
Медь
213
Нафталин
151
Олово
60,7
Платина
101
Ртуть
12
Свинец
25
Серебро
105
Цинк
112
Чугун (белый)
130
Чугун (серый)
100
28. Уравнение Клапейрона-Клаузиуса
Gж p, Tg ж p, T
mж
g г p, T
Gг p, T
mг
gж p0 , T0 gг p0 , T0 0
DK : gж p, T gг p, T
29.
dg ж vж dp sж dTdg г vг dp sг dT
0 dg ж dg г vж vг dp sж sг dT
qжг
dT
vж vг dp sж sг dT
T
qжг
dp
dT T vж vг
30. Первые производные потенциалов
UU
T,
p
S V
V S
H
H
T,
V
S p
p S
F
T
V
F
S ,
V
p
T
G
G
V,
S
p T
T p
31. Важный аспект метода потенциалов
P( x, y ), dP Q( x, y )dx R( x, y )dyQ
Q
R
R
dQ
dx
dy, dR dx dy
x
y
x
y
P
Q
y x y x
P
R
x y x
x
y
y
x
y
32.
U Q A; dU TdS pdVU T
S V V
2
H U pV ;
S
p
S
p
dH TdS Vdp,
H T
V
S p p S S
2
p
33. 6.324 методом термодинамических потенциалов
34. 6.324 методом термодинамических потенциалов
d F pdV SdT T d ; F V,T,F
2
F
,
T V T
VT
S
VT
1 Q
q
T VT
T
35.
36.
qг жdp qг ж
,
dT Tvг T RT
Mp
Mqг ж
ln p ln C
,
RT
1 dp Mqг ж
,
2
p dT
RT
Mqг ж
p C exp
RT
37.
38.
39.
qmQн qm S
Tкип
m
m
A p V RTкип RTкип
M
M
m
U Q A qm RTкип
M
40.
41.
qг жdp qг ж
,
dT Tvг T RT
Mp
d ln p Mqг ж
,
2
dT
RT
RT 2
qг ж
M
1 dp Mqг ж
p dT
RT 2
qг ж
RT 2 d ln p
M dT
a b R
2 a bT
T T M
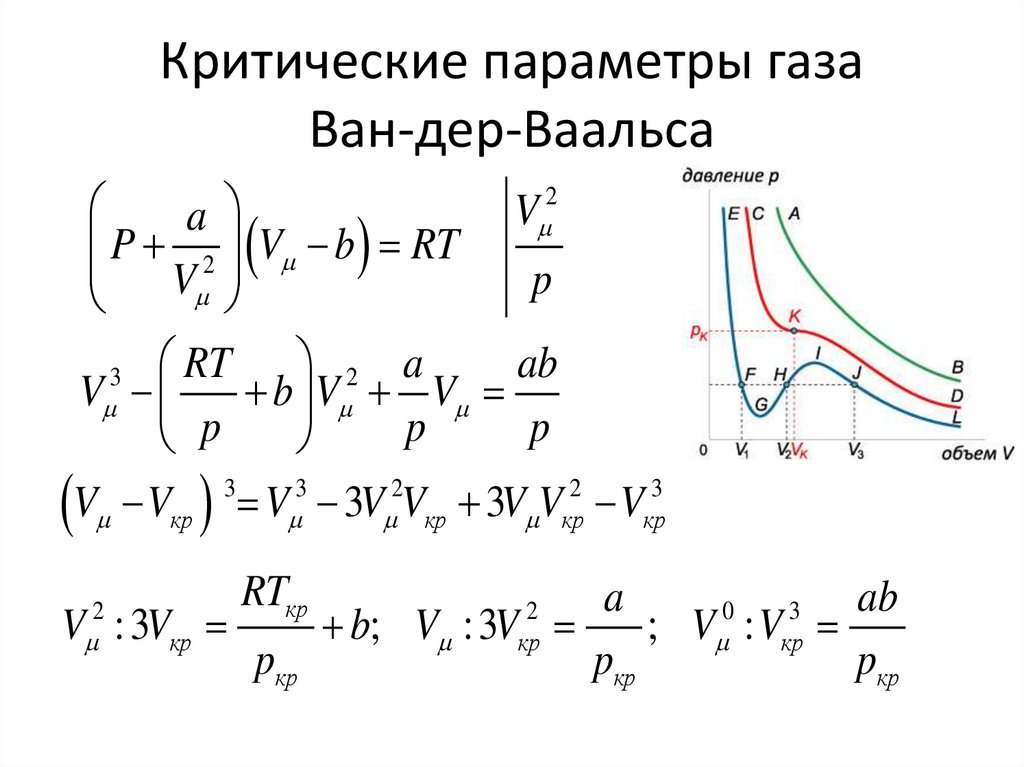
42. Критические параметры газа Ван-дер-Ваальса
2V
a
P 2 V b RT
p
V
2 a
ab
3 RT
V
b V V
p
p
p
3
3
2
2
3
V
V
V
3
V
V
3
V
V
V
кр кр кр кр
V : 3Vкр
2
RTкр
pкр
a
ab
0
3
b; V : 3V
; V : Vкр
pкр
pкр
2
кр
43.
V : 3Vкр2
RTкр
b
pкр
a
2
V : 3Vкр
pкр
ab
0
3
V : Vкр
pкр
a
8a
Vкр 3b; pкр
; Tкр
2
27b
27 Rb
a 3p V ; b
2
кр кр
Vкр
3
; Ri
8 pкрVкр
3Tкр
R




























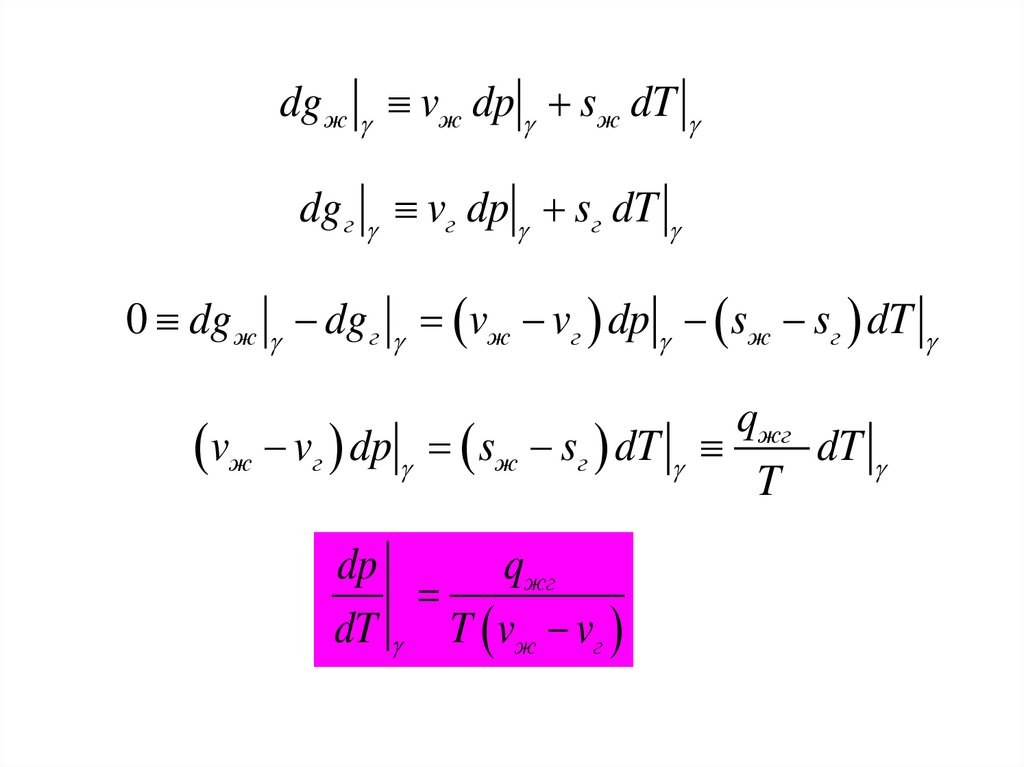


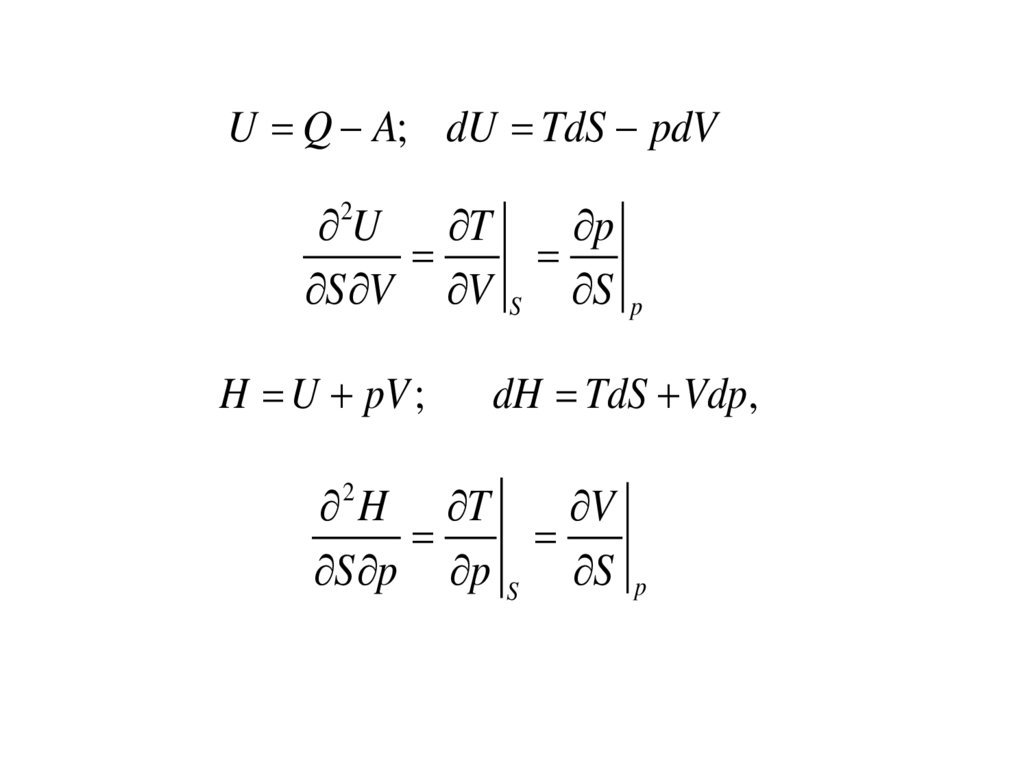










 physics
physics








