Similar presentations:
Спирты, карбоновые кислоты
1. Спирты, карбоновые кислоты
Производные углеводородов2. Цели урока:
• Познакомиться с понятием«функциональная группа»;
• Познакомиться с классом спиртов, кислот;
• Выяснить отличительные черты данных
классов веществ;
• Научиться писать реакции, характерные
для спиртов и кислот;
3. Понятие функциональной группы
Функциональная группа совокупность атомов, определяющаяхарактерные химические свойства
данного класса веществ.
4. Напишите структурную формулу метана и один атом водорода замените на -ОН группу:
СН3 – ОН5. Спирты – органические вещества, в молекулах которых содержится одна или несколько гидроксогрупп (-ОН)
6. Классификация спиртов
По числу гидроксильных групп:• одноатомные
(одна группа -ОН)
• многоатомные
(две и более групп -ОН)
7. Классификация спиртов
• По строению радикалов:• предельные (например, СH3CH2OH)
• непредельные, (CH2=CH–CH2–OH)
• ароматические (C6H5CH2–OH)
8. Общая формула предельных одноатомных спиртов:
СnH2n+1ОН илиR–OH,
где R - радикал
9. Названия предельных одноатомных спиртов
1. По названию углеводорода с добавлениемсуффикса -ол и цифры, указывающей положение
гидроксогруппы
Нумерация ведется от ближайшего к ОН-группе
конца цепи.
2. От названий радикалов с добавлением слова
"спирт". приведенные выше соединения называют:
метиловый спирт, этиловый спирт, н-пропиловый
спирт, изопропиловый спирт.
10. Напишите и назовите спирты с
1 вариант: 4 атомами углерода;2 вариант: 5 атомами углерода;
1 вариант: СН3 – СН2 – СН2 – СН2 – ОН
(С4Н9ОН – бутанол или бутиловый спирт)
2 вариант: СН3 – СН2 – СН2 – СН2 – СН2 ОН (С5Н11ОН) – пентанол или амиловый
спирт
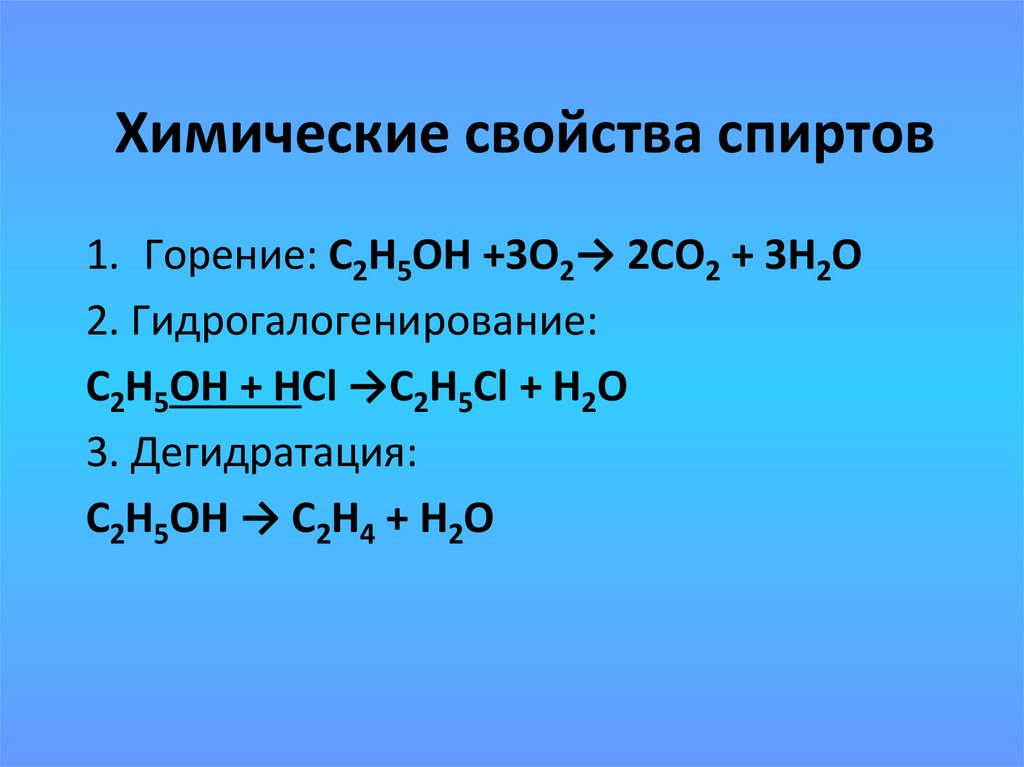
11. Химические свойства спиртов
1. Горение: С2Н5ОН +3О2→ 2СО2 + 3Н2О2. Гидрогалогенирование:
С2Н5ОН + НСl →С2Н5Cl + H2O
3. Дегидратация:
С2Н5ОН → С2Н4 + H2O
12. Карбоновые кислоты
- органические соединения, содержащиеодну или несколько карбоксильных
групп или
(-СООН),
связанных с углеводородным
радикалом
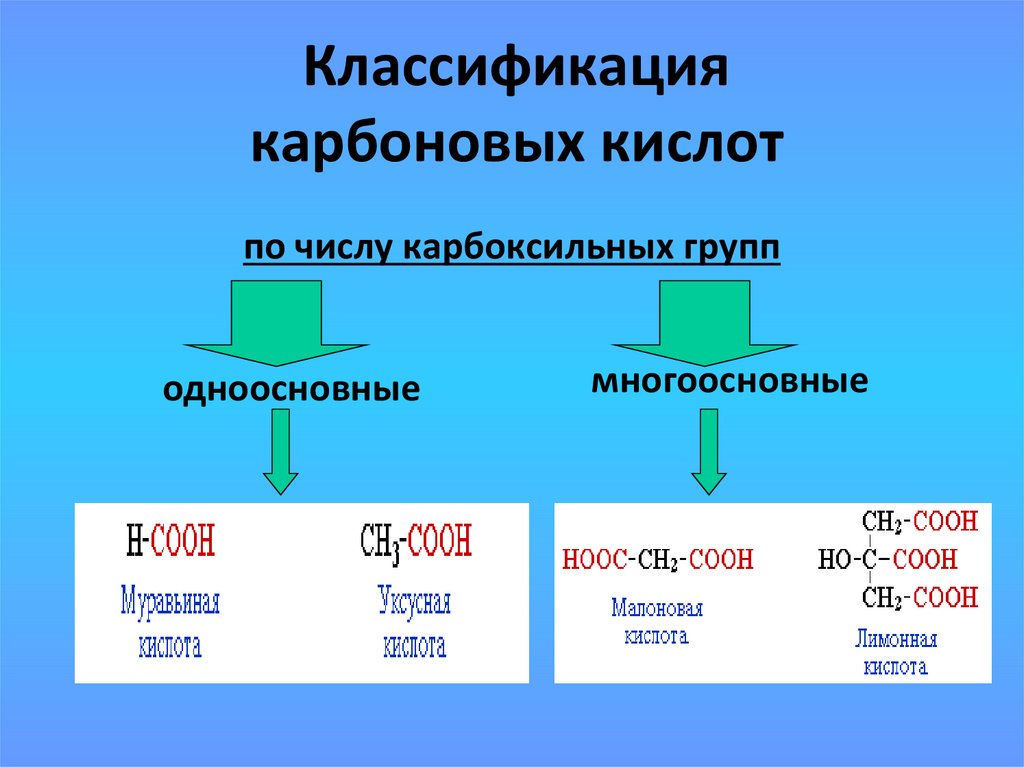
13. Классификация карбоновых кислот
по числу карбоксильных групподноосновные
многоосновные
14. Классификация карбоновых кислот
По характеру углеводородного радикала:• предельные (например, CH3CH2CH2COOH);
• непредельные (CH2=CHCH2COOH);
• и ароматические (RC6H4COOH)
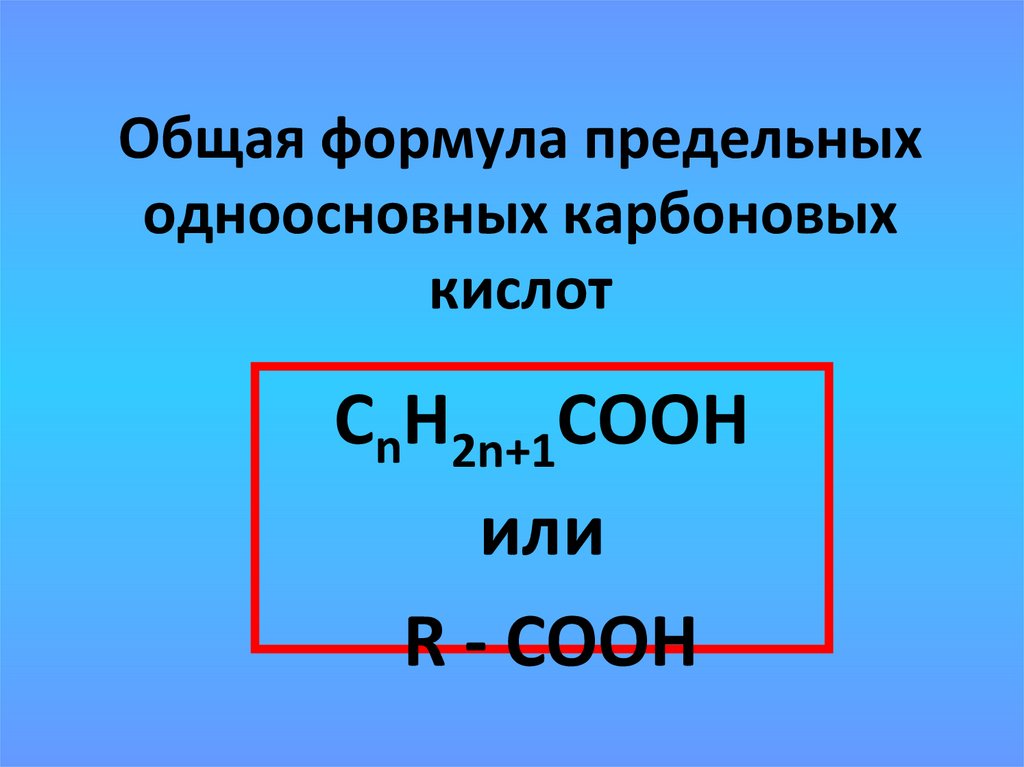
15. Общая формула предельных одноосновных карбоновых кислот
СnН2n+1СООНили
R - COOH
16. Названия кислот
• по названию соответствующегоуглеводорода с добавлением
суффикса –ов окончания -ая и
слова кислота
• тривиальные (исторические)
названия
17. Некоторые предельные одноосновные кислоты
ФормулаНазвание
систематическое
тривиальное
метановая
муравьиная
CH3COOH
этановая
уксусная
C2H5COOH
пропановая
пропионовая
HCOOH
C3H7COOH
бутановая
масляная
18. 1. Общие с неорганическими кислотами: а) С Ме: 2НСООН + FE= (НСОО)2Fe + H2↑ Б) С оксидами металлов: 2НСООН + К2О = 2НСООК + H2О
Химические свойства1. ОБЩИЕ С НЕОРГАНИЧЕСКИМИ
КИСЛОТАМИ:
А) С МЕ: 2НСООН + FE= (НСОО)2FE + H2↑
Б) С ОКСИДАМИ МЕТАЛЛОВ:
2НСООН + К2О = 2НСООК + H2О
В) С ОСНОВАНИЯМИ:
НСООН + КОН = НСООК + H2О
Г) С СОЛЯМИ, ЕСЛИ ↑/↓:
2НСООН + К2CО3 = 2НСООК + H2О + CO2↑
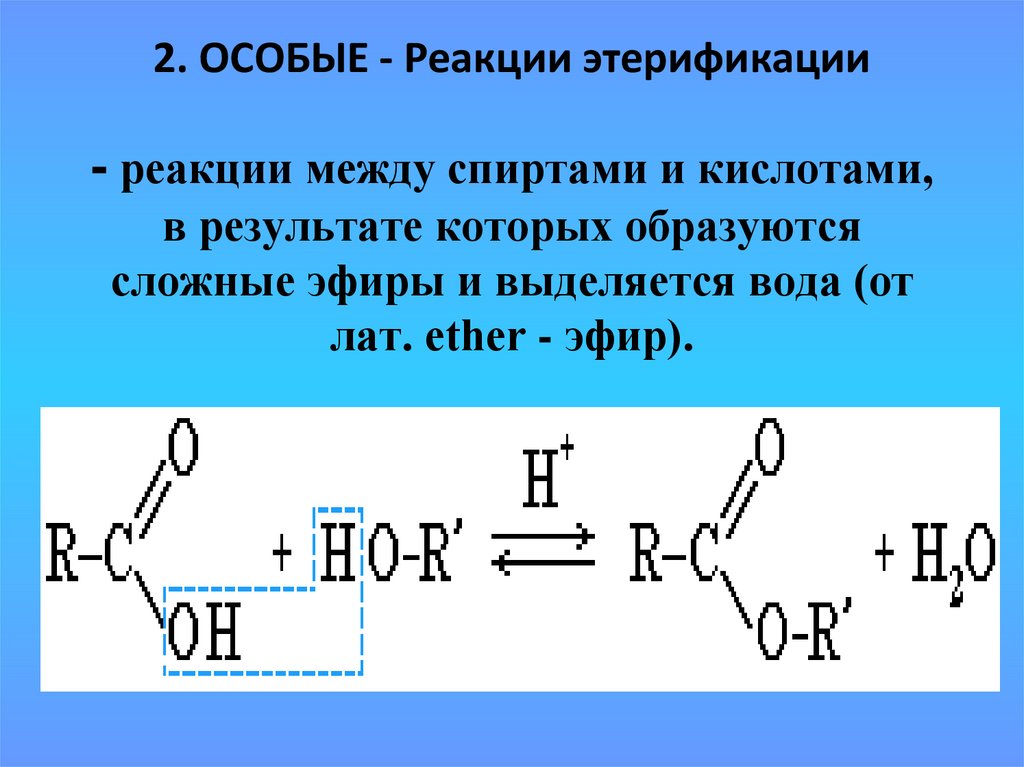
19. - реакции между спиртами и кислотами, в результате которых образуются сложные эфиры и выделяется вода (от лат. ether - эфир).
2. ОСОБЫЕ - Реакции этерификации- реакции между спиртами и кислотами,
в результате которых образуются
сложные эфиры и выделяется вода (от
лат. ether - эфир).
20. СН3СООН + С2Н5ОН = СН3СООС2Н5 + Н2О
этиловый эфир уксусной кислоты21. Назвать вещества и класс, к которому они принадлежат
Задание 1Назвать вещества и класс, к
которому они принадлежат
1 вариант:
а) С4Н8;
б) С2Н5ОН;
в) С7Н16;
г) С3Н7СООН;
2 вариант:
а) С10Н22;
б) С2Н5СООН;
в) С2Н4;
г) СН3ОН;
22. Из перечня веществ: СnН2n+1СООН; СnН2n+2; R-О-R; СnН2n; СnН2n-2;; R – COO – R; СnН2n+1ОН; выписать общие формулы
Задание 2Из перечня веществ: СnН2n+1СООН;
СnН2n+2;
R-О-R;
СnН2n;
СnН2n-2;;
R – COO – R;
СnН2n+1ОН;
выписать общие формулы
1 вариант:
а) спиртов;
б) алканов;
2 вариант:
а) кислот;
б) алкенов;
23. Домашнее задание
1. Повторяем алканы и алкены.2. п.50,51 – читать, учить записи в тетради
ПРОВЕР.Р.



















 chemistry
chemistry








