Similar presentations:
Органические соединения в атмосфере
1.
Органические соединения ватмосфере
Метан и другие углеводороды в
тропосфере
2.
К сожалению большинство из Вас не смогли правильноответить на первый вопрос самостоятельной работы.
Сравните равновесное значение концентрации оксида азота при 800
градусах Кельвина и содержание оксида азота в отходящих газах
тепловой электростанции работающей на угле.
Какая концентрация больше? Во сколько раз? Почему это происходит?
Правильный ответ.
При 800оК равновесное парциальное давление оксида азота составляет
0,23 Па. (см. пример 1).
Концентрация оксида азота в отходящих газах ТЭС 150 млн-1 (пример3).
Переведем содержание оксида азота выраженное в Па в млн-1.
3.
Рi = Pобщ.* αi ,где Рi - парциальное давление i компонента (в нашем случае NO); Pобщ. – общее давление в системе (в
нашем случае 101,3 *103Па); αi -объемная доля i компонента (в нашем случае NO).
αi = Рi/ Pобщ.
α =0.23/101,3 *103=2,27 *10-6
Сi(млн-1) = αi * 106
CNO = 2,27 *10-6 * 106 = 2,27млн-1
Содержание оксида азота в отходящих газах ТЭС будет больше равновесного при 800С в n раз.
n = 150/ 2,27= 66
4.
Содержание оксида азота в отходящих газах ТЭС будет больше равновесного при 800С в nраз.
n = 150/ 2,27= 66
Необходимо отметить что температура пара на ТЭС составляет всего 500 -600 С , при этих
температурах содержание оксида азота должно быть меньше,
23 Па, однако при сжигании угля в топке происходит образование зон перегрева.
Температура в этих зонах может подниматься до 2000С это и приводит к увеличению
концентрации оксидов азота в отходящих газах ТЭС.
Еще одной причиной является изменение механизма процесса окисления азота. Возможные
механизмы окисления мы разберем в курсе «Основы промышленной экологии».
5.
Ежегодно в атмосферу поступает 500 -550 млн. т метана иоколо 600 млн.т углеводородов, содержащих от 2 до 20
атомов углерода. Основное количество углеводородов
поступает
в
органических
атмосферу
в
результате
соединений
жизнедеятельности
животных
и
и
деструкции
в
растений.
процессе
Поэтому
локальные концентрации углеводородов в природных
условиях определяются типом и состоянием экосистем.
6.
На урбанизированных территориях заметный вклад впоступление углеводородов в атмосферу вносят процессы
сжигания
ископаемого
топлива
при
производстве
электрической и тепловой энергии и на транспорте.
Примерное
распределение
источников
поступления
метана в атмосферу по массе выбросов представлено на
следующем слайде.
7.
Доля метана, выделяющегося изразличных источников, %
8.
Процессы ферментации в желудкахкрупного рогатого скота
Этот путь поступления метана в атмосферу, в
настоящее время продолжает расширяться.
Связано это с увеличением численности
населения земли, вызывающим необходимость
роста численности крупного рогатого скота.
Путь
снижения метаногенеза у жвачных
животных, есть – это , например, использование
вторичных
метаболитов
растений
для
ингибирования метаногенеза.
Однако эти исследования находятся лишь в
начале своего развития.
9.
Содержание метана в воздухенад
природными
и
урбанизированными
территориями
примерно
одинаково.
Содержание
более
тяжелых
углеводородов больше в воздухе
природных
территорий,
поскольку
многие из них
выделяются
в
атмосферу
растительностью.
Значительные
количества
терпеновых
углеводородов
поступает
в
атмосферу
в
хвойных лесах.
10.
Окисление углеводородов в атмосфереФотохимическое окисление метана и его гомологов в
тропосфере протекает в основном по радикальному
механизму. На первой стадии при взаимодействии с
гидроксильным радикалом происходит образование
соответствующего алкильного радикала:
R-CH3 + OH = R-CH2 + H2O
11.
В случае метана образовавшийся на первой стадииметильный радикал при столкновении с молекулой
кислорода, в присутствии третьего тела, дает другую
неустойчивую частицу - метилпероксидный радикал:
CH3 + O2 + M = CH3OO + M*
Метилпероксидный радикал в атмосфере разлагается
с образованием метоксидного радикала по реакции:
2CH3OO = О2 + 2 СН3О
12.
Возможными являются и процессы взаимодействия соксидом азота или гидропероксильным радикалом:
CH3OO + NO = СН3О + NO2
СН3ОО +НО2 = СН3О + ОН
Следует обратить внимание на тот факт, что в этом
случае окисление оксида азота происходит без участия
озона.
13.
При взаимодействии метокcидного радикала с кислородомпроисходит образование формальдегида и гидропероксидного
радикала, который может вызвать окисление оксид азота без участия
озона:
СН3О + O2 = СН2О + НО2
NO + HO2 = NO2 + ОН
Молекулы CH2О значительно более устойчивы в атмосфере и более
токсичны, чем исходный метан и являются промежуточным
продуктом окисления метана.
Соответствующие альдегиды, образующиеся при окислении
углеводородов, гомологов метана, так же более токсичны и устойчивы
в атмосфере, чем исходные соединения.
14.
Молекулы формальдегида могут подвергнуться фотолизу припоглощении света в ближней ультрафиолетовой области:
CH2O + h = НСО + Н
Реагируя с ОН - радикалом, формильный радикал образует оксид
углерода, который является еще одним устойчивым и токсичным
промежуточным продуктом окисления метана и его гомологов:
НСО + ОН = СО +Н2О
Оксид
углерода
при
взаимодействии
с
гидроксильным
радикалом образует диоксид углерода, который является конечной
стадией окисления метана и его гомологов в атмосфере:
СО + ОН = СО2 + Н
15.
Процессывторичного
загрязнения
атмосферы
Необходимо отметить, что в процессе окисления органических
соединений в атмосфере, протекающем через ряд последовательных
стадий,
происходит
образование
органических
радикалов,
отличающихся высокой реакционной способностью и малым
временем
жизни
в
атмосфере,
и
достаточно
устойчивых
промежуточных продуктов окисления, которые часто являются
значительно более токсичными соединениями, чем исходные
вещества. Этот процесс часто называют процессом вторичного
загрязнения атмосферы.
:
16.
В случае окисления метана в присутствии оксидов азота цепочкупревращений можно представить следующими реакциями
CH4 + OH CH3 +H2 O
CH3 + O2 CH3 OO
CH3 OO + NO CH3 O + NO2
CH3 O + O2 CH2 O + HO2
HO2 + NO NO2 + OH
CH2 O +OH H2 O + HCO
HCO + O2 HO2 + CO
HO2 + NO NO2 + OH
CO +OH CO2 + H
H + O2 HO2
HO2 + NO NO2 + OH
4(NO2 + h ) 4(NO+O)
4(O + O2 + M) 4 O3 + 4М*
-------------------------------------------------Суммируя все реакции, получим:
CH4 + 8 O2 + 4 М = CO2 + 2Н2О + 4М* + 4 O3
17.
Или, выделяя более устойчивые продукты окисления:CH4 + OH CH3 +H2 O
CH3 + O2 CH3 OO
CH3 OO + NO CH3 O + NO2
CH3 O + O2 CH2 O + HO2
HO2 + NO NO2 + OH
CH4 + 2O2 CH2 O + H2O + 2O3
CH2 O +OH H2 O + HCO
HCO + O2 HO2 + CO
HO2 + NO NO2 + OH
CH2 O + 2O2 CO +H2O +O3
CO +OH CO2 + H
H + O2 HO2
CO + 2O2 CO2 +O3
HO2 + NO NO2 + OH
4(NO2 + h ) 4(NO+O)
4(O + O2 + M) 4 O3 + 4М*
-------------------------------------------------Суммируя все реакции, получим:
CH4 + 8 O2 + 4 М = CO2 + 2Н2О + 4М* + 4 O3
18.
ПримерКакое максимальное количество молекул озона может
образоваться в каждом кубическом сантиметре приземного
воздуха при полном окислении метана в присутствии
оксидов азота, если его концентрация уменьшилась с 20 до
1,6 млн-1. Давление равно 101,3 кПа, температура воздуха
288 К.
19.
Решение.При полном окислении метана в присутствии оксидов азота
цепочку превращений можно представить следующим
суммарным уравнением реакции:
CH4 + 8O2 + 4М = CO2 +2Н2О + 4М* + 4 O3
Таким образом, при полном окислении из каждой молекулы
метана в присутствии оксидов азота может образоваться до 4
молекул озона.
При уменьшении концентрации метана в воздухе с 20 до 1,6 млн-1
концентрация образовавшегося озона, при отсутствии его стока,
могла бы составить:
[O3] = 4 * (20 - 1,6) = 73,6 млн-1 .
20.
Таким образом, в каждом кубическом сантиметре воздуха моглообразоваться n(O3) молекул озона:
n(O3) = Na * (O3) * T0 / Vm* 10 3 * Тз (см-3),
где: Na - число Авогадро; ( O3) - объемная доля озона в воздухе, (O3)
= [O3 ] (млн-1) * 10-6; Vm - мольный объем газа при нормальных
условиях (л);
T0 и Тз - температура воздуха при нормальных условиях и средняя у
поверхности Земли, 273 и 288 К, соответственно.
n(O3) = 6,02 * 1023 * 73,6 * 10-6 * 273/ 22,4 * 103 * 288 = 18,8 * 1014 (см-3)
Ответ: в каждом кубическом сантиметре воздуха может образоваться
до 19 * 1014 молекул озона.
21.
ОРГАНИЧЕСКИЕСУПЕРЭКОТОКСИКАНТЫ
В АТМОСФЕРЕ
22.
ОРГАНИЧЕСКИЕСУПЕРЭКОТОКСИКАНТЫ
В АТМОСФЕРЕ
23.
Суперэкотоксиканты – высокотоксичный особыйкласс загрязняющих веществ
Суперэкотоксиканты
характеризуются
чрезвычайной стойкостью в окружающей среде и
практическим отсутствием предела токсичности
(сверх кумуляцией). В тех или иных концентрациях
они присутствуют во всех средах, циркулируют в них
и через компоненты окружающей среды проявляют
своё действие на человека, вызывая мутагенный,
канцерогенный эффекты, подавляя клеточный
иммунитет, поражая внутренние органы и приводя к
истощению организма.
24.
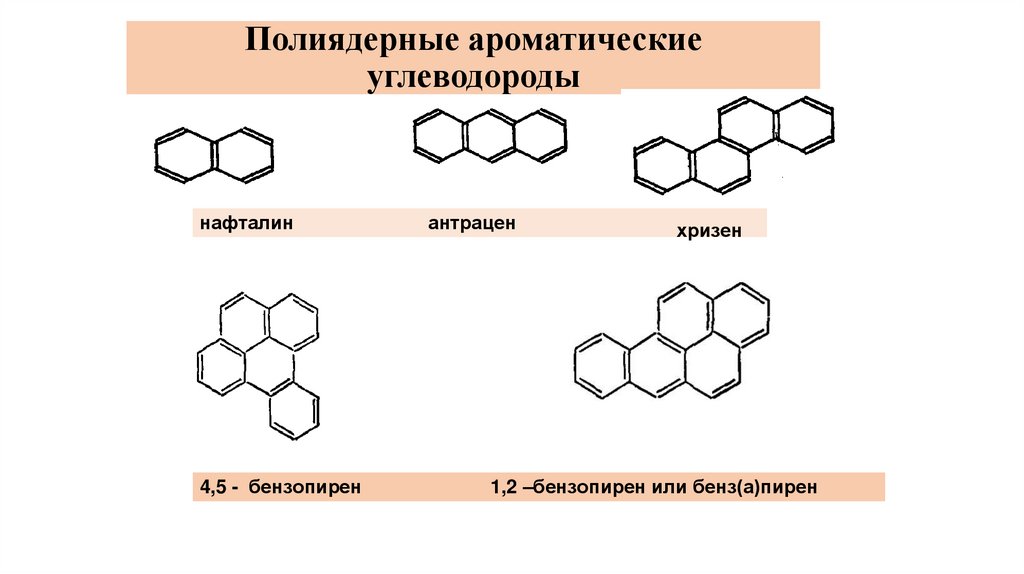
К суперэкотоксикантам относятся:- Полиядерные ароматические углеводороды (ПАУ);
- Галоген содержащие органические соединения;
- Соединения тяжелых металлов;
- Радионуклиды.
В данной лекции мы рассмотрим только
органические
соединения,
относящиеся
к
суперэкотоксикантам
25.
Полиядерные ароматическиеуглеводороды
нафталин
4,5 - бензопирен
антрацен
хризен
1,2 –бензопирен или бенз(а)пирен
26.
Присутствующие в атмосфере в газовой фазе ПАУинтенсивно поглощают излучение длиной волны 320 – 400 нм
и сравнительно быстро подвергаются трансформации с
образованием хинонов и карбонильных соединений.
Так экспериментально установлено, что в результате 20 минутного облучения ультрафиолетом (А) происходит
разложение более 30% пирена, примерно 80% антрацена и
около 50% бенз(а)пирена.
Процессы частичного окисления ПАУ приводят к
появлению в отходящих газах разнообразных
кислородсодержащих ПАУ (хинонов, спиртов, альдегидов).
В присутствии оксидов азота и озона ПАУ образуют
нитро- и кислород содержащие производные.
Так, при взаимодействии с диоксидом азота в воздухе
появляются обладающие высокой мутагенной и
канцерогенной активностью нитробензпирены, а в
присутствии озона образуются полиядерные хиноны и
гидроксипроизводные бензпирена.
27.
Галогенсодержащие суперэкотоксикантыВсе наиболее опасные из этих соединений попадают в список так
называемой «грязной дюжины», в который эксперты UNEP
выделили 12 наиболее опасных стойких органических
загрязнителей (СОЗ). В целом к СОЗ (в английском варианте –
Persistent organic pollutants (POPs) относятся вещества, которые
отвечают следующим требованиям:
Являются токсичными;
Являются устойчивыми в окружающей среде;
Способны к биоаккумуляции;
Склонны к трансграничному переносу и к накоплению в
окружающей среде;
Являются причиной значительного вредного воздействия на
здоровье человека или на окружающую среду вследствие его
трансграничного распространения.
28.
Пестициды• вещества, обладающие токсичными свойствами
по отношению к тем или иным живым
организмам – от бактерий и грибов до растений и
теплокровных животных.
• Пестициды – химические препараты,
уничтожающие вредителей сельского хозяйства.
Такие вещества применялись в небольших
масштабах и сотни лет назад, причем первые
пестициды включали соединения мышьяка,
известково-серные смеси, соли меди.
29.
ПестицидыВ настоящее время пестициды классифицируют по их
целевому назначению
• инсектициды – для уничтожения насекомых;
• гербициды – препараты против сорняков;
• фунгициды – для защиты растений от грибковых
болезней;
• родентициды – для борьбы с вредными грызунами;
• моллюскициды – для защиты растений от моллюсков;
• нематоциды – для защиты растений от круглых червей.
30.
Линдан(гексахлоран)
Элдрин
ДДТ
(дихлордифенилтрихлорметилметан)
ДДЕ
(дихлордифенилдихлорэтилен)
Диэлдрин
дихлордифенилдихлорметилметан)
Хлордан
31.
• Торговое название ДДТ• Назначение Против комаров, вредителей хлопка,
соевых бобов, арахиса
• химическое название
1,1,1-Трихлор-2,2-бис (n-хлорфенил) этан
32.
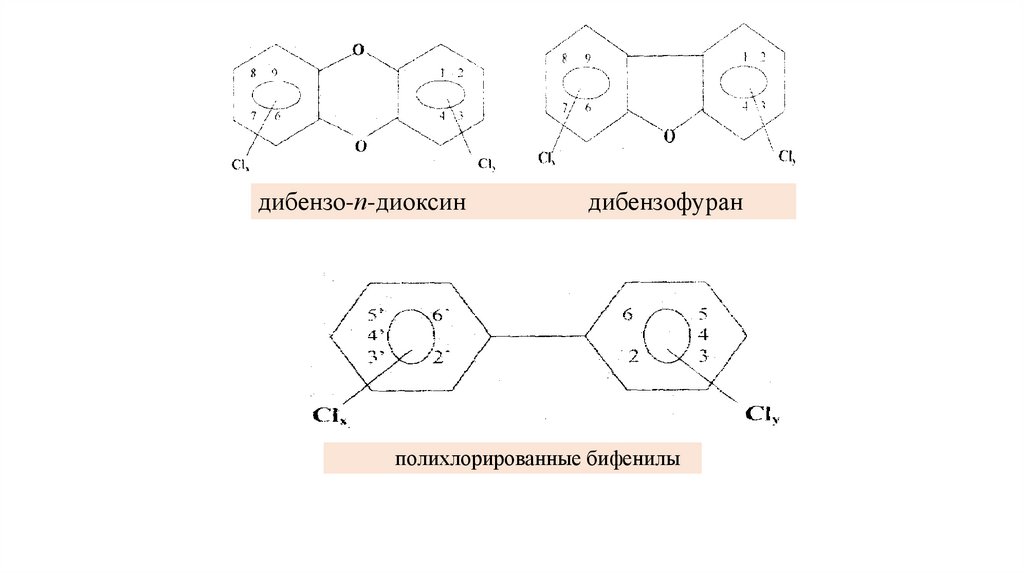
Диоксины и дибензофураныЭТО - большая группа гетероциклических полихлорированных
соединений, основу которых составляют два ароматических кольца,
соединенные, в случае диоксинов, или правильнее, дибензо-пдиоксинов (ПХДД), двумя кислородными мостиками, и, в случае
дибензофуранов
(ПХДФ),
одним
кислородным
мостиком,
содержащих от одного до 8 атомов хлора.
К этой группе хлорорганических соединений часто относят хотя и
менее токсичные, но выпускаемые в промышленных масштабах
полихлорированные бифенилы (ПХБ), в которых два бензольных
кольца непосредственно связаны друг с другом
33.
дибензо-п-диоксиндибензофуран
полихлорированные бифенилы
34.
Использование ПХБ• диэлектрические жидкости в трансформаторах и
конденсаторах, хладагентах, смазках,
стабилизируя добавки в гибких
поливинилхлоридных (ПВХ) покрытиях
электрического телеграфирования и
электронных компонентов,
• гидравлические жидкости, изоляторы
(используемый в затыкании, и т.д), пластырях,
деревянных концах этажа, краски
35.
26 мая 1971 г. в небольшом американском городке ТаймзБич (штат Миссури) на грунт ипподрома разбрызгали
примерно
10
м3
технического
масла,
чтобы
не
поднималась пыль во время скачек. Через несколько дней
ипподром был усеян трупами птиц, еще через день
заболели наездник и три лошади, а в течение июня
погибли 29 лошадей, 11 кошек и четыре собаки. В августе
заболели еще несколько взрослых и детей.
36.
Виной оказались диоксины и фураны, концентрация которых вгрунте ипподрома достигала 30-53 ppm (долей на миллион).
Техническое же масло представляло собой химические отходы
производства 2,4,5-трихлорфенола - промежуточного продукта
при производстве 2,4,5-трихлорфеноксиуксусной кислоты. Это
вещество применялось во время войны во Вьетнаме в качестве
дефолианта (гербицида, вызывающего опадание листьев),
известного под торговой маркой 2,4,5-Т ("Оранжевый реагент").
37.
Полихлорированные бифенилыядовиты
Производство ПХБ было запрещено в
1970-ых из-за высокой токсичности
большинства родственных ПХБ и смесей.
Они классифицируются как постоянные
органические загрязнители, которые
биоаккумулируются в животных.
38.
Диоксиныобладают
высокой
адгезионной
способностью, в том числе к почве, частичкам
золы и донным отложениям, что способствует их
накоплению и миграции в виде комплексов с
органическими веществами и поступлению в
воздух, воду и пищевые продукты.
39.
Уровень загрязненности женскогомолока (пикограмм на литр).
в Иордании - 48,
в Японии -30,
в США - 20,
в России - 16,
в Швеции - 22,
в Австрии и на Украине по 12 пикограмм на литр,
в Нидерландах - 30,
в Таиланде всего 3.
40.
Источникамисреды
загрязнения
диоксинами
продукты
окружающей
являются
побочные
целлюлозно-бумажной
промышленности, отходы металлургической
промышленности,
автомобилей,
выхлопные
газовые
выбросы
газы
из
источников, связанных со сжиганием отходов
и шламов, содержащих хлорорганические
вещества.






































 chemistry
chemistry








