Similar presentations:
Планетарная модель атома
1.
Планетарная модельатома
2.
ДЕМОКРИТ(около 460 до н.э. – 370 до н.э)
«Существует предел деления –
атом, не подверженное никаким
изменениям»
АРИСТОТЕЛЬ
(384 до н.э. – 322 до н.э)
«Делимость вещества
бесконечна»
3.
Ломоносов Михаил Васильевич(8/19.11.1711 - 4/15.04.1765 )
Все вещества состоят из «корпускул» —
«молекул», которые являются
«собраниями» «элементов» —
«атомов»: «Элемент есть часть тела, не
состоящая из каких-либо других
меньших и отличающихся от него тел...
Учёный указывает на шарообразную
его форму. Именно М. В. Ломоносову
принадлежит мысль о «внутреннем
вращательном движении частиц».
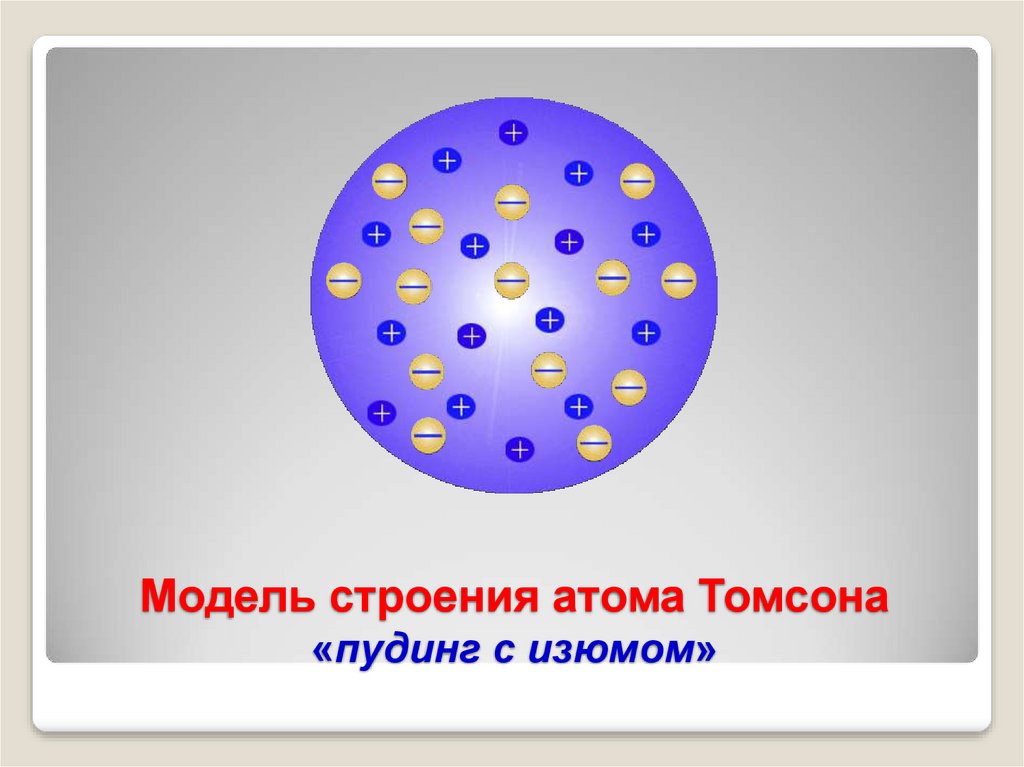
4. Модель строения атома Томсона
Атом – шар, по всему объёмукоторого равномерно
распределён положительный
заряд.
Внутри шара находятся
электроны.
Каждый электрон может
совершать колебательные
движения только около
своего положения равновесия.
Положительный заряд шара
равен по модулю суммарному
заряду электронов, поэтому
заряд атома в целом равен
нулю.
5. Модель строения атома Томсона «пудинг с изюмом»
6. Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный заряд распределён
по всему объёму атомас постоянной плотностью.
В 1909 г. Эрнест Резерфорд совместно со
своими сотрудниками Г. Гейгером и
Э. Марсденом провёл ряд опытов по
исследованию состава и строения атомов.
7.
Резерфорд Эрнест(1871–1937) – английский физик,
основоположник ядерной физики. Его
исследования посвящены атомной и
ядерной физике, радиоактивности.
Своими фундаментальными открытиями в
этих областях заложил основы
современного учения о радиоактивности и
теории строения атома.
В 1899 г. открыл α - и β- лучи.
Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного распада
и установил закон радиоактивных превращений.
В 1903 г. доказал, что альфа-лучи состоят из положительно заряженных
частиц. Предсказал существование трансурановых элементов.
В 1908 г. ему была присуждена Нобелевская премия.
В 1931 г. Э. Резерфорд за свои научные заслуги стал пэром Англии,
получив титул лорда Нельсона
8.
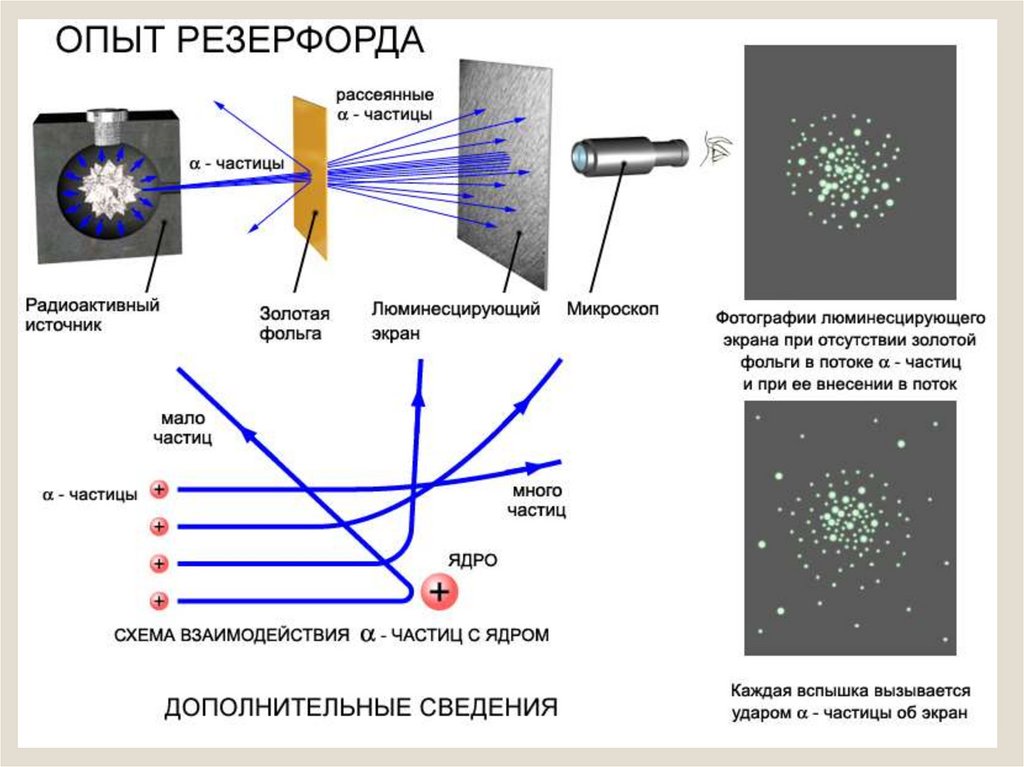
9.
Результаты опытов :Подавляющая часть α-частиц - более 90% проходит сквозь фольгу практически без
отклонения или с отклонением на малые углы
Некоторая небольшая часть α-частиц - менее
1% - при прохождении через фольгу отклоняется
на значительные углы ( 90, 120, 150 градусов)
Объяснить этот результат на основе
модели Томсона оказалось
невозможным.
10.
Обнаружилось, что некоторыеα-частицы отклонялись на большие углы,
до 180º.
Резерфорд понял, что такое отклонение
возможно лишь при встрече с положительно
заряженной частицей большой массы. Малая
вероятность отклонения на большие углы
говорила о том, что эта положительная частица
имеет малые размеры, порядка 10-14 м.
Электроны, по Резерфорду, движутся вокруг
ядра.
Оказалось, что радиус ядра R (10 14 ÷ 10 15)м
и зависит от числа нуклонов в ядре.
11. Выводы из опытов:
Положительный заряд сосредоточен в малойчасти атома – ядре;
Практически вся масса атома сосредоточена в
этом ядре – 99,4%
Отклонения альфа-частиц на большие углы
происходят в результате столкновения альфа –
частиц с ядром одного из атомов;
Теоретические расчеты позволили оценить
размеры ядер атомов – порядка
15
10 10
14
м, тогда как размеры атома 10
10
м
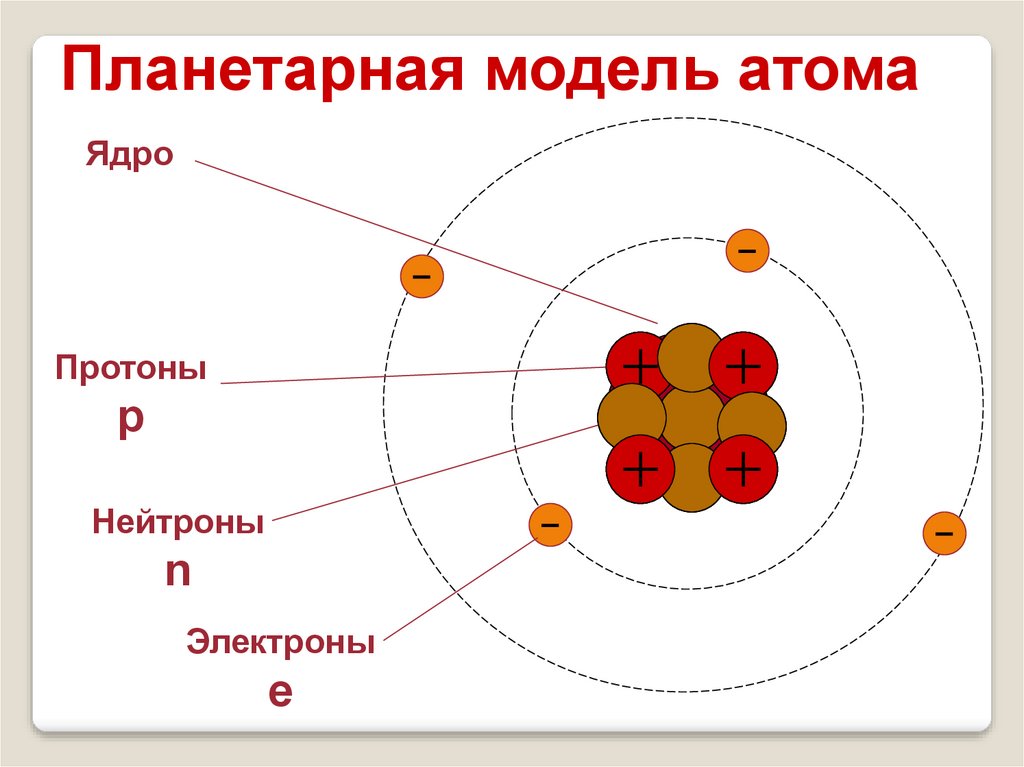
12.
Планетарная модель атомаЯдро
Протоны
+
р
Нейтроны
n
Электроны
е
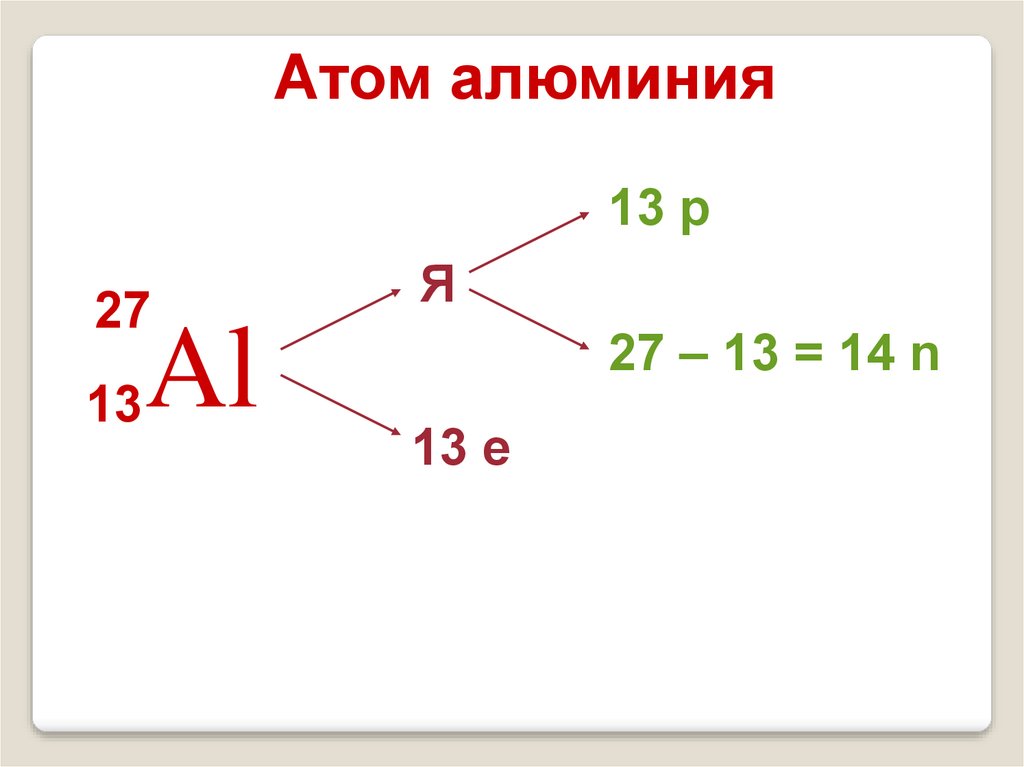
13.
Атом алюминия13 р
27
13
Al
Я
27 – 13 = 14 n
13 е
14.
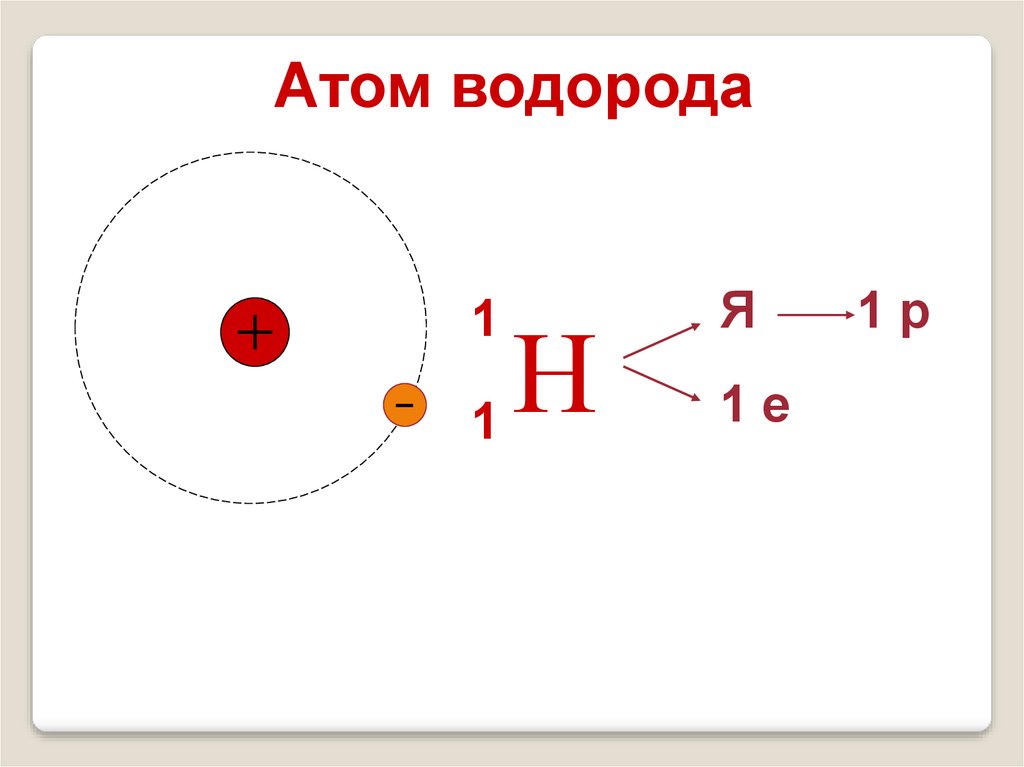
Атом водорода1
Н
1
Я
1е
1р
15.
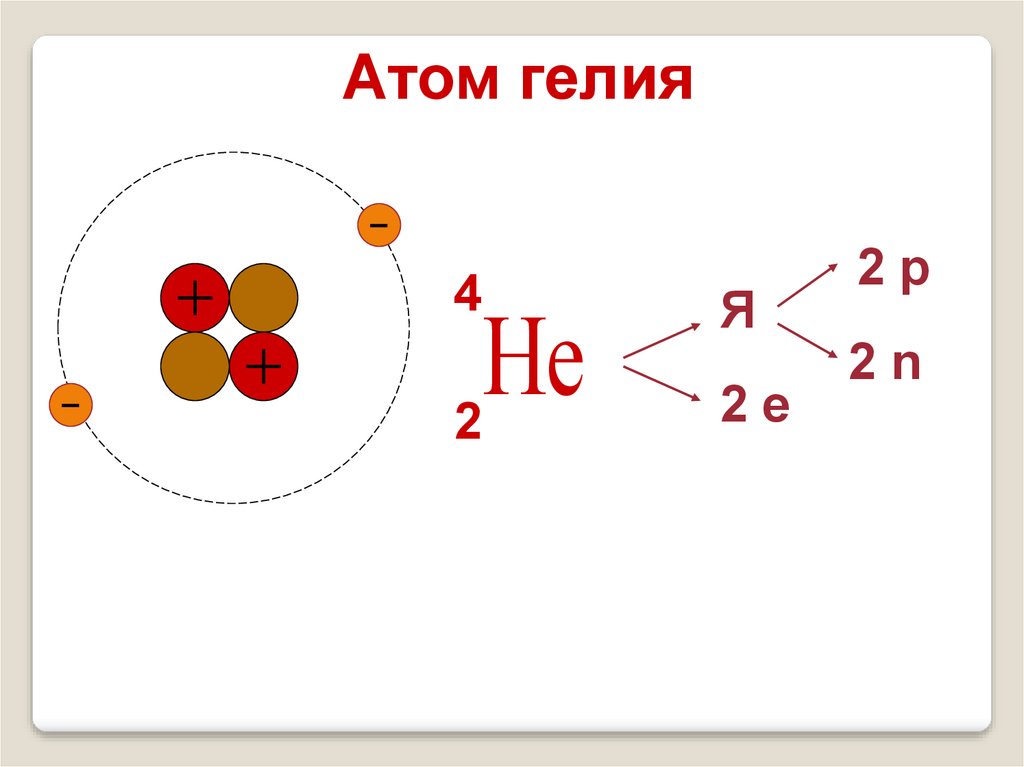
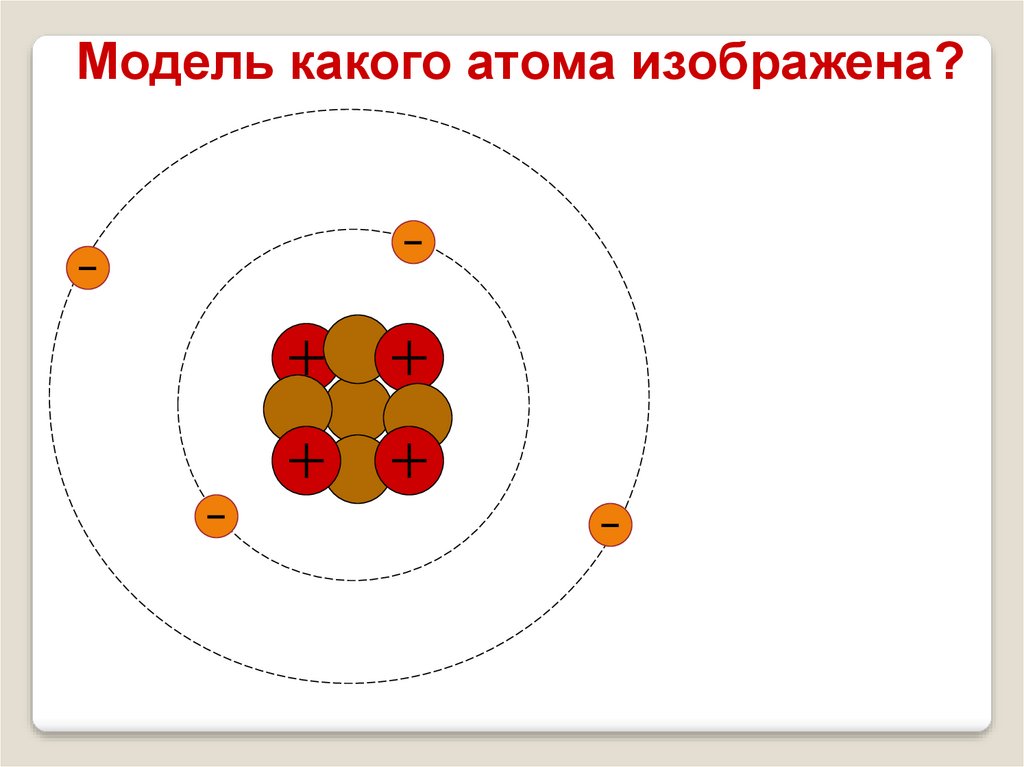
Атом гелия4
Не
2
Я
2е
2р
2n
16.
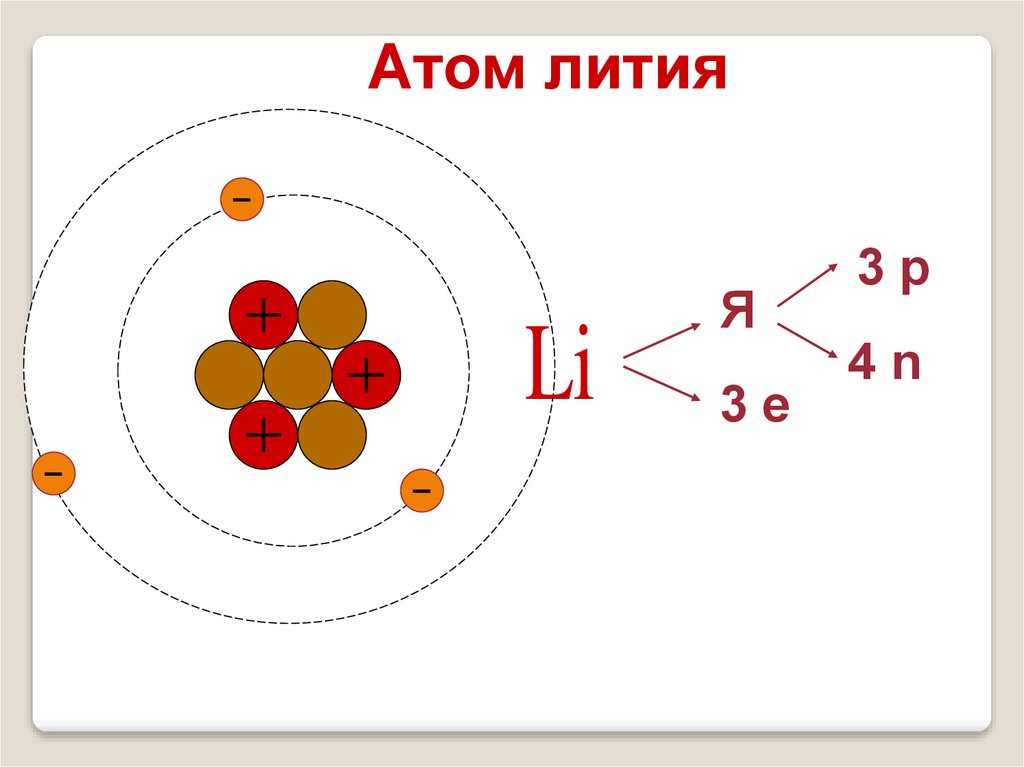
Атом лития7
Li
3
Я
3е
3р
4n
17.
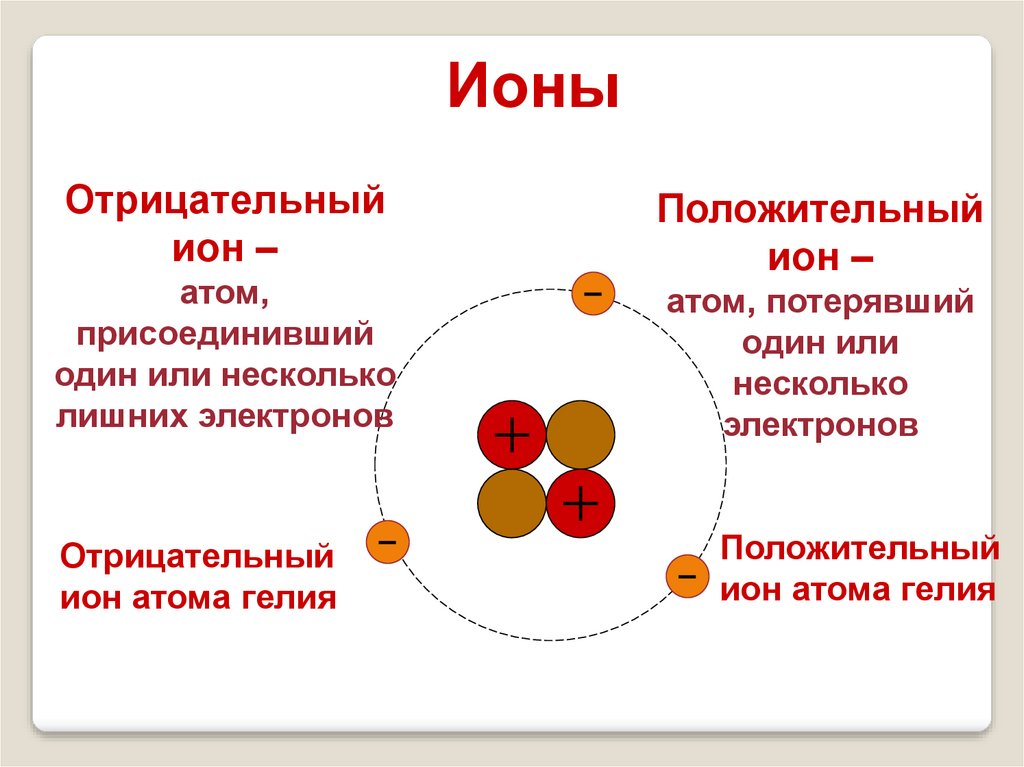
ИоныОтрицательный
ион –
атом,
присоединивший
один или несколько
лишних электронов
Отрицательный
ион атома гелия
Положительный
ион –
атом, потерявший
один или
несколько
электронов
Положительный
ион атома гелия
18.
19.
20. Вопросы на закрепление:
1. В чём заключается сущность модели Томсона?2. В чём заключалась идея опыта Резерфорда?
3.Объясните причину рассеивания альфачастиц атомами вещества.
4. В чём сущность планетарной модели атома?
5. В чем противоречивость модели атома
Резерфорда?
6. Какие частицы входят в состав атома?
7. Чем ядерные силы отличаются от
электромагнитных?
21.
Проверьте себя!Заполните пропуски:
1. В центре атома находится ______
2. Вокруг ядра движутся ___________
3. Ядро атома состоит из ____________________
4. Ядро имеет _______________ заряд.
5. Электроны имеют ______________ заряд.
6. Протоны имеют _______________ заряд.
22.
Проверьте себя!Заполните пропуски:
1. Нейтроны
имеют ______________ заряд.
2. Атом имеет ______________ заряд.
3. Атом, потерявший один или несколько
электронов, называется
______________________
4. Атом, присоединивший один или
несколько электронов, называется
______________________
23.
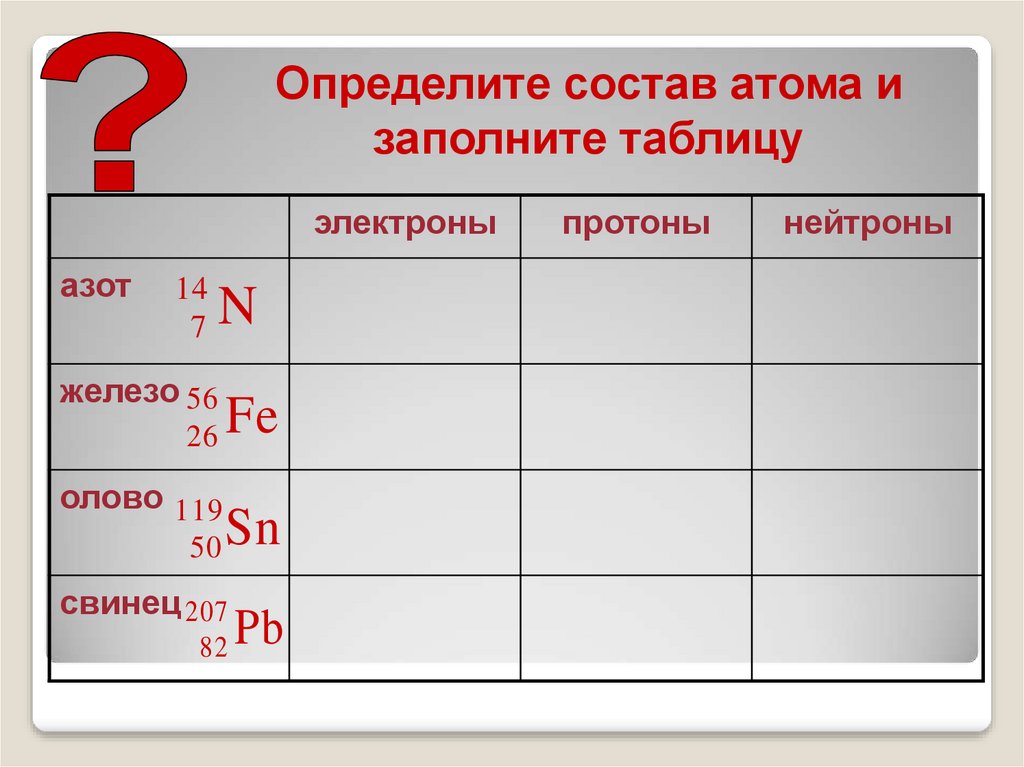
Определите состав атома изаполните таблицу
электроны
азот
14
7
N
железо 56
26
олово 119
50
Fe
Sn
свинец 207
82
Pb
протоны
нейтроны














 physics
physics








