Similar presentations:
Структурные особенности белков - ферментов. Мультиферментные комплексы (2 курс)
1.
СТРУКТУРНЫЕ ОСОБЕННОСТИБЕЛКОВ-ФЕРМЕНТОВ.
МУЛЬТИФЕРМЕНТНЫЕ
КОМПЛЕКСЫ.
2 КУРС , БАКАЛАВРИАТ
КАФЕДРА БИОХИМИИ
БИОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ
Подготовила: Пинковская Екатерина
Викторовна
2022
2.
ОСНОВНЫЕ ТЕРМИНЫФерменты - обычно сложные белковые соединения, РНК (рибозимы) или
их комплексы, ускоряющие химические реакции в живых системах,
биологические катализаторы.
Для функционирования фермента важно сохранения первичной, вторичной,
третичной и четвертичной структуре.
Катализаторы ускоряют реакцию путём снижения энергии активации
2
3.
Ферменты синтезируются в виде линейной цепочкиаминокислот, которая сворачивается определённым образом,
и получающаяся молекула (белковая глобула) обладает
уникальными свойствами. Несколько белковых цепей могут
объединяться в белковый комплекс.
Чтобы катализировать реакцию, фермент должен связаться с
одним или несколькими субстратами. Белковая цепь
фермента сворачивается таким образом, что на поверхности
глобулы образуется щель, или впадина, где связываются
субстраты. Эта область называется сайтом связывания
субстрата.
3
4.
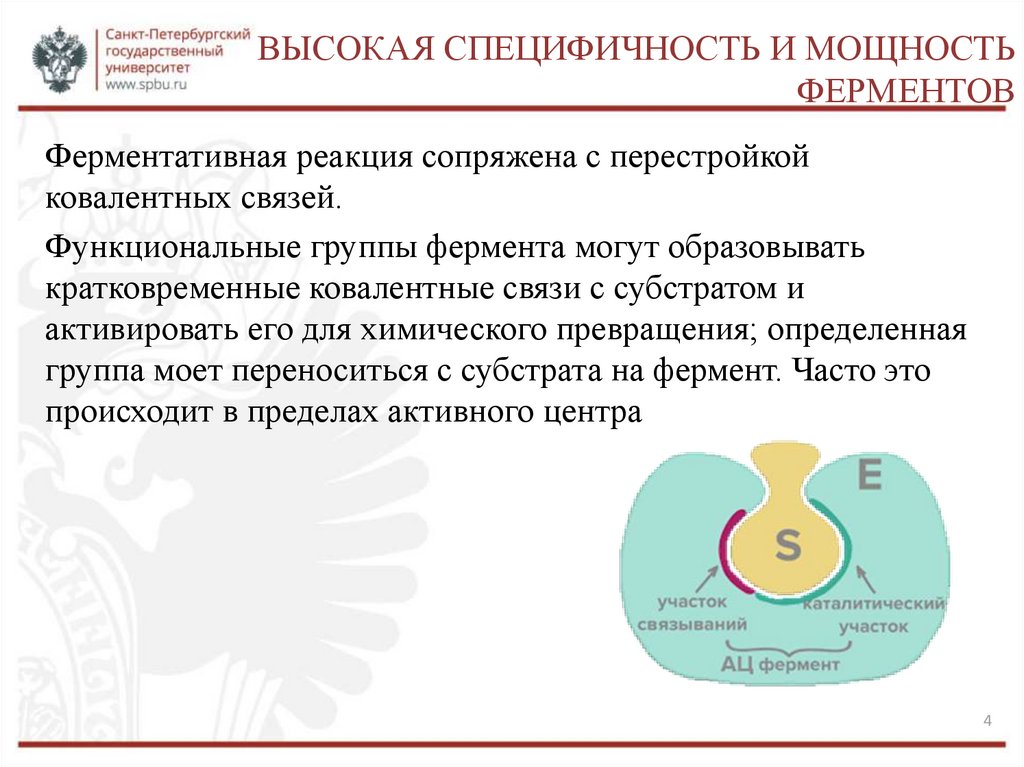
ВЫСОКАЯ СПЕЦИФИЧНОСТЬ И МОЩНОСТЬФЕРМЕНТОВ
Ферментативная реакция сопряжена с перестройкой
ковалентных связей.
Функциональные группы фермента могут образовывать
кратковременные ковалентные связи с субстратом и
активировать его для химического превращения; определенная
группа моет переноситься с субстрата на фермент. Часто это
происходит в пределах активного центра
4
5.
По строению ферменты могут быть однокомпонентными,простыми белками, и двухкомпонентными, сложными
белками. Во втором случае в составе фермента
обнаруживается добавочная группа небелковой природы.
Характерной особенностью двухкомпонентных ферментов
является то, что ни белковая часть, ни добавочная группа в
отдельности не обладают заметной каталитической
активностью.
5
6.
КОФАКТОРЫ – ИОНЫ МЕТАЛЛОВРоль металлов в присоединении субстрата в активном центре
фермента. Ионы металла выполняют функцию стабилизаторов молекулы
субстрата, активного центра фермента и конформации белковой
молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов – стабилизаторы молекулы
Ионы металлов – стабилизаторы активного центра фермента. В
некоторых случаях ионы металлов служат «мостиком» между ферментом
и субстратом. Они выполняют функцию стабилизаторов активного
центра, облегчая присоединение к нему субстрата и протекание
химической реакции
Роль металлов в стабилизации структуры фермента. Ионы металлов
обеспечивают сохранение вторичной, третичной, четвертичной
структуры молекулы фермента. Такие ферменты в отсутствие ионов
металлов способны к химическому катализу, однако они нестабильны.
6
7.
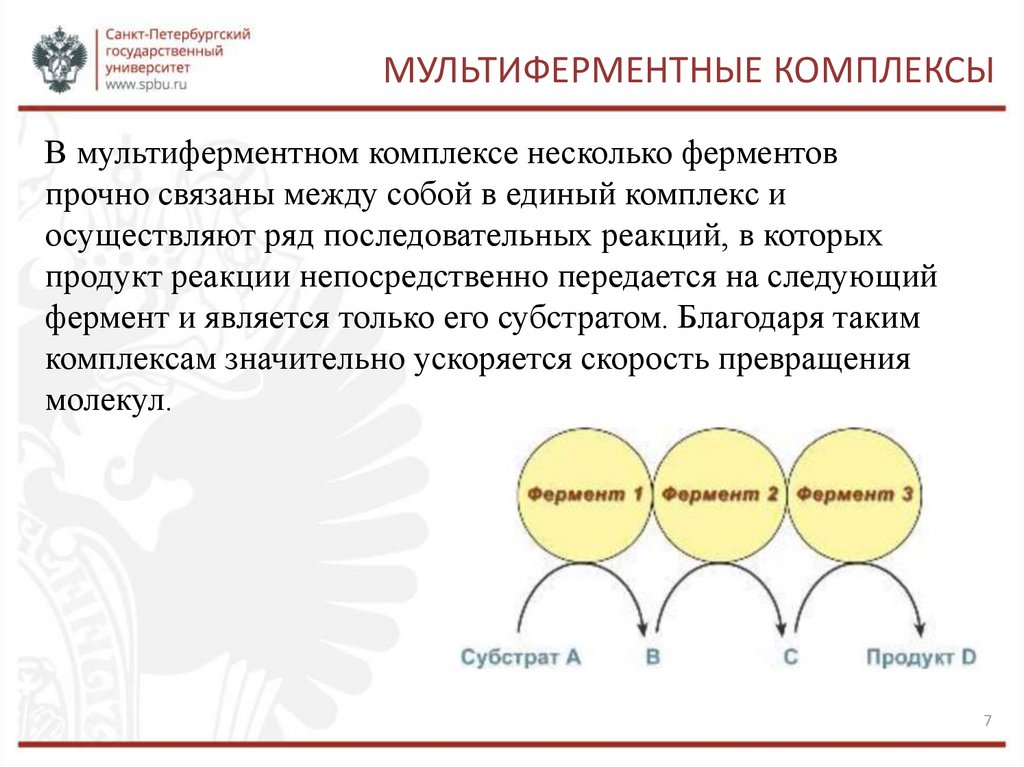
МУЛЬТИФЕРМЕНТНЫЕ КОМПЛЕКСЫВ мультиферментном комплексе несколько ферментов
прочно связаны между собой в единый комплекс и
осуществляют ряд последовательных реакций, в которых
продукт реакции непосредственно передается на следующий
фермент и является только его субстратом. Благодаря таким
комплексам значительно ускоряется скорость превращения
молекул.
7
8.
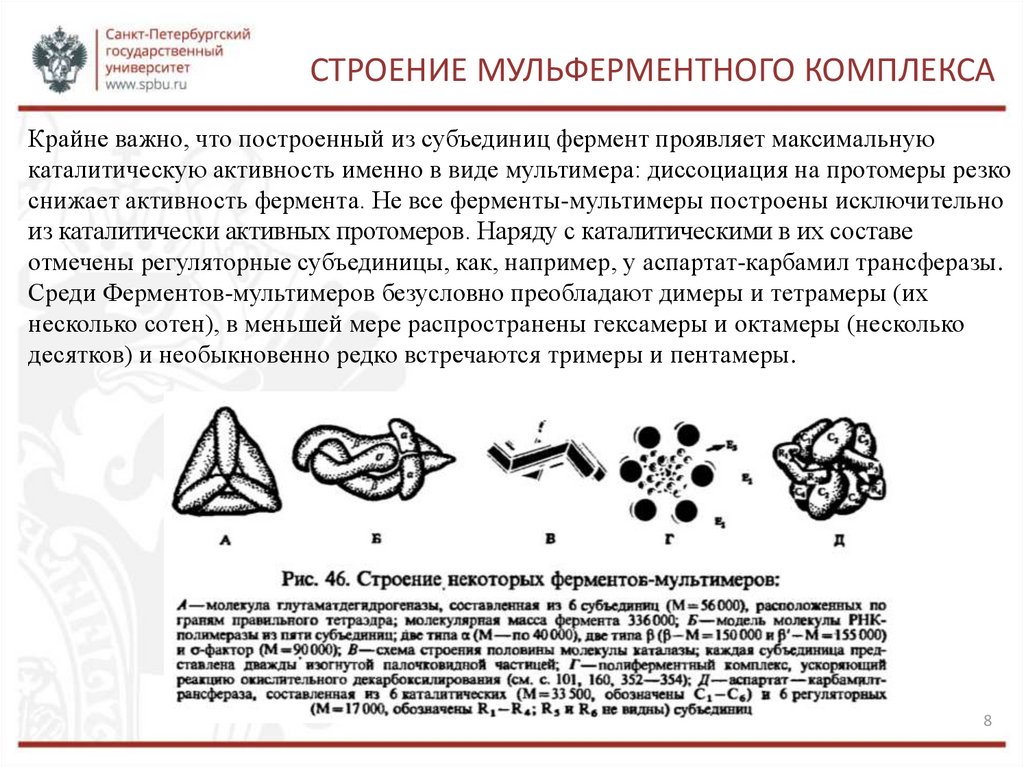
СТРОЕНИЕ МУЛЬФЕРМЕНТНОГО КОМПЛЕКСАКрайне важно, что построенный из субъединиц фермент проявляет максимальную
каталитическую активность именно в виде мультимера: диссоциация на протомеры резко
снижает активность фермента. Не все ферменты-мультимеры построены исключительно
из каталитически активных протомеров. Наряду с каталитическими в их составе
отмечены регуляторные субъединицы, как, например, у аспартат-карбамил трансферазы.
Среди Ферментов-мультимеров безусловно преобладают димеры и тетрамеры (их
несколько сотен), в меньшей мере распространены гексамеры и октамеры (несколько
десятков) и необыкновенно редко встречаются тримеры и пентамеры.
8
9.
СТРОЕНИЕ МУЛЬФЕРМЕНТНОГО КОМПЛЕКСАМолекулы Ферментов-мультимеров в ряде случаев составлены из
субъединиц двух типов, обозначаемых условно как субъединицы типа А
и В. Они сходны друг с другом, но отличаются по некоторым деталям
первичной и третичной структур. В зависимости от соотношения
протомеров типа А и В в мультимере последний может существовать в
виде нескольких изомеров, которые называют изозимами. Так, при
четырех субъединицах возможны 5 изозимов:
Это явление хорошо изучено у фермента, ускоряющего в мышцах
превращение молочной кислоты в пировиноградную и обратно с
помощью лактатдегидрогеназы:
9
10.
СПИСОК ЛИТЕРАТУРЫhttps://studfile.net/preview/6659418/page:34/
Филиппович – Основы биохимии
https://www.brsu.by/sites/default/files/e_editions/aab.pdf
10
11.
Спасибоза внимание!
Санкт-Петербургский
государственный университет
spbu.ru








 biology
biology








