Similar presentations:
Ферменты. Особенности ферментов
1.
Ферменты1. Общее понятие о ферментах как биологических
катализаторах
2. Строение ферментов
3. Специфичность действия ферментов
4. Регуляция активности ферментов: активаторы и
ингибиторы.
5. Влияние температуры и рН среды на активность
ферментов
6. Механизм действия ферментов
7. Классификация ферментов
2.
Понятие о роли ферментов ворганизме
Обмен веществ (метаболизм) — это
совокупность химических реакций в живом
организме. Состоит из реакций анаболизма
(синтез) и катаболизма (распад). Все реакции
протекают одновременно, поэтому
происходит регуляция их скорости, начала и
конца. Регуляторами всех реакций являются
ФЕРМЕНТЫ. Это белки катализаторы
(ускорители реакций). В организме человека
все хим.реакции протекают с участием
ферментов.
3.
Особенности ферментовФЕРМЕНТЫ — БЕЛКИ:
1. высокая эффективность действия
(ускоряют реакции в 106-1012 раз выше)
2. высокая специфичность действия
(избирательность к субстрату и реакции)
3. способность к регуляции активности
(можно изменять активность фермента —
повышать или понижать)
4. мягкие условия функционирования
4.
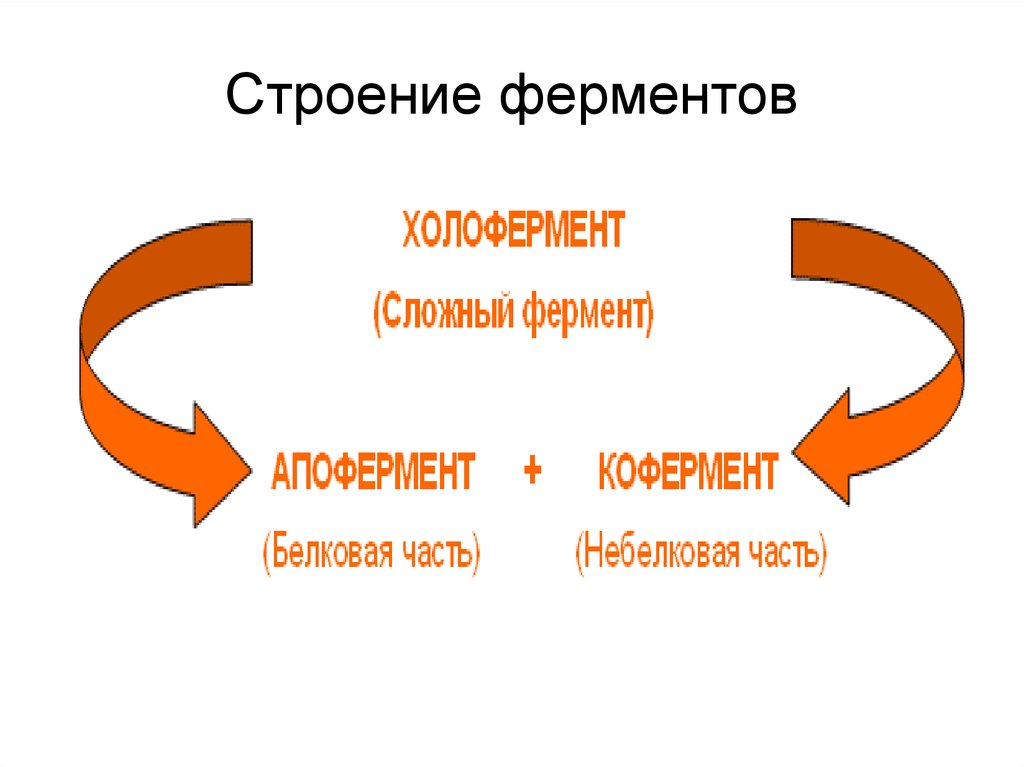
Строение ферментовБольшой размер
Ферменты — простые (только из
аминокислот), сложные (белковый компонент
+ дополнительный компонент)
5.
Строение ферментов6.
Кофакторы ферментов1. Простетическая группа — прочно связаны
с апоферментом (ионы металлов, ФМН,
ФАД)
Коферменты — легко диссоциируют
(органические соединения: НАД, НАДФ, ПФ,
КоА и др.)
7.
Коферменты:1) Синтезируются из водорастворимых
витаминов:
В1 (тиамин) — ТДФ (тиаминдифосфат)
В2 (рибофлавин) — ФАД
(флавинадениндинуклеотид)
В3 (пантотеновая кислота) — КоА (коэнзимА)
В5 (никотинамид) — НАД
(никотинамидадениндинуклеотид)
В6 (пиридоксамин) — ПФ
(пиридоксальфосфат)
8.
Коферменты:2) функция : участвуют в химических
реакциях — претерпевает хим.изм-я,
противоположные субстрату (практически
являются вторым субстратом для фермента)
3) в отсутствии кофермента фермент не
активен
4) присоединяются в каталитическом участке
активного центра фермента
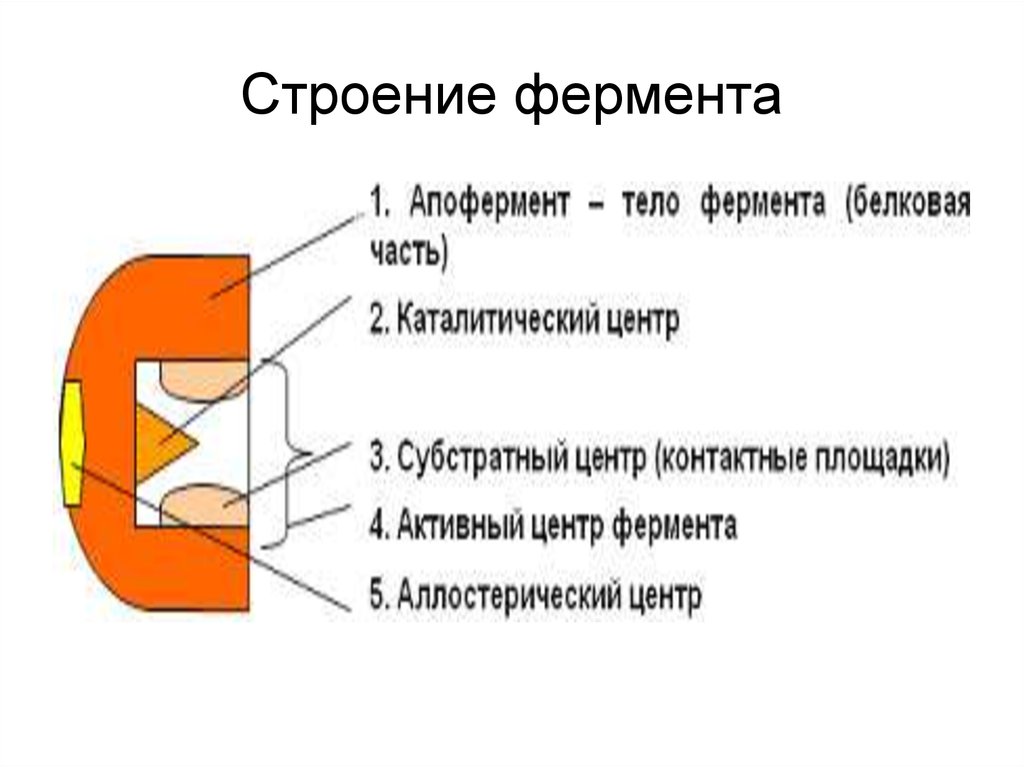
9.
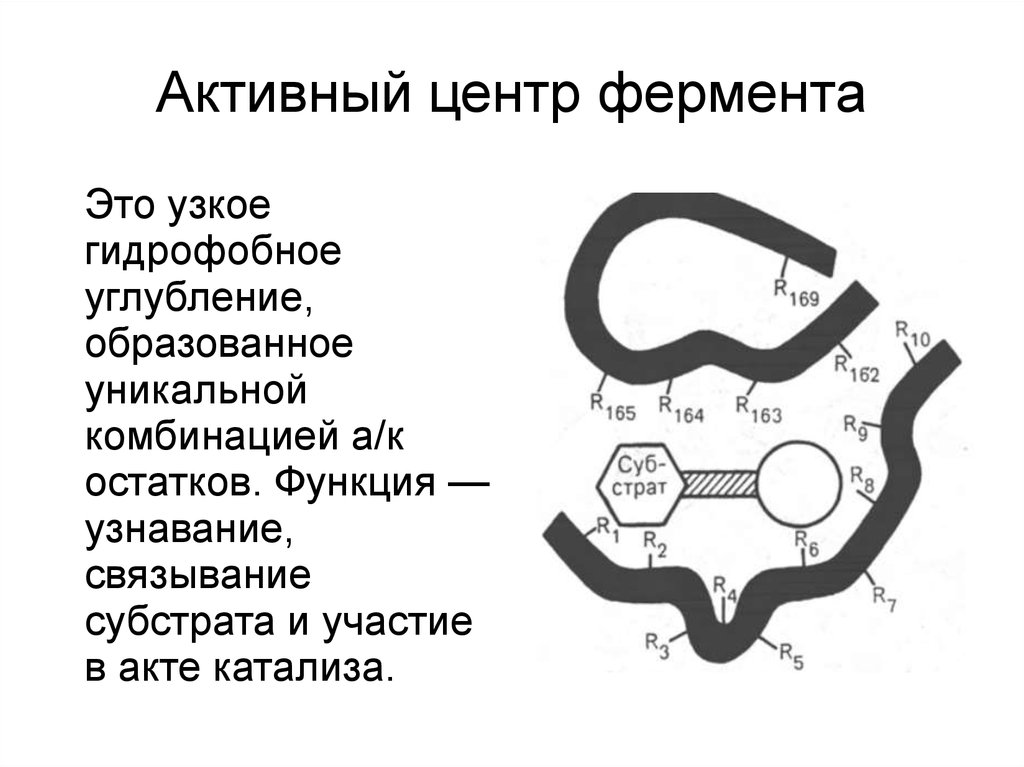
Строение фермента10.
Активный центр ферментаЭто узкое
гидрофобное
углубление,
образованное
уникальной
комбинацией а/к
остатков. Функция —
узнавание,
связывание
субстрата и участие
в акте катализа.
11.
Активный центр- Формируется 12-16 а/к остатками
- субстрат и акт.центр имеют геометрическое
соответствие, связываются слабыми связями
(гидроф., ионная, водор.), т. е.
устанавливается электронное или
химическое соответствие =
комплементарность
12.
Аллостерический центр- Характерен для ферментов-олигомеров
- Связывает эффектор
- Функция — регуляция активности ферментов
13.
Специфичность действияферментов
Это способность ферментов выбирать
определенный субстрат и катализировать
определенную реакцию
Имеется несколько видов специфичности.
Наиболее узкая специфичность —
абсолютная, широкая специфичность групповая
14.
Изменение активности ферменов:1. активирование (повышение активности)
под действием активаторов: неорг.в-ва (HСl
для пепсина), органич.в-ва (цистеин для
папаина), ионы Ме
2. Ингибирование (понижение активности)
а) обратимое: конкурентное и неконкурентное
б) необратимое
15.
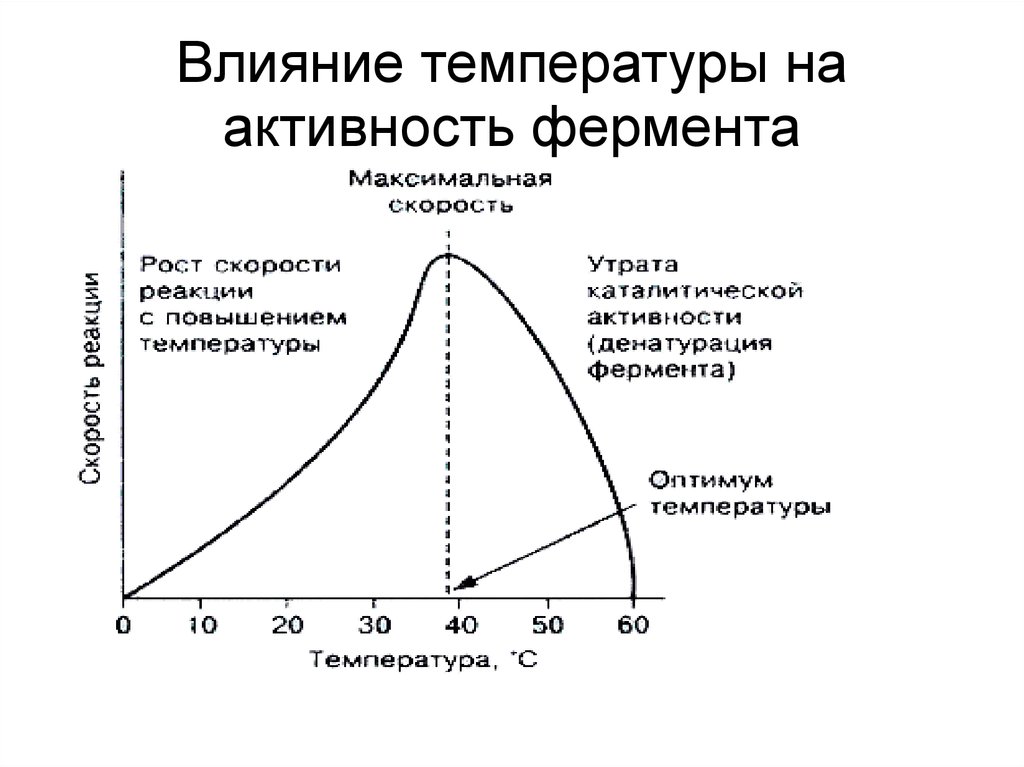
Влияние температуры наактивность фермента
16.
Влияние рН среды17.
Механизм действия ферментовФерментативная реакция описывается:
18.
Механизм действия ферментовI. Узнавание и присоединение.
Избирательное присоединение субстрата за
счет слабых связей (многоточечное).
II. Ориентирование S в активном центре
(переходное состояние).
S ориентируется с помощью контактных
участков таким образом, чтобы обеспечить
доступ каталитическим группам к
реакционному центру
19.
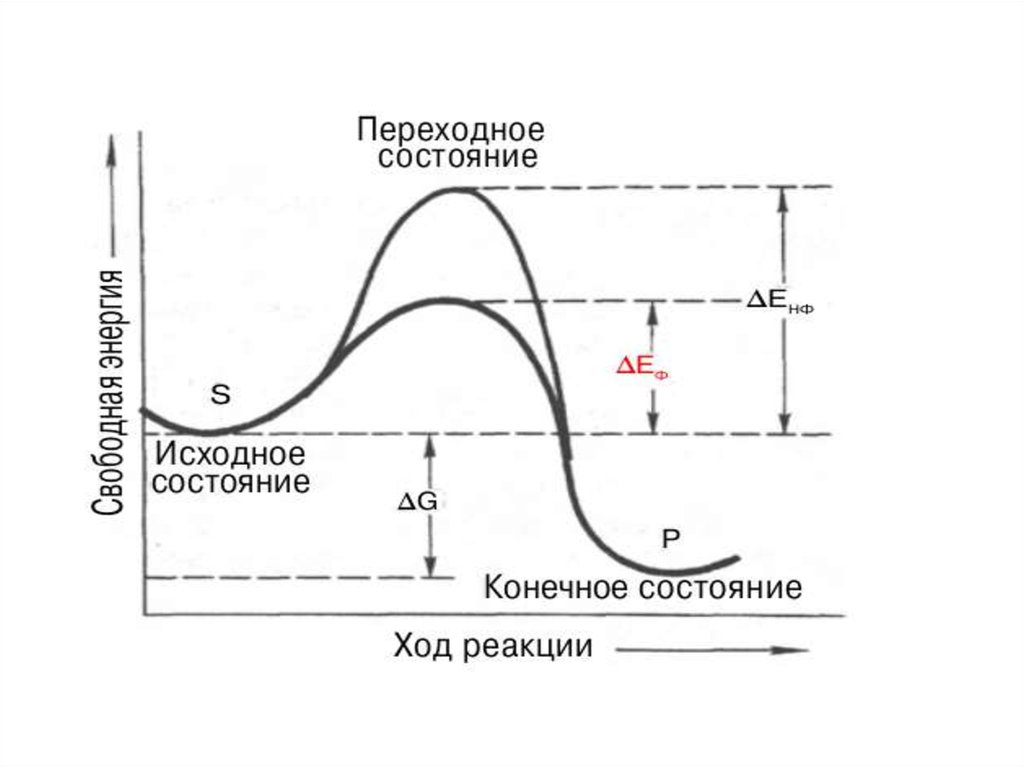
Механизм действия ферментовIII. Катализ реакции превращения S. Теория
столкновений: молекулы должны
сталкиваться и для продуктивности, они
должны обладать энергией, достаточной для
преодоления энергетического барьера.
Роль фермента: фермент снижает
свободную энергию переходного состояния
путем увеличения доли активных соударений
(многоточечность связывания).
20.
21.
Механизм действия ферментовIV. образование продукта реакции. Продукт
имеет другую конформацию, чем субстрат,
поэтому комплементарность снижается или
исчезает — происходит диссоциация.
Фермент возвращается в исходное
состояние.
22.
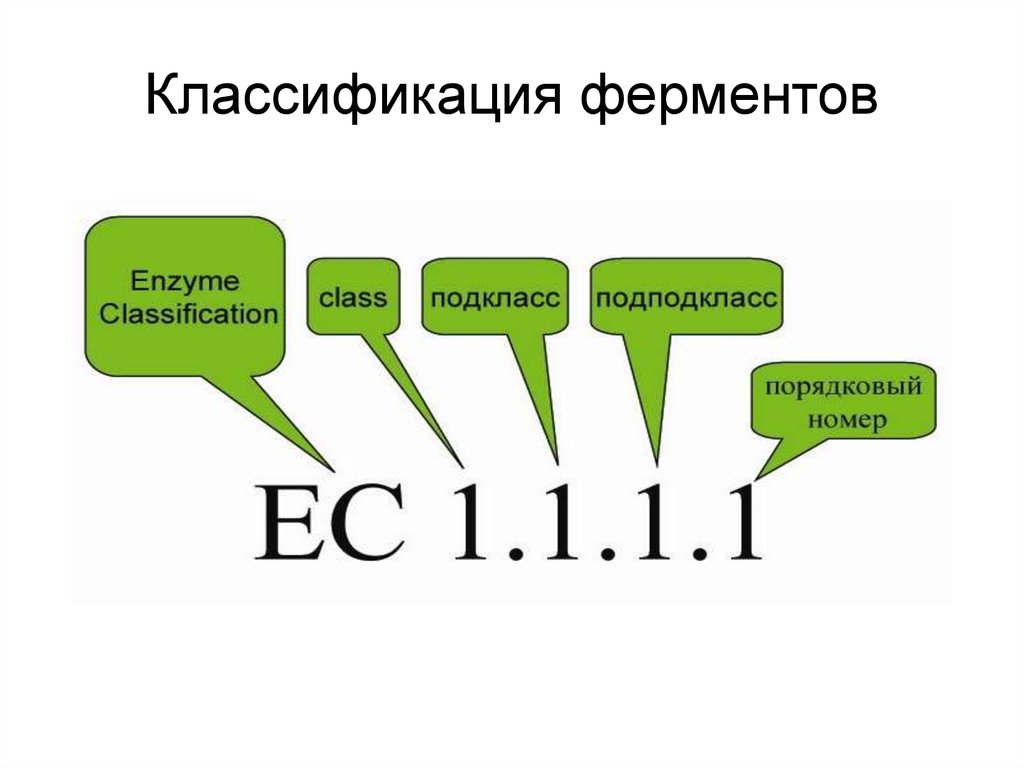
Классификация ферментов23.
Классы ферментовПо типу катализируемых реакций все
ферменты делят на 6 классов:
1. Оксидоредуктазы
2. Трансферазы
3. Гидролазы
4. Лиазы
5. Изомеразы
6. Лигазы (синтетазы)

















 biology
biology








