Similar presentations:
Азот. Соединения азота
1.
Азот. Аммиак.2.
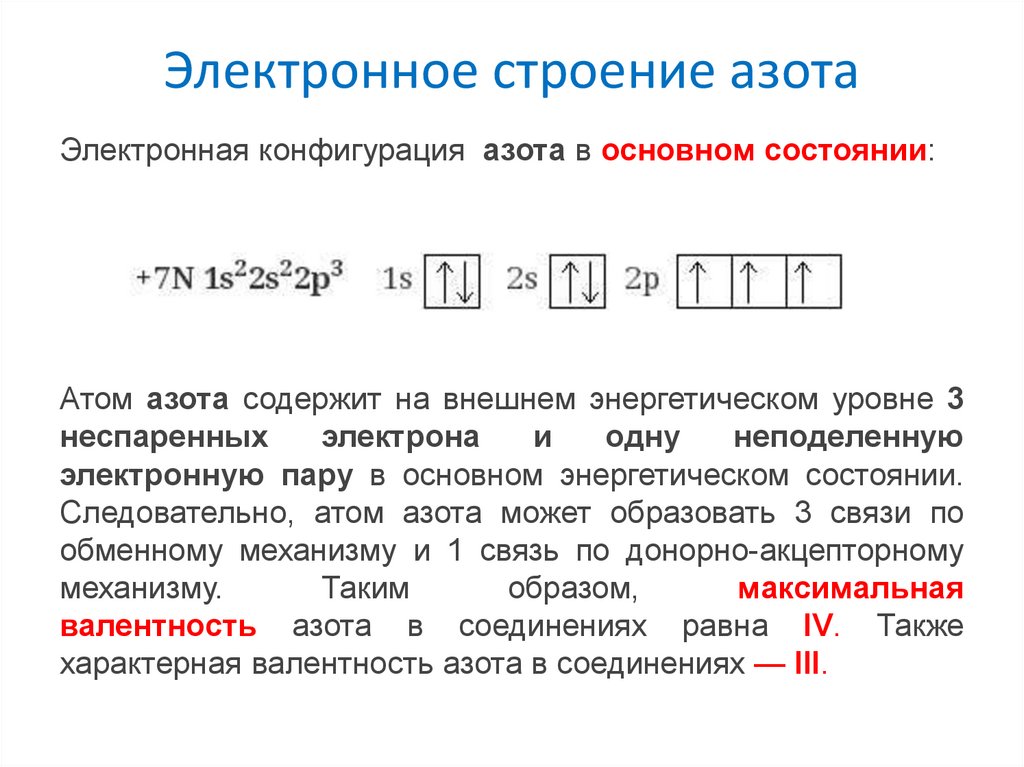
Электронное строение азотаЭлектронная конфигурация азота в основном состоянии:
Атом азота содержит на внешнем энергетическом уровне 3
неспаренных
электрона
и
одну
неподеленную
электронную пару в основном энергетическом состоянии.
Следовательно, атом азота может образовать 3 связи по
обменному механизму и 1 связь по донорно-акцепторному
механизму.
Таким
образом,
максимальная
валентность азота в соединениях равна IV. Также
характерная валентность азота в соединениях — III.
3.
Электронное строение азотаСтепени окисления атома азота – от -3
до +5. Характерные степени окисления
азота -3, 0, +1, +2, +3, +4, +5.
4.
Электронное строение азотаСтепени окисления атома азота – от -3 до
+5. Характерные степени окисления азота 3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
В виде простого вещества газа N2. Нет
цвета,
запаха
и
вкуса.
Молекула
N2 неполярная, следовательно, в воде азот
практически нерастворим.
Азот – это основной
компонент воздуха (79% по массе).
5.
Строение молекулыСвязь между атомами в молекуле азота –
тройная, т.к. у каждого атома в молекуле
по 3 неспаренных электрона. Одна σсвязь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:
Структурно-графическая формула
молекулы азота: N≡N.
6.
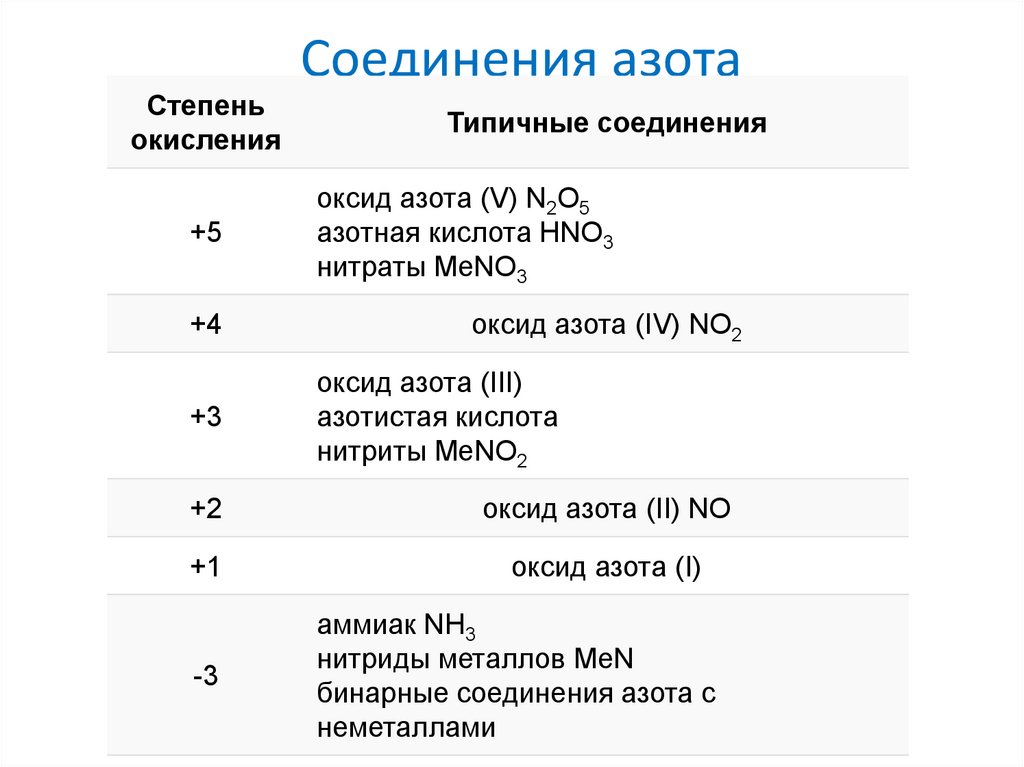
Степеньокисления
+5
+4
+3
Соединения азота
Типичные соединения
оксид азота (V) N2O5
азотная кислота HNO3
нитраты MeNO3
оксид азота (IV) NO2
оксид азота (III)
азотистая кислота
нитриты MeNO2
+2
оксид азота (II) NO
+1
оксид азота (I)
-3
аммиак NH3
нитриды металлов MeN
бинарные соединения азота с
неметаллами
7.
Способы получения азота1. Азот в лаборатории получают при взаимодействии
насыщенных растворов хлорида аммония и нитрита натрия.
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Азот также образуется при горении аммиака:
• 4NH3 + 3O2 → 2N2 + 6H2O
2.
Наиболее
чистый
азот
разложением азидов щелочных металлов.
Например, разложением азида натрия:
• 2NaN3 → 2Na + 3N2
получают
3. Еще один лабораторный способ получения азота —
восстановление оксида меди (II) аммиаком при температуре
~700 °C:
• 3CuO + 2NH3 → 3Cu + N2 + 3H2O
8.
Химические свойства азотаМолекулярный азот при обычных условиях с
кислородом не реагирует. Реагирует с кислородом
только при высокой температуре (2000оС),
на
электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с
поглощением теплоты.
При сильном нагревании (3000оС-5000оС или
действие электрического разряда) образуется
атомарный азот, который реагирует с серой,
фосфором,
мышьяком,
углеродом
с
образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с
серой, фосфором, мышьяком, углеродом.
9.
Азот взаимодействует с водородом привысоком давлении и высокой температуре, в
присутствии
катализатора.
При
этом
образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот
процесс
экзотермический,
т.е.
протекает с выделением теплоты.
Азот реагирует с активными металлами: с
литием
при
комнатной
температуре,
кальцием,
натрием
и
магнием
при
нагревании. При этом образуются бинарные
соединения-нитриды.
Например, литий реагирует с азотом с
образованием нитрида лития:
• N2 + 6Li → 2Li3N
10.
Взаимодействие со сложнымивеществами
Со сложными веществами азот
практически не реагирует из-за крайне
низкой реакционной способности.
Взаимодействие возможно только в
жестких
условиях
с
активными
веществами,
например,
сильными
восстановителями.
Например, азот окисляет гидрид лития:
• N2 + 3LiH → Li3N + NH3
11.
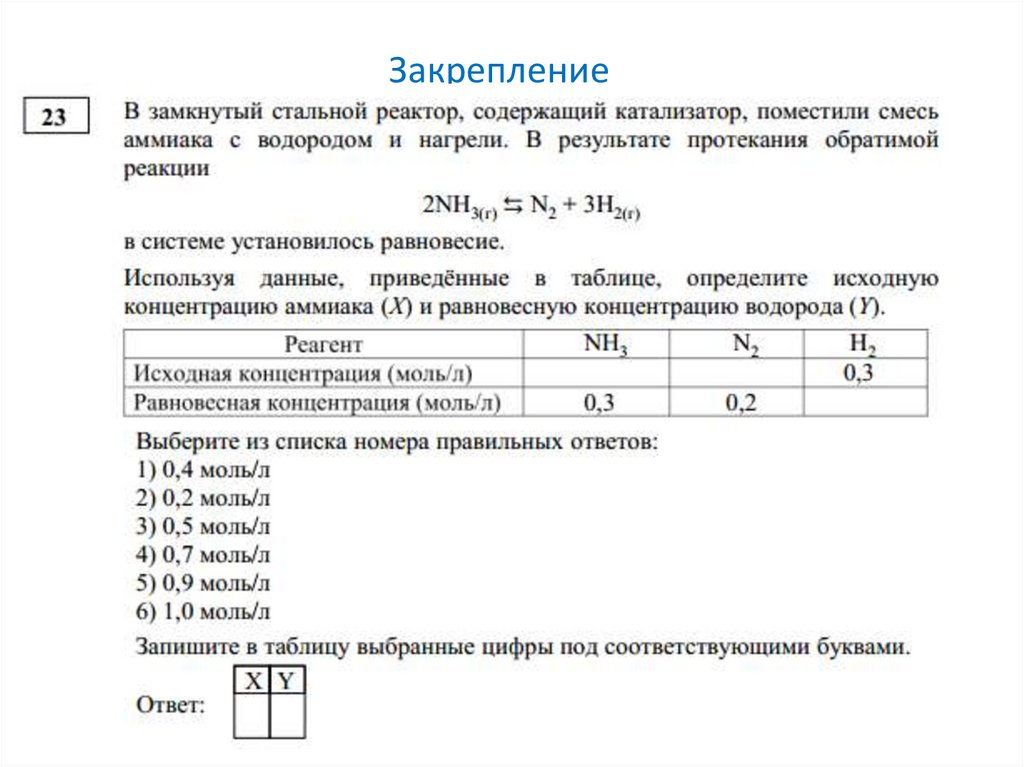
Закрепление12.
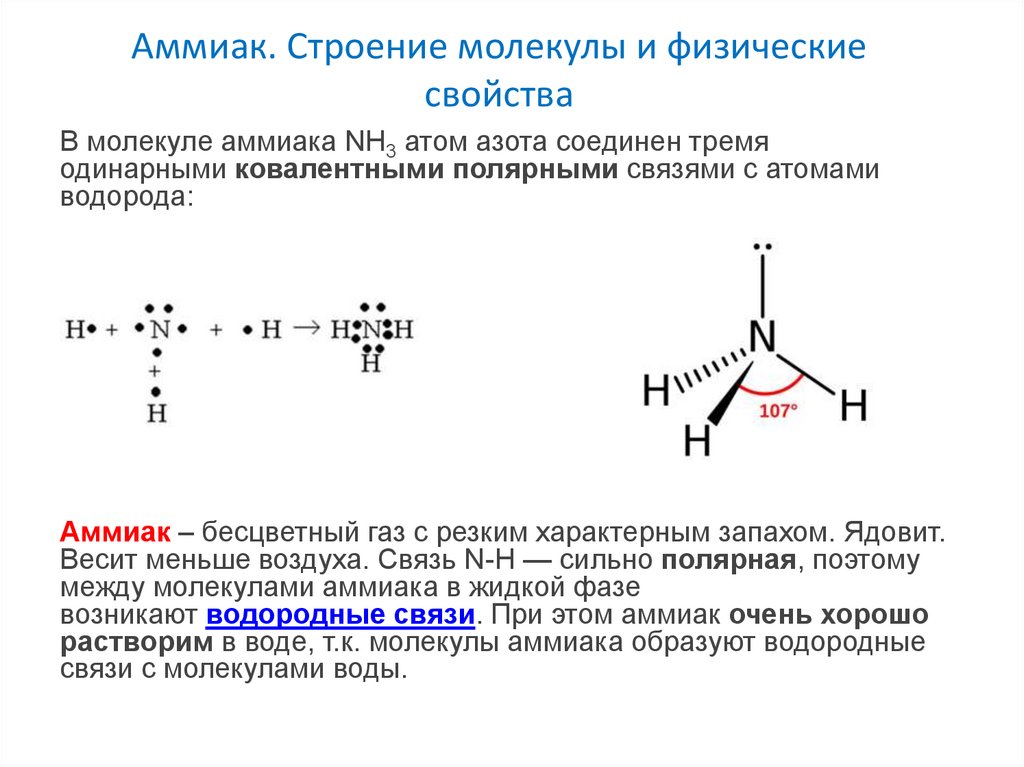
Аммиак. Строение молекулы и физическиесвойства
В молекуле аммиака NH3 атом азота соединен тремя
одинарными ковалентными полярными связями с атомами
водорода:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит.
Весит меньше воздуха. Связь N-H — сильно полярная, поэтому
между молекулами аммиака в жидкой фазе
возникают водородные связи. При этом аммиак очень хорошо
растворим в воде, т.к. молекулы аммиака образуют водородные
связи с молекулами воды.
13.
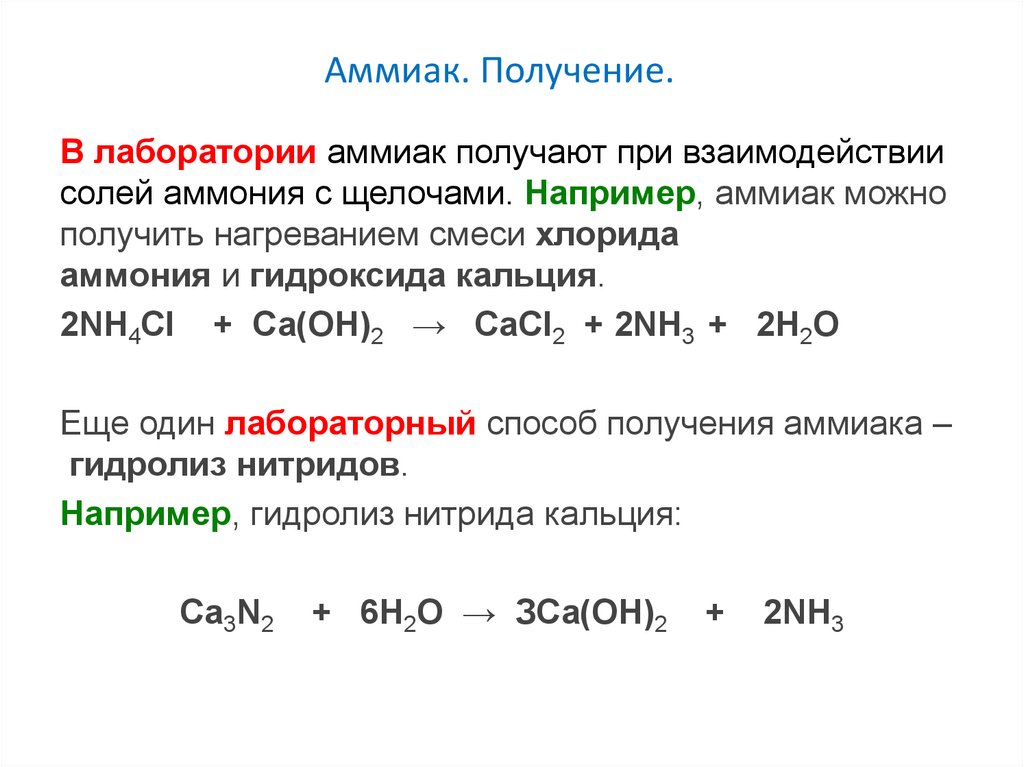
Аммиак. Получение.В лаборатории аммиак получают при взаимодействии
солей аммония с щелочами. Например, аммиак можно
получить нагреванием смеси хлорида
аммония и гидроксида кальция.
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Еще один лабораторный способ получения аммиака –
гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2
+ 6H2O → ЗСа(OH)2
+
2NH3
14.
Аммиак. Получение.В промышленности аммиак получают с помощью
процесса
Габера:
прямым
синтезом
из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
15.
Аммиак. Химические свойства аммиака.В водном растворе аммиак проявляет основные
свойства (за счет неподеленной электронной пары).
Принимая протон (ион H+), он превращается в ион аммония.
Реакция может протекать и в водном растворе, и в газовой
фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Как основание, аммиак взаимодействует с кислотами в
растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с
образованием либо кислой соли – гидросульфата
аммония (при избытке кислоты), либо средней соли –
сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
16.
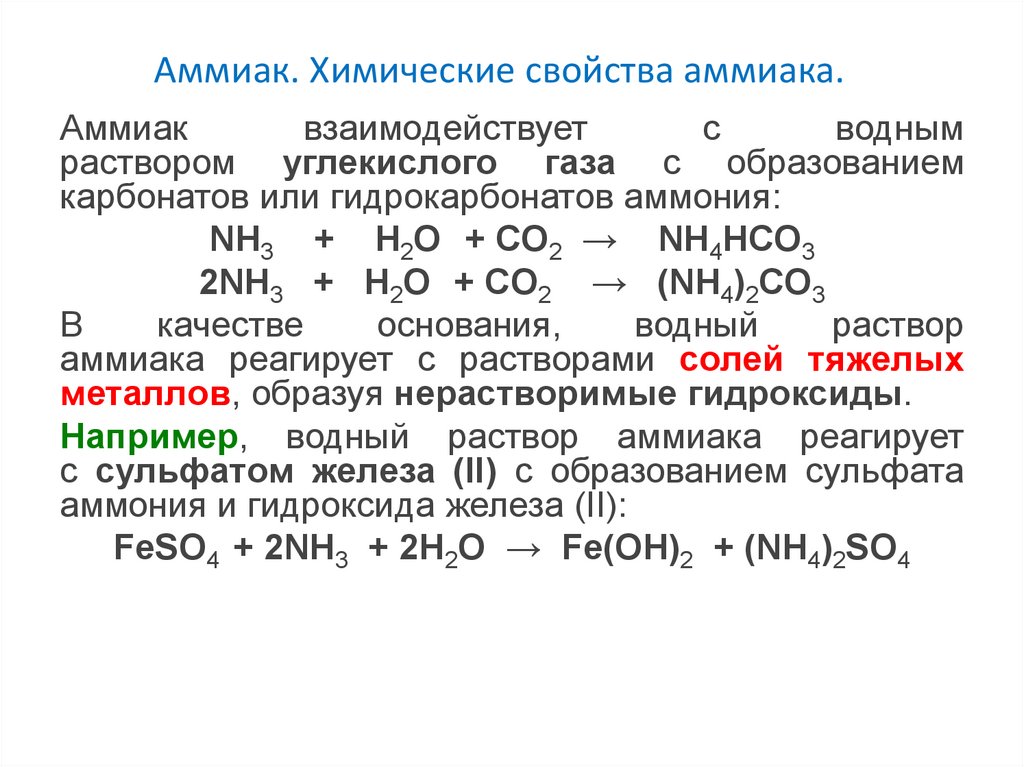
Аммиак. Химические свойства аммиака.Аммиак
взаимодействует
с
водным
раствором углекислого газа с образованием
карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
В
качестве
основания,
водный
раствор
аммиака реагирует с растворами солей тяжелых
металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует
с сульфатом железа (II) с образованием сульфата
аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
17.
Аммиак. Химические свойства аммиака.Соли и гидроксиды меди, никеля, серебра растворяются
в избытке аммиака, образуя комплексные соединения –
амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с
образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то
азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
18.
Аммиак. Химические свойства аммиака.За счет атомов водорода в степени окисления +1
аммиак может выступать в роли окислителя,
например
в
реакциях
с
щелочными,
щелочноземельными металлами, магнием и
алюминием. С металлами реагирует только
жидкий аммиак.
Например, жидкий аммиак реагирует
с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При
взаимодействии
аммиака
с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
19.
Аммиак. Химические свойства аммиака.За счет азота в степени окисления -3 аммиак проявляет
восстановительные свойства. Может взаимодействовать
с сильными окислителями — хлором, бромом,
пероксидом
водорода,
пероксидами и оксидами некоторых металлов. При этом
азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного
азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду
напряжений металлов расположены справа — сильные
окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
20.
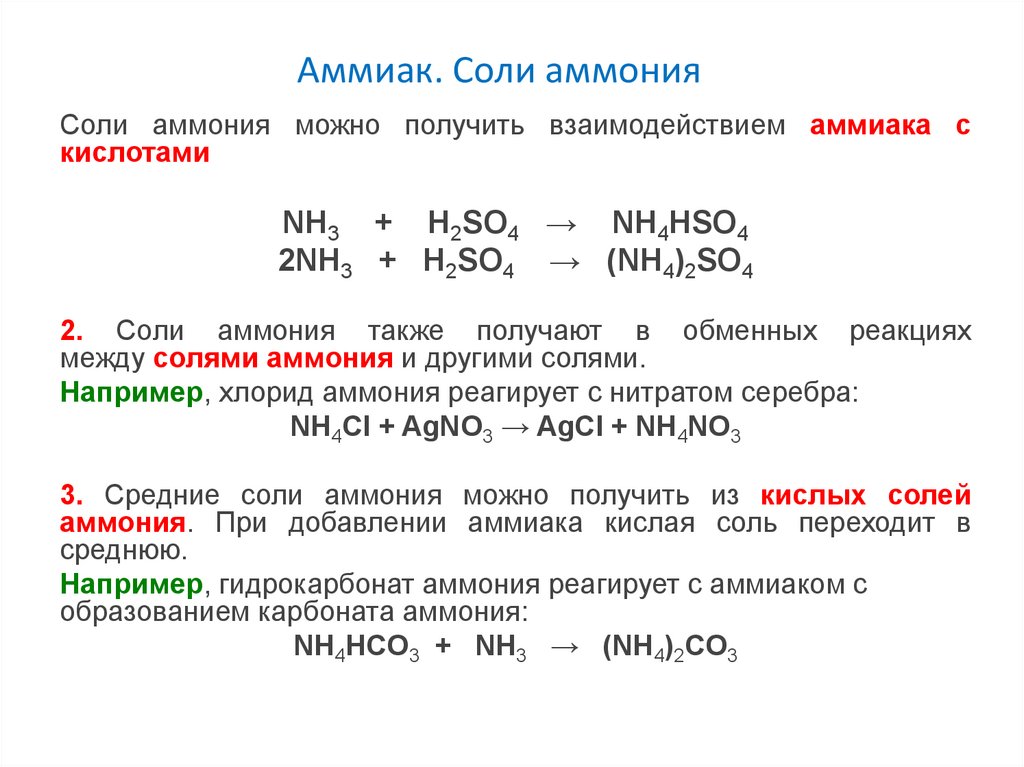
Аммиак. Соли аммонияСоли аммония можно получить взаимодействием аммиака с
кислотами
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
2. Соли аммония также получают в обменных реакциях
между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl + AgNO3 → AgCl + NH4NO3
3. Средние соли аммония можно получить из кислых солей
аммония. При добавлении аммиака кислая соль переходит в
среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с
образованием карбоната аммония:
NH4НCO3 + NH3 → (NH4)2CO3
21.
Химические свойства солей аммонияВсе соли аммония – сильные электролиты, почти
полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4+ + Cl–
2. Соли аммония проявляют свойства обычных растворимых
солей –вступают в реакции обмена с щелочами, кислотами
и растворимыми солями, если в продуктах образуется газ,
осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной
кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
Соли аммония реагируют с щелочами с образованием
аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на
ионы аммония. Выделяющийся аммиак можно обнаружить
по характерному резкому запаху и посинению
лакмусовой бумажки.
22.
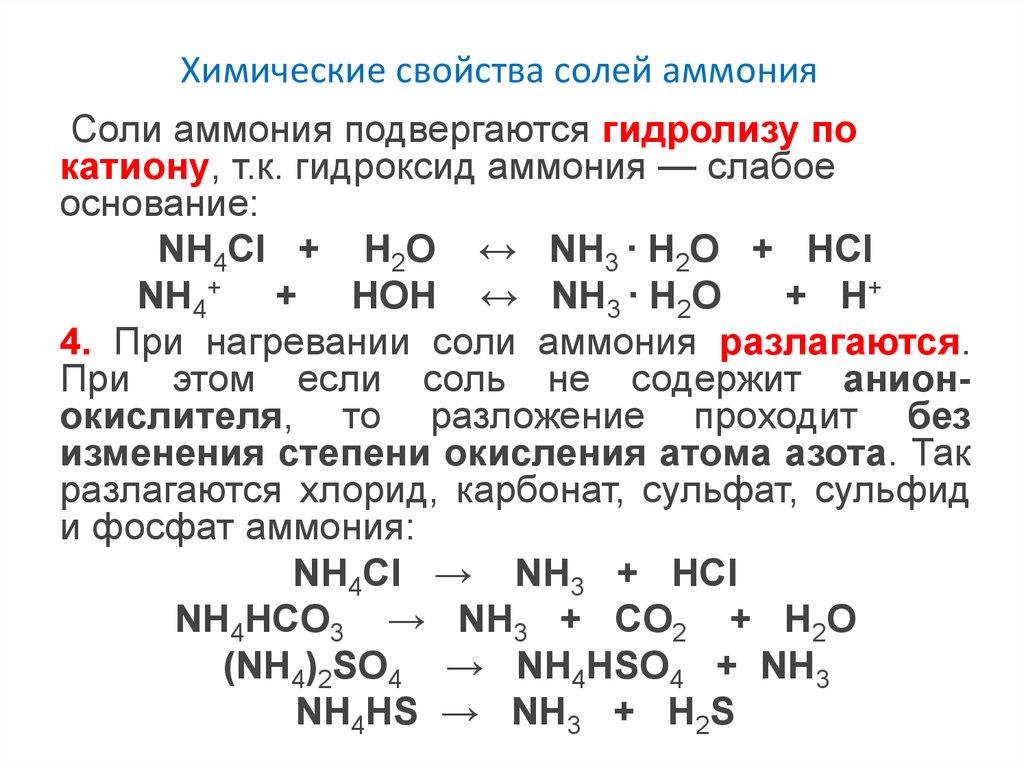
Химические свойства солей аммонияСоли аммония подвергаются гидролизу по
катиону, т.к. гидроксид аммония — слабое
основание:
NH4Cl + Н2O ↔ NH3 ∙ H2O + HCl
NH4+ + HOH ↔ NH3 ∙ H2O
+ H+
4. При нагревании соли аммония разлагаются.
При этом если соль не содержит анионокислителя, то разложение проходит без
изменения степени окисления атома азота. Так
разлагаются хлорид, карбонат, сульфат, сульфид
и фосфат аммония:
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
23.
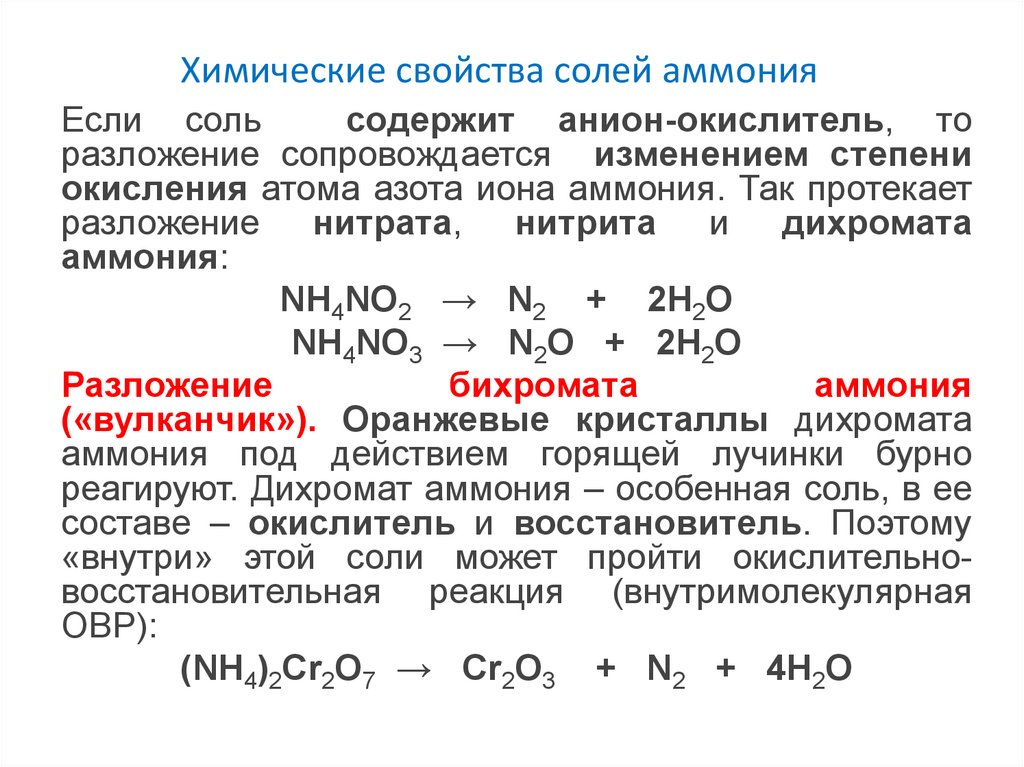
Химические свойства солей аммонияЕсли соль
содержит анион-окислитель, то
разложение сопровождается изменением степени
окисления атома азота иона аммония. Так протекает
разложение нитрата, нитрита и дихромата
аммония:
NH4NO2 → N2 + 2H2O
NH4NO3 → N2O + 2H2O
Разложение
бихромата
аммония
(«вулканчик»). Оранжевые кристаллы дихромата
аммония под действием горящей лучинки бурно
реагируют. Дихромат аммония – особенная соль, в ее
составе – окислитель и восстановитель. Поэтому
«внутри» этой соли может пройти окислительновосстановительная реакция (внутримолекулярная
ОВР):
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O






















 chemistry
chemistry








