Similar presentations:
Основания
1.
Основания – это сложные веществасостоящие из атомов металлов,
соединенных с одной или несколькими
гидроксогруппами (ОН).
I
I
KOH – гидроксид калия
Fe(OH)2 – гидроксид железа(II)
Fe(OH)3 – гидроксид железа (III)
2.
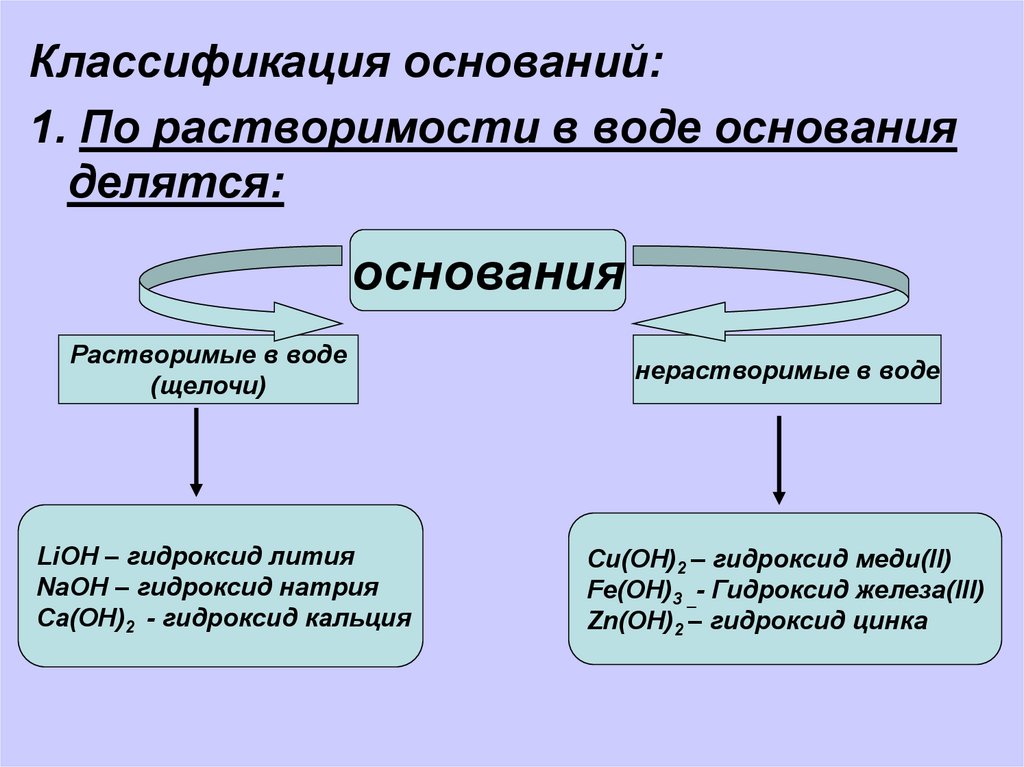
Классификация оснований:1. По растворимости в воде основания
делятся:
основания
Растворимые в воде
(щелочи)
LiOH – гидроксид лития
NaOH – гидроксид натрия
Ca(OH)2 - гидроксид кальция
нерастворимые в воде
Cu(OH)2 – гидроксид меди(II)
Fe(OH)3 _- Гидроксид железа(III)
Zn(OH)2 – гидроксид цинка
3.
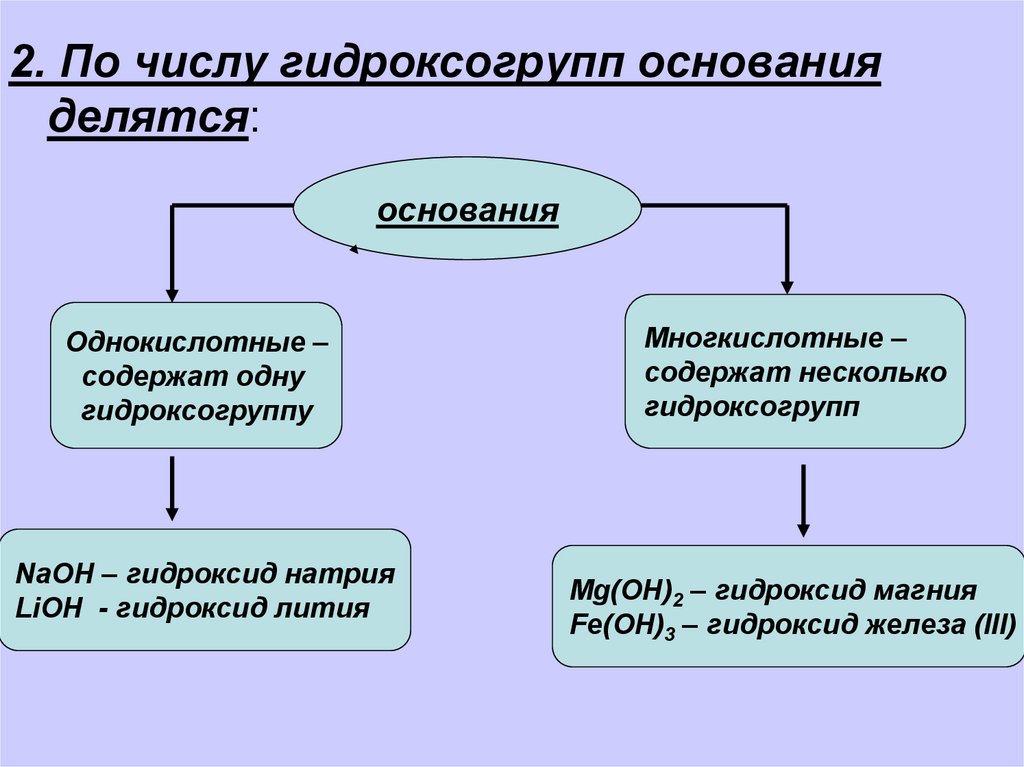
2. По числу гидроксогрупп основанияделятся:
основания
Однокислотные –
содержат одну
гидроксогруппу
NaOH – гидроксид натрия
LiOH - гидроксид лития
Многкислотные –
содержат несколько
гидроксогрупп
Mg(OH)2 – гидроксид магния
Fe(OH)3 – гидроксид железа (III)
4.
I. Получение растворимых оснований1. Взаимодействие активных
металлов (Li, Na, K, Rb, Cs, Fr, Ca, Sr,
Ba) с водой в результате реакции
образуются основание и водород.
I
I
2Na + 2H2O = 2NaOH + H2
гидроксид натрия
Са +2Н2О = Са(ОН)2 + Н2
гидроксид кальция
5.
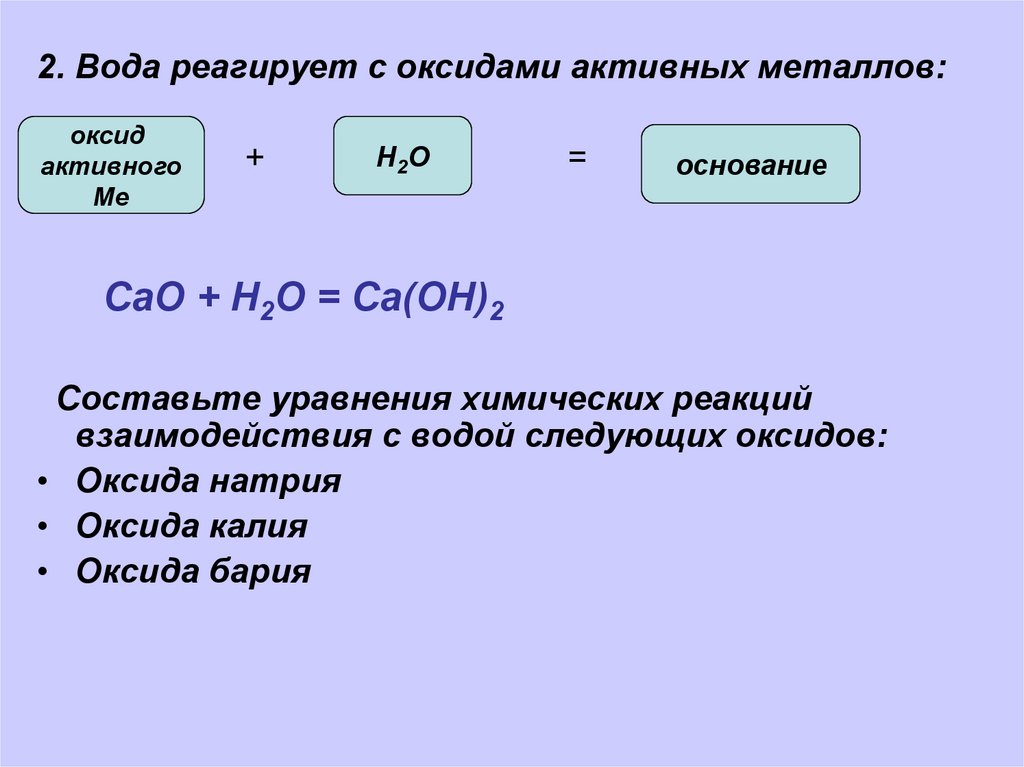
2. Вода реагирует с оксидами активных металлов:оксид
активного
Ме
+
Н 2О
=
основание
СаО + Н2О = Са(ОН)2
Составьте уравнения химических реакций
взаимодействия с водой следующих оксидов:
• Оксида натрия
• Оксида калия
• Оксида бария
6.
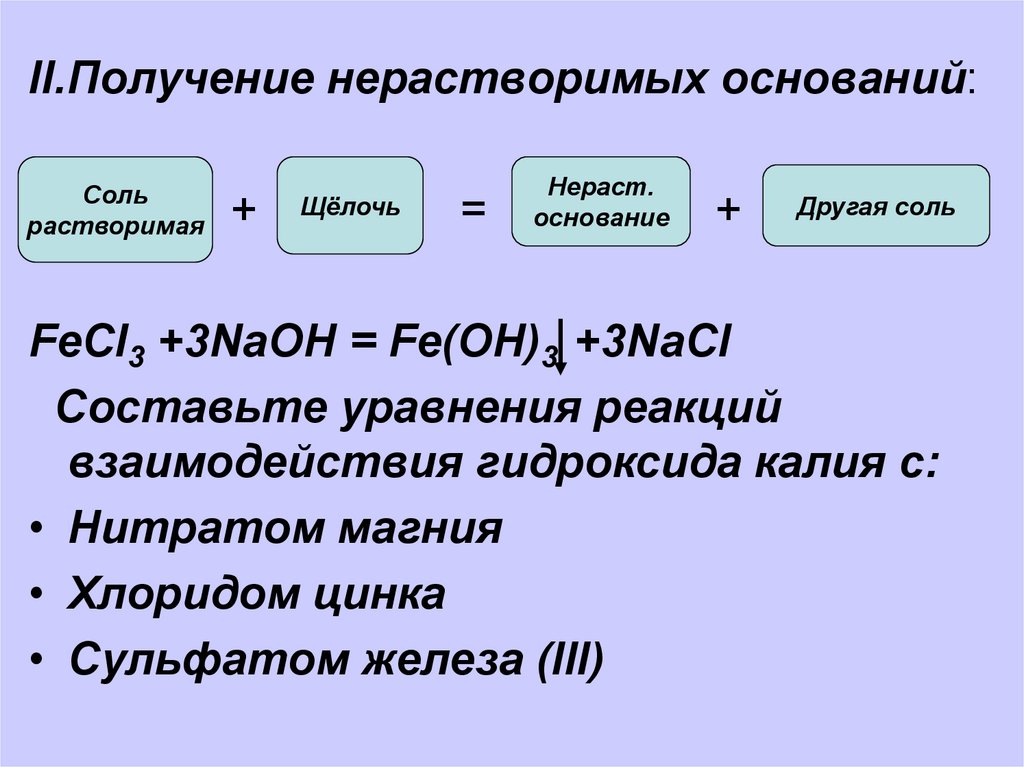
II.Получение нерастворимых оснований:Соль
растворимая
+
Щёлочь
=
Нераст.
основание
+
Другая соль
FeСl3 +3NaOH = Fe(OH)3 +3NaCl
Составьте уравнения реакций
взаимодействия гидроксида калия с:
• Нитратом магния
• Хлоридом цинка
• Сульфатом железа (III)


 chemistry
chemistry








