Similar presentations:
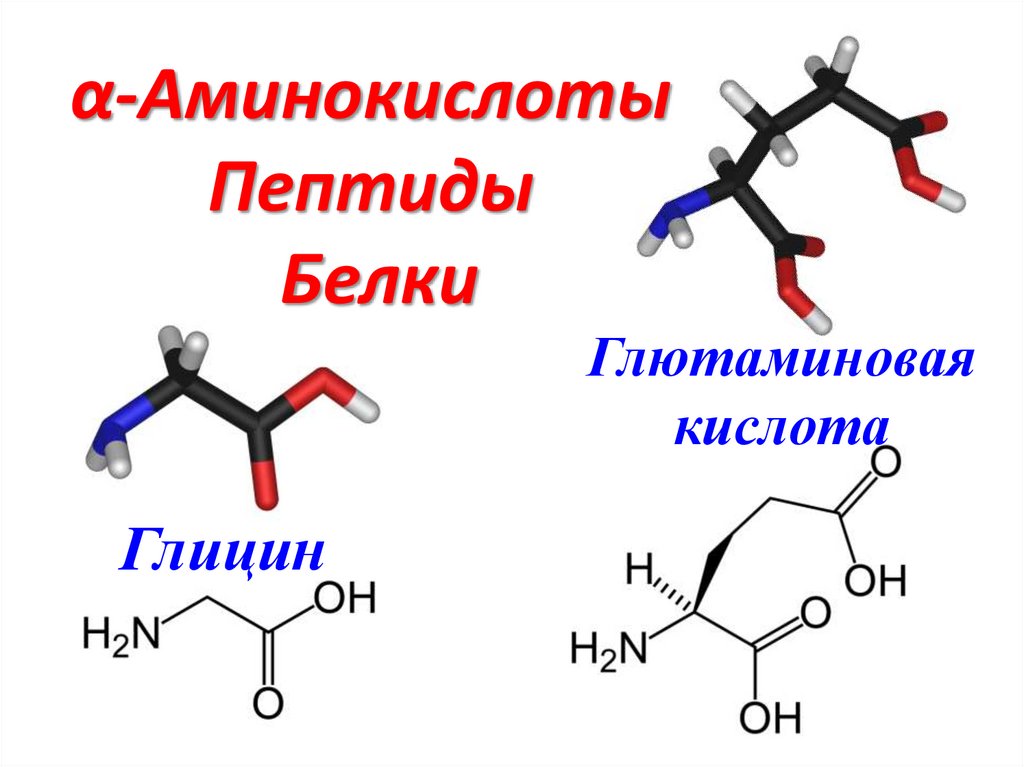
α-Аминокислоты
1.
α-АминокислотыПептиды
Белки
Глютаминовая
кислота
Глицин
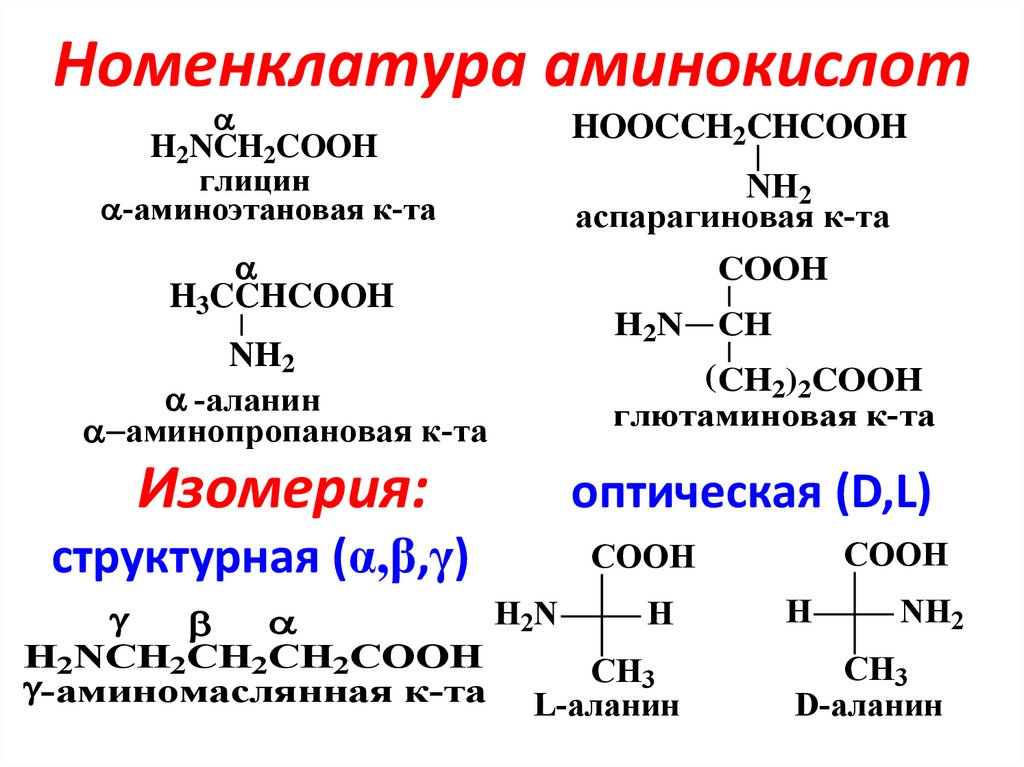
2. Номенклатура аминокислот
H2NCH2COOHглицин
-аминоэтановая к-та
H3CCHCOOH
NH2
-аланин
аминопропановая к-та
Изомерия:
структурная (α,β,γ)
HOOCCH2CHCOOH
NH2
аспарагиновая к-та
COOH
H2N
CH
(CH2)2COOH
глютаминовая к-та
оптическая (D,L)
COOH
COOH
H2N
H
H2NCH2CH2CH2COOH
CH3
-аминомаслянная к-та
L-аланин
H
NH2
CH3
D-аланин
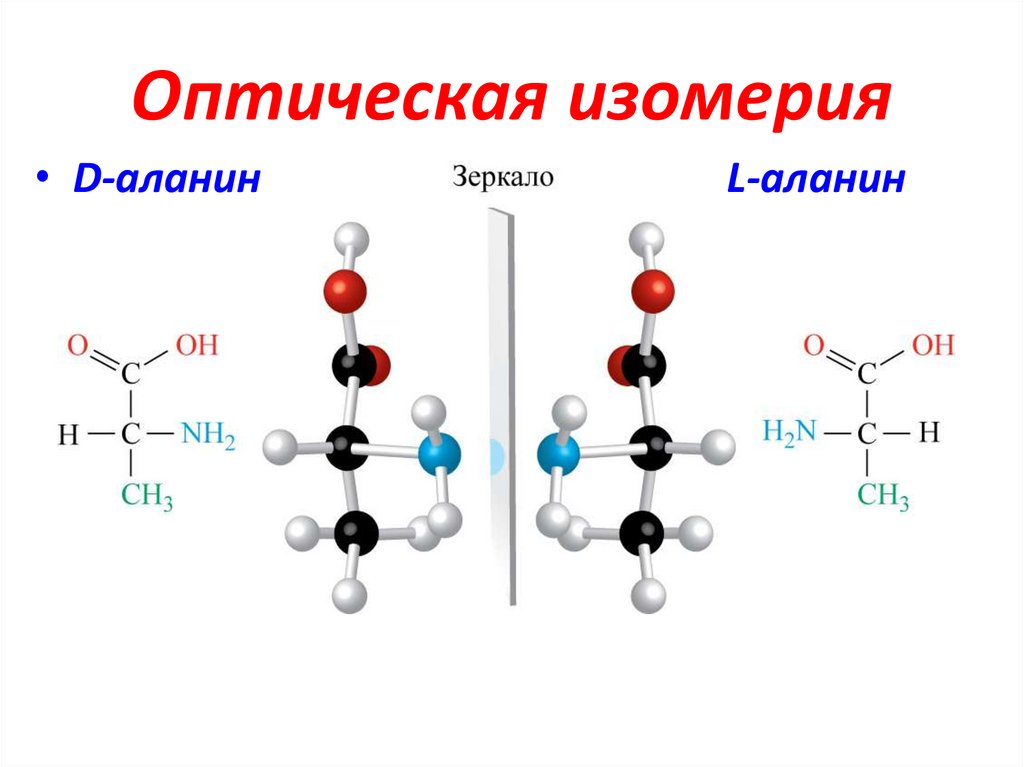
3. Оптическая изомерия
• D-аланинL-аланин
4. Способы получения
• 1. Гидролиз белков (для α-аминокислот)- Н+,ОНферментативный. Разделяют аминокислоты:ионообменной хром-ей, электрофорезом, ГЖХ.
• 2. Присоединение (1,4 АЕ) NH3 (против правила
Морковникова) к α,β-ненасыщенным к-там
CH2 CH C
O
OH
акриловая к-та
..
HNH2
CH2 CH
C
O H
OH
NH2
перегруппировка Эльтекова
CH2 CH2 C
O
OH
NH2
пропановая к-та
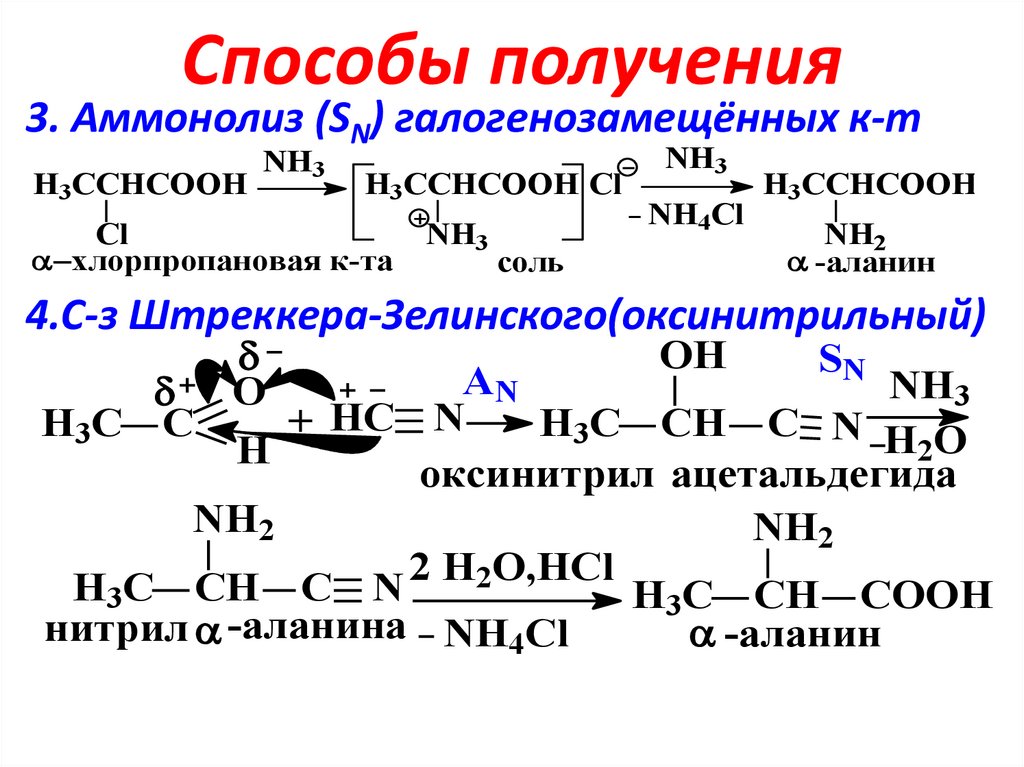
5. Способы получения
3. Аммонолиз (SN) галогенозамещённых к-тH3CCHCOOH
NH3
H3CCHCOOH Cl
Cl
хлорпропановая к-та
NH3
соль
NH3
NH4Cl
H3CCHCOOH
NH2
-аланин
4.С-з Штреккера-Зелинского(оксинитрильный)
OH
SN
AN
NH3
O
+ HC N
H3C C
H3C CH C N H O
2
H
оксинитрил ацетальдегида
NH2
NH2
2
H
O,HCl
2
H3C CH C N
H3C CH COOH
нитрил -аланина NH4Cl
-аланин
6. Способы получения
5. Восстановление ароматических нитрок-тCH3
HNO3 k
H2SO4 k
H 2O
толуол
[O]
COOH SE
HNO3 k
H2SO4 k
H 2O
COOH
CH3
[O]
COOH
6[H]
-2H2O
NO2
NO2
COOH
n-амино NH2
бензойная к-та
COOH
6[H]
-2H2O
NH2
NO2
м-аминобензойная
к-та
7. Физические св-ва α-аминок-т
• α-Аминокислоты–бесцветные крист. в-ва,ЛР в H2O, высокая tпл, нелетучи. Природные
α-аминокислоты L-ряда – безвкусные, D-ряда
– сладкие. «Природные» α-аминокислоты –
L-ряда - используются для построения белков
человеческого организма. Аминокислоты Dряда – «неприродные», чужеродны
человеческому организму. Напр. D-глутаминовая к-та входит в состав белков бактерий
сибирской язвы.
• L-глутаминовая к-та имеет вкус мяса
(усилитель вкуса глутамат натрия)
8. Глутамат натрия E621
Глутамат натрия E621• мононатриевая соль глутаминовой кислоты
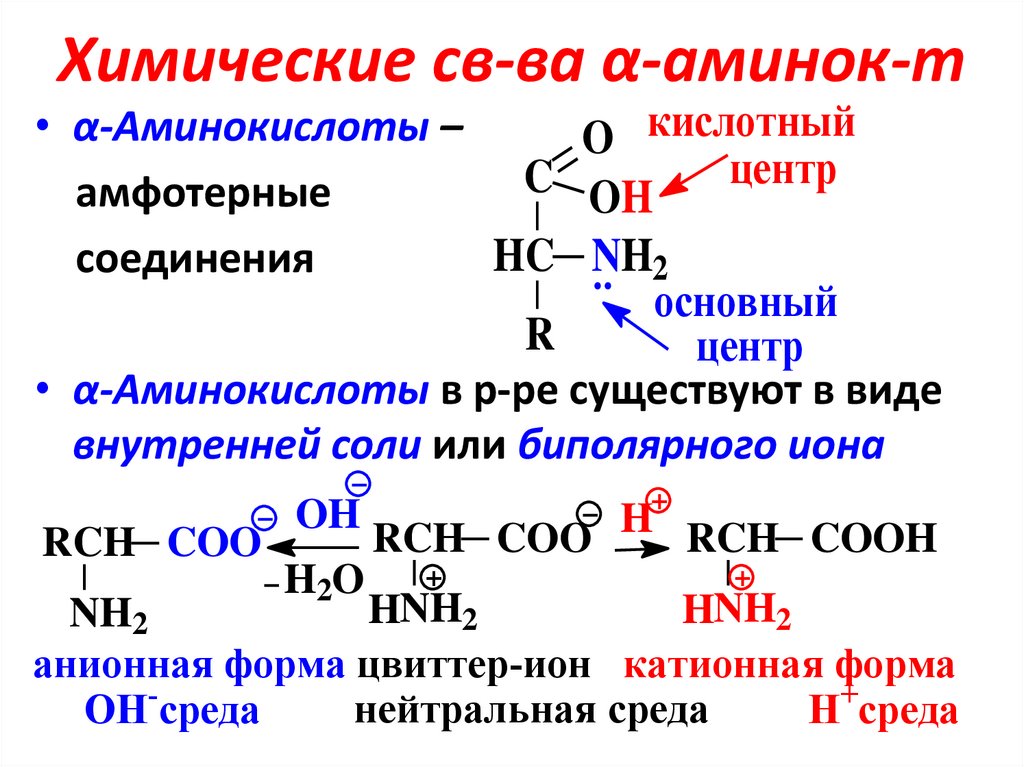
9. Химические св-ва α-аминок-т
• α-Аминокислоты –O кислотный
центр
C
амфотерные
OH
HC NH2
соединения
основный
R
центр
• α-Аминокислоты в р-ре существуют в виде
внутренней соли или биполярного иона
RCH COO
OH
H2O
RCH COO H RCH COOH
HNH2
HNH2
NH2
анионная форма цвиттер-ион катионная форма
нейтральная среда
OH-среда
H+среда
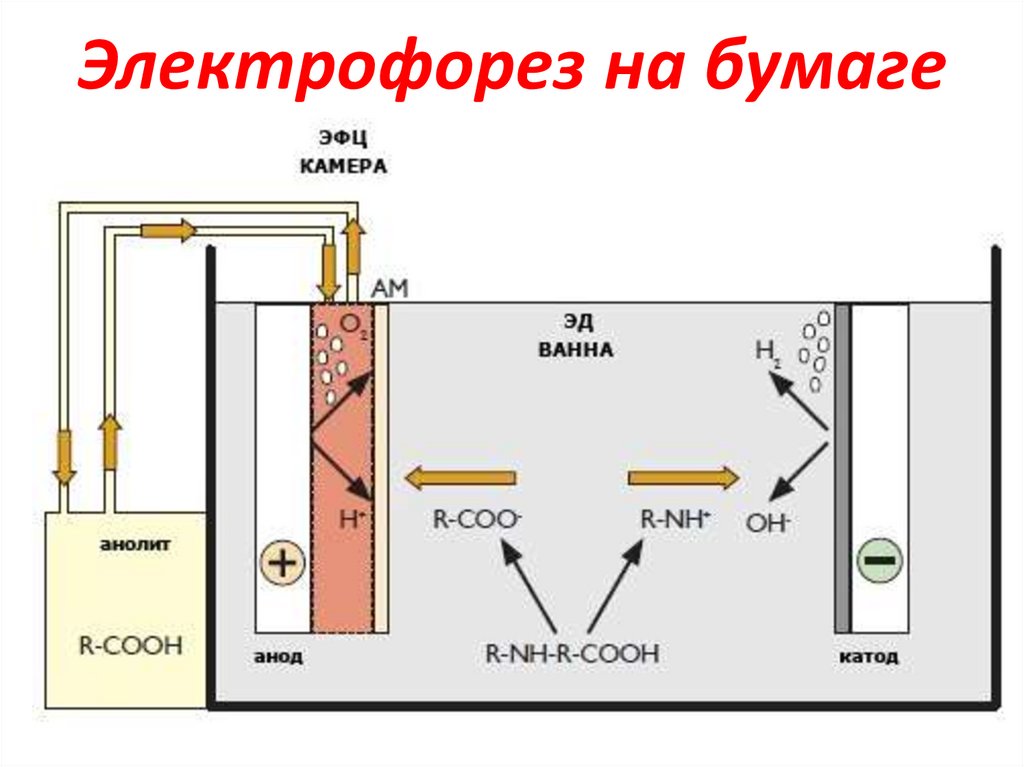
10. Электрофорез на бумаге
+An
ванна
для
электрофореза
-
Kat бумага
для
электрофореза
буферный
раствор
• Ацетатный буферный р-р – аминокислота в
катионной форме движется от Аn+ к Каt• Аммиачный буферный р-р – аминокислота
в анионной форме движется от Каt- к Аn+
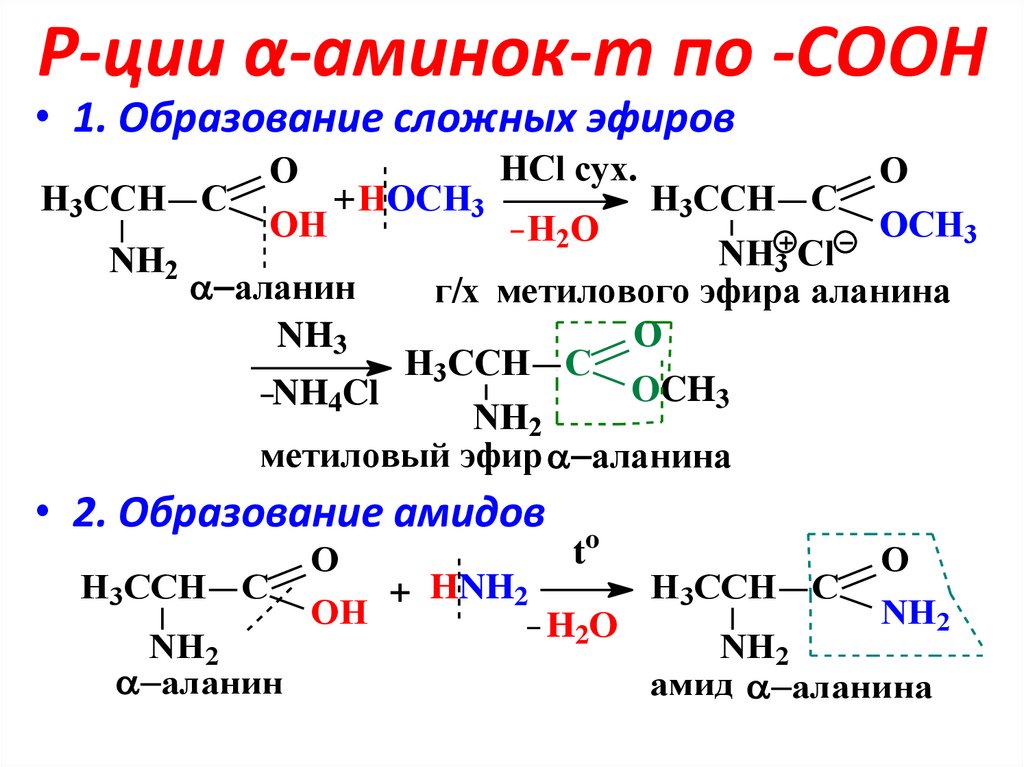
11. Р-ции α-аминок-т по -СООН
• 1. Образование сложных эфировHCl сух.
O
O
H3CCH C
H3CCH C
+ HOCH3
OH
OCH3
H2O
NH3 Cl
NH2
аланин
г/х метилового эфира аланина
O
NH3
H3CCH C
OCH3
NH4Cl
NH2
метиловый эфир аланина
• 2. Образование амидов
to
O
O
H3CCH C
H3CCH C
+ HNH2
OH
NH2
H2O
NH2
NH2
аланин
амид аланина
12. Р-ции α-аминок-т по -СООН
• 3. Образование галогенангидридовO
O
H3CCH C
H3CCH C
+ PCl5
Cl
POCl3
OH
NHCCH3
HCl
NHCCH3
N-ацетилхлорангидрид
аланин O
N-ацетил- аланина O
Ангидридов и галогенангидридов аминокислот не
существует из-за высокой реакционоспособ-ти –NH2
• 4. Декарбоксилирование ( получение аминов
из аминокислот)
Ba(OH) ,to
H3CCH
NH2
O
C
OH CO2
твёрдый
2
H3CCH2NH2
этиламин
13. Р-ции α-аминок-т по -NH2
• 1. Ацилирование (как способ защиты –NH2)H3CCHCOOH + H3CC
H NH
аланин
O
H3CCHCOOH
Cl HCl
NHCCH3
ацетилхлорид
N-ацетил- O
аланина
• 2. Алкилирование
H3CCHCOOH
HNH
CH3I
HI
H3CCHCOOH
CH3I
HI
H NCH3
N-метил- аланин
CH3I
H3CCHCOOH
H3CCHCOOH
H3C NCH3
H3C NCH3
I
N,N-диметил- аланин
CH3
триметиламмоний йодид аланина
14. Р-ции α-аминок-т по -NH2
• 3. Дезаминирование с НNO2 до гидроксик-тH3CCHCOOH HNO2 H3CCHCOOH HOH,to H3CCHCOOH
N N
соль диазония
NH2
N2 , H+
OH
молочная к-та
• 4. Образование иминов с альдегидами
H3CCHCOOH
NH2
AN -H2O
H2O
+ O CH2
NaOH
H3CCHCOOH
..
H2O
N CH2
имин аланина
H3CCHCOONa
N CH2
• Используется в количественном анализе αаминокислот – метод формольного
титрования
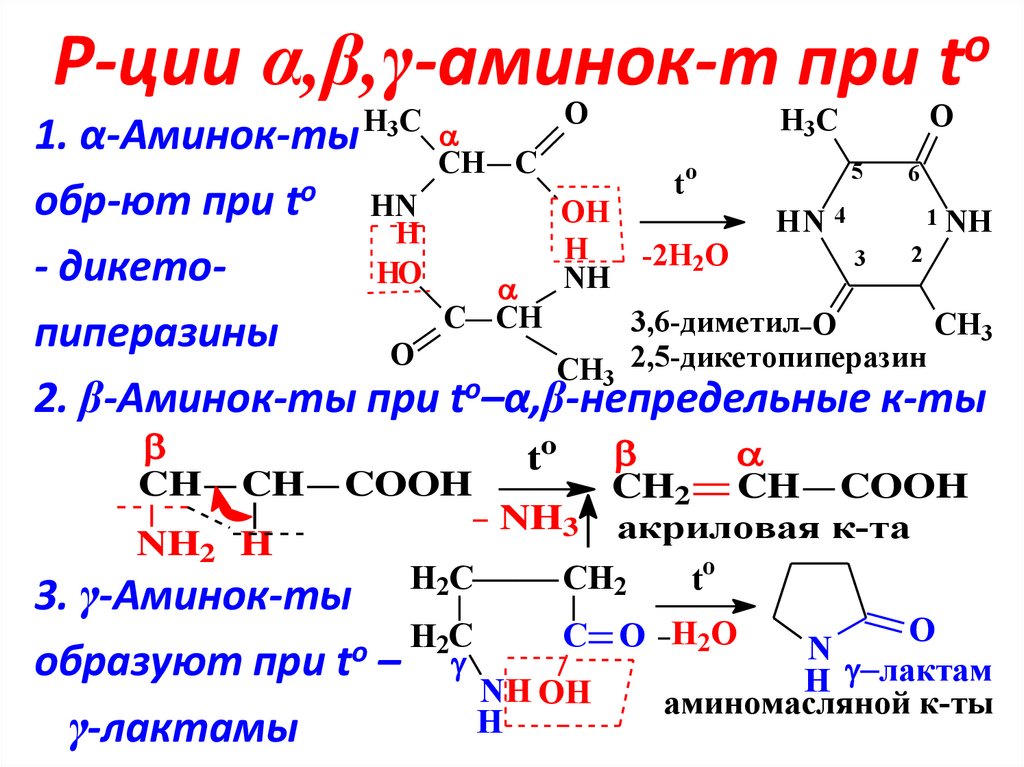
15. Р-ции α,β,γ-аминок-т при to
Р-ции α,β,γ-аминок-т приo
t
O
O
H3C
H3C
1. α-Аминок-ты
CH C
o
5
6
t
o
обр-ют при t
HN
OH
1 NH
HN 4
H
H
2
-2H2O
3
- дикетоHO
NH
C CH
3,6-диметил O
CH3
пиперазины
O
CH3 2,5-дикетопиперазин
2. β-Аминок-ты при to–α,β-непредельные к-ты
CH
CH COOH
CH2 CH COOH
NH3 акриловая к-та
NH2 H
H2C
CH2
to
3. γ-Аминок-ты
O
H
O
C
C
O
H
2
2
N
образуют при to –
лактам
H
NH OH
аминомасляной к-ты
H
γ-лактамы
to
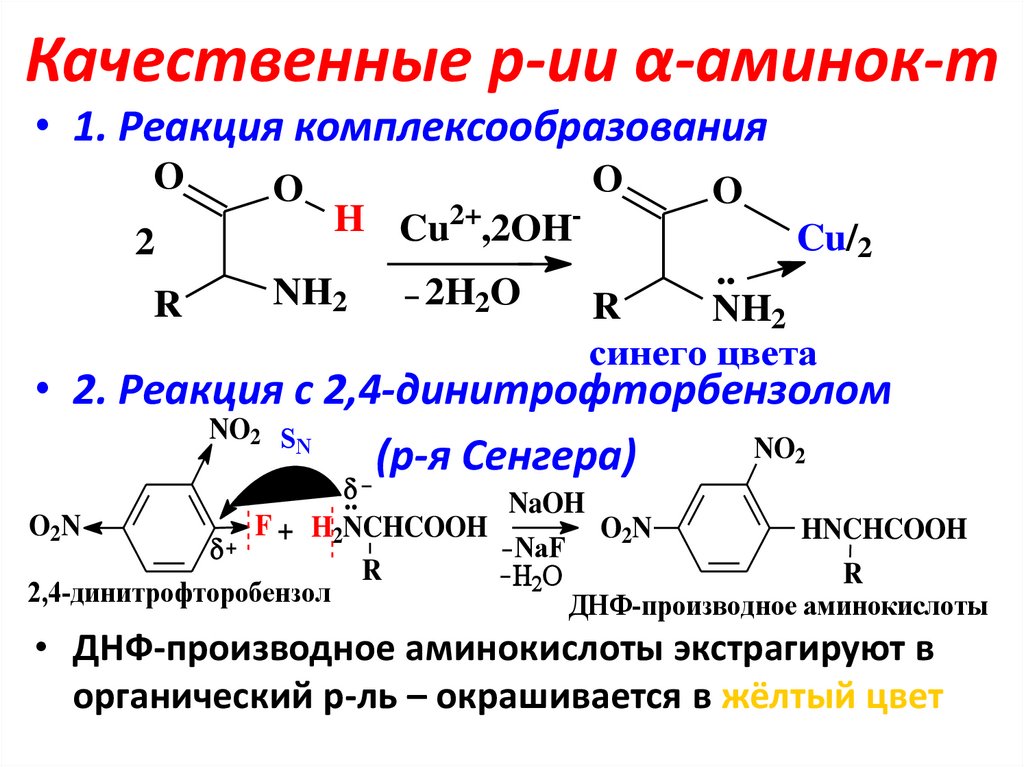
16. Качественные р-ии α-аминок-т
• 1. Реакция комплексообразованияO
2
R
O
O
H Cu2+,2OH-
NH2
2H2O
O
Cu/2
..
R
NH2
синего цвета
• 2. Реакция с 2,4-динитрофторбензолом
NO2 S
N
NO2
(р-я Сенгера)
..
NaOH
O2N
F + H2NCHCOOH
O2N
HNCHCOOH
NaF
R
R
2,4-динитрофторобензол
ДНФ-производное аминокислоты
• ДНФ-производное аминокислоты экстрагируют в
органический р-ль – окрашивается в жёлтый цвет
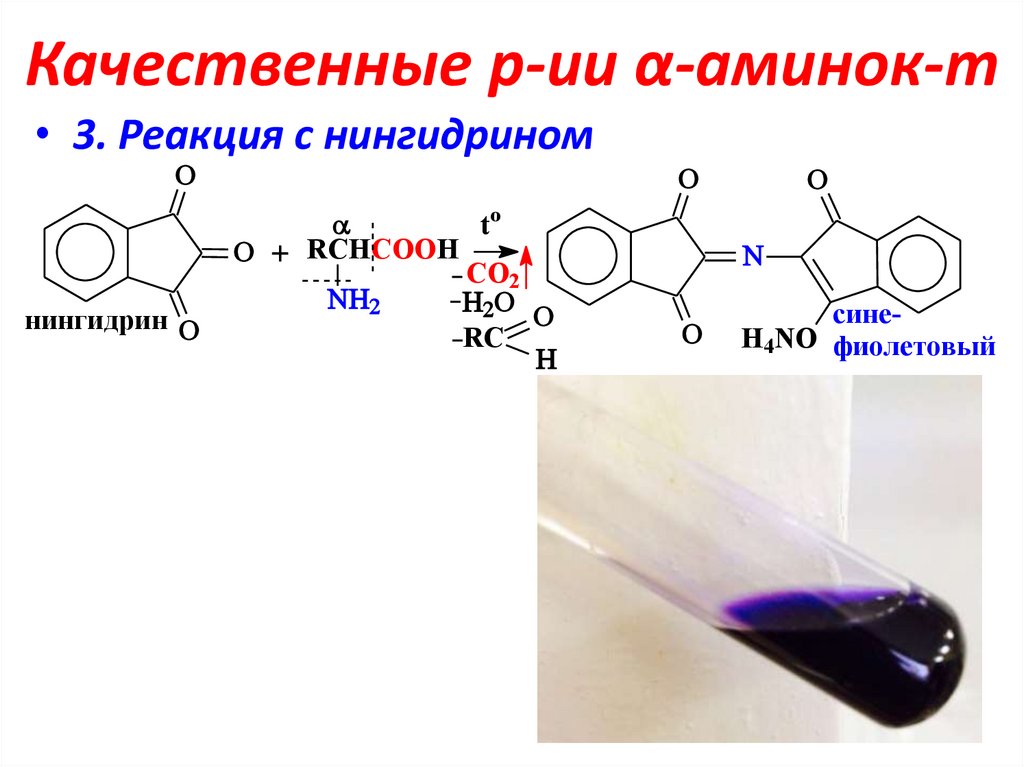
17. Качественные р-ии α-аминок-т
• 3. Реакция с нингидриномнингидрин
to
RCHCOOH
CO2
RC
синеH4NO фиолетовый
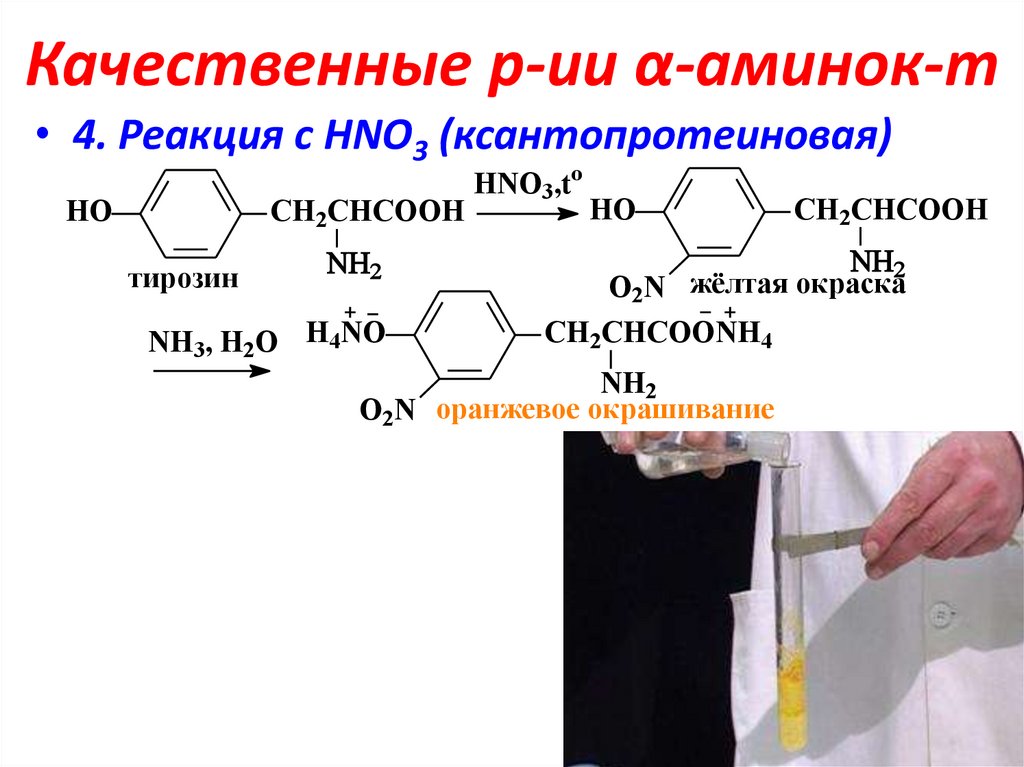
18. Качественные р-ии α-аминок-т
• 4. Реакция с НNO3 (ксантопротеиновая)HO
CH2CHCOOH
тирозин
NH3, H2O H4NO
HNO3,to
HO
CH2CHCOOH
O2N жёлтая окраска
CH2CHCOONH4
NH2
O2N оранжевое окрашивание
19. Применение аминокислот
Глицин• уменьшает психоэмоциональное напряжение
• повышает умственную работоспособность
γ-аминомасляная кислота
• снимает возбуждение и оказывает успокаивающее
действие
• при эпилепсии, синдроме дефицита внимания
Стресс
• Во время стресса необходимы аминокислоты
• Недостаток аминокислот снижает иммунитет
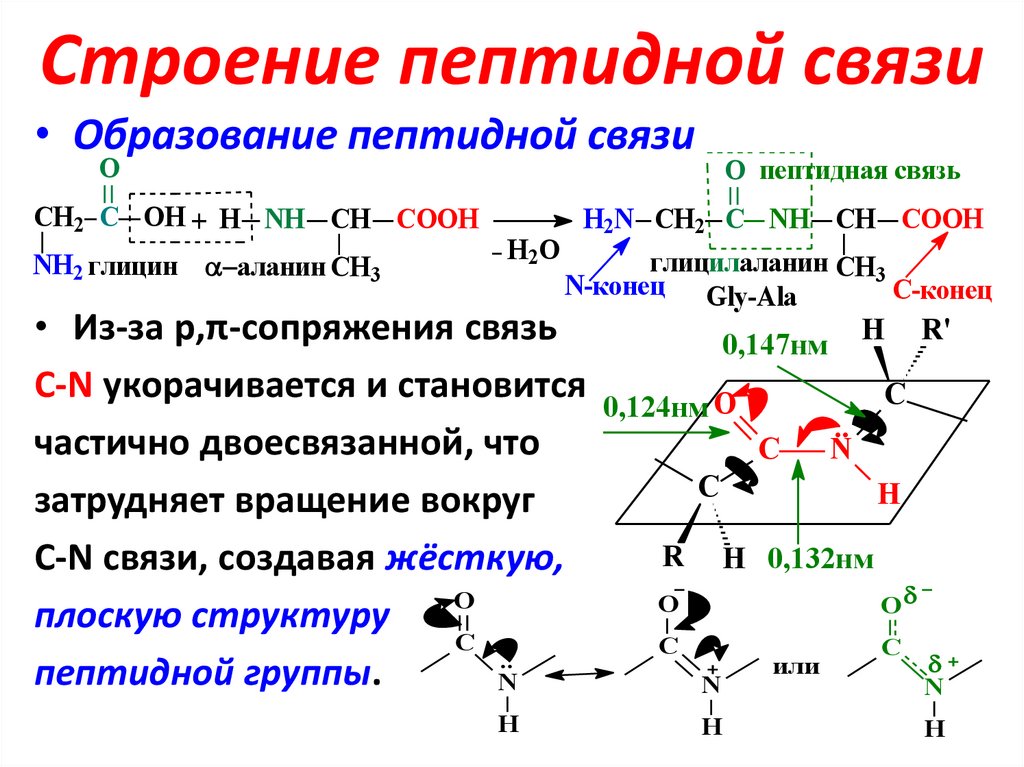
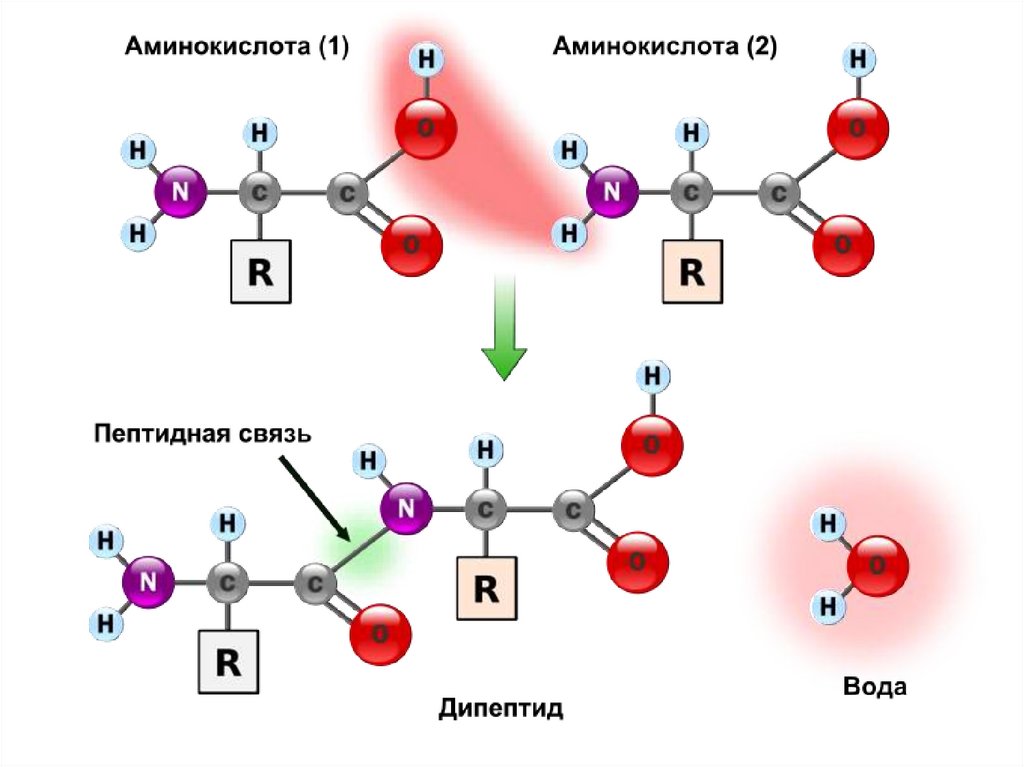
20. Строение пептидной связи
• Образование пептидной связиO
CH2 C OH + H NH CH COOH
NH2 глицин аланин CH3
H2O
O пептидная связь
H2N CH2 C NH CH COOH
глицилаланин CH3
N-конец Gly-Ala
С-конец
H R'
связь
0,147нм
• Из-за p,π-сопряжения
С-N укорачивается и становится
частично двоесвязанной, что
затрудняет вращение вокруг
С-N связи, создавая жёсткую,
O
плоскую структуру
С
..
пептидной группы.
N
H
0,124нм O
C
..
N
C
R
C
H
H 0,132нм
O
O
С
N
H
или
С
N
H
21.
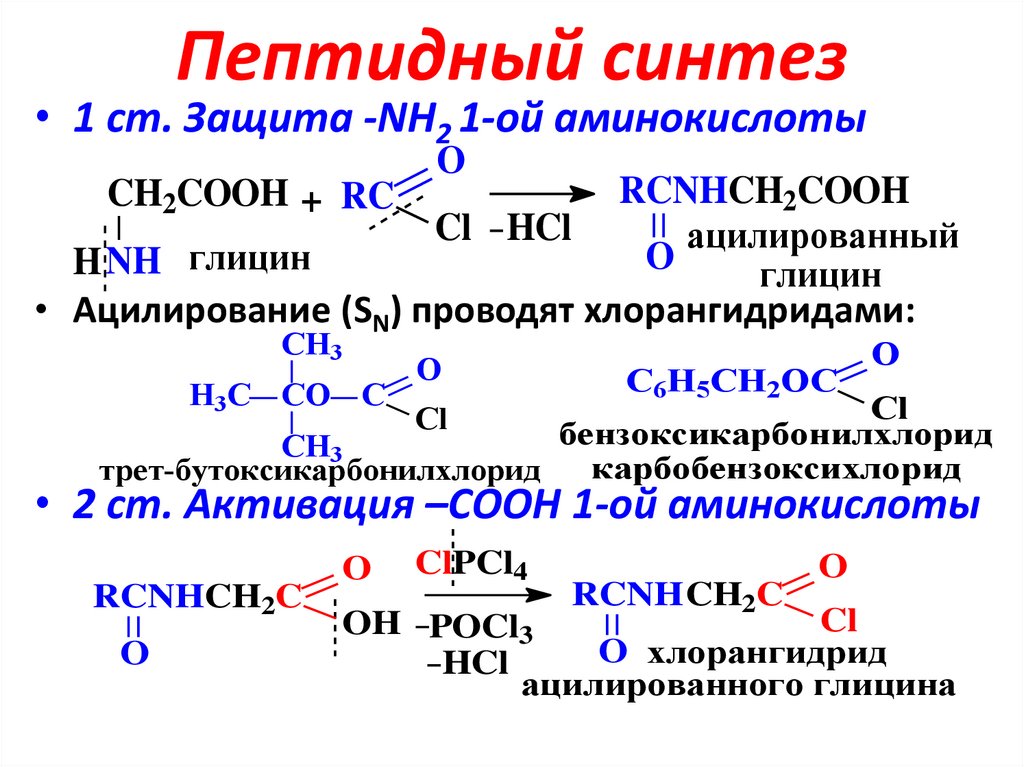
22. Пептидный синтез
• 1 ст. Защита -NH2 1-ой аминокислотыO
RCNHCH2COOH
CH2COOH + RC
Cl HCl
ацилированный
O
H NH глицин
глицин
• Ацилирование (SN) проводят хлорангидридами:
CH3
H3C CO
C
O
C6H5CH2OC
O
Cl
бензоксикарбонилхлорид
CH3
карбобензоксихлорид
трет-бутоксикарбонилхлорид
Cl
• 2 ст. Активация –СООН 1-ой аминокислоты
RCNHCH2C
O
O
ClPCl4
RCNH CH2C
O
Cl
OH POCl3
O хлорангидрид
HCl
ацилированного глицина
23. Пептидный синтез
• 3 ст. Защита –СООН 2-ой аминокислотыCH3CHC
O
OH
+ EtOH
H+
CH3CHC
OEt
H2O
NH2
этиловый эфир аланина
NH2
аланин
• 4 ст. Образование пептидной связи
RCNH CH2C
CH3
O
O
+ HNHCHC
Cl
O
O
OEt HCl
RCNH CH2C
O
O
CH3
NCHC
H
O
OEt
• 5 ст. Удаление защиты групп гидролизом
H CH3
O
C
гидролиз H2N
EtOH
RCH3, CO2
C
C
N
H H
H
COOH
дипептид
глицилаланин
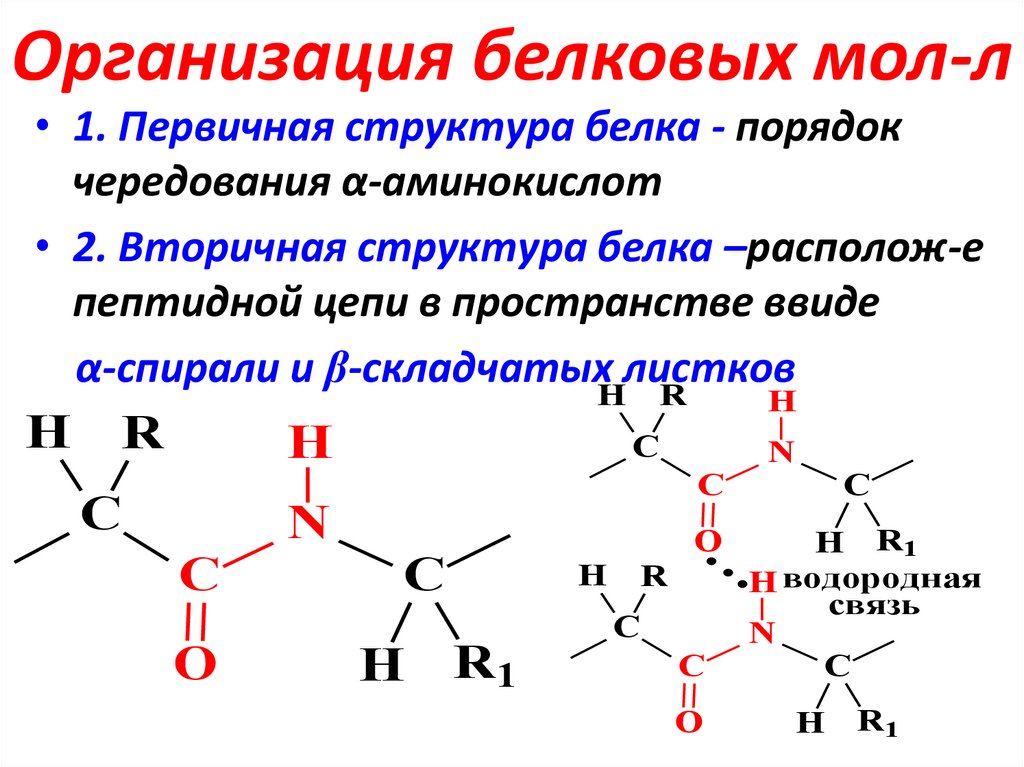
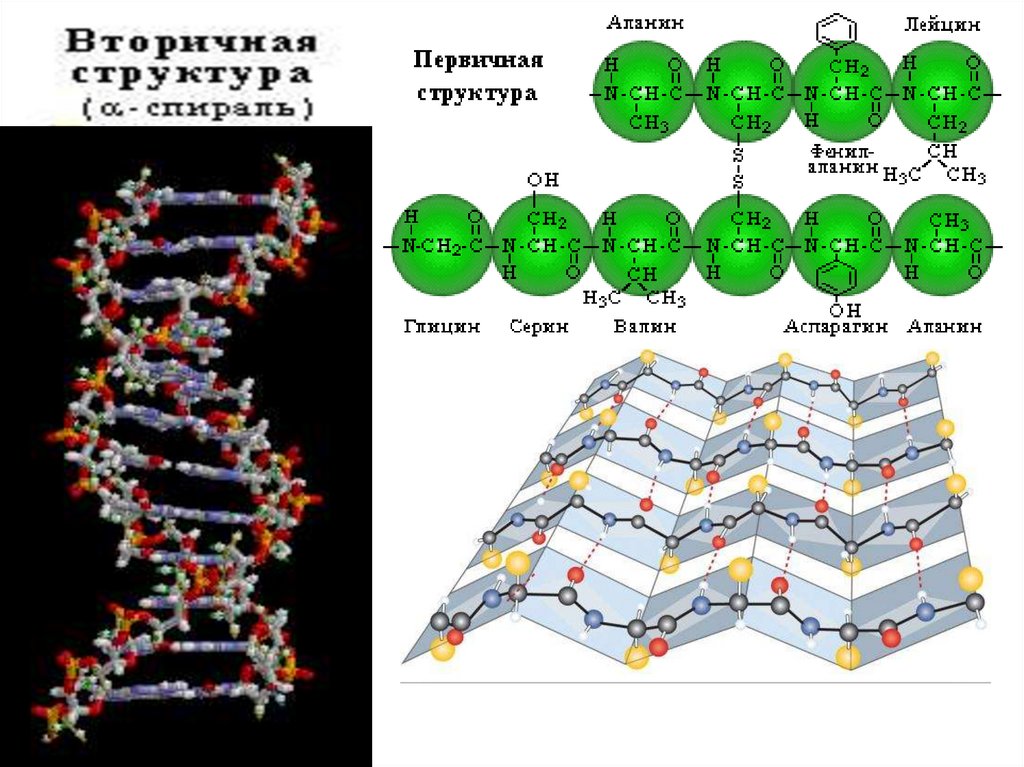
24. Организация белковых мол-л
• 1. Первичная структура белка - порядокчередования α-аминокислот
• 2. Вторичная структура белка –располож-е
пептидной цепи в пространстве ввиде
α-спирали и β-складчатых листков
H R
H
H R
С
H
N
С
C
O
N
C
H
H
R1
C
C
O
H R1
H водородная
связь
N
C
R
С
C
O
H
R1










 chemistry
chemistry








