Similar presentations:
Қайтымды реакциялар
1.
ТапсырмаЖұппен жұмыс
• 0,5 моль, 0,2 моль өнім түзілу барысында
бөлінетін жылу мөлшерін анықтаңыз.
• А) 2Н2 +О2 = 2Н2О + 572 кДж
• В) 4Al + 3O2 = 2Al2O3 + 3282кДж
• С) СН4 + 2О2 = СО2 + 2Н2О + 880 кДж
• Д) 2Fe + O2 = FeO + 532 кДж
2.
Бүгінгі сабағымыз не жайындаболмақ?
3.
Мына суреттен қанша реакциякөріп тұрсыздар?
4.
Жауаптары:1. Адамның тыныс алуы
2.Судың булануы
3. Заводтарда түтіннің шығуы
4. машинаның оталдырғышында
бензиннің жануы нәтижесінде пайда
болған газ
5. Есіктің топсасының жіне темір
тордың тот басуы
6.Оттың жануы
7. Тас үстіндегі шоколадтың балқуы
5.
6.
Сабақ тақырыбы:Қайтымды реакциялар
№ 6 Көрсетілім «Қайтымды химиялық
реакциялар»
7.
Сабақ мақсаты:• - жағдайлардың өзгеруі әсерінен кейбір
реакциялардың қайтымды болуы мүмкін
екендігін түсіндіру
• - химиялық тепе – теңдікті динамикалық
үдеріс ретінде түсіну
• - химиялық тепе-теңдікті бөлшектер
теориясы тұрғысынан түсіндіру
8.
Бағалау критерийлері:- Қайтымды және қайтымсыз реакцияларды ажырата алады;
-Жағдайлардың өзгеруі әсерінен кейбір реакциялардың
қайтымды болуы мүмкін екендігін түсіндіре алады
9.
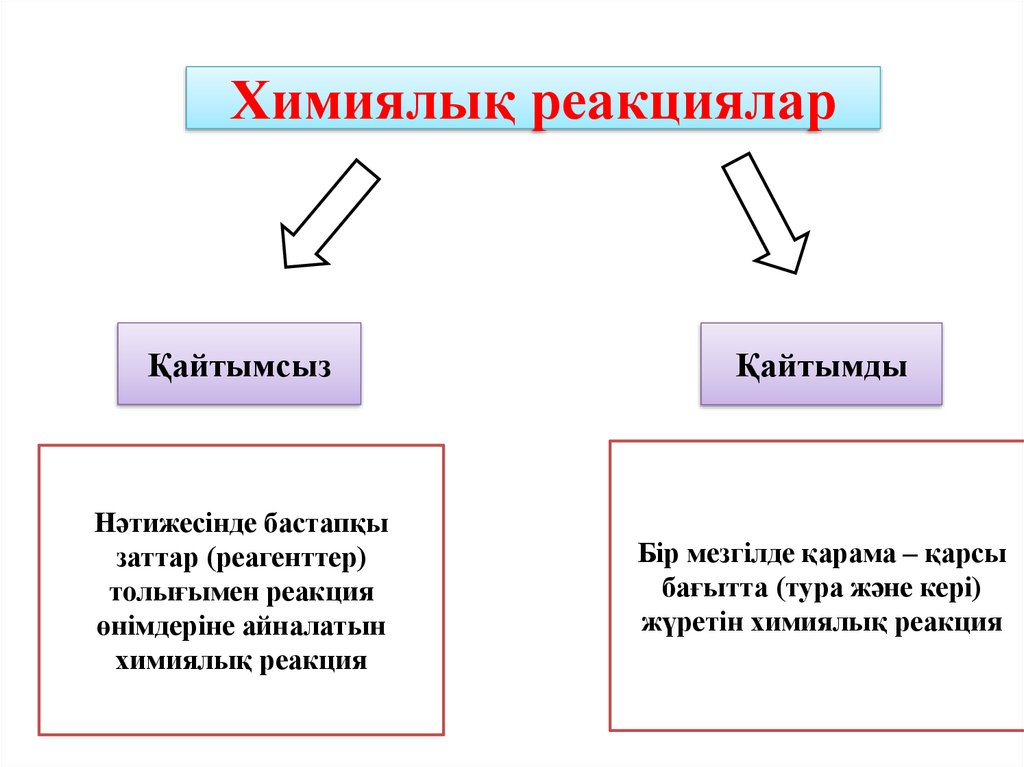
Химиялық реакцияларҚайтымсыз
Қайтымды
Нәтижесінде бастапқы
заттар (реагенттер)
толығымен реакция
өнімдеріне айналатын
химиялық реакция
Бір мезгілде қарама – қарсы
бағытта (тура және кері)
жүретін химиялық реакция
10.
жану1. Тұнбаның түсуі
Кейбір
қосылыстардың
ыдырауы
2. Газ бөліну
3. Өте аз диссоцияланатын заттар п.б.
Н2О
11.
Қайтымсыз реакцияларАgNO3 + NaCl → AgCl↓+NaNO3
2LiOH + H2SO4 → Li2SO4+2H2O
K2CO3 + 2HCl → 2KCl + CO2↑+ H2O
12.
Қайтымды реакцияларN2 + 3H2 ↔ 2NH3
N2 + O2 ↔ 2NO
FeCl3 + 3KCNS ↔ Fe(CNS)3+ 3KCl
сары
түссіз
қызыл
түссіз
13.
Қайтымды және қайтымсыз реакциялар• Бензинде табылған көмірсутектің негізгі жану өнімдері –
көмірқышқыл газы мен су буы. Бұл газ тәрізді өнімдерден
бензин алу мүмкін емес. Осылайша, бензиннің жану
процесі қайтымсыз реакция болады.
• реагенттер → өнімдер
A⟶B
14.
• Қайтымды реакциялар жүру бағыттарытура не айтуға болады?
Қайтымды реакциялар соңына дейін жүрмейді.
https://www.youtube.com/watch?v=JsoawKguU6A
15.
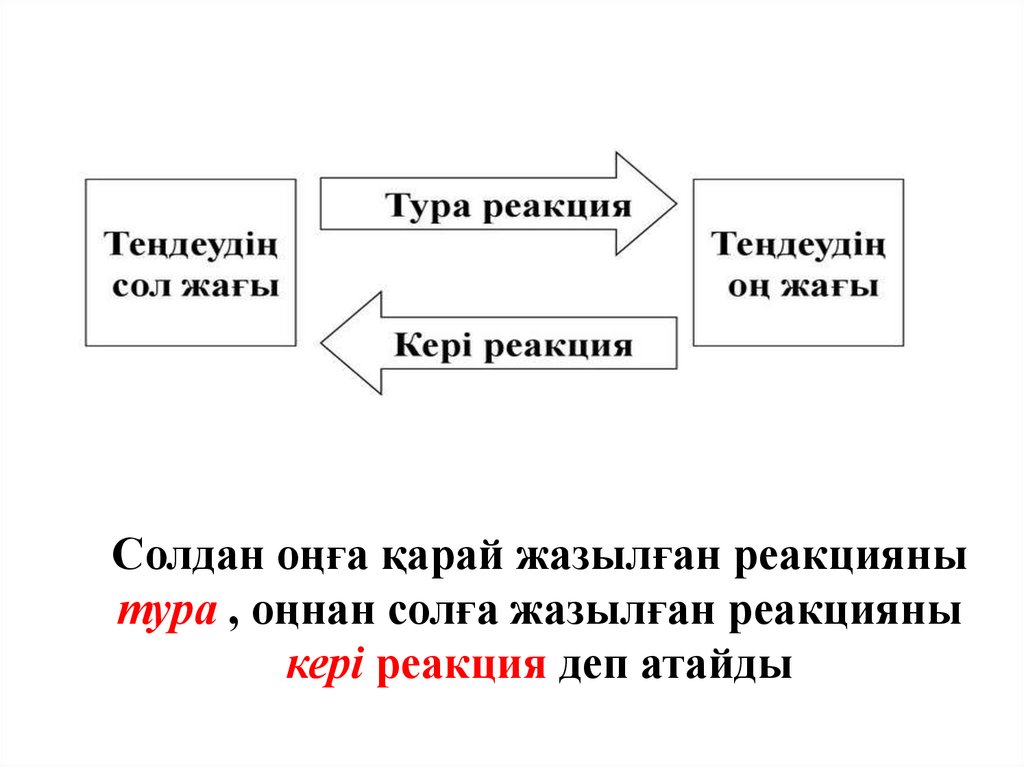
Солдан оңға қарай жазылған реакциянытура , оңнан солға жазылған реакцияны
кері реакция деп атайды
16.
Кез-келген қайтымды реакция реакция үшін бастапқысәтте әрекеттесуші массалар заңына сәйкес тура
реакцияның жылдамдығы нөлге тең. Уақыт өте келе
бастапқы заттардың концентрациялары кемиді., кері
реакциялардың жылдамдығы артады. Ерте ме, кешпе
реакцияның жылдамдықтары теңесетін кез болады, ол
кезде жүйеде тепе-теңдік орнайды.
17.
Химиялық тепе-теңдікТура және кері реакциялардың жылдамдықтары
тең болғандағы жүйенің күйін химиялық тепетеңдік деп атайды.
18.
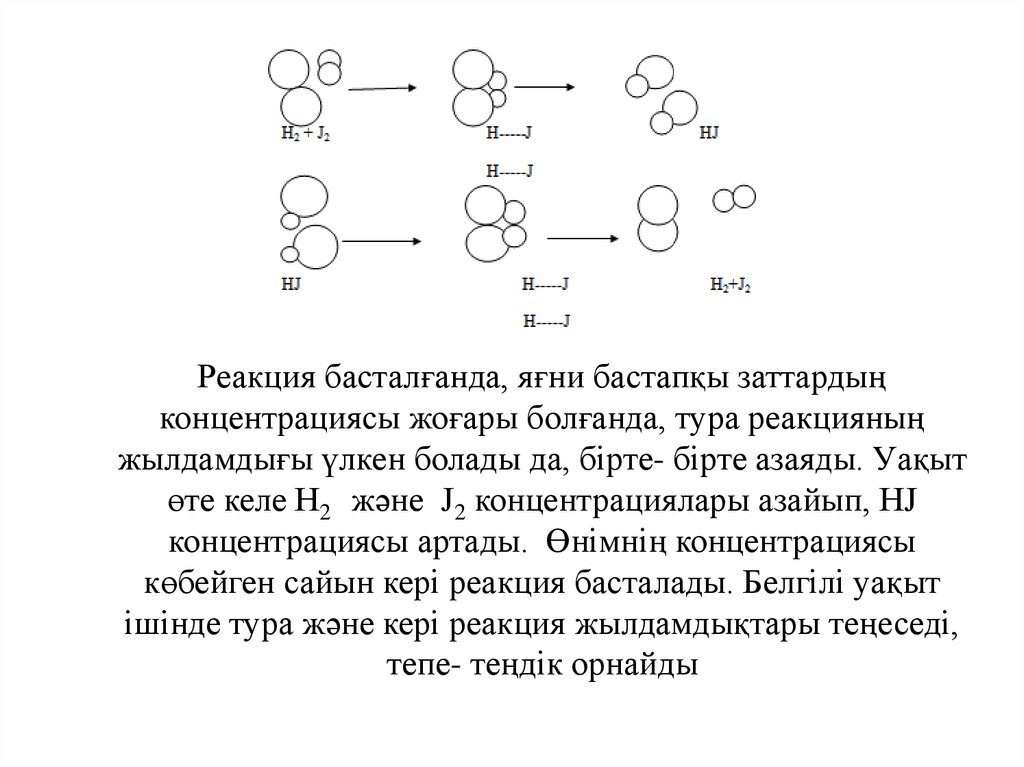
Реакция басталғанда, яғни бастапқы заттардыңконцентрациясы жоғары болғанда, тура реакцияның
жылдамдығы үлкен болады да, бірте- бірте азаяды. Уақыт
өте келе Н2 және J2 концентрациялары азайып, НJ
концентрациясы артады. Өнімнің концентрациясы
көбейген сайын кері реакция басталады. Белгілі уақыт
ішінде тура және кері реакция жылдамдықтары теңеседі,
тепе- теңдік орнайды
19.
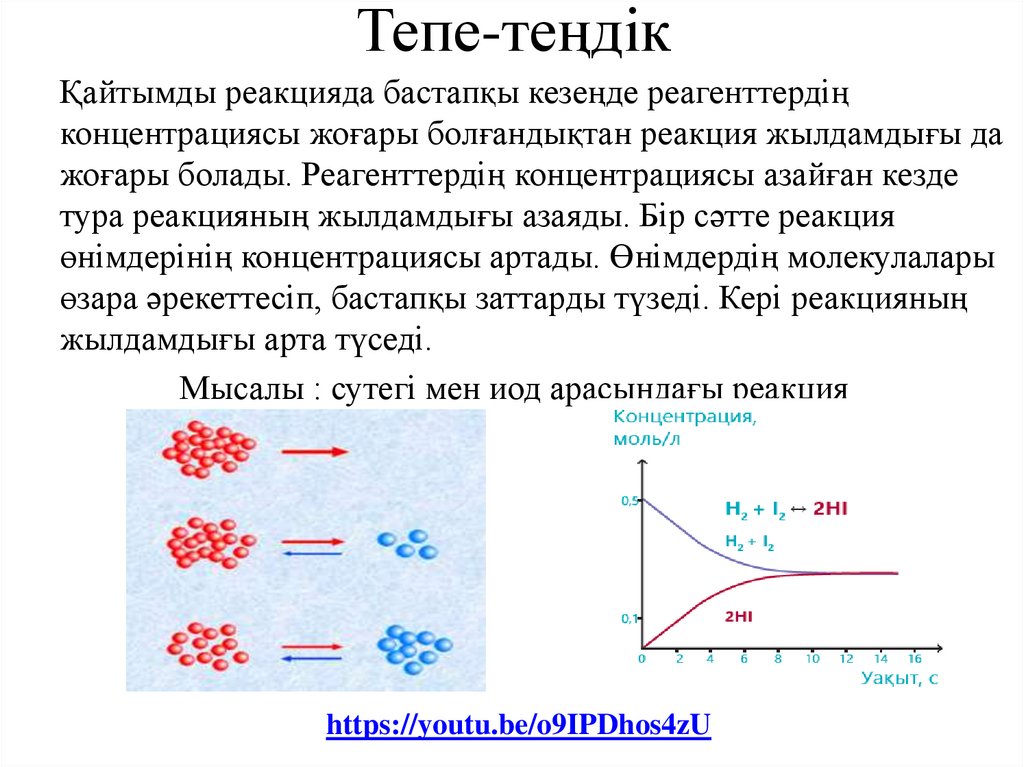
Тепе-теңдікҚайтымды реакцияда бастапқы кезеңде реагенттердің
концентрациясы жоғары болғандықтан реакция жылдамдығы да
жоғары болады. Реагенттердің концентрациясы азайған кезде
тура реакцияның жылдамдығы азаяды. Бір сәтте реакция
өнімдерінің концентрациясы артады. Өнімдердің молекулалары
өзара әрекеттесіп, бастапқы заттарды түзеді. Кері реакцияның
жылдамдығы арта түседі.
Мысалы : сутегі мен иод арасындағы реакция
https://youtu.be/o9IPDhos4zU
20.
Тура реакция жүрген сайын реакцияға алынған заттың концентрациясыазайып, v1 — жылдамдығы кемиді, керісінше, тіке реакциядан пайда
болған өнімнің концентрациясы артып, v2 күшейеді. Біртіндеп екі
реакция жылдамдығы теңеседі: v1=v2. Осындай жағдайды химиялық
тепе-теңдік деп атайды. Тепе-теңдік орнағанмен қарама-қарсы
бағытталған екі реакция да тоқтамай жүре береді. Егер сыртқы жағдай
(қысым, концентрация, температура) өзгермесе реакция жылдамдықтары
тең болып, химиялық тепе-теңдік орнаған қалпында қала береді,
сондықтан оны жылжымалы немесе [динамикалық] тепе-теңдік деп те
атайды.
21.
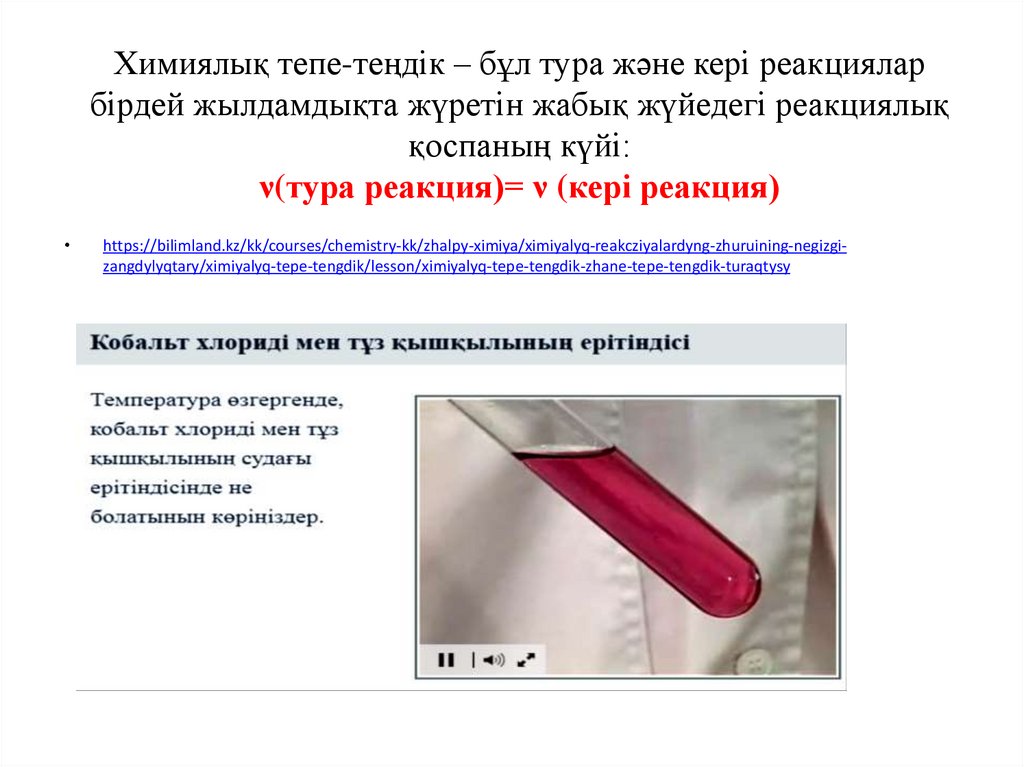
Химиялық тепе-теңдік – бұл тура және кері реакцияларбірдей жылдамдықта жүретін жабық жүйедегі реакциялық
қоспаның күйі:
ν(тура реакция)= ν (кері реакция)
https://bilimland.kz/kk/courses/chemistry-kk/zhalpy-ximiya/ximiyalyq-reakcziyalardyng-zhuruining-negizgizangdylyqtary/ximiyalyq-tepe-tengdik/lesson/ximiyalyq-tepe-tengdik-zhane-tepe-tengdik-turaqtysy
22.
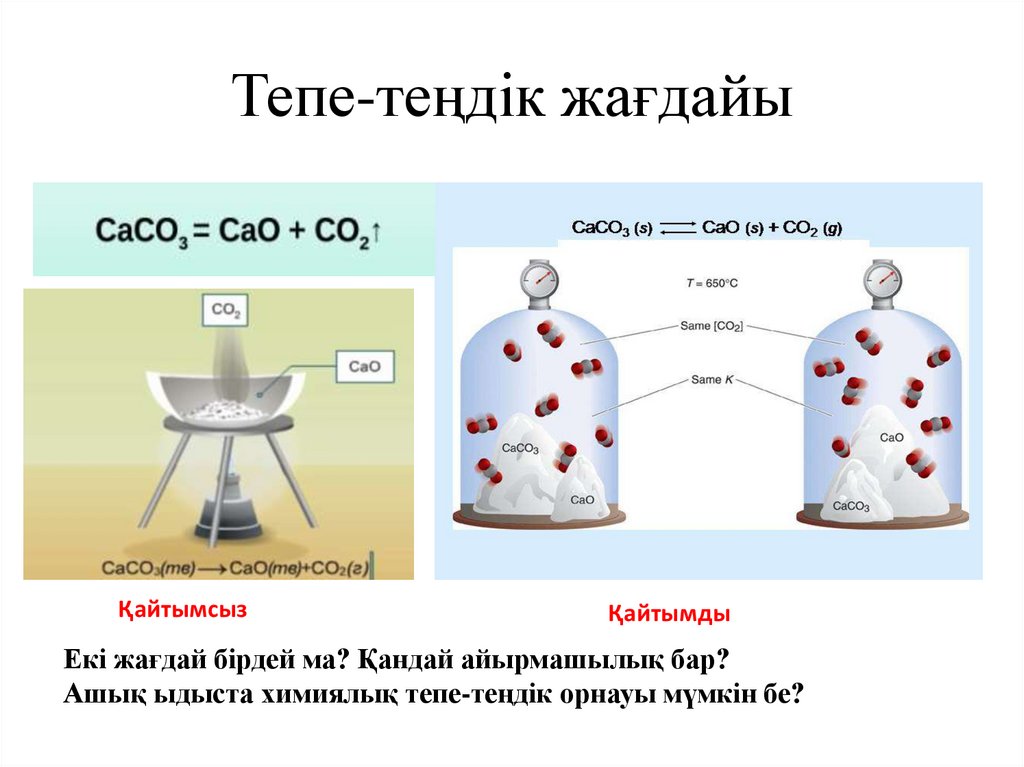
Тепе-теңдік жағдайыҚайтымсыз
Қайтымды
Екі жағдай бірдей ма? Қандай айырмашылық бар?
Ашық ыдыста химиялық тепе-теңдік орнауы мүмкін бе?
23.
Динамикалық тепе-теңдікМикроскопиялық деңгейде реагенттер үздіксіз бір түрден
басқаға түрге және кері өзгеріп тұрады, бұл тепе-теңдік түрі
динамикалық тепе-теңдік деп аталады. «Динамикалық тепетеңдік» термині реакция тоқтамайтын, бірақ көзге көрінетін
өзгерістер болмайтынын білдіреді
Диазот тетраоксидінің азот диоксидіне дейін ыдырауы
https://bilimland.com/kk/courses/chemistry-kk/zhalpy-ximiya/ximiyalyqreakcziyalardyng-zhuruining-negizgi-zangdylyqtary/ximiyalyq-tepetengdik/lesson/ximiyalyq-tepe-tengdik-zhane-tepe-tengdik-turaqtysy
24.
H2 + S ↔ H2S2SO2 + O2 ↔ 2SO3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
СО + 2Н2 ↔ СН3ОН
N2 + 3H2 ↔ 2NH3
3NaOH + H3РО4 = Na3РО4 + 3H2O
Na2SO4 + BaCl2 = BaSО4↓ + 2NaCl
N2 + O2 ↔ 2NO
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
NaCl + AgNO3 = NaNО3 + AgCl↓
С + СО2 ↔ 2СО
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
25.
ҚАЙТЫМДЫ РЕАКЦИЯ(↔)
ҚАЙТЫМСЫЗ РЕАКЦИЯ
N2 + 3H2 ↔ 2NH3
Al2O3 + 6HCl = 2AlCl3 + 3H2O
(қайтымсыз болу себебі - судың түзілуі)
СО + 2Н2 ↔ СН3ОН
3NaOH + H3РО4 = Na3РО4 + 3H2O
N2 + O2 ↔ 2NO
Na2SO4 + BaCl2 = BaSО4↓ + 2NaCl
(қайтымсыз болу себебі - судың түзілуі)
(қайтымсыз болу себебі – тұнбаның түзілуі)
2SO2 + O2 ↔ 2SO3
K2CO3 + 2HCl = 2KCl + CO2↑ + H2O
H2 + S ↔ H2S
NaCl + AgNO3 = NaNО3 + AgCl↓
С + СО2 ↔ 2СО
(қайтымсыз болу себебі – тұнбаның түзілуі)
(қайтымсыз болу себебі – тұнбаның түзілуі)
CuSO4 + 2KOH = Cu(OH)2↓ + K2SO4
(қайтымсыз болу себебі – тұнбаның түзілуі)



















 physics
physics








