Similar presentations:
Электролит ерітінділері тоқ өткізетін заттар (электрөткізгіштер)
1.
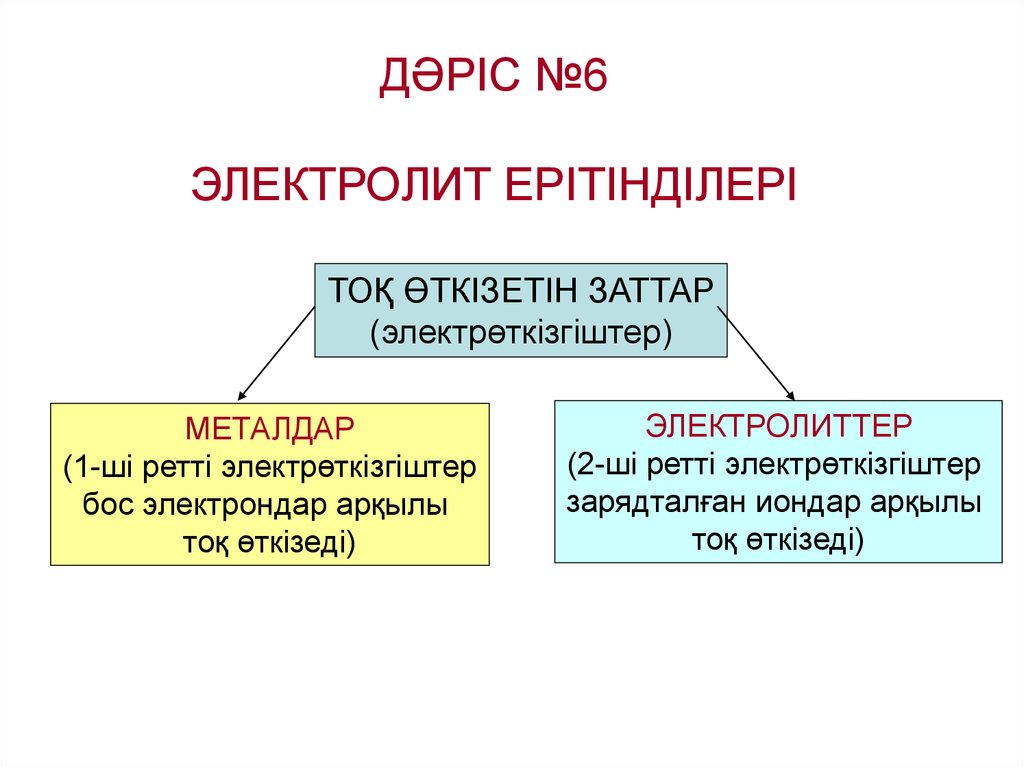
ДӘРІС №6ЭЛЕКТРОЛИТ ЕРІТІНДІЛЕРІ
ТОҚ ӨТКІЗЕТІН ЗАТТАР
(электрөткізгіштер)
МЕТАЛДАР
(1-ші ретті электрөткізгіштер
бос электрондар арқылы
тоқ өткізеді)
ЭЛЕКТРОЛИТТЕР
(2-ші ретті электрөткізгіштер
зарядталған иондар арқылы
тоқ өткізеді)
2.
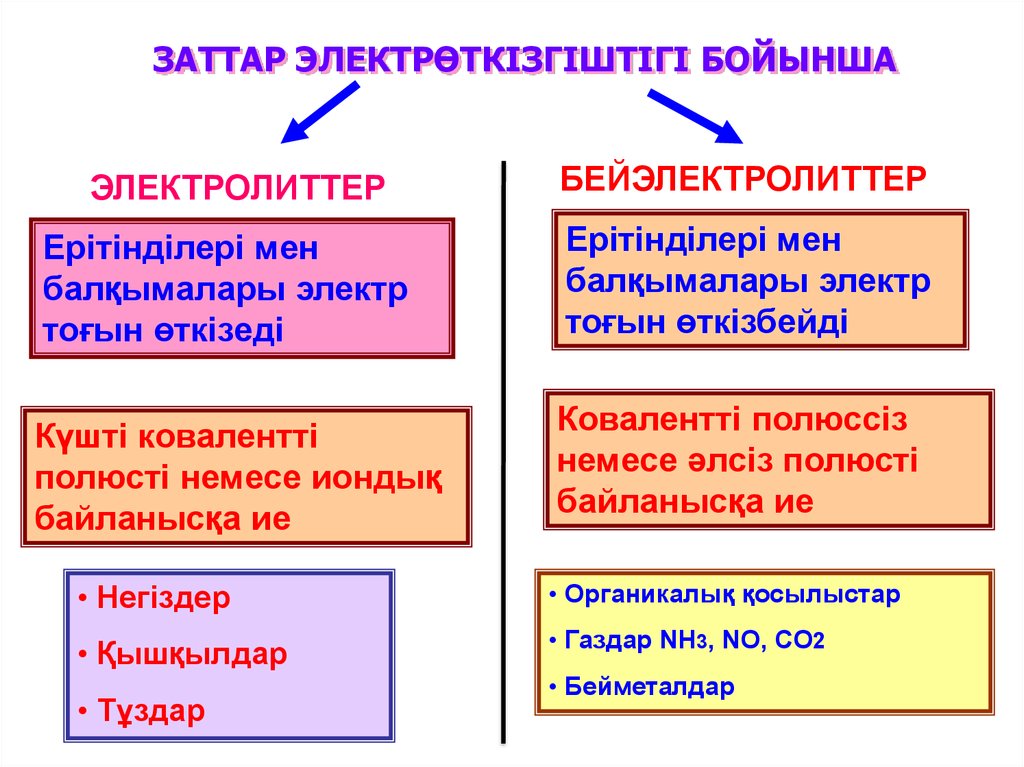
ЗАТТАР ЭЛЕКТРӨТКІЗГІШТІГІ БОЙЫНШАЭЛЕКТРОЛИТТЕР
БЕЙЭЛЕКТРОЛИТТЕР
Ерітінділері мен
балқымалары электр
тоғын өткізеді
Ерітінділері мен
балқымалары электр
тоғын өткізбейді
Күшті ковалентті
полюсті немесе иондық
байланысқа ие
Ковалентті полюссіз
немесе әлсіз полюсті
байланысқа ие
• Негіздер
• Органикалық қосылыстар
• Қышқылдар
• Газдар NH3, NO, CO2
• Тұздар
• Бейметалдар
3.
Қышқылдар диссоциалағанда Н+ катонын түзеді2
4
Н 2 SO4 2Н SO
Негіздер диссоциалағанда ОН- анионын түзеді
NaOH Na OH
-
Амфолиттер диссоциалағанда Н+ және ОН- иондарын түзеді
H 2 O Н OH
-
Zn(OH ) 2 Zn(OH ) OH
2
H 2 ZnO2 HZnO H
4.
Электролиттер дегеніміз балқымалары менерітінділері
электр
тоғын
өткізетін,
иондық
электроөткізгіштікке ие болатын заттар.
Электролиттердің
қасиеттерін
электролиттік
диссоциациялану теориясы (ЭДТ) түсіндіреді, оның негізін
С.Аррениус (Нобель сыйлығының лауреаты, 1093 жылы)
қалады (1887ж.). Ол еруді тек физикалық құбылыс деп
карастырды, диссоциациялану нәтижесінде бөлінген иондар
еріткіш молекулаларына біртіндеп таралады деп санап,
еріткіштің
әсерін
ескермеді.
Осындай
көзқарасты
калыптастырып дамытқан әрі С. Аррениус теориясын
толықтырған ғалымдар – И.А.Каблуков, В.А.Кистяковский,
Д.И.менделеев. Ал қазіргі кезде диссоциациялануды күрделі
физика-химиялық үдеріс деп қарастырады.
Электролиттік диссоциация – полярлы еріткіш
әсерінен электролит молекуласының иондарға ыдырауы.
5.
Тұздар, қышқылдар, негіздербалқығанда иондарға ыдырайды.
ерігенде
және
Ерітінділер мен балқымалардың ток өткізгіштігі
осы иондардың концентрациясына тәуелді болады.
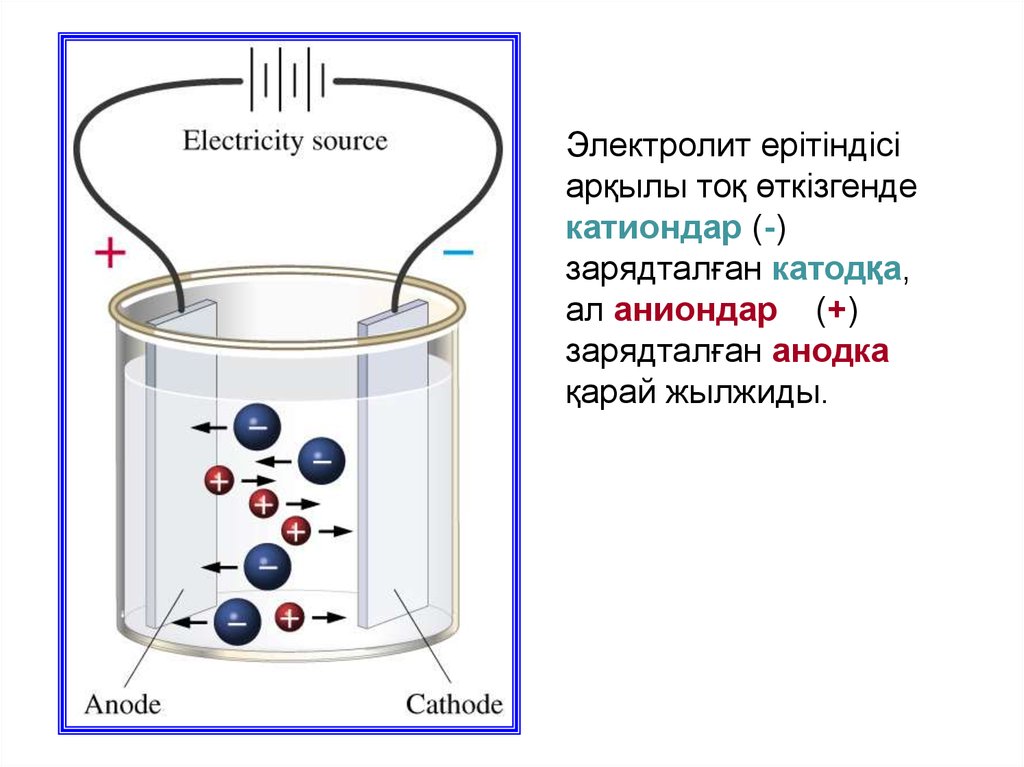
Иондардың оң зарядталғаны катодка тартылатындықтан
катиондар деп, ал анодқа тартылатындары теріс
зарядталған аниондар деп аталады.
Ағылшын физигі М.Фарадей XIXғасырдың 30-шы
жылдары «электролит, ион, катион, анион»
терминдерін енгізді. Ионды және ковалентті полюсті
байланысты молекулалар суда ерігенде иондарға
толығымен ыдырайды:
NaCl Na Cl
2
4
Na2 SO4 2 Na SO
6.
Электролит ерітіндісіарқылы тоқ өткізгенде
катиондар (-)
зарядталған катодқа,
ал аниондар (+)
зарядталған анодка
қарай жылжиды.
7.
Электролиттік диссоциация теориясының қағидалары:1) Заттар суда ерігенде оң жөне теріс иондарға ыдырайды.
2) Диссоциация полярлы еріткіштің әсерінен жүреді және оның себебі заттардың гидратациялануы.
3) Электр тоғының әсерінен иондар катод пен анодқа бағытталады.
4) Диссоциация қайтымды үдеріс: диссоциация (ыдырау)↔ ассоциация
(бірігу)
m
n
K X AY xK
yA
6) Электролиттер әр түрлі шамада диссоциацияланады (α).
7) Электролит ерітінділерінің химиялық касиеттері ондағы иондардың
табиғатымен анықталады.
8) Элемент атомы мен оның ионының қасиеттері әр түрлі болады.
Иондар ерітінділерде гидратталған күйде болғанымен,
заттардың диссоциациялану теңдеуін жазған кезде гидраттық қоршауын
еске алмай, жалаң иондар күйінде жазылады. Бұл - жазу үдерісін
оңайлату үшін жасалған шара. Электролит ерітінділерінде электр
тоғын тасымалдаушы иондар болады. Ондай электролиттерді екінші
ретті өткізгіштер деп атайды.
8.
Диссоциациялану үдерісін сандық жағынан да сипаттауғаболады.
Диссоциацияланудың
қаншалықты
толық
жүретіндігін
диссоциациялану дәрежесі (α) көрсетеді, α-ны сандық
үлеспен (0-1) немесе пайызбен (0-100%) беруге болады.
n
100%
N
n – иондарға ыдыраған электролит молекулалардың саны
N – электролит молекулалардың жалпы саны
Диссоциациялану дәрежесінің мәніне қарай электролиттер үш
топка бөлінеді:
3%
1) Әлсіз электролиттер
2) Орташа электролиттер
3) Күшті электролиттер
3% 30%
30%
9.
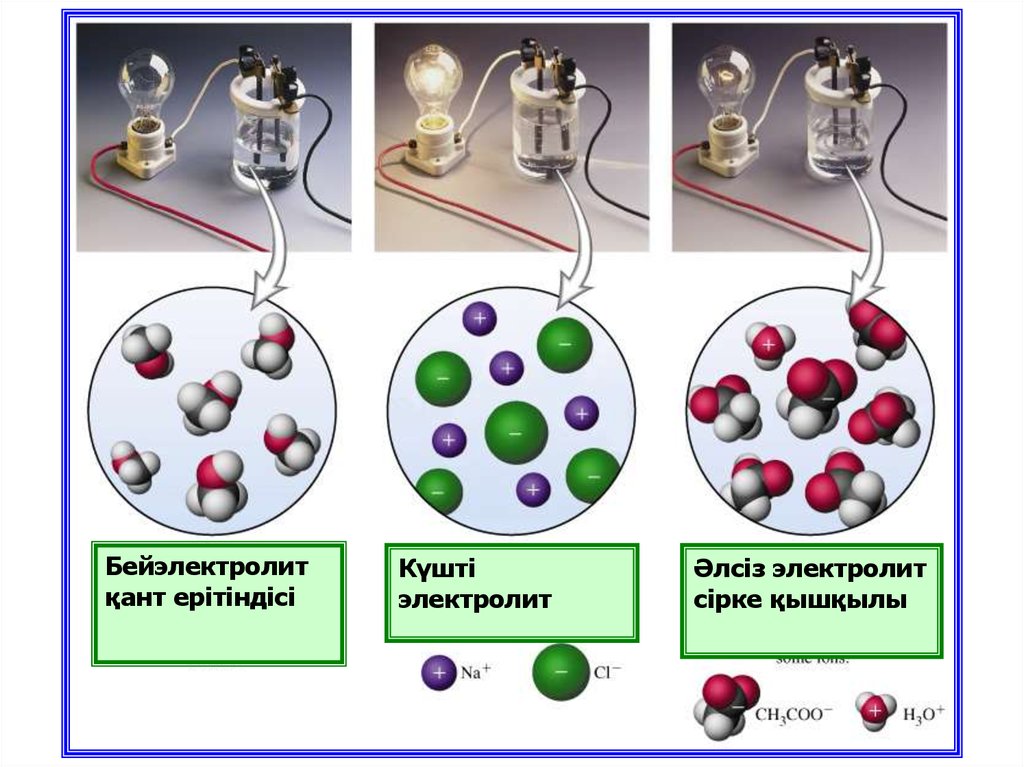
Бейэлектролитқант ерітіндісі
Күшті
электролит
Әлсіз электролит
сірке қышқылы
10.
Диссоциациялану дәрежесі (α) электролиттің табиғатына,температураға, концентрацияға тәуелді
Температураны
көтерген сайын
диссоциациялану
дәрежесі артады
Концентрацияны көтерген
сайын электролиттердің
диссоциациялану дәрежесі
кемиді
11.
Диссоциация процесі қайтымды болғандықтан, оғанәрекеттесуші массалар заңы бойынша тепе-теңдік жағдайы
тән болады. Ол жағдай тепе-теңдік константасымен (Кдисс)
анықталады:
K X AY xK m yA n
K дисс
[K
n x
m y
] [ A ]
[ K x Ay ]
Мысалы :
3
4
a) H 3 PO4 3H PO
K дисс
[ H ]3 [ PO43 ]
[ H 3 PO4 ]
b) Cu(OH ) 2 Cu 2 2OH
K дисс
[Cu 2 ] [OH ] 2
[Cu (OH ) 2 ]
12. Диссоциациялану константасы
Кдиссәлсіз
қабілеттілігін
электролиттер
табылады
электролиттің
иондарға
ыдырау
көрсетеді, оның мәні тек әлсіз
үшін тұрақты (const) шама болып
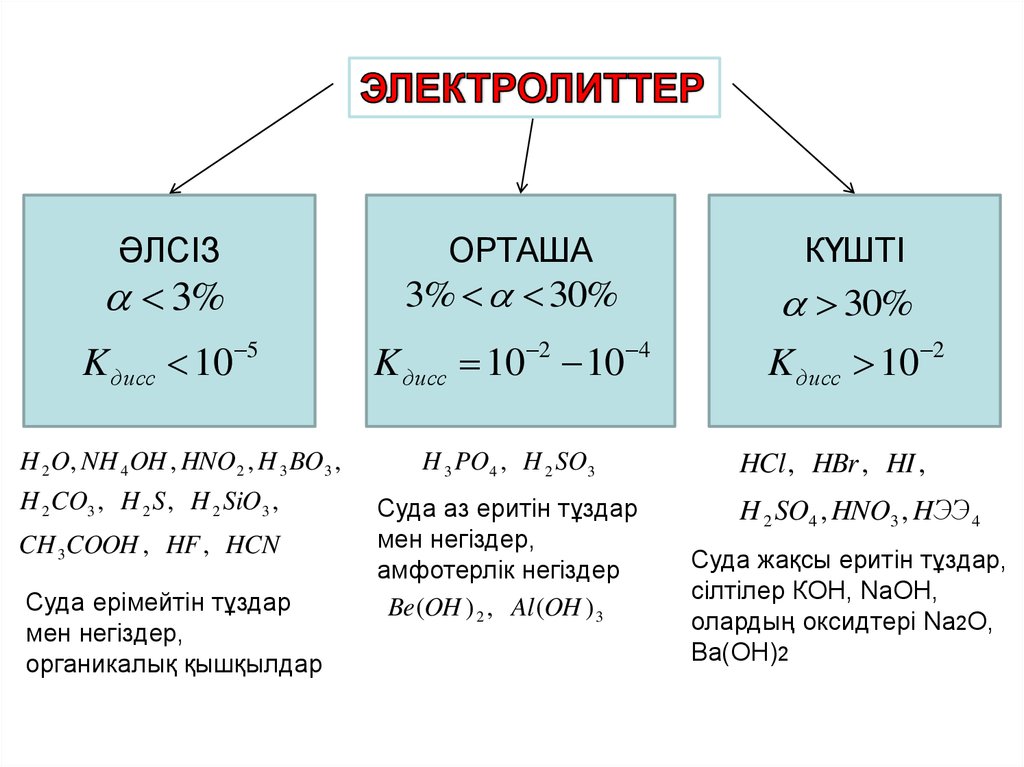
13.
ӘЛСІЗОРТАША
3%
K дисс 10
КҮШТІ
3% 30%
5
H 2 O, NH 4 OH , HNO2 , H 3 BO 3 ,
H 2 CO3 , H 2 S , H 2 SiO3 ,
CH 3COOH , HF , HCN
Суда ерімейтін тұздар
мен негіздер,
органикалық қышқылдар
2
K дисс 10 10
4
H 3 PO4 , H 2 SO3
Суда аз еритін тұздар
мен негіздер,
амфотерлік негіздер
Be (OH ) 2 , Al (OH ) 3
30%
2
K дисс 10
HCl , HBr , HI ,
H 2 SO4 , HNO3 , HЭЭ 4
Суда жақсы еритін тұздар,
сілтілер КOH, NaOH,
олардың оксидтері Na2O,
Ba(OH)2
14.
Оствальдтің сұйылту заңыЭлектролиттердің
диссоциациялану
дәрежесі
мен
константасының арасында математикалық тәуелділік бар
және ол Оствальдтің сұйылту заңымен анықталған:
CM
1
2
К дисс
Әлсіз электролиттер үшін α=1 және Кдисс тұрақты шама
болғандықтан:
К дисс С М
2
онда
К дисс
СМ
Қорытынды: ерітіндіні сұйылтқан сайын, оның
диссоциация мүмкіндігі (α) жоғарылайды
15.
Күшті электролиттер теориясы (Дебай, Хюккель)бойынша
күшті
электролиттер
ерітіндіде
толық
диссоциацияланғандықтан иондар концентрациясы жоғары
болады.
Әр аттас иондар арасында электростатикалық тартылыс
күштері туады. Нәтижесінде әр ион қарама-қарсы зарядты
ионмен «иондық атмосфера» құрып қоршалады. Бұл
иондардың қозғалғыштығын тежейді. Соның салдарынан
иондардың активтігі төмендейді. Реакцияға түскенде, олардың
концентрациясы нақты концентрациясынан кем болып көрінеді.
Осы құбылысты түсіндіру үшін «активтілік» деген ұғым
енгізілген. Химиялық реакцияға түсетін концентрацияға сәйкес
концентрацияны ионның активтілігі деп атайды:
а= c
а – ионның активтілігі, моль/л;
– активтілік коэффициенті;
с – мольдік концентрация, моль/л
16.
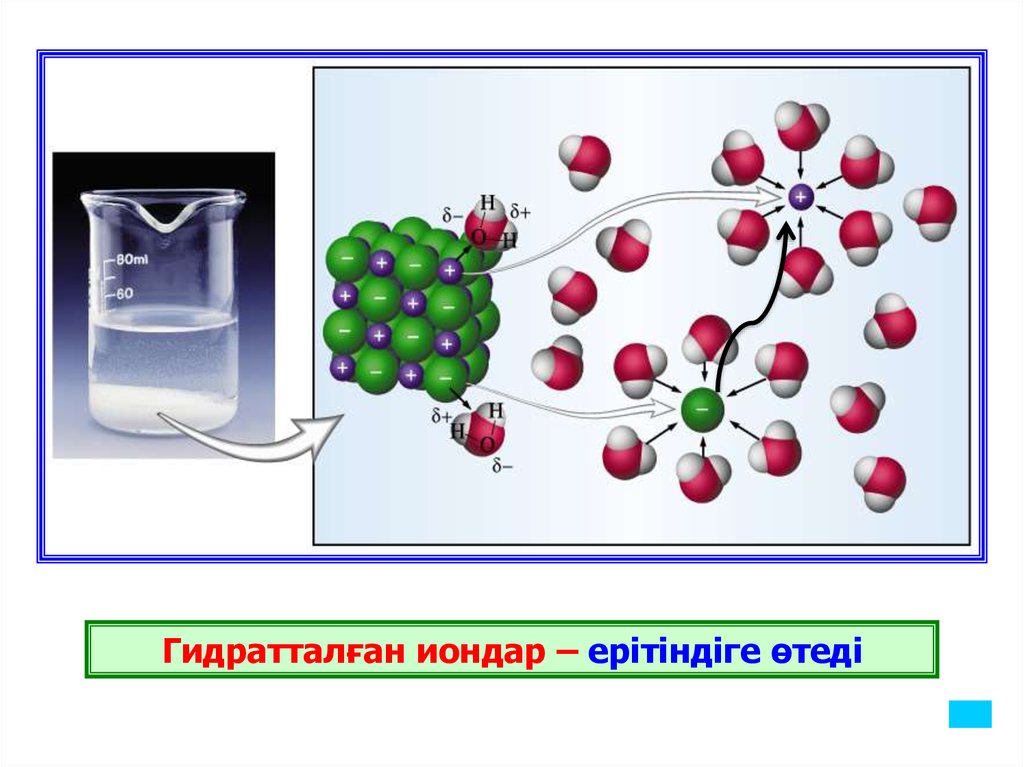
Гидратталған иондар – ерітіндіге өтеді17.
Активтілік коэффиценті ерітіндінің иондық күшінебайланысты. Ерітіндінің иондық күші ондағы барлық
иондардың мольдік концентрациясы мен олардың
зарядтарының
квадратының
көбейтіндісінің
жартылай қосындысына тең:
- ерітіндінінің иондық күші
1
2
I Ci Z i
2
Сi – i-ионның мольдік концентрациясы, моль/л
Zi – i-ионның заряды
Мысалы: 0,1М алюминий сульфаты ерітіндісінің иондық күшін есептегенде
Al2 ( SO4 )3 2 Al 3 3SO42
C Al 3 2 0,1М 0,2 моль / л
CSO2 3 0,1М 0,3 моль / л
4
1
1
1
2
2
2
2
I [C Al3 Z Al3 CSO2 Z SO2 ] [0,2 ( 3) 0,3 ( 2) ] [1,8 1,2] 1,5
4
4
2
2
2
18.
.Электролит ерітінділерінің электр тоғын өткізу
қабілеті ондағы иондардың қозғалғыштығына байланысты
болады.
Заттың
электр тоғын өткізу мүмкіндігі
электрөткізгіштікпен немесе оған кері шама
кедергімен (R, Ом) сипатталады.
1-ретті өткізгіштер үшін кедергі Ом заңымен
анықталады :
l
R
S
Меншікті кедергіге ( ) кері шаманы меншікті
электрөткізгіштік ( , Сим/м, 1 Сименс = 1 Ом-1) деп
атайды:
1
немесе
1 l
R s
19.
Ерітінділердің кедергісі(R) кондуктометриялық ұяшық
арқылы
өлшенеді,
ондағы
электродтар
бір
қалыпты
орнатылған, яғни:
l
const K c
s
I l
R s
зерт.ерт
Кс
R зерт.ерт
мұндағы
Кс
–
ыдыстың
сыйымдылық константасы, оның
мәні барлық ерітінділер үшін
ортақ болады
20.
Меншікті электрөткізгіштік ( ) ерітіндінің концентрациясынатәуелсіз шама, сондықтан есептеулерде оның орнына
эквиваленттік электрөткізгіштік шамасы алынады:
1000
с
Эквиваленттік
электрөткізгіштік
деп
әрқайсысының ауданы 1 см2 электродтардың өзара
арақашықтығы 1 см болғанда, сол аралықтағы көлемі
(Vсм3) ерітіндінің электрөткізгіштігін айтады.
Кольрауш заңы бойынша шексіз сұйылтқан ерітіндінің
эквиваленттік электрөткізгіштігі катиондары мен аниондарының
қозғалуынан болатын иондық өткізгіштіктердің қосындысынан
тұрады:
21.
Катиондар мен аниондардың жылжу жылдамдықтарыжалпы алғанда бірдей емес, сондықтан олардың таситын
электр мөлшері де әр түрлі болады.
Иондарының электрдің әртүрлі таситын мөлшерін
иондардың тасымалдау саны деп айтады:
nkat
nаn
nkat nаn 1
Әлсіз
электролиттер
үшін
эквиваленттік
электрөткізгіштіктің
және
шексіз
сұйылтқандағы
эквиваленттік
электрөткізгіштіктің
қатынасы
V
диссоциациялану дәрежесіне ( ),
ал күшті электролиттер үшін бұл қатынас электроөткізгіштік
коэффициентке (f) тең:
f
V















 physics
physics








