Similar presentations:
Амфотерные гидроксиды
1. АМФОТЕРНЫЕ ГИДРОКСИДЫ
2. Цели и задачи урока
15.02.2022ЦЕЛИ И ЗАДАЧИ УРОКА
Обучающие:
сформировать у учащихся понятие амфотерного гидроксида .
закрепить умения составлять структурные формулы веществ.
изучить химические свойства амфотерных гидроксидов
Развивающие:
развить умение устанавливать причинно-следственные связи,
умение прогнозировать свойства веществ, исходя из их строения
способствовать развитию грамотного химического языка;
развивать умение анализировать, исследовать, формировать аналитическое
мышление.
Воспитательные:
повышение предметной мотивации (через использование ИТК средств обучения),
воздействуя на эмоциональную сферу школьника формировать такие чувства, как
уверенность в своих силах, удовлетворение от умственной деятельности .
3. Земноводные
15.02.2022Мыслящий ум не чувствует себя счастливым,
пока не удается связать воедино,
разрозненные факты, им наблюдаемые
ЗЕМНОВОДНЫЕ
1.
2.
3.
4.
5.
6.
Д Хевеши.
Дитя солнца, зимой его не встретить.
Не очень красивое, но очень важное в природе
животное.
Если весной, ты услышал его голос, значит, будет тепло
или пойдёт дождь.
Живет в двух средах обитания живых организмов.
Название класса этого животного получил самолет
приземляющийся на воду, и машины высокой
проходимости.
Эта подсказка , самая лёгкая: Консумент 2-го порядка,
съевший консумент 1 –го порядка (зелененького цвета).
4.
15.02.2022АМФО - (гр. amphi вокруг, около, с обеих сторон,
оба)- приставка обозначающая –двоякий.
5.
15.02.2022гидроксиды,
проявляющие в зависимости от условий
основные или кислотные свойства
Zn(OH)2
H2ZnO2
H O
H O
Zn
Zn
O H
O H
АМФОТЕРНОСТЬ - ДВОЙСТВЕННОСТЬ СВОЙСТВ
6.
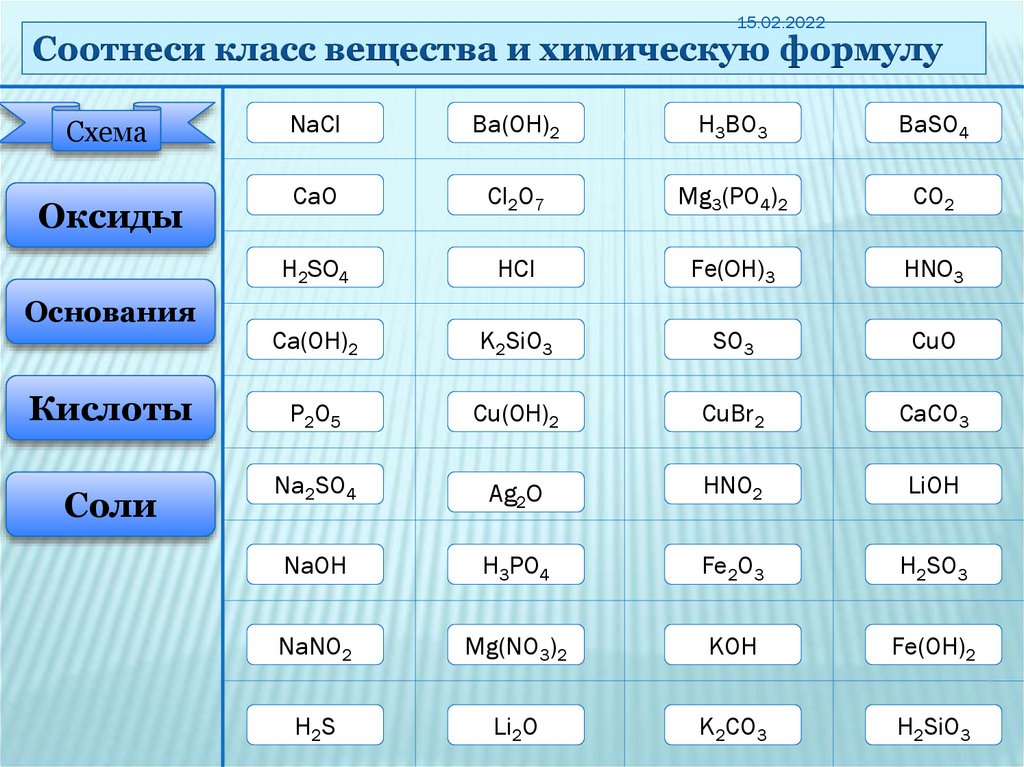
15.02.2022Соотнеси класс вещества и химическую формулу
Схема
Оксиды
Основания
Кислоты
Соли
NaCl
Ba(ОH)2
H3BО3
BaSO4
СaО
Cl2О7
Mg3(PO4)2
CО2
H2SО4
HCl
Fe(ОH)3
HNO3
Сa(ОH)2
K2SiO3
SО3
CuО
P2 О 5
Сu(ОH)2
CuBr2
CaCO3
Na2SO4
Ag2О
HNO2
LiОH
NaОH
H3PО4
Fe2О3
H2SО3
NaNO2
Mg(NO3)2
KОH
Fe(ОH)2
H2S
Li2О
K2CO3
H2SiО3
7.
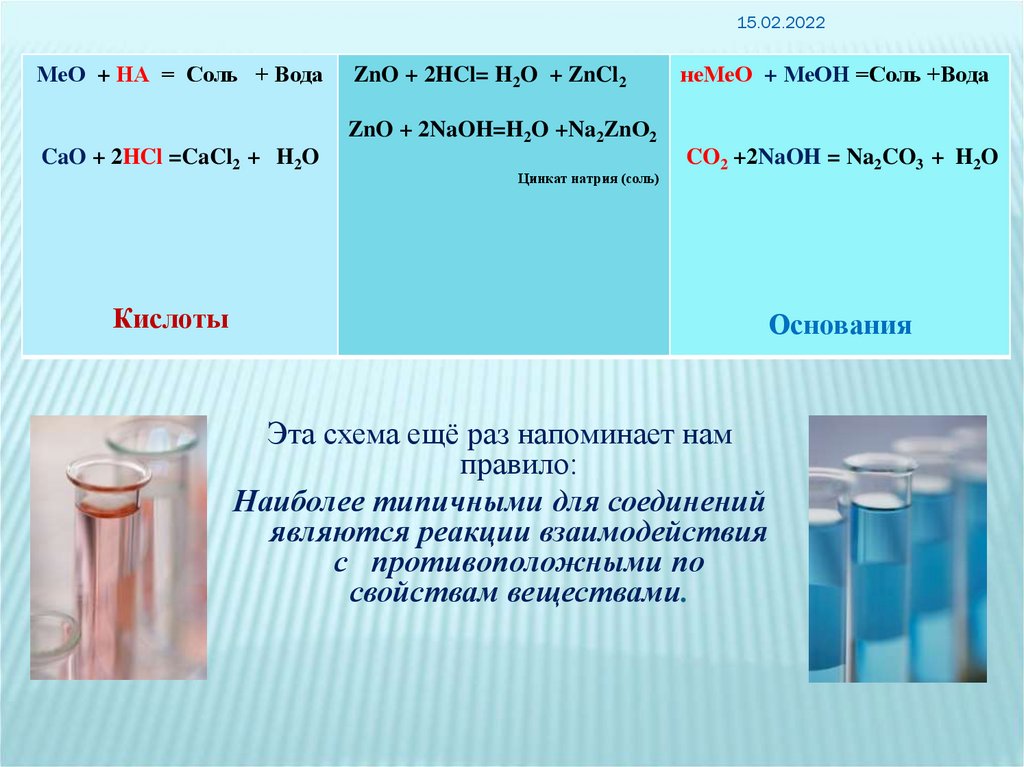
15.02.2022МеО + НА = Соль + Вода
ZnO + 2HCl= H2O + ZnCl2
неМеО + МеОН =Соль +Вода
ZnO + 2NaOH=H2O +Na2ZnО2
CaO + 2HCl =CaCl2 + H2O
Цинкат натрия (соль)
CO2 +2NaOH = Na2CO3 + H2O
Кислоты
Основания
Эта схема ещё раз напоминает нам
правило:
Наиболее типичными для соединений
являются реакции взаимодействия
с противоположными по
свойствам веществами.
8.
15.02.20229. Лабораторный опыт получение и свойства амфотерного гидроксида
15.02.2022ЛАБОРАТОРНЫЙ ОПЫТ
ПОЛУЧЕНИЕ И СВОЙСТВА АМФОТЕРНОГО ГИДРОКСИДА
ZnSO4 + 2NaOH= Na 2 SO4 +Zn(OH)2↓
Zn(OН)2 + 2HCl= 2H2O + ZnCl2
Zn(OН)2 + 2NaOH = Na 2 [Zn(OH) 4]
Тетрагидроксоалюминат
натрия ( комплексная соль)
10.
15.02.20221
Как основания, реагируют с кислотами:
2
Как основания, реагируют с кислотными оксидами:
3
Как кислоты , взаимодействуют со щелочами:
4
Как кислоты , реагируют с основными оксидами:
5
Как нераств. основания разлагаются при нагревании:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
t
Zn(OH)
СаО
= СаZnO
H2O
O
O
H
H
Cl
2 +
2++H
Zn(OH)
+
SO
=
ZnSO
4 + 2H
2
Zn гидроксид+2
t 3 = цинкат
ZnCl
O
2
2
гидроксид
сульфат
кальция
O цинка
H Zn(OH)
H 2 =Cl ZnO
+ H2O
хлорид
цинка
цинка
гидроксид
соляная
Zn(OH)2 +гидроксид
2NaOH
цинка
цинка
кислота
= Na2цинка
ZnO2 + 2H2O
11.
15.02.2022С гидроксидом натрия
взаимодействуют:
ОШИБКА!2
Mg(OH)
ВЕРНО!3
Al(OH)
ВЕРНО!
H2SO4
ОШИБКА!
Na2CO3
С азотной кислотой
взаимодействуют:
ВЕРНО!2
Mg(OH)
ВЕРНО!3
Al(OH)
ОШИБКА!
H2SO4
ВЕРНО!
Na
2CO3
Основные свойства
сильнее выражены:
ВЕРНО!
KOH
ОШИБКА!
NaOH
ОШИБКА!
LiOH
Основные свойства
сильнее выражены:
ОШИБКА!
Al(OH)3
ОШИБКА!2
Mg(OH)
ВЕРНО!
NaOH
Кислотные свойства
сильнее выражены:
ОШИБКА!
H3PO4
ОШИБКА!
H2SiO3
ВЕРНО!
H2SO4
Кислотные свойства
сильнее выражены:
ОШИБКА!
H3AsO4
ВЕРНО!
HNO3
ОШИБКА!
H3PO4
§ 44
в 1,2
Цепочка
превращ
ений
Д/з
12. Генетический ряд алюминия. Осуществите превращения:
15.02.2022ГЕНЕТИЧЕСКИЙ РЯД АЛЮМИНИЯ.
ОСУЩЕСТВИТЕ ПРЕВРАЩЕНИЯ:
NaAlO2
Al
Al2O3
AlCl3
Al(OH)3
Al2(SO4)3










 chemistry
chemistry








