Similar presentations:
Основания и кислоты. Тема 2
1.
Основания и кислоты2.
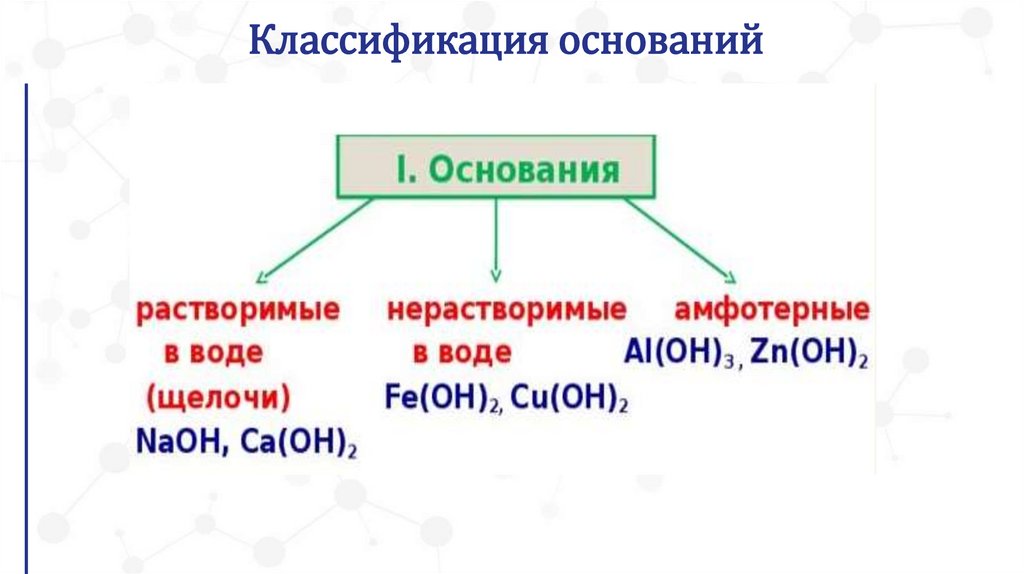
Основания• Основания – это сложные вещества, молекулы которых состоят
из атомов металла (или группы аммония NH4+) и одной или
нескольких гидроксильных групп.
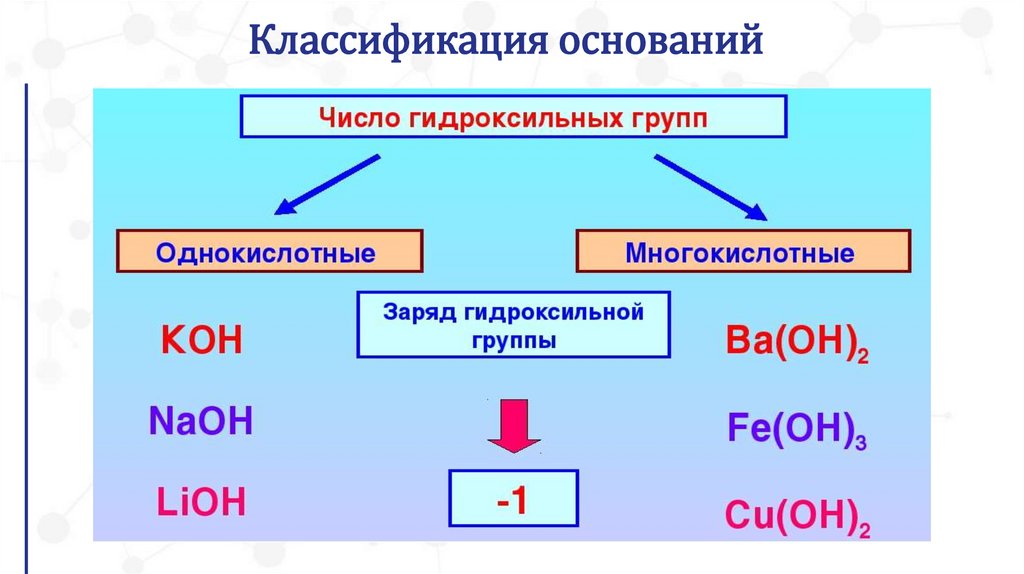
• Валентность гидроксильной группы равна I.
• Число гидроксильных групп в основании равно валентности металла.
• При написании названий сначала указывают слово «гидроксид», а
затем название металла в родительном падеже
• КОН – гидроксид калия, Ca(OH)2 – гидроксид кальция
• Если металл образует основания переменного состава, то после
названия в скобках указывается его валентность
• Fе(ОН)3 – гидроксид железа (III). Fе(ОН)2 – гидроксид железа (II)
3.
Классификация оснований4.
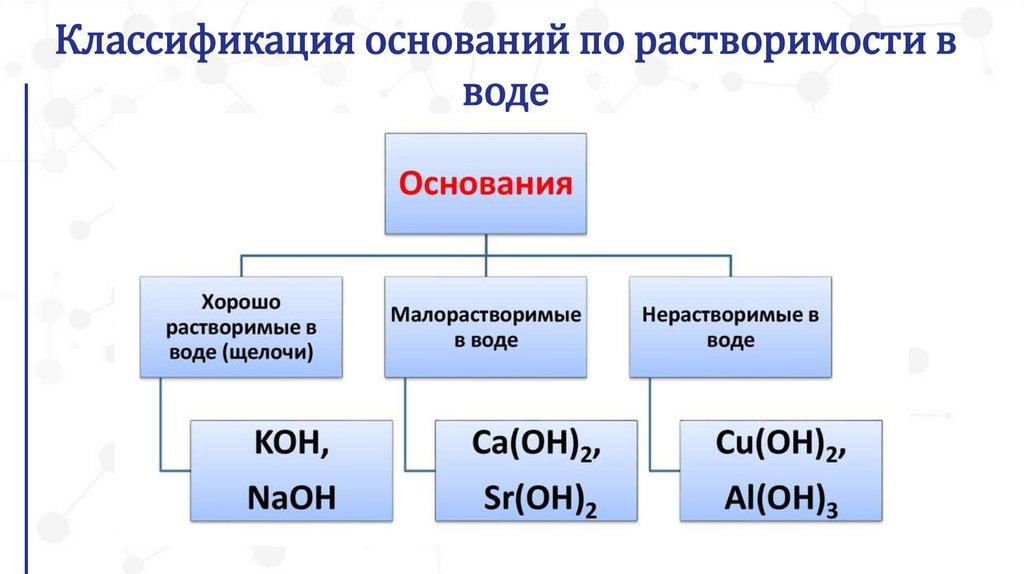
Классификация оснований по растворимости вводе
5.
Классификация оснований6.
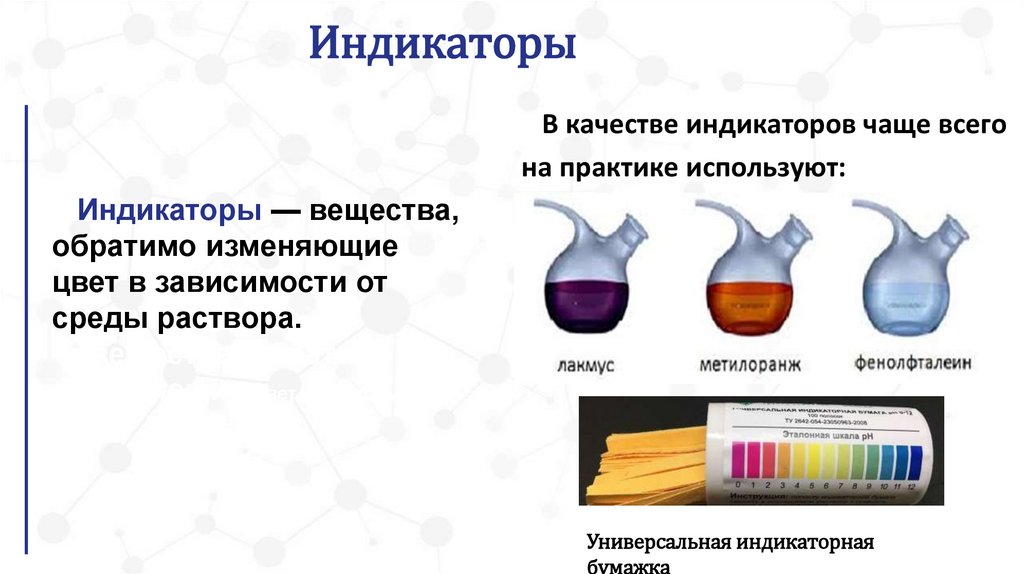
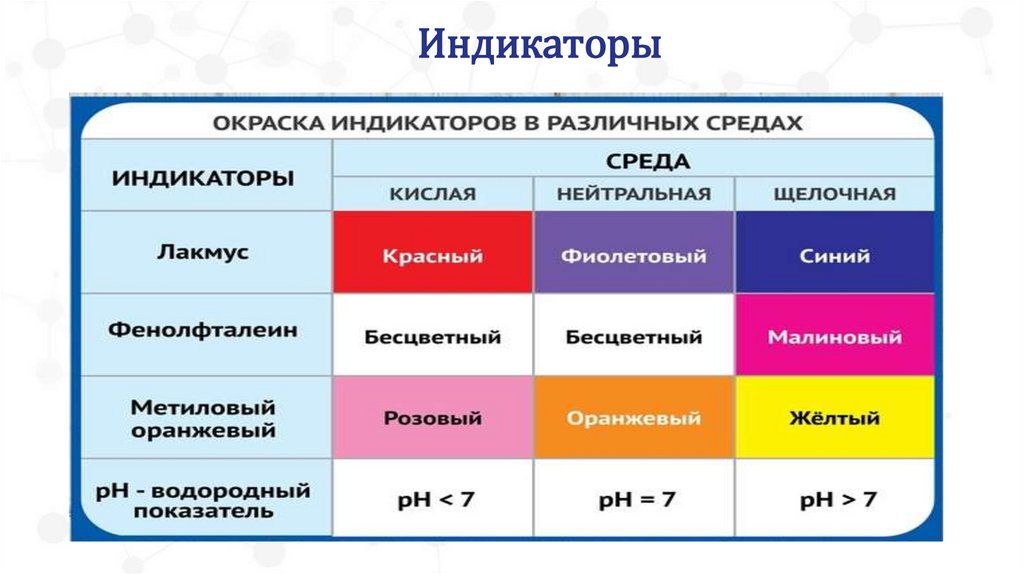
ИндикаторыВ качестве индикаторов чаще всего
на практике используют:
Индикаторы — вещества,
обратимо изменяющие
цвет в зависимости от
среды раствора.
— вещества, обратимо
изменяющие цвет в зависимости
от среды раствора.
Универсальная индикаторная
бумажка
7.
ИндикаторыСамым первым появился индикатор
лакмус. Лакмус – это водный настой
лакмусового лишайника, растущего на
скалах в Шотландии. Этот индикатор
случайно открыл в 1663 году английский
физик и химик Роберт Бойль. Позднее
лакмусовым настоем стали пропитывать
фильтровальную бумагу; ее высушивали и
получали таким образом "лакмусовые
бумажки".
8.
Индикаторы9.
Окраска индикаторов в щелочной среде10.
Fe(OH)2Нерастворимое основание
грязно-зеленого цвета
11.
Fe(OH)3Нерастворимое основание
бурого цвета
12.
Cu(OH)2Нерастворимое основание
синего цвета
13.
Cr(OH)3Нерастворимое основание
зеленого цвета
14.
Al(OH)3Нерастворимое
амфотерное основание
15.
Яркие представители класса оснований, ихтривиальные названия и применение
Основания используются при производстве моющих средств,
мыла, шампуней. Именно щелочная среда создает эффект
мылкости, растворяет жир и смывает грязь. При побелке
потолков, стен и стволов деревьев по весне используют
гашеную известь, которая тоже является основанием. На основе
нерастворимых в воде оснований изготавливают малярные и
художественные краски. Щелочные батарейки мы используем
как источник питания. И наконец, нашатырный спирт и
ржавчина тоже являются основаниями.
16.
NaOH- едкий натрЛегкоплавкие (tпл = 320 °С) белые
гигроскопичные кристаллы и поэтому
расплывающиеся в воздухе; хорошо
растворимы в воде. Раствор мылкий
на ощупь и является опасной едкой
жидкостью, так как разъедает кожу,
ткани, бумагу и другие материалы.
NaOH – один из важнейших продуктов
химической промышленности. Широко
применяется
в
мыловаренной,
бумажной, текстильной и других
отраслях промышленности, а также
для
производства
искусственного
волокна.
Тривиальное название-каустическая сода
17.
КOH- едкое калиБелые гигроскопичные кристаллы,
хорошо растворимы в воде. Раствор
мылкий на ощупь и является опасной
едкой жидкостью. Свойства КОН
аналогичны свойствам NaOH, но
применяется гидроксид калия гораздо
реже ввиду его более высокой
стоимости.
Применяют его в качестве добавки
при производстве мыла, тугоплавкого
стекла.
Тривиальное название-каустический
поташ
18.
Ва(ОН)2- едкий баритБелые гигроскопичные кристаллы.
Насыщенный
водный
раствор
гидроксида
бария
называется
баритовой водой. Гидроксид бария
применяют в виде баритовой воды как
реактив на SO42- (сульфат) и СО32(карбонат)
ионы,
для
очистки
растительных масел и животных
жиров, как компонент смазок, для
удаления
сульфат-ионов
из
промышленных растворов.
19.
Са(ОН)2 – гашеная известьРыхлый белый порошок, малорастворим в
воде. Получается при взаимодействии
негашёной извести СаО с водой. Этот
процесс называют гашением. Прозрачный
раствор называется «известковой водой»,
суспензия
–
«известковым
молоком».
Гидроксид
кальция
применяют
в
строительстве при кладке и штукатурке стен,
для побелки деревьев, для получения
хлорной извести – дезинфицирующего
средств.
20.
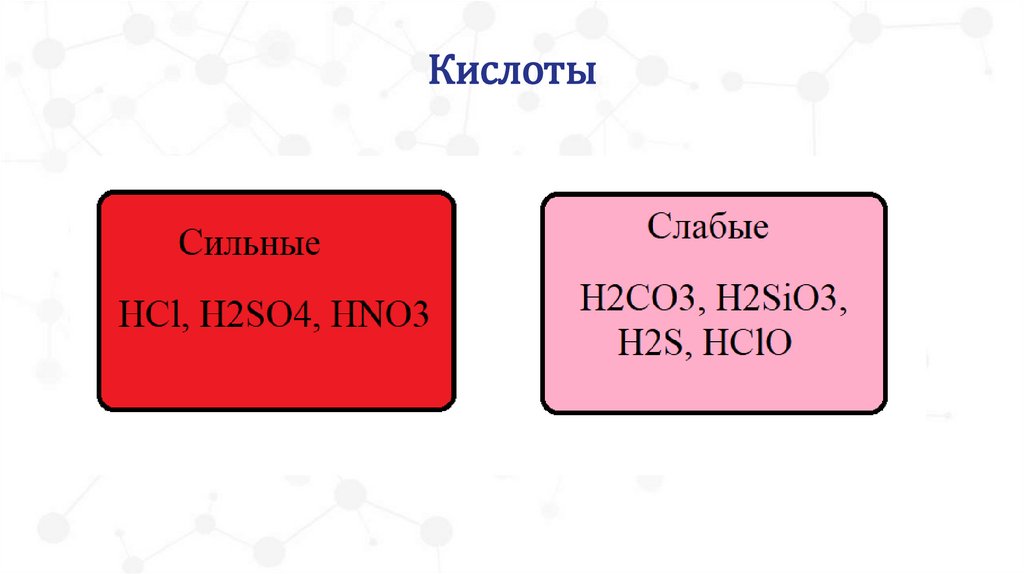
КислотыКислоты – сложные вещества, молекулы которых состоят из
атомов водорода, способных замещаться на атомы металла, и
кислотных остатков.
• Общая формула кислот: НхАх,
• где А – кислотный остаток;
• Н – атомы водорода;
• х –валентность кислотного остатка, равная, числу атомов
водорода.
21.
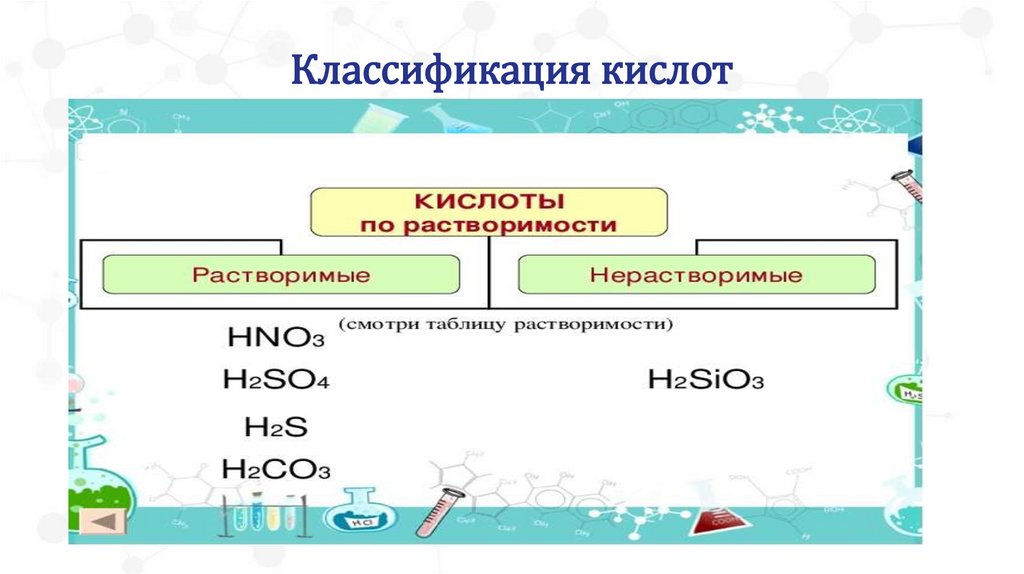
Классификация кислот22.
Классификация кислот23.
Классификация кислот24.
Классификация кислот25.
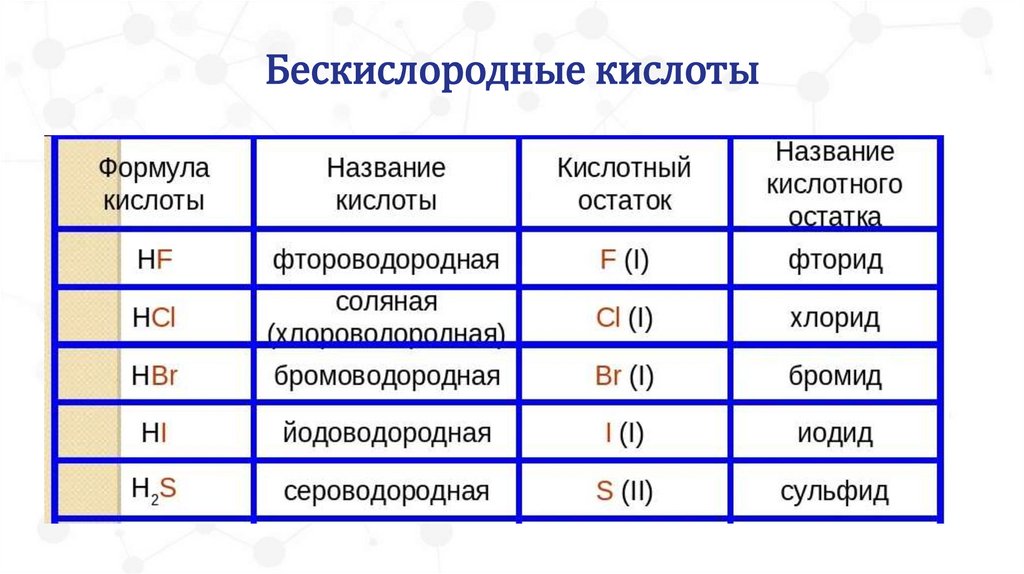
Бескислородные кислоты26.
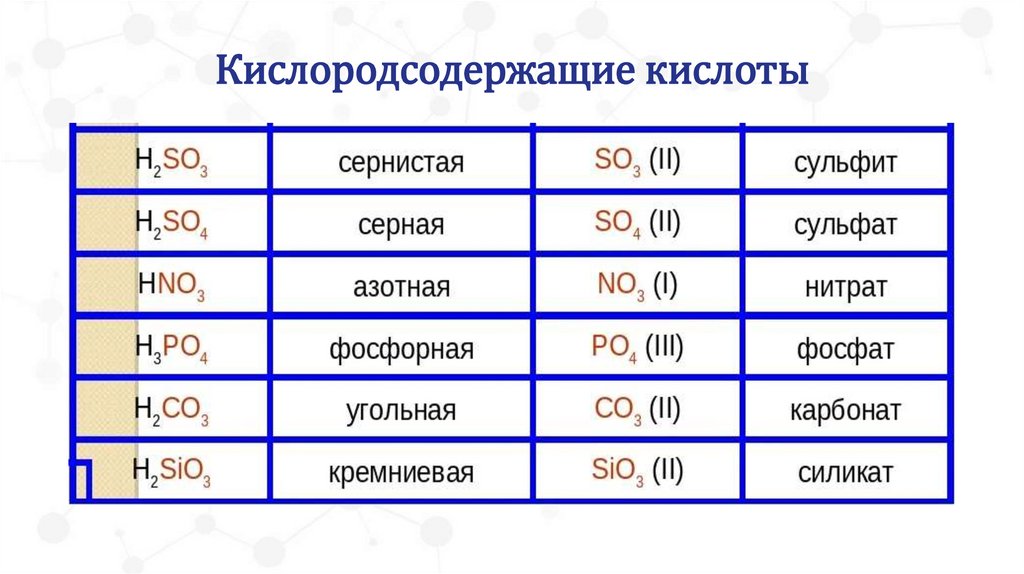
Кислородсодержащие кислоты27.
Кислоты в истории индикаторовОднажды английский химик Р. Бойль, изучая свойства
соляной кислоты, закупленной в Германии у И. Глаубера,
случайно пролил ее. Кислота попала на сине-фиолетовые
лепестки фиалок. Спустя некоторое время лепестки стали
ярко-красными. Это явление удивило Р. Бойля, и он тут же
провел серию опытов с разными кислотами и цветкам разных
растений. Оказалось, что и васильки, и розы, и цветки
некоторых других растений изменяли свою окраску при
действии кислот. После некоторых раздумий такие вещества Р.
Бойль назвал индикаторами, что в переводе с латинского
означало "указатели". Эти вещества затем стали использовать
многие химики в опытах для распознавания кислот.
28.
Кислоты29.
Определение силы кислоты по формулеЧтобы определить силу кислородсодержащей кислоты HxЭОy,
необходимо из числа атомов кислорода в кислоте вычесть число
атомов водорода, то есть y – x.
Если y–x =0, то кислота слабая (H3ВO3, HClO, H6TeO6)
Если y–x =1, то кислота слабая (H2CO3) или средней силы (H3РO4)
Если y–x =2, 3, то кислота сильная (H2SO4, HNO3, HClO4)
30.
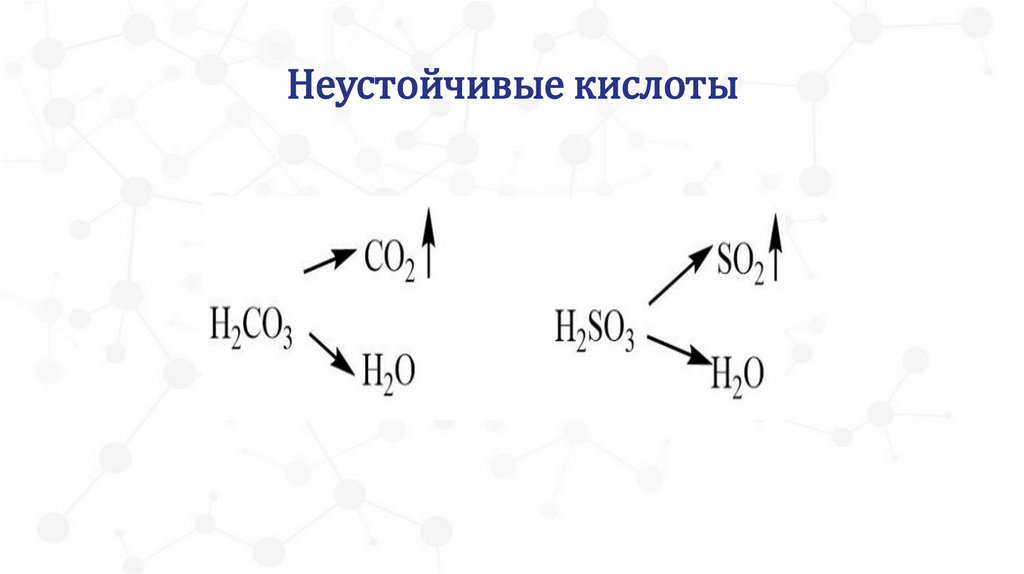
Неустойчивые кислоты31.
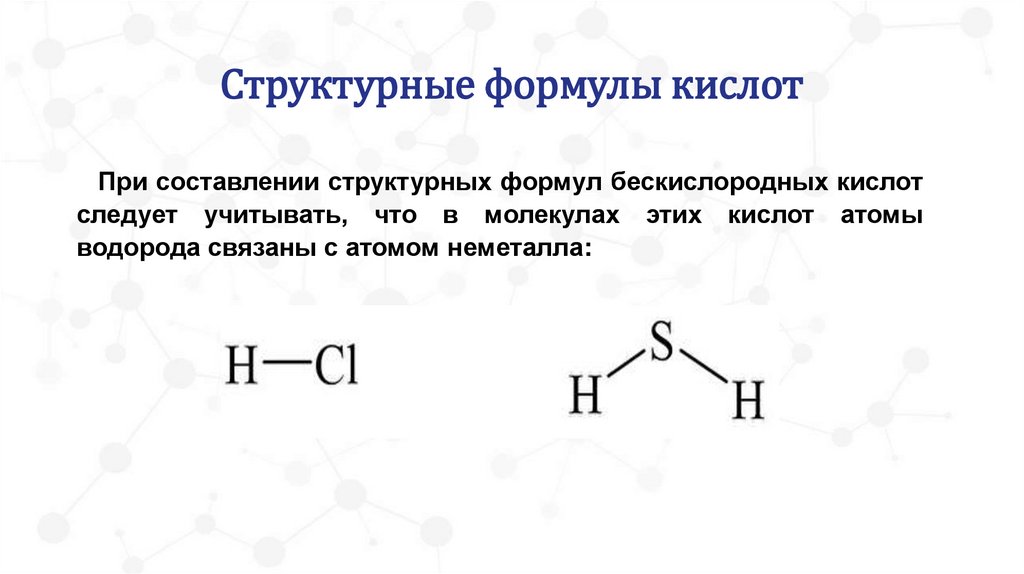
Структурные формулы кислотПри составлении структурных формул бескислородных кислот
следует учитывать, что в молекулах этих кислот атомы
водорода связаны с атомом неметалла:
32.
Структурные формулы оксокислотПри составлении структурных формул кислородсодержащих кислот
нужно помнить, что водород с центральным атомом связан
посредством атомов кислорода. Для составления структурных
формул кислородсодержащих кислот пользуются следующим
принципом (для примера взяты H2S+6O4 и H3P+5O4):
1. Пишут один под другим атомы водорода данной кислоты. Затем
через атомы кислорода черточками связывают их с центральным
атомом:
33.
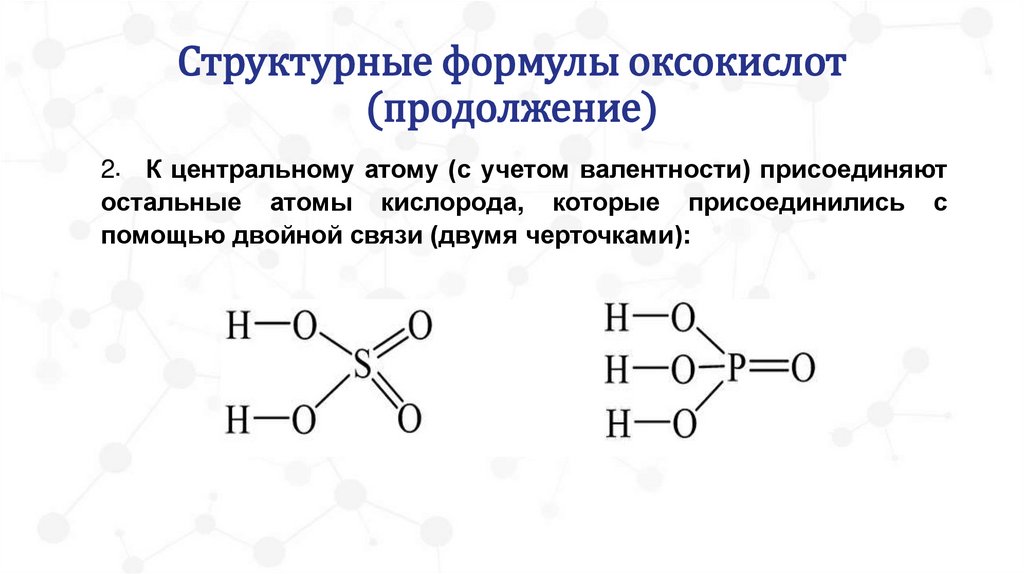
Структурные формулы оксокислот(продолжение)
2. К центральному атому (с учетом валентности) присоединяют
остальные атомы кислорода, которые присоединились с
помощью двойной связи (двумя черточками):
34.
Окраска индикаторов кислой среде35.
Серная кислота H2SO4• При обычных условиях концентрированная серная кислота –
тяжёлая маслянистая жидкость без цвета и запаха, с
сильнокислым «медным» вкусом. В технике серной кислотой
называют её смеси как с водой, так и с серным ангидридом
SO3. Если молярное отношение SO3 : H2O < 1, то это водный
раствор серной кислоты, если >1 – раствор SO3 в серной
кислоте (олеум). Серная кислота, метко названная
Д.И.Менделеевым «хлебом промышленности», применяется
в производстве минеральных удобрений, для получения
других минеральных кислот и солей, в производстве
химических волокон, красителей, дымообразующих и
взрывчатых веществ, в нефтяной, металлообрабатывающей,
текстильной, кожевенной, пищевой и других отраслях
промышленности.
36.
Хлороводородная (соляная) кислота HClБесцветная, прозрачная, едкая жидкость. В
концентрации около 0,5 % присутствует в
желудке человека. В желудке соляная кислота
выполняет
несколько
функций.
Первая
функция – участие в процессе переваривания
пищи, расщепления белков, жиров, углеводов.
Вторая
функция
–
дезинфицирующая:
большинство
болезнетворных
микроорганизмов гибнут в кислой среде.
Желудочный сок начинает выделяться уже
тогда, когда вы начинаете пережевывать пищу.
Поэтому жевать резинку на голодный желудок
очень
вредно:
в
отсутствии
пищи
выделяющаяся при жевании соляная кислота
разрушает слизистую оболочку желудка.
37.
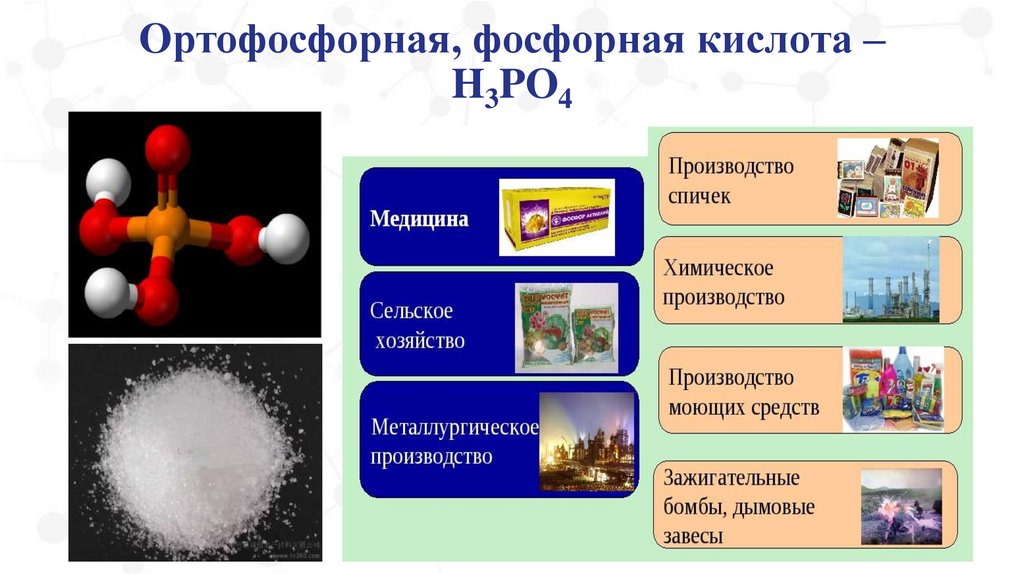
Oртофосфорная, фосфорная кислота –H3PO4
38.
Oртофосфорная, фосфорная кислота –H3PO4
39.
Азотная кислота – HNO340.
Правила приготовления растворов изконцентрированных кислот
41.
Выводы-
Основания – сложные вещества, состоящие из ионов металла и
гидроксид-ионов.
-
Алгоритм составления названия : "Гидроксид + название металла +
(степень окисления, если переменная").
-
По растворимости в воде основания делят на две основные группы
растворимые (щёлочи) и нерастворимые.
-
-
Качественной реакцией на растворимые основания (щёлочи) является
взаимодействие их с индикаторами: − лакмус – синий; − метилоранж –
жёлтый; − фенолфталеин – малиновый.
Основания - твердые вещества (кроме гидроксида аммония – NH4OH),
которые имеют различную окраску.
42.
Выводы-
Кислоты – сложные вещества, молекулы которых состоят из атомов
водорода, способных замещаться на атомы металла, и кислотных остатков;
-
Кислоты делятся по наличию кислорода в них на бескислородные (не
имеют кислорода) и кислородсодержащие (оксокислоты). Также кислоты
делятся по основности (число атомов водорода, способных замещаться
на атомы металла) на одноосновные (1 атом водорода) и многоосновные
(2 или больше атомов водорода);
Качественной реакцией на кислоты является взаимодействие их с
индикаторами: в кислой среде лакмус – красный; метилоранж – красный;
фенолфталеин – бесцветный
-
При работе с кислотами нужно использовать защитные перчатки и очки,
работать под вытяжкой. При разбавлении концентрированной кислоты
необходимо приливать кислоту в воду при постоянном перемешивании.






























 chemistry
chemistry








