Similar presentations:
Хлористый водород
1.
Хлористый водородВыполнила: Комольцева Анна Павловна
Проверил: доцент, к. пед. н. Чабарова Бибинур Мутовна
2.
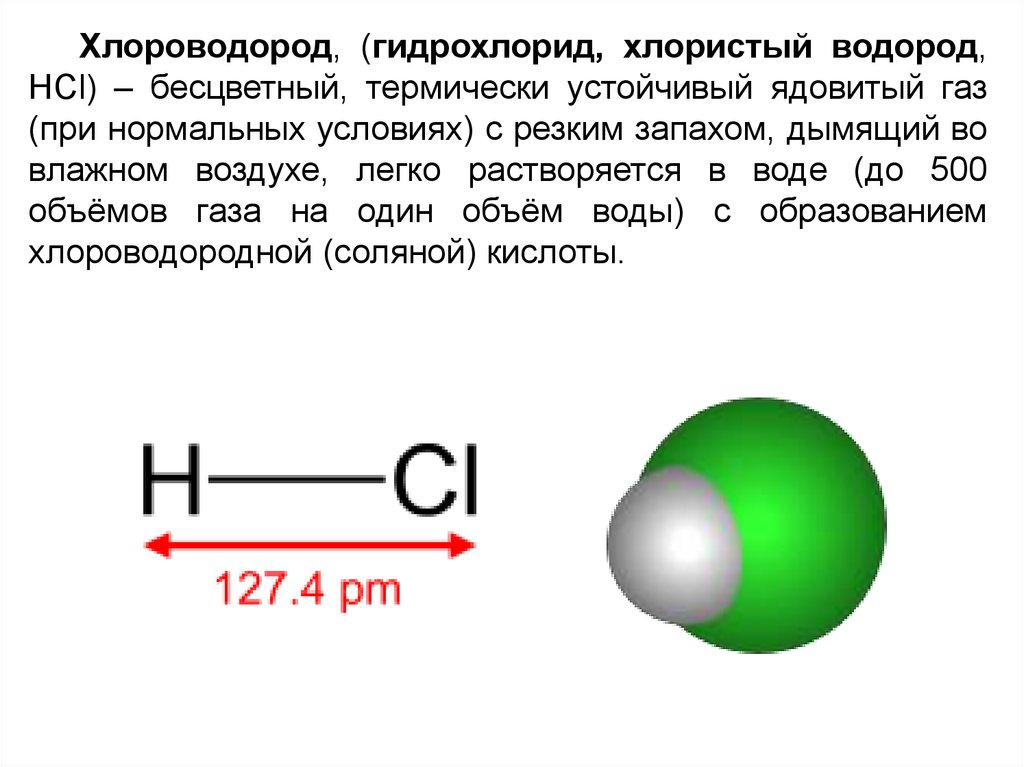
Хлороводород, (гидрохлорид, хлористый водород,HCl) – бесцветный, термически устойчивый ядовитый газ
(при нормальных условиях) с резким запахом, дымящий во
влажном воздухе, легко растворяется в воде (до 500
объёмов газа на один объём воды) с образованием
хлороводородной (соляной) кислоты.
3.
Физические свойства• Тяжелее воздуха.
• Соединение хорошо растворяется в воде. Раствор
хлороводорода в воде называют соляной кислотой.
• Хлороводород может менять агрегатное состояние под
воздействием температуры. При -85,1°C образуется
бесцветная жидкость, а при -114,22°C он переходит в
твердое (кристаллическое) состояние.
• Имеет способность поглощать пары воды из воздуха,
поэтому при высокой влажности дымится.
• Молярная масса 36,4606 г/моль.
• Плотность равна 1,477 г/л, в газообразном состоянии
при 25 °C.
• Температура плавления −114,22 °C.
• Температура кипения −85,1 °C.
• Температура разложения 1500 °C
4.
Химические свойстваРаствор хлороводорода в воде называют соляной кислотой.
Процесс растворения можно описать с помощью следующего
уравнения реакции:
HCl+H2O→H3O+Cl
В присутствии сильных окислителей или в процессе электролиза
хлороводород способен проявлять свойства восстановителя, при этом
окисляясь с выделением газообразного хлора:
MnO2+4HCl→MnCl2+Cl2+2H2O
В условиях повышенной температуры происходит окисление
хлороводорода кислородом в присутствии катализатора, роль которого
играет хлорид меди:
4HCl+O2→2H2O+2Cl2
5.
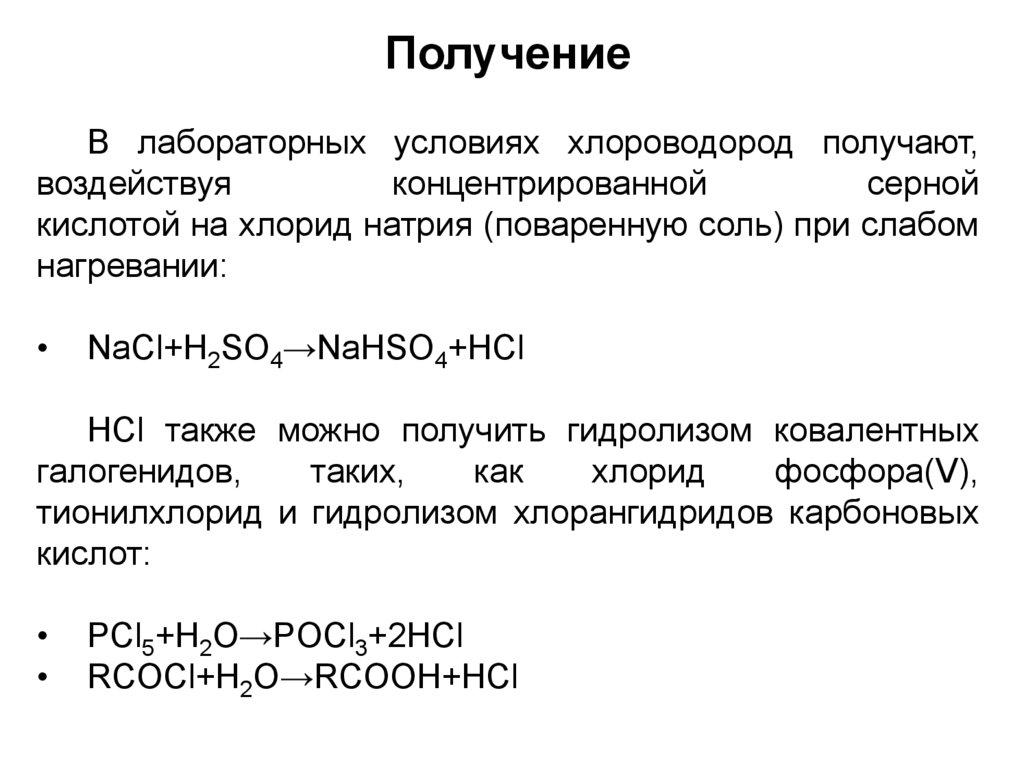
ПолучениеВ лабораторных условиях хлороводород получают,
воздействуя
концентрированной
серной
кислотой на хлорид натрия (поваренную соль) при слабом
нагревании:
NaCl+H2SO4→NaHSO4+HCl
HCl также можно получить гидролизом ковалентных
галогенидов,
таких,
как
хлорид
фосфора(V),
тионилхлорид и гидролизом хлорангидридов карбоновых
кислот:
PCl5+H2O→POCl3+2HCl
RCOCl+H2O→RCOOH+HCl
6.
В промышленности для получения хлороводородаобычно используют прямой синтез из простых веществ:
H2+Cl2⇄2HCl+184,7кДж
В производственных условиях синтез осуществляется в
специальных установках, в которых водород непрерывно
сгорает ровным пламенем в токе хлора, смешиваясь с ним
непосредственно в факеле горелки. Тем самым
достигается спокойное (без взрыва) протекание реакции.
7.
ПрименениеГазообразный
хлороводород
практически
не
используется из-за его физических и химических
характеристик. Широкое применение находит соляная
кислота:
1. Металлургия. Вещество используют, как средство для
очистки руд. Может также применяться для удаления
ржавчины и производства паяльной кислоты, необходимой
в области точного машиностроения.
2. Производство бытовой химии.
3. Медицина. Кислота применяется в смеси с пепсином в
качестве лекарства от пониженной кислотности желудка.
4. Пищевая промышленность. Регулятор кислотности
(пищевая добавка Е507).
8.
ТоксичностьХлороводород (Гидрохлорид, хлористый водород, HCl)
особо токсичен, числится в списке сильнодействующих
ядовитых веществ, относится к III классу опасности и в
высоких концентрациях обладает удушающим действием.
ПДК хлористого водорода в воздухе рабочей зоны
составляет 5 мг/м³.
Вдыхание хлороводорода в больших количествах
может привести к кашлю, воспалению носа, горла и
верхних дыхательных путей, а в тяжёлых случаях – к отёку
легких, нарушению работы кровеносной системы и
даже смертельному исходу. Контактируя с кожей, может
вызывать покраснение, боль и серьёзные ожоги.
Хлористый водород может вызвать серьёзные ожоги глаз
и их необратимое повреждение.
9.
Приотравлении
нужно
немедленно
вынести
пострадавшего на свежий воздух, освободить от
стесняющей дыхание одежды и дать кислород. Затем
промыть глаза, нос и полость рта 2 %-ным раствором
бикарбоната натрия. При затруднении дыхания ввести
эфедрин, атропин. В более тяжелых случаях для
профилактики и лечения следует делать ингаляции
антибиотиков; при поражении глаз – промыть их водой и
ввести 2 %-ный раствор новокаина или 0,5 %-ный раствор
дикаина с адреналином.
10.
При работе с соляной кислотой и хлористымводородом необходимо носить шерстяную защитную
одежду, прошитую нейлоновыми или шелковыми нитками,
или одежду из импрегнированной резины, резиновую
обувь, резиновые перчатки, резиновый передник, шляпу
или защитный головной убор, защитные очки с
обрамлением из резины с пластмассовыми линзами.
Работающие должны быть обеспечены фильтрующим
промышленным противогазом марки В. При большой
утечке газа в производственные помещения применяют
шланговые противогазы, маски с автономной подачей
воздуха или кислородные аппараты.
11.
Список информационных источников1. Википедия
–
Хлороводород
–
https://ru.wikipedia.org/wiki/Хлороводород
2. Свойства
хлороводорода
–
https://wika.tutoronline.ru/himiya/class/9/svojstvahlorovodoroda-sposoby-polucheniya
3. Техника безопасности при работе с хлороводородом –
https://studwood.ru/1783312/matematika_himiya_fizika/tehni
ka_bezopasnosti_rabote_hloristym_vodorodom_solyanoy_ki
slotoy
12.
Хлористый водородВыполнила: Комольцева Анна Павловна
Проверил: доцент, к. пед. н. Чабарова Бибинур Мутовна










 chemistry
chemistry








