Similar presentations:
Идеальный газ. Основное уравнение молекулярно-кинетической теории газов
1.
Идеальный газ. Основное уравнениемолекулярно-кинетической теории
газов.
2.
Цели занятия:1. Иметь представление о идеальном
газе, как физической модели.
2. Понимать и перечислять, от каких
величин зависит давление газа на
стенки сосуда.
3. Написать основное уравнение МКТ.
4. Указывать, как влияют изменения
величин, входящих в основное
уравнение МКТ, на изменение давления
газа.
3.
ИДЕАЛЬНЫЙ ГАЗИзвестно, что частицы в газах, в отличие от
жидкостей и твердых тел, располагаются друг
относительно
друга
на
расстояниях,
существенно превышающих их собственные
размеры. В этом случае взаимодействие
между молекулами пренебрежимо мало и
кинетическая энергия молекул много больше
энергии межмолекулярного взаимодействия.
Для выяснения наиболее общих свойств,
присущих всем газам, используют упрощенную
модель реальных газов идеальный газ
4.
Идеальный газ(модель)
Реальный газ
1. Совокупность большого числа
молекул массой m0, размерами
молекул пренебрегают (принимают
молекулы за материальные точки).
2. Молекулы находятся на больших
расстояниях друг от друга и
движутся хаотически.
3. Молекулы взаимодействуют по
законам упругих столкновений ,
силами притяжения между
молекулами пренебрегают.
4. Скорости молекул разнообразны,
но при определенной температуре
средняя скорость молекул остается
постоянной.
1. Молекулы реального газа не
являются точечными
образованиями, диаметры
молекул лишь в десятки раз
меньше расстояний между
молекулами.
2. Молекулы не взаимодействуют по законам
упругих столкновений.
5.
Идеальный газ – газ, молекулы которогопредставляют собой материальные
точки, а их взаимодействие носит
характер абсолютно упругого удара
Идеальный газ –
физическая модель
реального газа
Модели идеального газа
соответствует реальный
газ находящийся под
низким давлением и при
высокой температуре
Воздух при нормальных условиях можно приближенно считать
идеальным газом
6.
Свойства идеального газа1.Суммарный
объем
молекул
по
сравнению с объемом, занимаемым
газом, пренебрежимо мал.
2. Молекулы представляют собой упругие
шарики
3. Внутренняя энергия газа определяется
лишь кинетической энергией.
7.
8.
9.
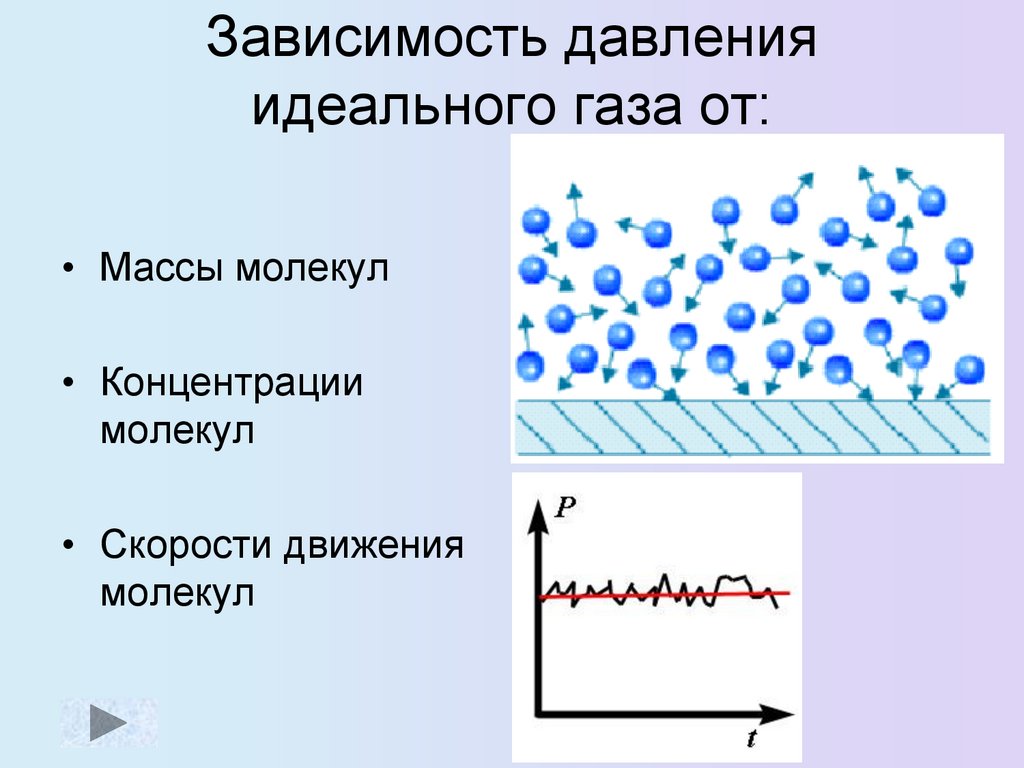
Зависимость давленияидеального газа от:
• Массы молекул
• Концентрации
молекул
• Скорости движения
молекул
10.
11.
12.
13.
14.
Пусть V1, V 2, V3……. VN -,модули скоростей молекул, они могут быть разными, а средняя скорость, вполне
определенная величина, и равна среднему арифметическому скоростей молекул.
15.
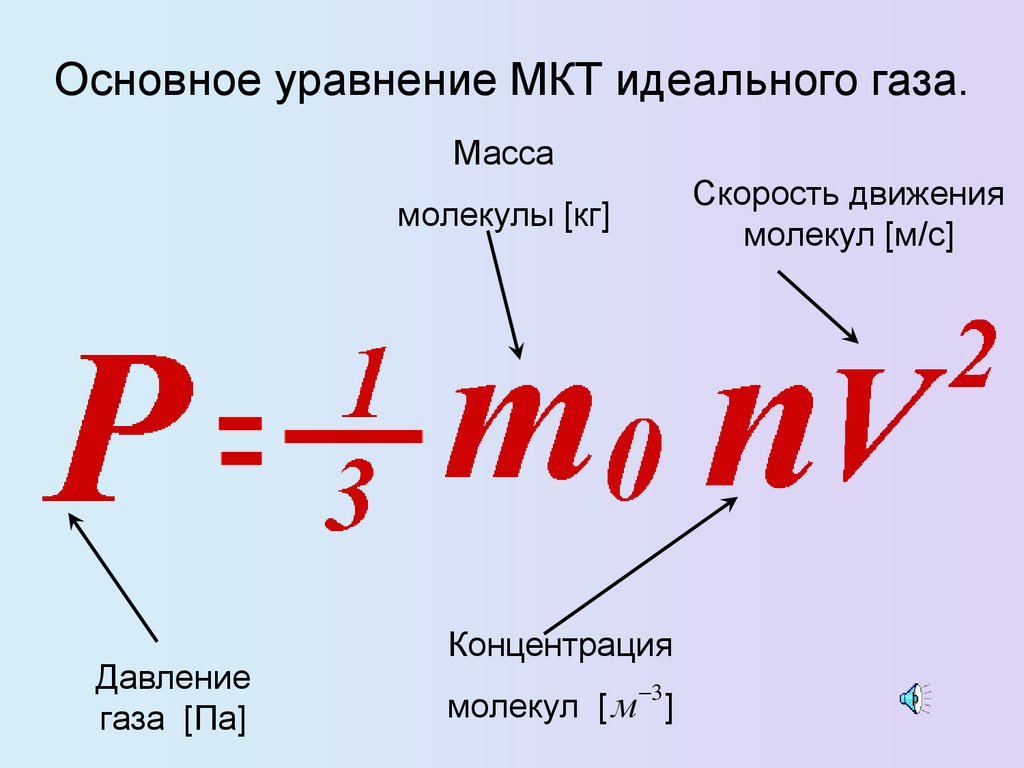
Основное уравнение МКТ идеального газа.Масса
Скорость движения
молекул [м/с]
молекулы [кг]
Давление
газа [Па]
Концентрация
3
молекул [ м ]
16.
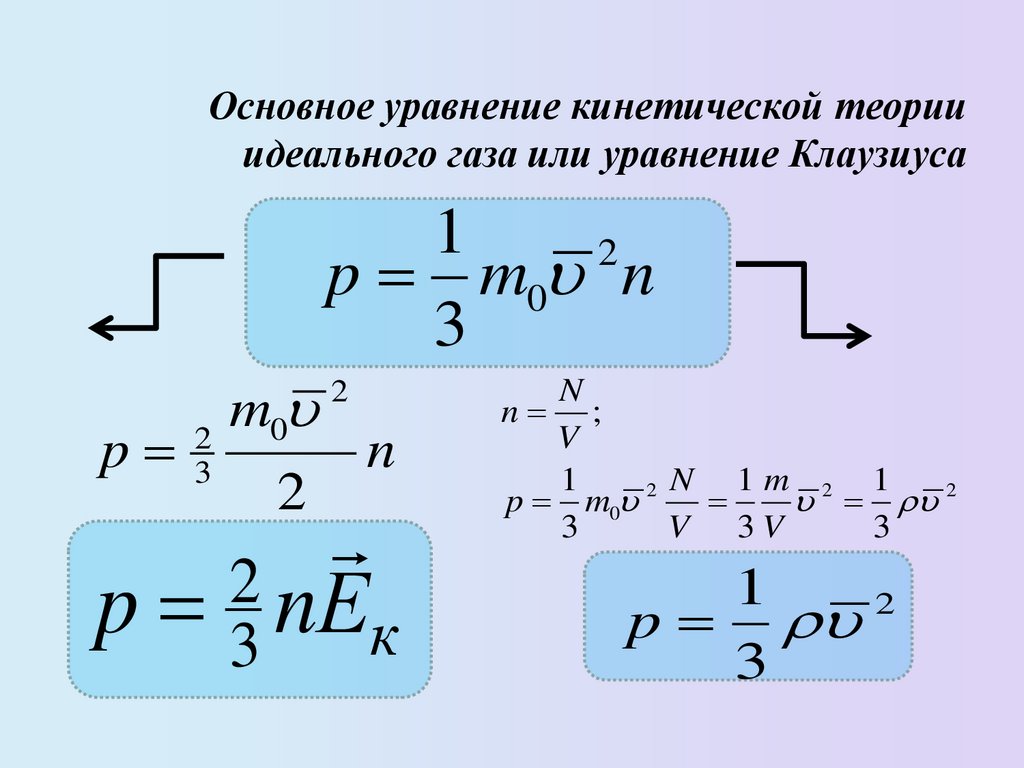
Основное уравнение кинетической теорииидеального газа или уравнение Клаузиуса
1
2
p m0 n
3
p
2
3
m0
2
2
n
2
p 3 nЕк
N
n ;
V
1
N 1m 2 1
p m0 2
2
3
V 3V
3
1
p
3
2
17.
Как изменится давление газа настенки сосуда, если:
масса молекулы увеличится в 3 раза
концентрация молекул уменьшится в 4 раза
скорость движения молекул увеличится в 2 раза
объем увеличится в 5 раз
масса молекулы уменьшится в 4 раза, а
концентрация увеличится в 2 раза
• масса молекулы увеличится в 2 раза, а скорость
движения молекул увеличится в 3 раза
• концентрация молекул увеличится в 3 раза,
скорость движения молекул уменьшится в 3 раза
18.
19.
20.
21.
22.
23.
Домашнее задание• Конспект занятия!
• Задача №1. Найти концентрацию молекул азота (N2 ), если
давление его 0,2МПа,а средняя квадратическая скорость
молекул равна 700м/с?
• Задача№2.Найти среднюю кинетическую энергию молекулы
одноатомного газа при давлении 20кПа. Концентрация молекул
газа при указанном давлении составляет 3·1025 м-3.
• Задача№3. Во сколько раз изменится давление одноатомного
газа в результате уменьшения его объема в 3 раза и
увеличении средней кинетической энергии его молекул в 2
раза?
• Задача№4. Каково давление кислорода, если средняя
квадратическая скорость его молекул 800 м/с, а его плотность 1,
35 кг/м3?








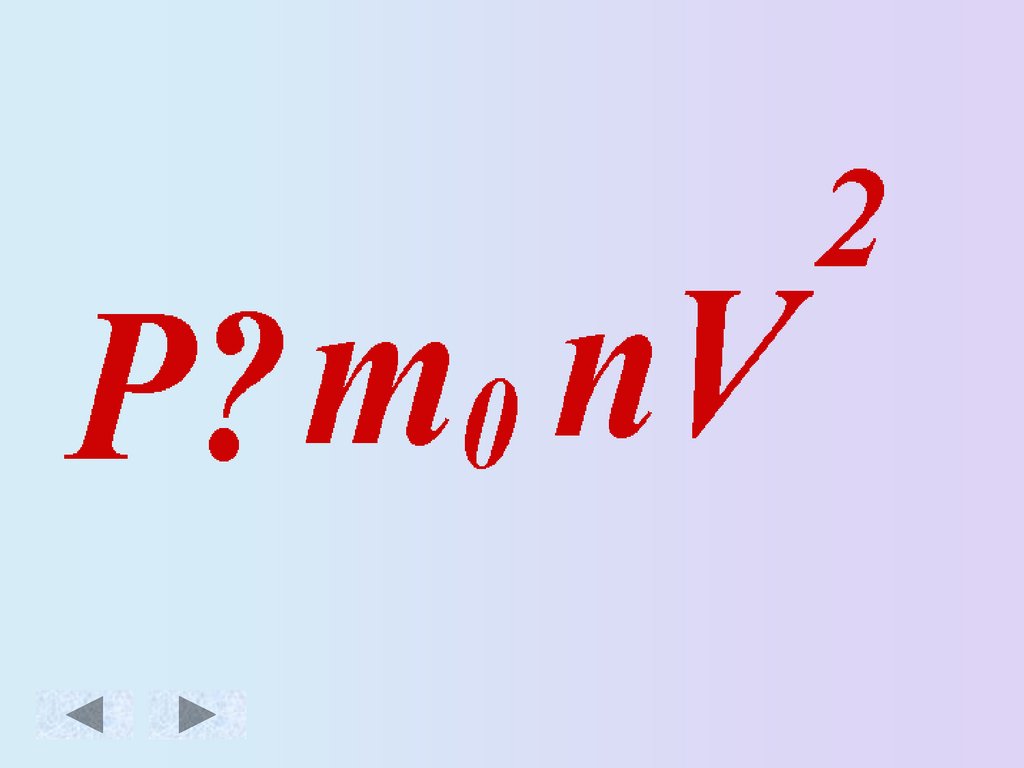








 physics
physics








