Similar presentations:
УФ-спектроскопия. Часть 1
1.
УФ СПЕКТРОСКОПИЯ2.
Введение■ Важнейшей способностью современной химии является
использование физико-химических методов исследования.
■ В основе определения химических свойств находится
молекулярная и структурная формулы веществ и
реакционная способность.
■ Многие из химических свойств прямо или косвенно связаны
с физическими свойствами.
■ Физические величины имеют определенные числовые
характеристики. Поэтому в плане определения химического
строения можно говорить о соответствии или корреляции
физических величин и характеристик химического строения.
3.
Введение■ Особое значение физические методы имеют для
целей определения состава веществ (в
аналитических целях).
■ Физико-химические методы исследований
основаны на измерении физических (главным
образом ядерные, атомных, молекулярных)
характеристик, обуславливающих химические
индивидуальности определяемых компонентов
■ Наиболее широкое распространение при
исследовании органических веществ получили
методы спектрального анализа: электронной,
инфракрасной, ЯМР-спектроскопии и массспектрометрии.
4.
Общая характеристика физическихметодов исследования веществ
■ Строгого разграничения физико-химических и
физических методов исследования нет.
■ Однако под физическими методами обычно понимают
методы, особенно современные, разработанные
физиками и используемые в химии.
■ Эти методы, естественно, не включают такие, как
разделение перегонкой, перекристаллизацией,
взвешивание, определение температур плавления и
кипения, термохимические и электрохимические
методы и т.п.
5.
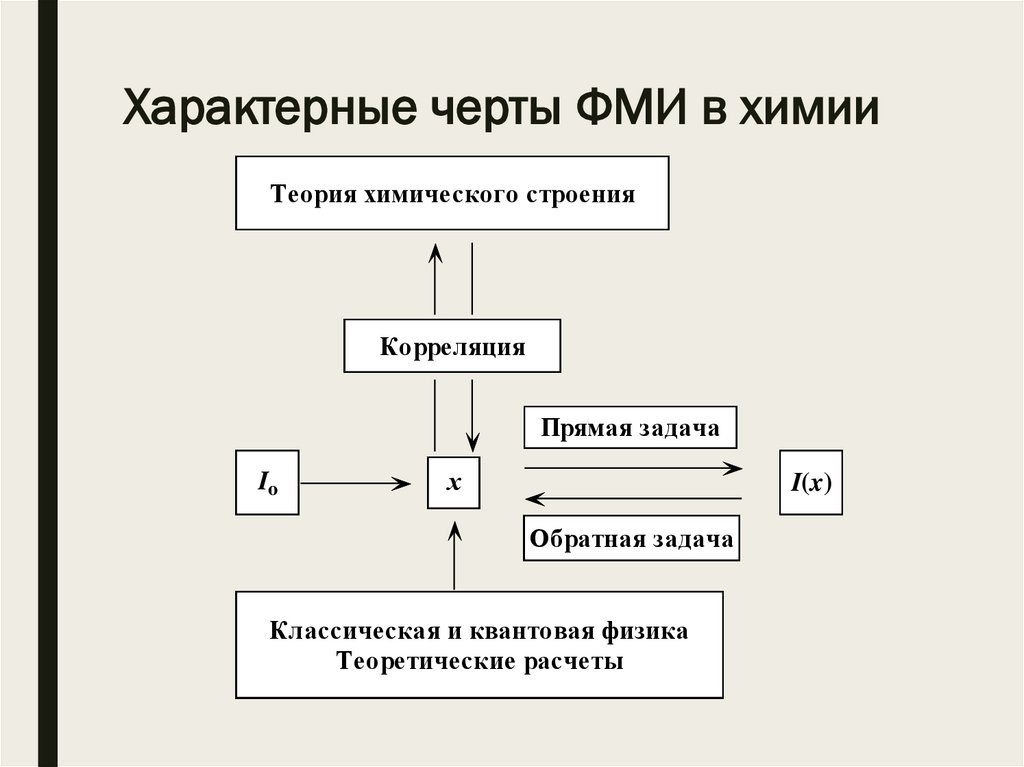
Характерные черты ФМИ в химииТеория химического строения
Корреляция
Прямая задача
Io
х
I(x)
Обратная задача
Классическая и квантовая физика
Теоретические расчеты
6.
Общие положенияспектроскопических методов
■ В большинстве спектроскопических методах
измеряют зависимость интенсивности излучения
I, прошедшее через вещество или рассеянное
веществом, от частоты , т.е. определяют
функцию I( ).
■ Самой важной характеристикой излучения
является энергия, которая определяется
соотношением:
Е = h× ,
(1)
где – изменение энергии системы, кДж;
h – постоянная Планка, 6,626×10-34 Дж·с;
– частота излучения, Гц или с-1.
7.
Шкала электромагнитных волн8.
Шкала электромагнитных волн9.
Общие положенияспектроскопических методов
■ Энергию молекулы рассматривают как сумму
независимых (с некоторым приближением)
энергий: электронной, колебательной,
вращательной (вращение всей молекулы),
спиновой (вращение ядер):
Емол. = Еэл + Екол.+ Евр. + Еспин.
■ Энергии молекул распределяются следующим
образом:
Еэл > Екол.> Евр. > Еспин.
(2)
10.
Общие положенияспектроскопических методов
■ Единственный способ изменить внутримолекулярное
движение – это сообщить молекуле или отнять у нее
определенное количество энергии.
■ Если энергия поглощена, молекула перейдет в новое
энергетическое состояние, которое расположено
выше на энергетической шкале и является менее
стабильным (возбужденное состояние, Екон.).
■ Состояние молекулы до сообщения ей
дополнительной энергии – основным (Енач.).
■ Чем больше поглощено энергии, тем выше
возбужденное состояние и тем оно менее стабильно.
11.
Общие положенияспектроскопических методов
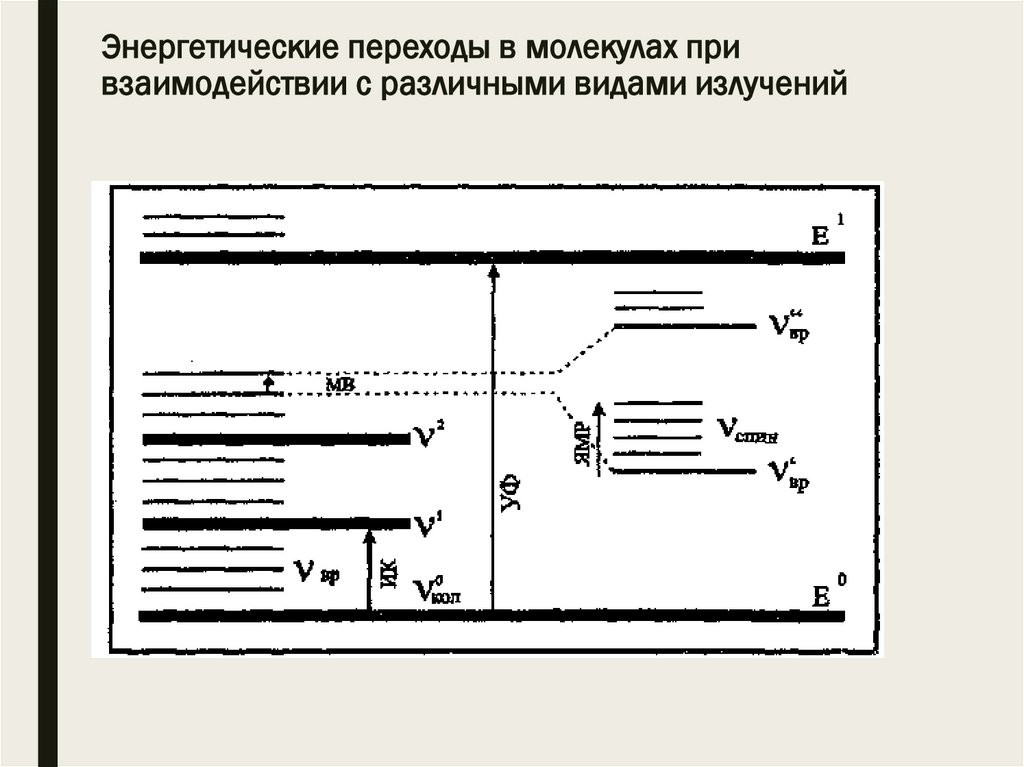
■ В зависимости от энергии поглощающего излучения
изменяются различные виды движения.
■ УФ и видимое излучение возбуждает электроны
молекулы, ИК излучение – колебательное движение,
радиочастотное излучение вызывает изменение
спинового состояния ядер.
■ Самым энергоемким является электронное
возбуждение, менее всего требуется энергии на
возбуждение ядерного спина.
Е = Екон – Енач = h·
12.
Общие положения спектроскопическихметодов
■ Внутренняя энергия молекулы квантована. В связи с
этим количество поглощаемой энергии может иметь
только строго определенные значения, т.е.
поглощается излучение только определенной частоты.
■ Поглощение излучения, а, следовательно, и энергии
происходит в том случае, если квант излучения
соответствует разности между двумя энергетическими
уровнями облучаемого вещества.
■ Переходами между уровнями энергии Екон и Енач
«управляют» правила отбора.
■ Это означает, что не все переходы возможны.
13.
Энергетические переходы в молекулах привзаимодействии с различными видами излучений
14.
Энергия переходов■ Область интенсивного поглощения излучения
называется полосой.
■ Совокупность полос представляет собой спектр
поглощения.
■ Электромагнитное излучение имеет двойную природу –
оно обладает волновыми и корпускулярными
свойствами. Излучение и поглощение энергии
происходит квантами, энергия которых описывается
уравнением:
E h h
c
,
где с – скорость света в вакууме;
– длина волны, см, мкм (10–4 см, 10–6 м), нм (10–7 см,
10–9 м).
(3)
15.
Волновое число■ Часто употребляют волновое число (также
называемое частотой) (см–1):
1
,
(4)
с
т.е. число волн, приходящихся на 1 см длины
светового луча.
■ Волновое число прямо пропорционально частоте;
шкала волновых чисел прямо пропорциональна
энергии квантов излучения.
■ C помощью специальных устройств может быть
получено излучение, имеющее определенную
длину волны, и, соответственно, одинаковую
энергию квантов. Такое излучение называют
монохроматическим.
1
16.
УЛЬТРАФИОЛЕТОВАЯ(ЭЛЕКТРОННАЯ)
СПЕКТРОСКОПИЯ
Основные принципы и законы
17.
Классификация УФ-области■ Ультрафиолетовая (электронная) спектроскопия –
раздел оптической спектроскопии, который включает
получение, исследование и применение спектров
испускания, поглощения и отражения в
ультрафиолетовой области.
■ Энергия фотонов ультрафиолетового и видимого
диапазонов спектра достаточно высока (1,7–100 эВ
или 120–1000 кДж/моль), чтобы перевести электроны
органических молекул из основного состояния в
возбужденное – со связывающей на разрыхляющие
орбитали.
18.
Классификация УФ-области■ В УФ-области (10–780 нм) поглощают все
органические вещества.
■ «Рабочая» область составляет интервал 190–780 нм,
главным образом от 200 до 380 нм (ближняя область
УФ-спектра).
■ В этих областях прозрачен оптический материал для
изготовления призм и кювет.
19.
Классификация УФ-области■ Длины волн менее 190 нм (дальняя область УФспектра, вакуумный ультрафиолет) малопригодна
для работы, так как в этой поглощают компоненты
воздуха – кислород и азот. Поэтому используются
специальные вакуумные камеры, что обычно
усложняет лабораторную практику.
■ Вакуумный ультрафиолет незаменим при
исследовании диэлектриков с большой величиной
запрещенной зоны.
■ Необходимые для исследования количества
вещества невелики – около 0,1 мг.
■ В связи с этим УФ-спектроскопия является одним
из наиболее распространенных ФХМИ
органических соединений.
20.
Метод молекулярных орбиталей■ К настоящему моменту наиболее глубокая
информация о строении электронных оболочек
молекул получена с помощью методов квантовой
механики, а именно, метода молекулярных
орбиталей (МО).
■ Одним из наиболее плодотворных и наглядных
методов МО является представление
молекулярной орбитали в виде линейной
комбинации атомных орбиталей (МО – ЛКАО).
21.
Метод молекулярных орбиталей■ количество МО равно количеству АО всех атомов
данной молекулы;
■ МО, как и АО, заполняются электронами попарно
снизу вверх по энергетической шкале, поэтому
приблизительно половина МО будет
заселенными, остальные – свободными;
■ МО различаются по симметрии ( и ), при этом
и орбитали являются ортогональными, то есть
их взаимодействие минимально;
■ МО различаются по степени делокализациилокализации: те МО, которые состоят из
нескольких АО, в соизмеримых соотношениях
называются делокализованными, а те МО,
которые представлены доминирующим участием
одной-двух АО называются локализованными.
22.
Метод молекулярных орбиталей■ Из занятых локализованных МО часто можно выделить
такие, которые не участвуют в образовании химической
связи – их называют МО неподеленной электронной
пары (МО типа НЭП). Орбитали типа НЭП присущи
атомам азота (одна), кислорода (две), серы (две),
галогенов (три).
■ Существуют МО, имеющие одинаковую энергию – они
называются вырожденными.
■ Граничные молекулярные орбитали – верхние занятые
(ВЗМО) и нижние свободные (НСМО), которые можно
рассматривать как валентные орбитали молекулы,
отвечающие как за химические, так и за
спектроскопические свойства молекул.
23.
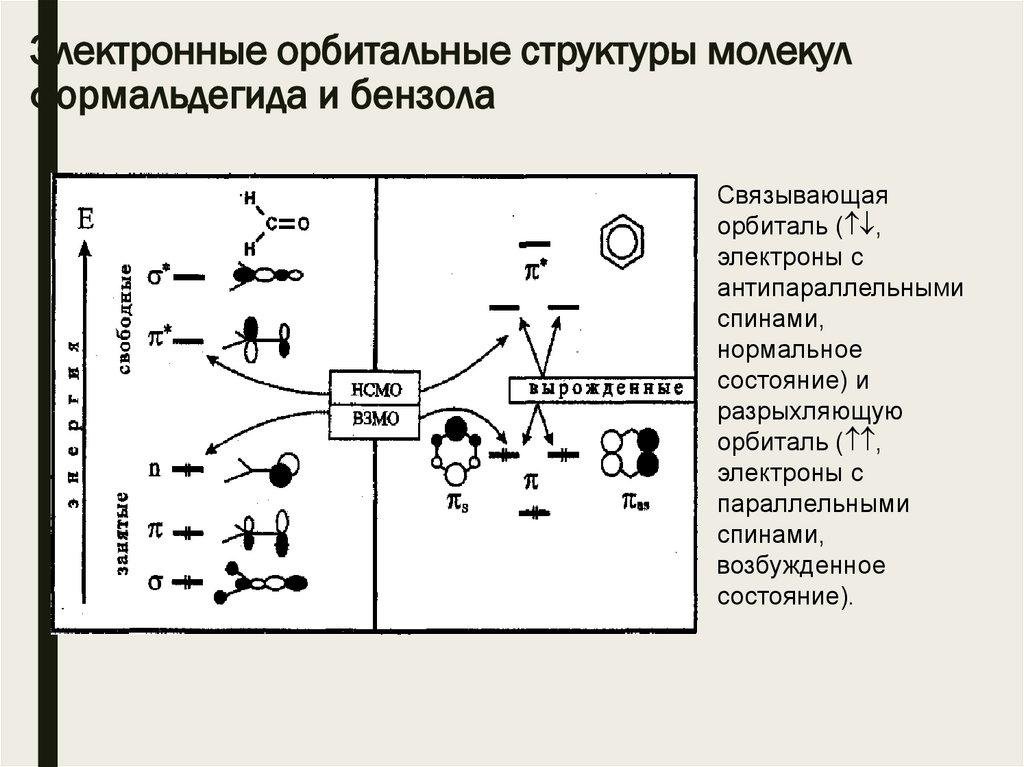
Электронные орбитальные структуры молекулформальдегида и бензола
Связывающая
орбиталь ( ,
электроны с
антипараллельными
спинами,
нормальное
состояние) и
разрыхляющую
орбиталь ( ,
электроны с
параллельными
спинами,
возбужденное
состояние).
24.
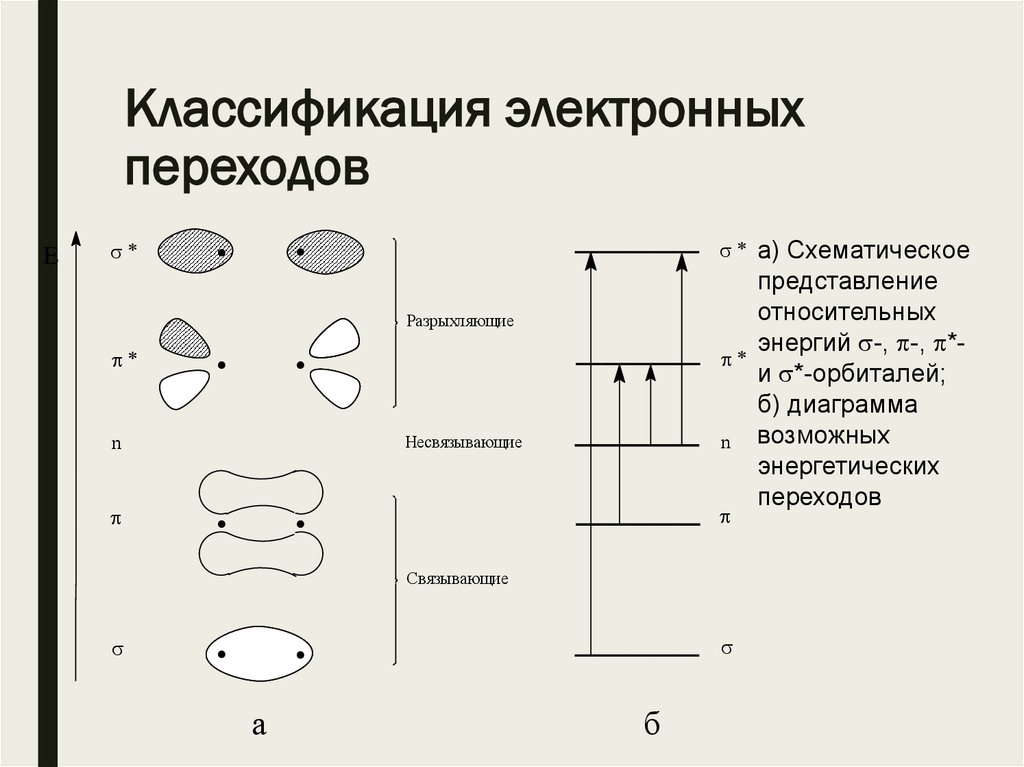
Классификация электронныхпереходов
E
. .
. .
n
Разрыхляющие
n
Несвязывающие
. .
Связывающие
. .
a
б
а) Схематическое
представление
относительных
энергий -, -, *и *-орбиталей;
б) диаграмма
возможных
энергетических
переходов
25.
Энергетические переходы■ Наибольшая энергия кванта необходима для
осуществления перехода , т.е. для возбуждения
электронов наиболее прочной связи необходимы
кванты света минимальной длины (менее 190 нм), при
этом происходит разрыв связи.
■ Энергия перехода меньше, и, следовательно,
длина волны света, возбуждающего такой переход,
соответственно больше ( 190 нм).
26.
Энергетические переходы■ Энергия n-уровня электронов выше энергий -уровней,
поэтому возбуждение вызывается квантами света
(n переход) еще большей длины волны.
■ Наиболее информативными являются переходы n и
(переход ВЗМО НСМО), поскольку им
соответствуют длины волн, попадающие в рабочий
диапазон прибора.
■ Исключения составляют переходы
изолированных кратных связей С=С, С=N, С С и С N
( макс = 160–180 нм).
■ Для изолированных кратных связей в используемом для
измерений интервале проявляется только переход
карбонильной группы С=О ( макс 270 нм).
27.
Основные характеристикиУФ-спектра
■ Длина волны ( макс, нм) электронного перехода является
одной из двух характеристик (координат) электронного
спектра.
■ Другая характеристика – это интенсивность полосы
поглощения, то есть вероятность каждого типа
электронного перехода.
28.
Правила отбора1. По симметрии. С наибольшей вероятностью
совершаются электронные переходы между МО одного
типа или близкой симметрии.
Переходы типа: и являются разрешенными,
а переходы типа: и n – запрещенными,
поскольку в последнем случае электронный обмен
совершается между орбиталями разной симметрии,
расположенными ортогонально.
За счет различных взаимодействий второго порядка
(более слабых) этот запрет частично снимается. Это значит,
что переходы типа и n будут иметь место, но с
малой вероятностью и малой интенсивностью.
n переходы расположены в более длинноволновой
области, а переходы имеют большую интенсивность.
29.
Правила отбора2. Поглощение энергии молекулой должно
сопровождаться изменением положения
электрического центра молекулы.
■ Дипольные моменты молекулы в основном и
возбужденном состояниях должны различаться при
совершении работы электронного перехода.
■ Этот запрет также может частично сниматься
различными слабыми взаимодействиями.
■ В ряде случаев идентификацию электронных
переходов можно провести экспериментально, если
измерять спектры одного и того же вещества в
растворителях различной полярности.
■ При переходе от менее полярного к более полярному
растворителю полосы переходов смещаются в
длинноволновую, а полосы n переходов – в
коротковолновую область.
30.
Правила отбора3. По мультиплетности: запрещены переходы между
состояниями различной мультиплетности (с поворотом
электрона).
■ Мультиплетность определяется суммарным спином
электронов.
■ Так как большинство электронов в молекулах спарено,
то для большинства веществ в основном состоянии
характерен нулевой суммарный спин, то есть М = 1
(синглетное) состояние (исключением является,
например, кислород, у которого основное состояние
триплетное).
31.
Правила отбора■ При возбуждении молекулы один из электронов
переходит в возбужденное состояние. При этом
мультиплетность может либо не меняться, если не
меняется взаимная ориентация спинов, либо
меняется, когда взаимная ориентация спинов
изменяется. Из основного синглетного состояния
молекула может перейти в возбужденное синглетное
или триплетное (М = 3) состояние.
■ Разрешены S S (синглет–синглетные переходы) и
запрещены S Т (синглет–триплетные).
32.
Правила отбора4. Запрещены переходы, при которых происходит
возбуждение более чем одного электрона.
■ Разрешенные переходы – это те, которые
соответствуют правилам отбора, имеют большую
вероятность совершения и, следовательно, большую
интенсивность (lg 4).
■ «Запрещенные» переходы имеют малую вероятность
совершения и малую интенсивность (lg 1–2).




























 physics
physics








