Similar presentations:
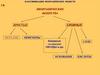
Классификация неорганических веществ
1.
Классификация неорганических веществВещества
Простыесостоят из атомов
одного химического
элемента.
Сложныесостоят из атомов
разных элементов
2.
Сложные веществаОксиды Гидроксиды
Кислоты
Соли
Основания
Амфотерные гидроксиды
3.
ОксидыОксиды – это сложные вещества,
состоящие из двух химических элементов,
один из которых – кислород со степенью
окисления -2
Общая формула:
Э mOn
m число атомов элемента Э,
n – число атомов кислорода.
Называют так – «оксид элемента» (степень
окисления), если она переменна.
Примеры
CO2 оксид углерода (IV)
FeO оксид железа (II)
4.
Сравните двавещества:
О
Н
Н
Н
Н
О
О
Соединения, содержащие в своем составе непосредственно
связанные друг с другом атомы кислорода (-О-О-),
называются пероксиды.
5.
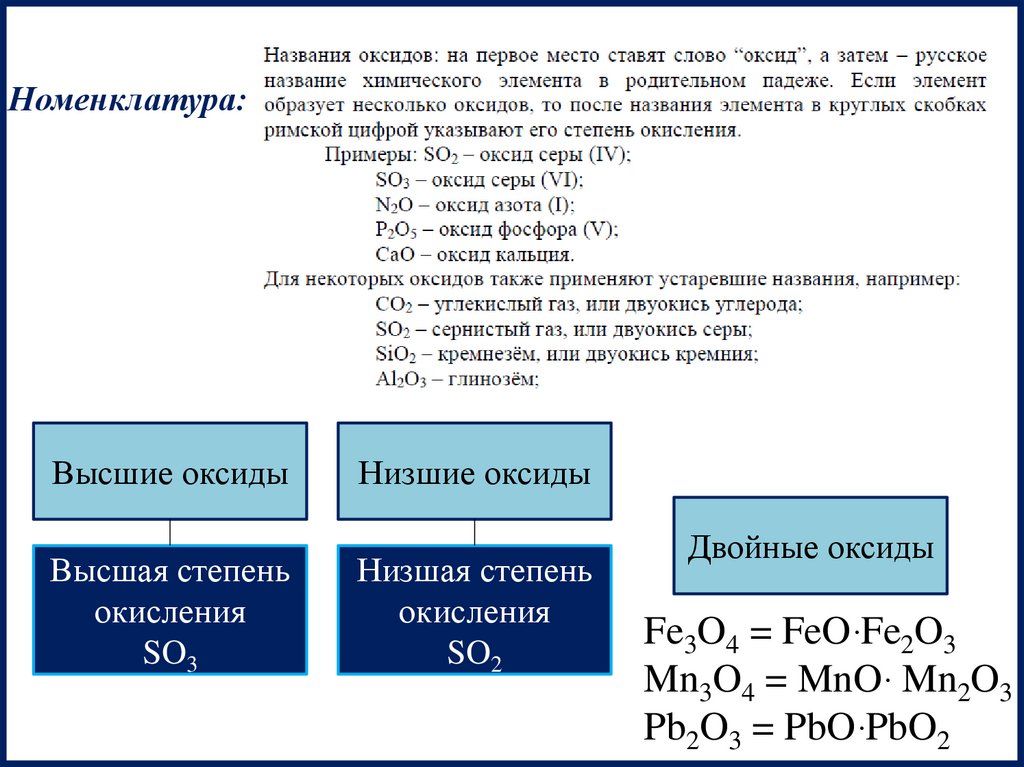
Номенклатура:Высшие оксиды
Высшая степень
окисления
SO3
Низшие оксиды
Низшая степень
окисления
SO2
Двойные оксиды
Fe3O4 = FeOּ Fe2O3
Mn3O4 = MnOּ Mn2O3
Pb2O3 = PbOּ PbO2
6.
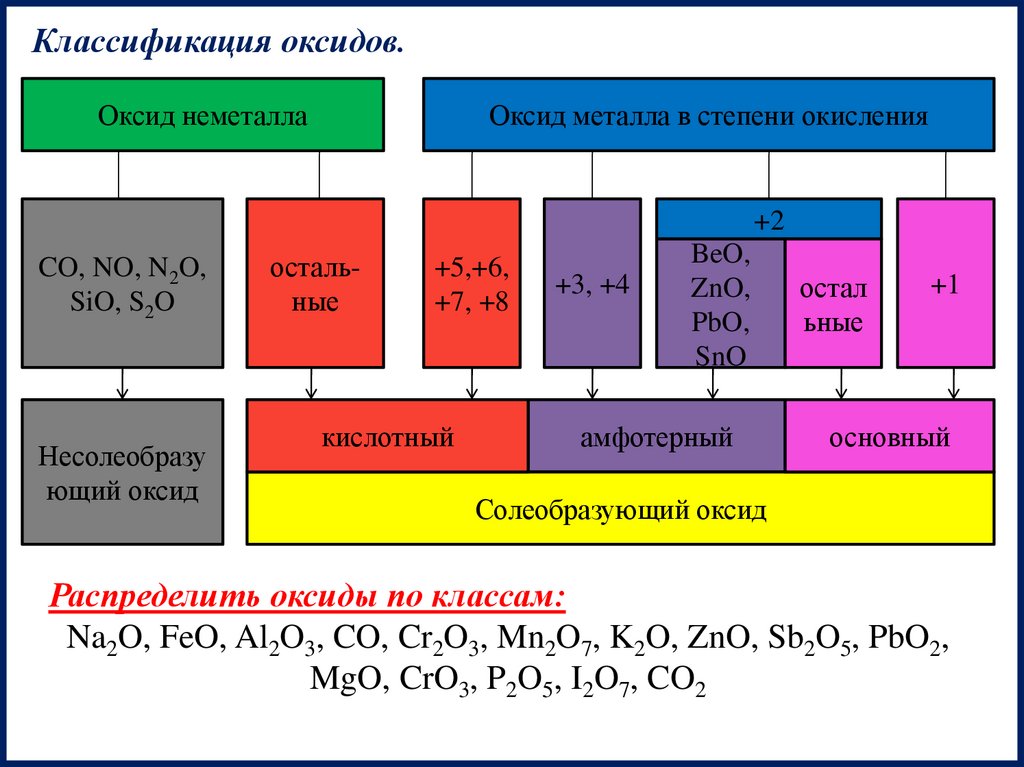
Классификация оксидов.Оксид неметалла
Оксид металла в степени окисления
+2
CO, NO, N2O,
SiO, S2O
Несолеобразу
ющий оксид
остальные
+5,+6,
+7, +8
кислотный
+3, +4
BeO,
ZnO,
PbO,
SnO
амфотерный
остал
ьные
+1
основный
Солеобразующий оксид
Распределить оксиды по классам:
Na2O, FeO, Al2O3, CO, Cr2O3, Mn2O7, K2O, ZnO, Sb2O5, PbO2,
MgO, CrO3, P2O5, I2O7, CO2
7.
Несолеобразующие оксидыCO, NO, N2O,
SiO, S2O
СО (угарный газ):
При высокой температуре
восстанавливает многие металлы и
неметаллы из их оксидов:
CO + CuO = Cu + CO2↑
1) В химические реакции
CO + Fe3O4 = Fe + CO2↑
вступают редко
2) Безразличны к кислотам и
щелочам
CO + H2O = H2↑ + CO2↑
3) Не имеют соответствующих
гидроксидов
CO + P2O5 = P + + CO2↑
8.
ОксидСоответствующий
гидроксид
Основный оксид
Основание
Кислотный оксид
Кислота
Амфотерный оксид
Амфотерный
гидроксид
9.
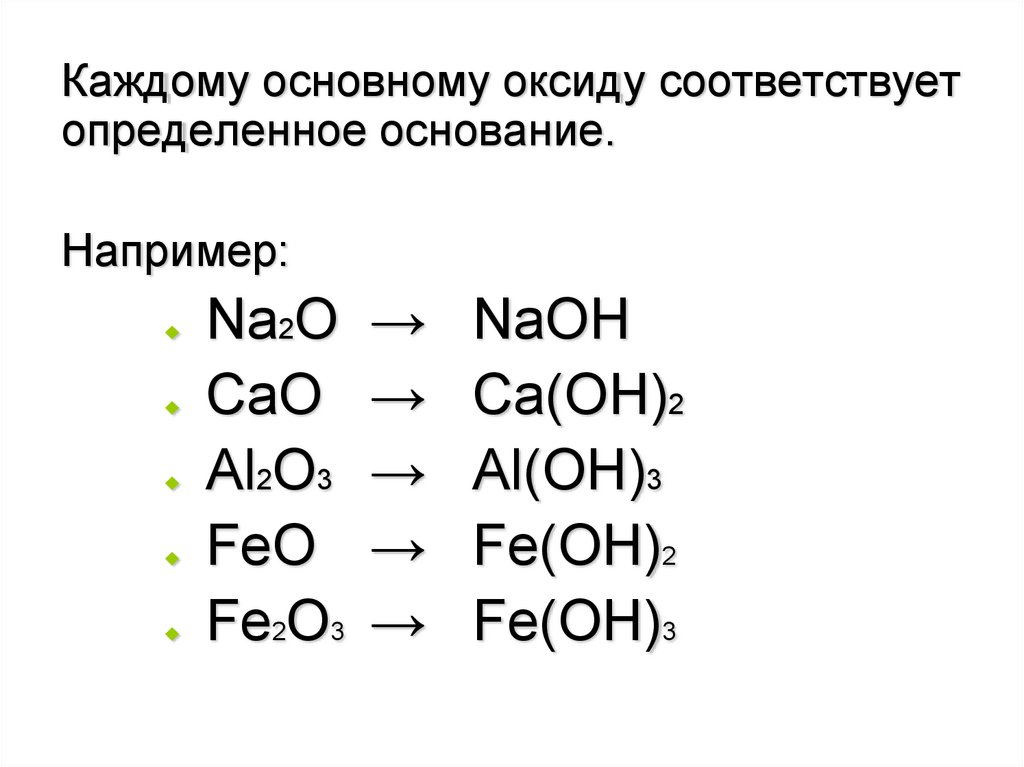
Каждому основному оксиду соответствуетопределенное основание.
Например:
Na2O
CaO
Al2O3
FeO
Fe2O3
→
→
→
→
→
NaOH
Ca(OH)2
Al(OH)3
Fe(OH)2
Fe(OH)3
10.
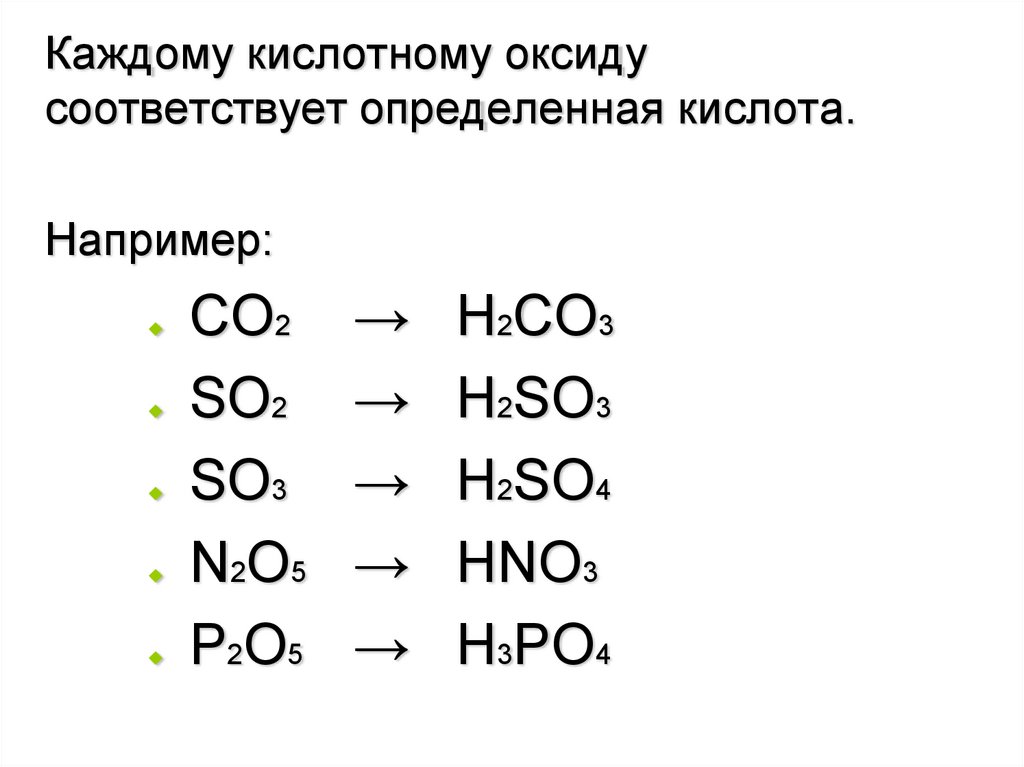
Каждому кислотному оксидусоответствует определенная кислота.
Например:
СО2
SО2
SО3
N2О5
P2О5
→
→
→
→
→
Н2СО3
H2SО3
Н2SО4
HNO3
H3PO4
11.
12.
ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ
ТВЕРДЫЕ
ЖИДКИЕ
ГАЗООБРАЗНЫЕ
13.
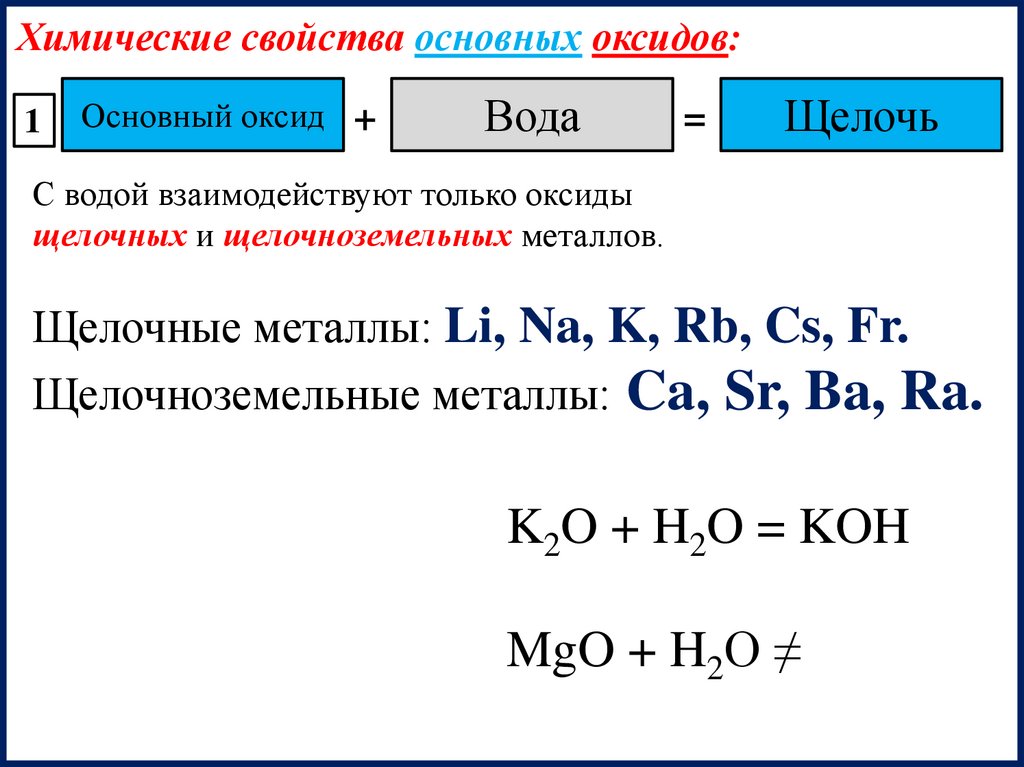
Химические свойства основных оксидов:1
Основный оксид +
Вода
=
Щелочь
С водой взаимодействуют только оксиды
щелочных и щелочноземельных металлов.
Щелочные металлы: Li, Na, K, Rb, Cs, Fr.
Щелочноземельные металлы: Ca, Sr, Ba, Ra.
K2O + H2O = KOH
MgO + H2O ≠
14.
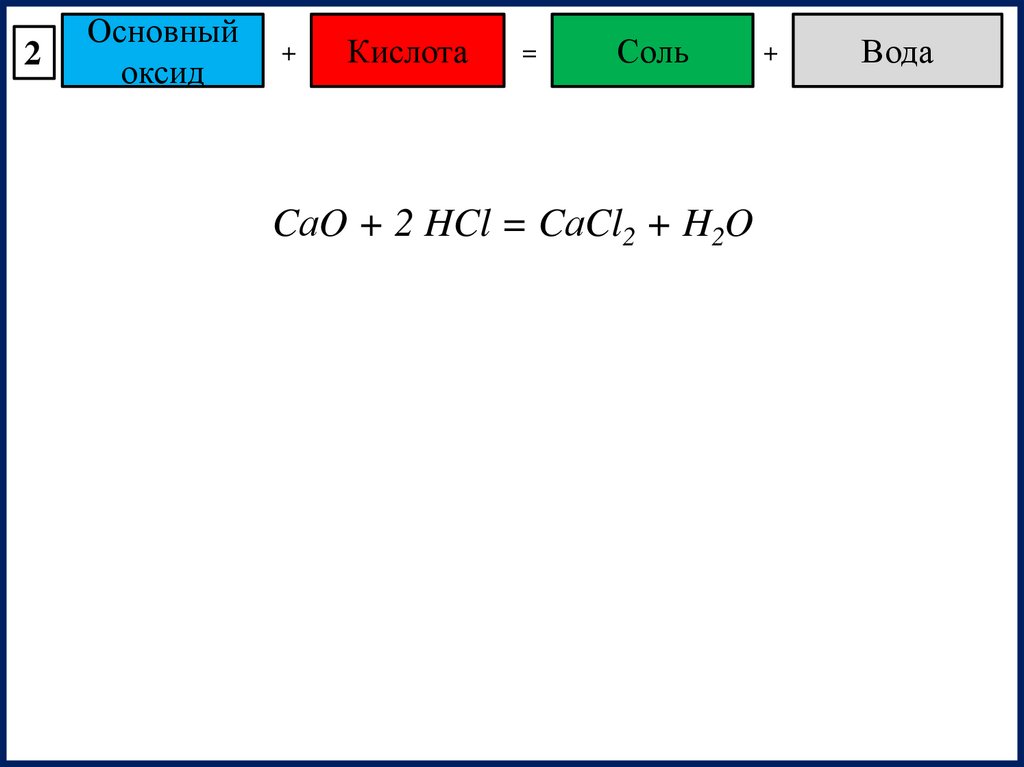
2Основный
оксид
+
Кислота
=
Соль
CаO + 2 HCl = CаCl2 + H2O
+
Вода
15.
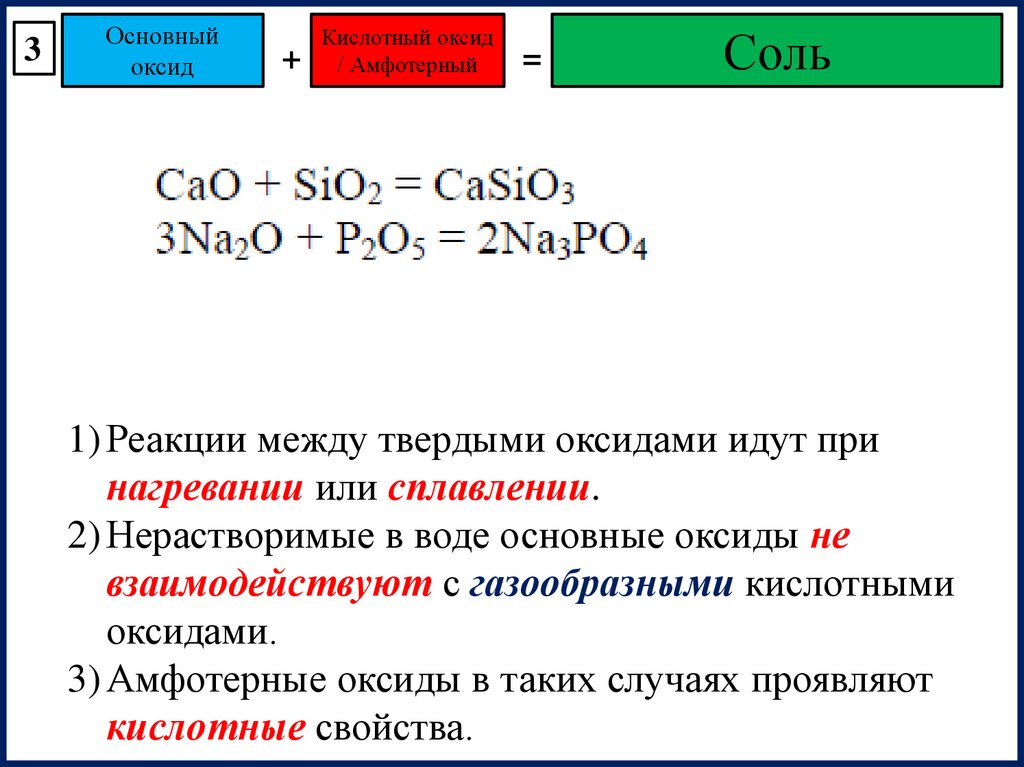
3Основный
оксид
+
Кислотный оксид
/ Амфотерный
=
Соль
1) Реакции между твердыми оксидами идут при
нагревании или сплавлении.
2) Нерастворимые в воде основные оксиды не
взаимодействуют с газообразными кислотными
оксидами.
3) Амфотерные оксиды в таких случаях проявляют
кислотные свойства.
16.
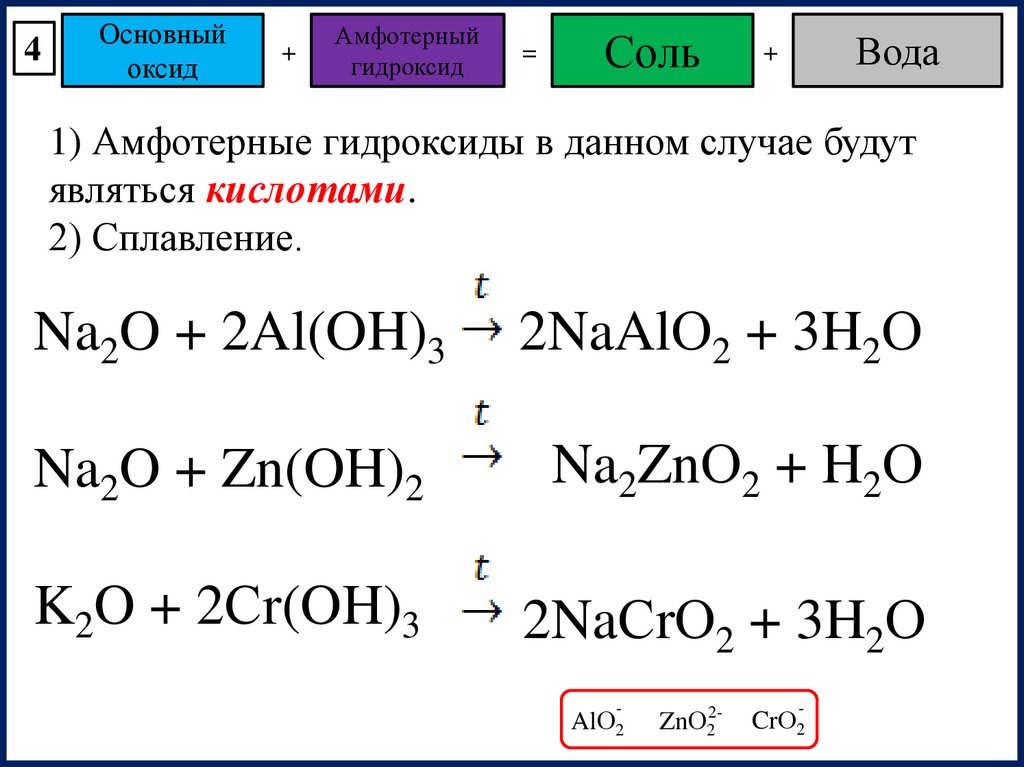
4Основный
оксид
+
Амфотерный
гидроксид
=
Соль
Вода
+
1) Амфотерные гидроксиды в данном случае будут
являться кислотами.
2) Сплавление.
Na2O + 2Al(OH)3
2NaAlО2 + 3H2О
Na2O + Zn(OH)2
Na2ZnО2 + H2О
K2O + 2Сr(OH)3
2NaСrО2 + 3H2О
-
AlО2
ZnО22-
-
CrО2
17.
Окислительно-восстановительные реакцииосновных оксидов:
Ag2O =
Восстановление:
1) При нагревании разлагаются оксиды
HgO =
благородных металлов и ртути.
2) При высокой температуре С и H2 ( как и СО) Fe2O3 + C =
восстанавливают оксиды (частично или
FeO + C =
полностью). При восстановлении оксидов
CaO + C =
щелочных, щелочноземельных металлов и Al
выделяется не сам металл, а его карбид или Al2O3 + C =
гидрид.
CaO + H2 =
3) При высокой температуре более активные
Cr2O3 + H2 =
металлы восстанавливают менее активные
металлы из их оксидов. В качестве
Fe3O4 + Al =
восстановителей обычно используют Al
CuO + Zn =
(алюмотермия) или Mg (магнийтермия)
WO3 + Al =
Окисление:
1) Под действием кислорода (при нагревании или FeO + O =
2
с катализатором) низшие оксиды переходят в
BaO + O2 =
высшие, а оксиды щелочных и
щелочноземельных металлов в пероксиды.
Na2O + O2 =
5
18.
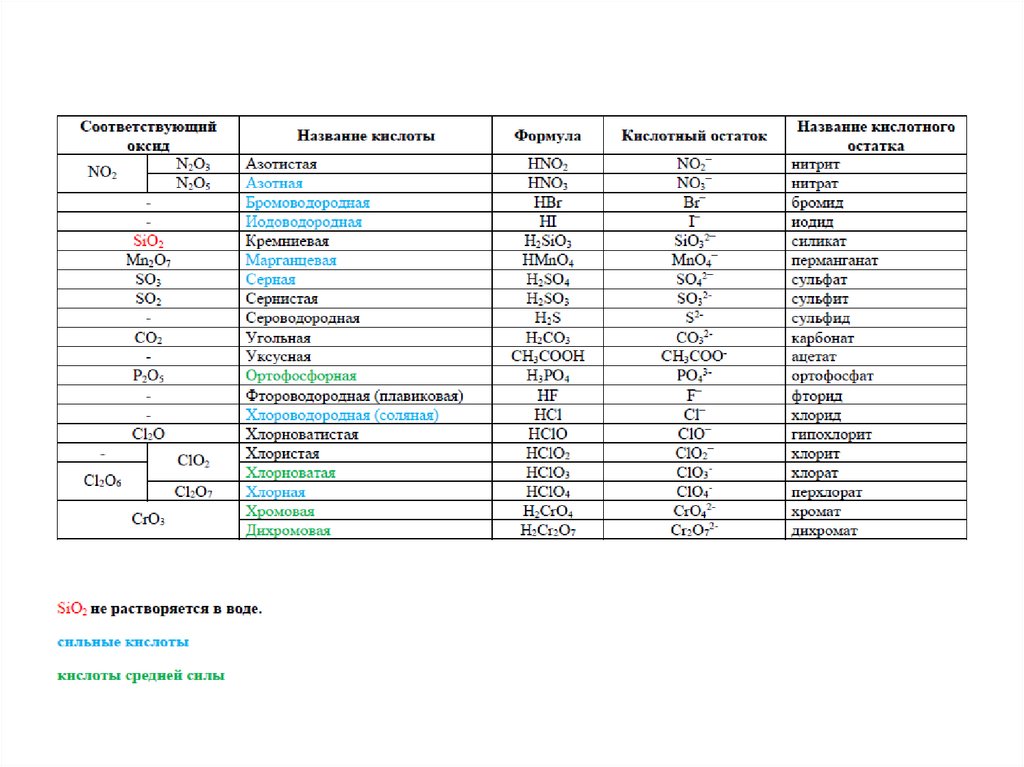
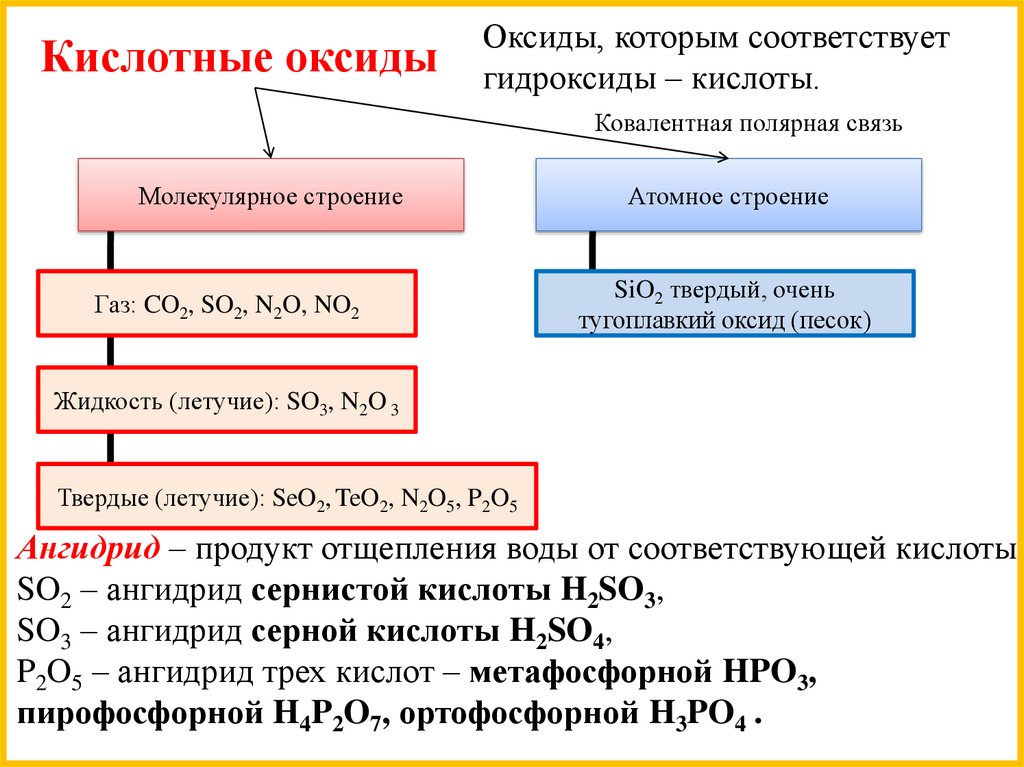
Кислотные оксидыОксиды, которым соответствует
гидроксиды – кислоты.
Ковалентная полярная связь
Молекулярное строение
Газ: CO2, SO2, N2O, NO2
Атомное строение
SiO2 твердый, очень
тугоплавкий оксид (песок)
Жидкость (летучие): SO3, N2O 3
Твердые (летучие): SeO2, TeO2, N2O5, P2O5
Ангидрид – продукт отщепления воды от соответствующей кислоты.
SO2 – ангидрид сернистой кислоты H2SO3,
SO3 – ангидрид серной кислоты H2SO4,
P2O5 – ангидрид трех кислот – метафосфорной HPO3,
пирофосфорной H4P2O7, ортофосфорной H3PO4 .
19.
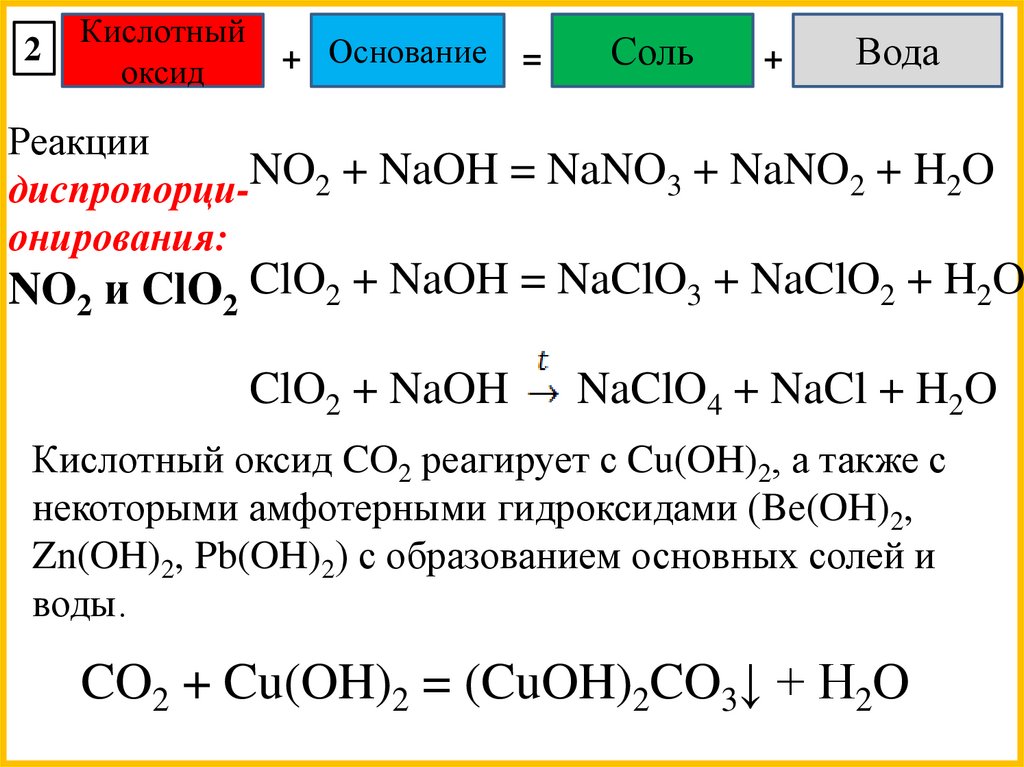
Химические свойства кислотных оксидов:1
Кислотный
оксид
+
Вода
1) Ст.ок. сохраняется.
2) Реакции
диспропорционирования:
NO2 и ClO2
3) При растворении в
воде оксидов P2O5 и CrO3
в зависимости от числа
присоединенных
молекул воды могут
образоваться разные
кислоты.
=
Кислота
SO3 + H2O= H2SO4
NO2 + H2O = HNO3 + HNO2
NO2 + H2O = HNO3 + NO↑
ClO2 + H2O = HClO3 + HClO2
ClO2 + H2O = HClO3 + HCl
P2O5 + H2O = HPO3
P2O5 + H2O = H4P2O7
P2O5 + H2O = H3PO4
CrO3 + H2O = H2CrO4
CrO3 + H2O = H2Cr2O7
20.
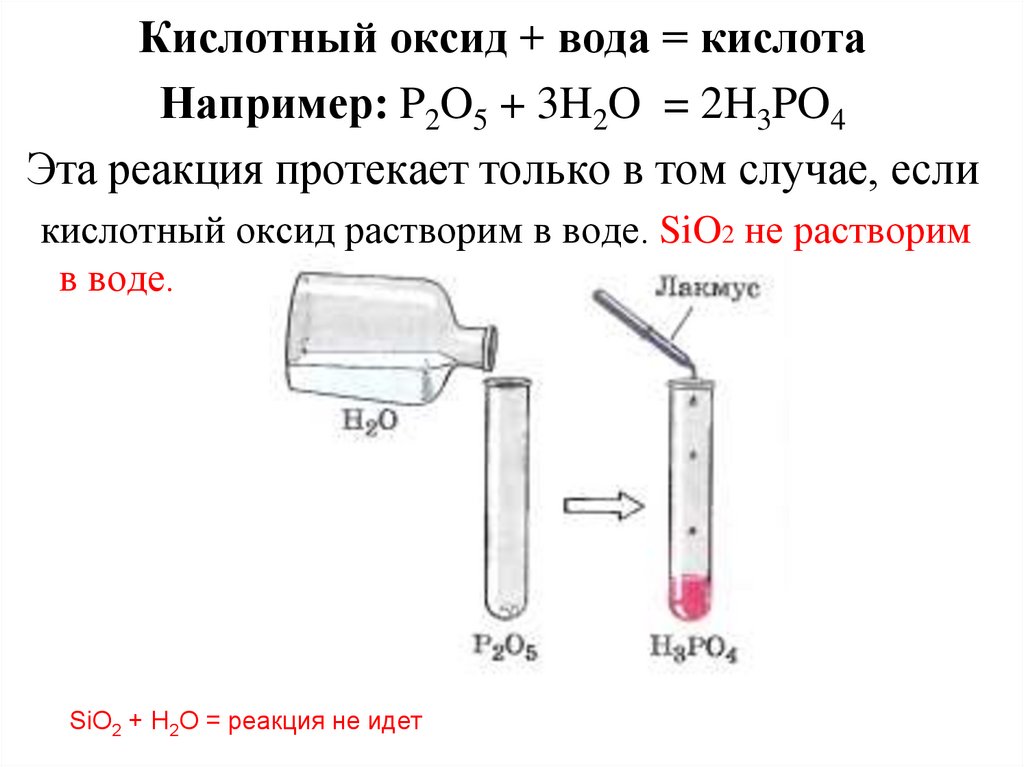
Кислотный оксид + вода = кислотаНапример: P2O5 + 3H2O = 2H3PO4
Эта реакция протекает только в том случае, если
кислотный оксид растворим в воде. SiO2 не растворим
в воде.
SiO2 + H2O = реакция не идет
21.
2Кислотный
оксид
+ Основание
=
Соль
+
Вода
CO2+ 2NaOH = Na2CO3 + Н2О
При избытке
кислотного CO (изб) + NaOH = NaHCO
2
3
оксида
образуется P2O5(изб) + Ca(OH)2 = CaHPO4 + H2O
кислая соль. P2O5(изб) + Ca(OH)2 + H2O = Ca(H2PO4)
При избытке
основания CO
2
образуется
основная соль.
+ Mg(OH)2(изб) = (MgOH)2CO3 +
H2O
22.
2Кислотный
оксид
+ Основание
=
Соль
+
Вода
Реакции
диспропорци-NO2 + NaOH = NaNO3 + NaNO2 + H2O
онирования:
NO2 и ClO2 ClO2 + NaOH = NaClO3 + NaClO2 + H2O
ClO2 + NaOH
NaClO4 + NaCl + H2O
Кислотный оксид CO2 реагирует с Cu(OH)2, а также с
некоторыми амфотерными гидроксидами (Be(OH)2,
Zn(OH)2, Pb(OH)2) с образованием основных солей и
воды.
CO2 + Cu(OH)2 = (CuOH)2CO3↓ + H2O
23.
3Кислотный
оксид
+
Основный оксид
/ Амфотерный
1) Реакции между
твердыми оксидами
идут при нагревании
или сплавлении.
2) Амфотерные оксиды в
таких случаях
проявляют основные
свойства.
=
Соль
BaO + SiO2 =
P2O5 + CuO =
SO3 + Al2O3 =
24.
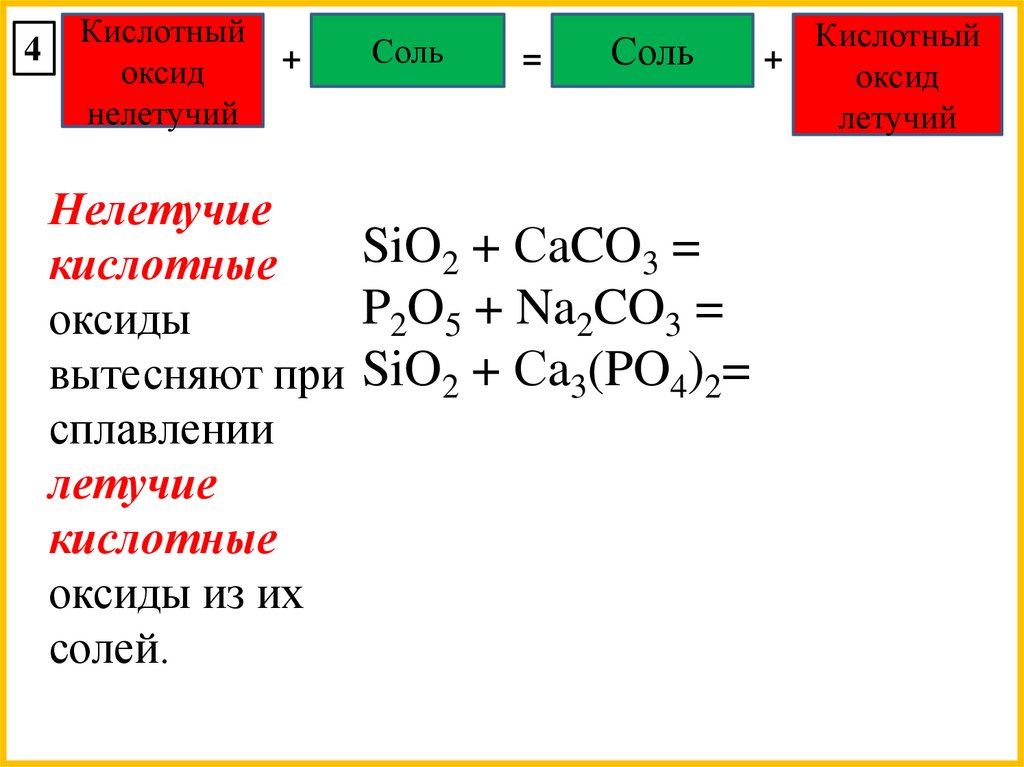
4Кислотный
оксид
нелетучий
+
Соль
=
Соль
Нелетучие
SiO2 + СaCO3 =
кислотные
P2O5 + Na2CO3 =
оксиды
вытесняют при SiO2 + Сa3(PO4)2=
сплавлении
летучие
кислотные
оксиды из их
солей.
Кислотный
+
оксид
летучий
25.
Окислительно-восстановительные реакциикислотных оксидов:
СO2 + C = CO↑
Восстановление:
1) При высокой температуре С и H2
SiO2 + C = SiO + CO↑
восстанавливают оксиды (частично или
SO3 + C = SO2 + CO↑
полностью).
2) При восстановлении неметаллов из их SO2 + C = S + CO2↑
оксидов часто используют
N2O + C = N2 + CO2↑
магнийтермию.
NO + C = N2 + CO2↑
NO2 + C = N2 + CO2↑
P2O5 + C = P + CO↑
CO2 + Mg = C + MgO
H2O + C = H2 + CO↑
SiO + Mg = Si + MgO
5
2
N2O + Mg = N2 + MgO
CO2 + Ca = CaC2 + CaO
N2O + H2 = N2 + H2O
NO + H2 = N2 + H2O
CO2 + H2 = CH4 + H2O
26.
5Окислительно-восстановительные реакции
кислотных оксидов:
Восстановление:
NO + O3 = NO2 + O2
1) При высокой температуре С и H2
восстанавливают оксиды (частично или SO2 + O3 = SO3 + O2
полностью).
NO2 + O3 = N2O5 + O2
2) При восстановлении неметаллов из их
оксидов часто используют
магнийтермию.
CO
+
O
=
CO
2
2
Окисление:
1) Под действием кислорода (озона) при
SO2 + O2 = SO3
нагревании или с катализатором низшие
2 3
2
2 5
оксиды переходят в высшие.
P O +O =P O
NO + O2 = NO2
N2O3 + O2 = N2O4
27.
Амфотерные оксидыСт.ок. +3, +4
BeO
ZnO
PbO
SnO
Проявляют кислотные и
основные свойства.
28.
Химические свойства амфотерных оксидов:1
Амфотерный
+
оксид
Вода
Al2O3 + H2O ≠
≠
29.
2Амфотерный
+ Кислота
оксид
Основный
оксид
При избытке
кислоты
образуется
кислая соль.
При избытке
оскида
образуется
основная соль.
=
Соль
+
Вода
Al2O3 + H2SO4 = Al2(SO4)3 + H2O
Al2O3 + H3PO4(изб) = Al(H2PO4)3 + H2O
ZnO(изб) + HCl = ZnOHCl
30.
3Амфотерный
Кислотный
+
=
оксид
оксид
Основный
оксид
SO3 + Al2O3 =
ZnO + P2O5 =
Соль
* см. «Кислотные оксиды»
31.
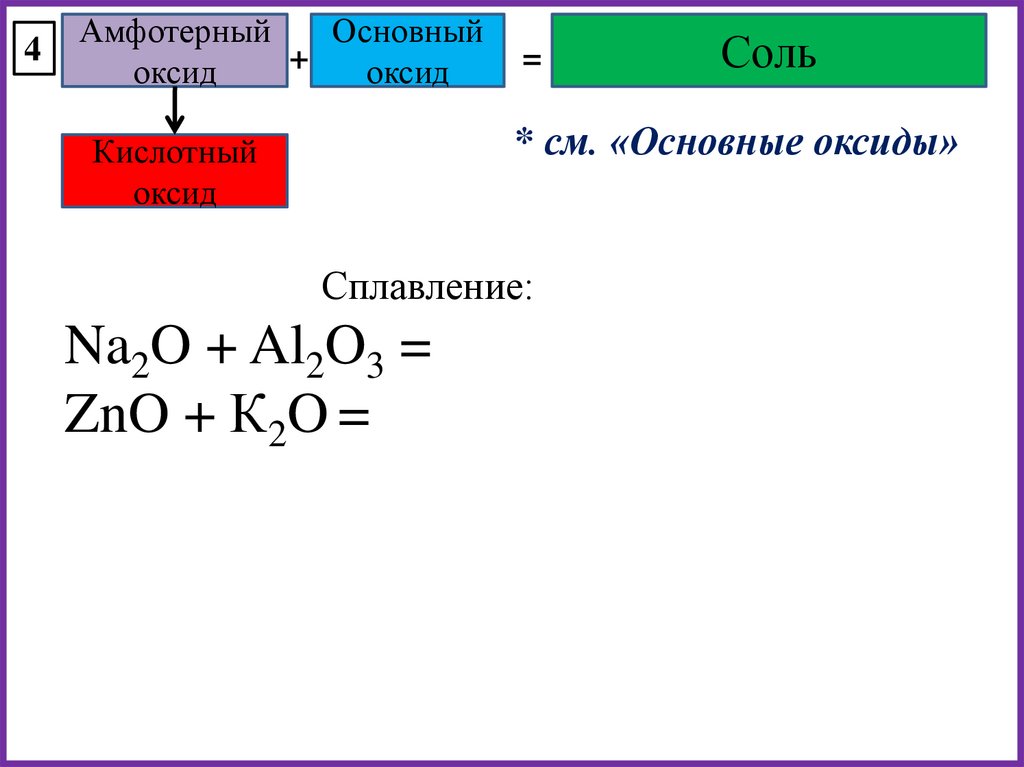
4Амфотерный
Основный
+
оксид
оксид
=
Соль
* см. «Основные оксиды»
Кислотный
оксид
Сплавление:
Na2O + Al2O3 =
ZnO + К2O =
32.
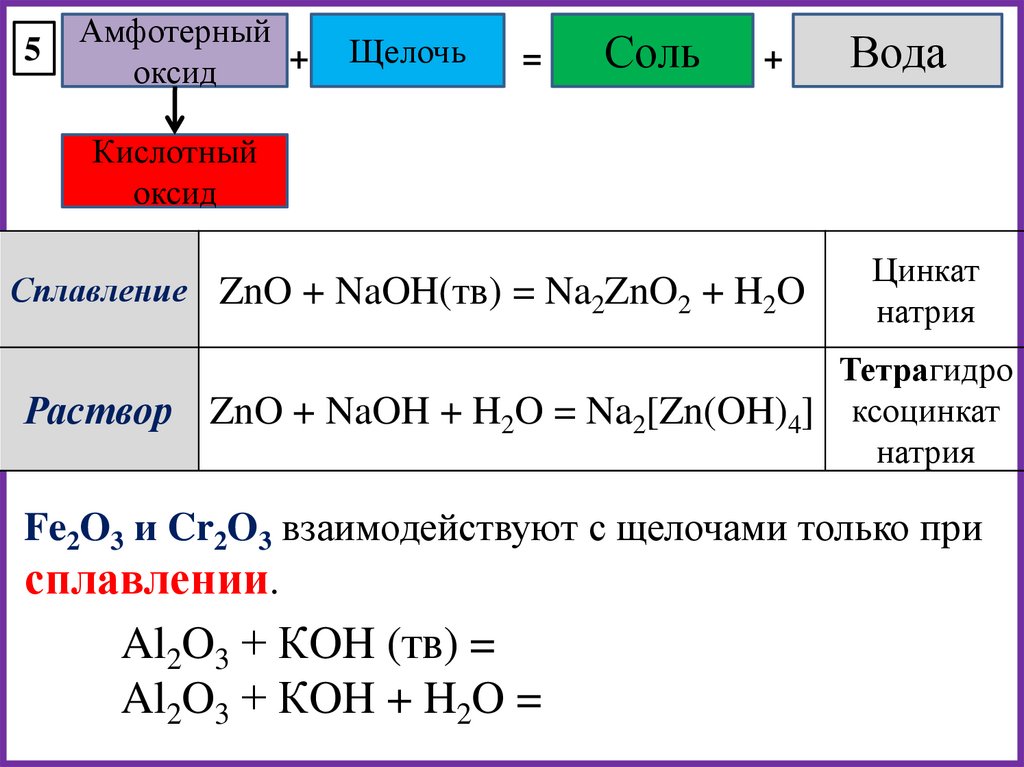
5Амфотерный
+
оксид
Щелочь
=
Соль
+
Вода
Кислотный
оксид
Сплавление ZnO + NaOH(тв) = Na2ZnO2 + H2O
Раствор
Цинкат
натрия
Тетрагидро
ZnO + NaOH + H2O = Na2[Zn(OH)4] ксоцинкат
натрия
Fe2O3 и Cr2O3 взаимодействуют с щелочами только при
сплавлении.
Al2O3 + КOH (тв) =
Al2O3 + КOH + H2O =
33.
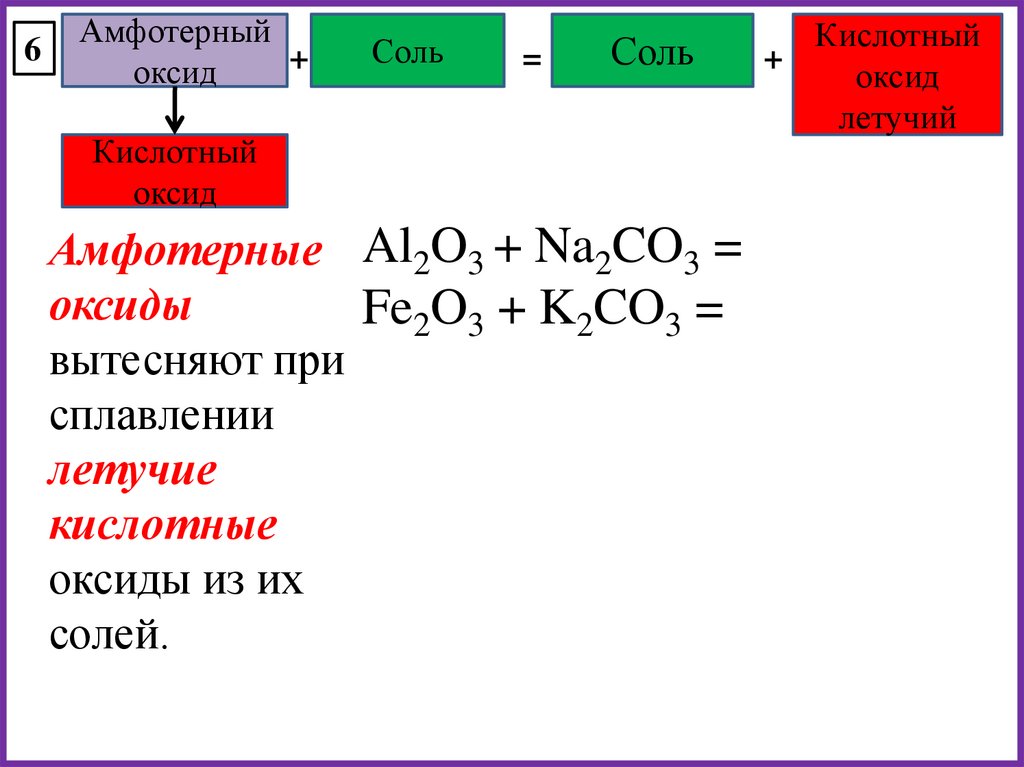
6Амфотерный
+
оксид
Соль
=
Соль
Кислотный
оксид
Амфотерные Al2O3 + Na2CO3 =
оксиды
Fe2O3 + K2CO3 =
вытесняют при
сплавлении
летучие
кислотные
оксиды из их
солей.
Кислотный
+
оксид
летучий
34.
35.
• 1 способ: окисление металловt
2Cu O2 2CuO
где CuO – оксид меди (II)
36.
• 2 способ: окисление неметалловt
C O2 CO2
где CO2 – оксид углерода (IV)
37.
• 3 способ: разложение кислотt C
H 2 SO3 SO2 H 2 O
где H SO - сернистая кислота,
2
3
SO2 – оксид серы (IV)
38.
• 4 способ: разложение солейt C
CaCO3 CaO CO2
где CaCO - карбонат кальция
3
CаO – оксид кальция (II)
39.
• 5 способ: разложение нерастворимыхоснований
t C
Fe(OH ) 2 FeO H 2 O
где Fe(OH ) 2 - гидроксид железа (II),
FeO – оксид железа (II)
40.
• 6 способ: вытеснение из солей другимиоксидами
t C
Na2 CO3 SiO 2 Na2 SiO3 CO2
где Na CO - карбонат натрия,
SiO2 – оксид кремния (IV),
Na2SiO3 - силикат натрия
2
3
41.
• 7 способ: горение сложных веществt C
C 2 H 5 OH 3O2 2CO2 3H 2 O Q
где C 2 H 5OH - этанол (этиловый
спирт),
СO2 – оксид углерода (IV)

























 chemistry
chemistry