Similar presentations:
Классификация неорганических веществ
1. Классификация неорганический веществ
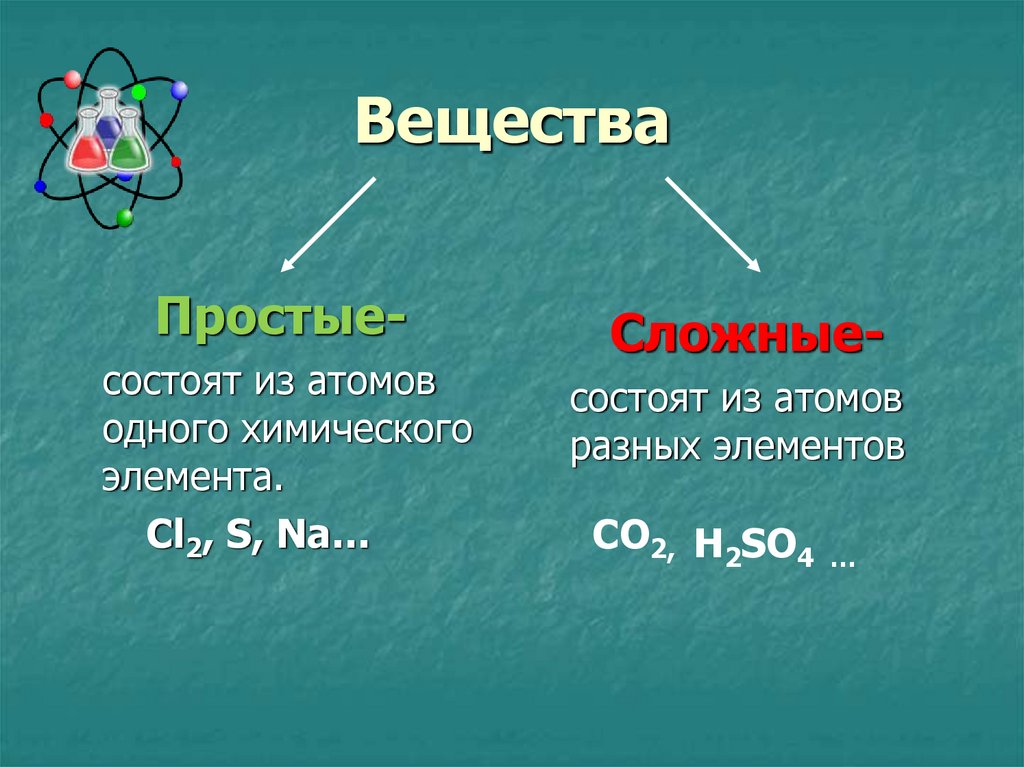
2. Вещества
Простыесостоят из атомоводного химического
элемента.
Cl2, S, Na…
Сложныесостоят из атомов
разных элементов
CO2, H2SO4
…
3. Простые вещества
МеталлыNa,
Fe,
Al,
Zn…
Благородные
газы
Неметаллы
O2,
H2,
Cl2,
S,
P,
C…
He,
Ne,
Ar,
Kr,
Xe,
Rn
4. Сложные вещества
ОксидыГидроксиды
Кислотные
Соли
Основные
Амфотерные
Кислородсодержащие
кислоты
Основания
5.
Оксиды-2
(ЭхО y )
Несолеобразующие
(СO,SO,SiO,NO, N2O)
Солеобразующие
Кислотные
Амфотерные
Основные
6. Основные оксиды-
оксиды металловсо степенью окисления +1(I),+2(II)
Na2O
Li2O
K 2O
MgO
CaO
BaO
CrO
FeO
NiO
7. Кислотные оксиды
Оксидынеметаллов:
SO2
SO3
CO2
P2O5
SiO2
N2O3
N2O5
Оксиды металлов со
степенью окисления
+5(V),+6 (VI), +7(VII)
V2O5
СrO3
Mn2O7
8. Амфотерные оксиды оксиды металлов со степенью окисления +3(III),+4(IV)
(искл.)+2 ZnO, BeO,GeO, SnO,PbOAl2O3 SnO2 PbO2
Fe2O3
Cr2O3
9. Кислоты (НхR)
HNO3 – азотнаяHNO2 – азотистая
H2SO4 – серная
H2SO3 – сернистая
H2SiO3 – кремниевая
H2CO3 – угольная
H3PO4 – фосфорная
HCl – хлороводородная
или соляная
HF – фтороводородная
или плавиковая
HBr – бромоводородная
HI – йодоводородная
H2S – сероводородная
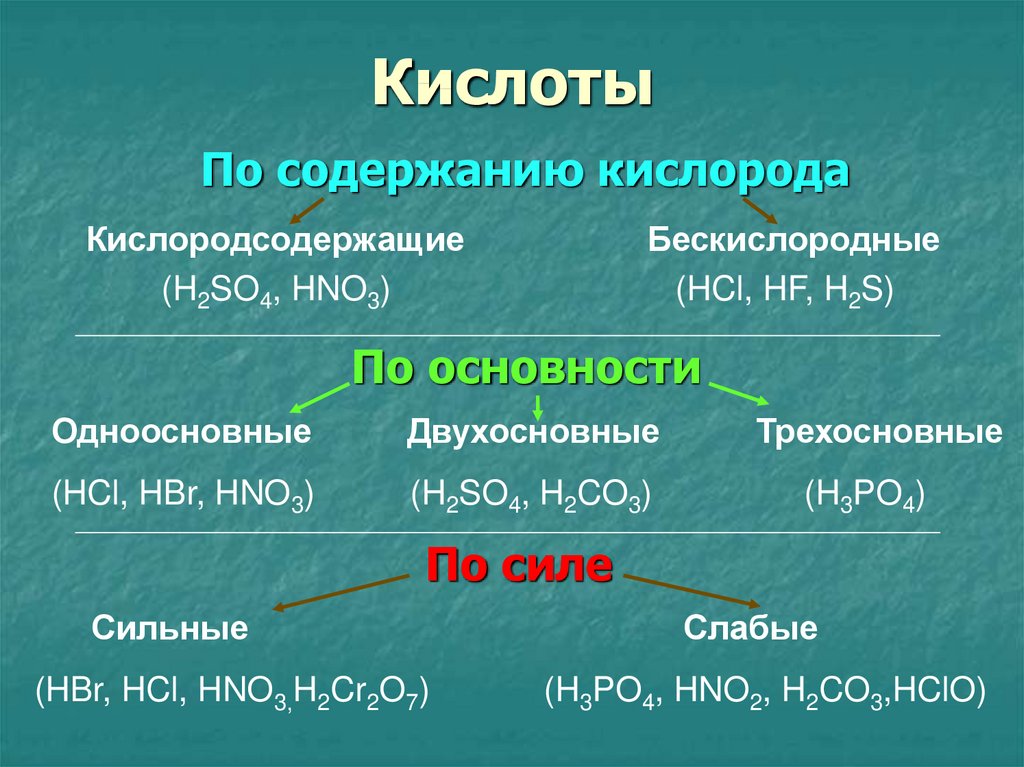
10. Кислоты
По содержанию кислородаКислородсодержащие
(H2SO4, HNO3)
Бескислородные
(HCl, HF, H2S)
По основности
Одноосновные
Двухосновные
(HCl, HBr, HNO3)
(H2SO4, H2CO3)
Трехосновные
(H3PO4)
По силе
Сильные
(HBr, HCl, HNO3,H2Cr2O7)
Слабые
(H3PO4, HNO2, H2CO3,HClO)
11. Соответствие кислот и оксидов
SO2+
H 2O
H2SO3
N2O5
+
H2O
H2N2O6
HNO3
2
SO2 –
SO3 –
CO2 –
P2O5 –
SiO2 –
N 2O 3 –
N 2O 5 –
СrO3 –
Mn2O7 –
H2SO3
H2SO4
H2CO3
H3PO4
H2SiO3
HNO2
HNO3
H2CrO4
HMnO4
12. Основания (Ме(ОН)x)
По растворимости в водеРастворимые – щелочи
(NaOH, KOH, Ba(OH)2)
Нерастворимые
(Fe(OH)2, Ni(OH)2, Mg(OH)2)
По силе
Сильные (щелочи)
Слабые
13. Соответствие оснований и оксидов
Na2O – NaOH1(у атома Na валентность I)Li2O – LiOH
K2O – KOH
MgO
- Mg(OH)2 (у атома Mg валентность II)
CaO – Ca(OH)2
BaO – Ba(OH)2
CrO – Cr(OH)2
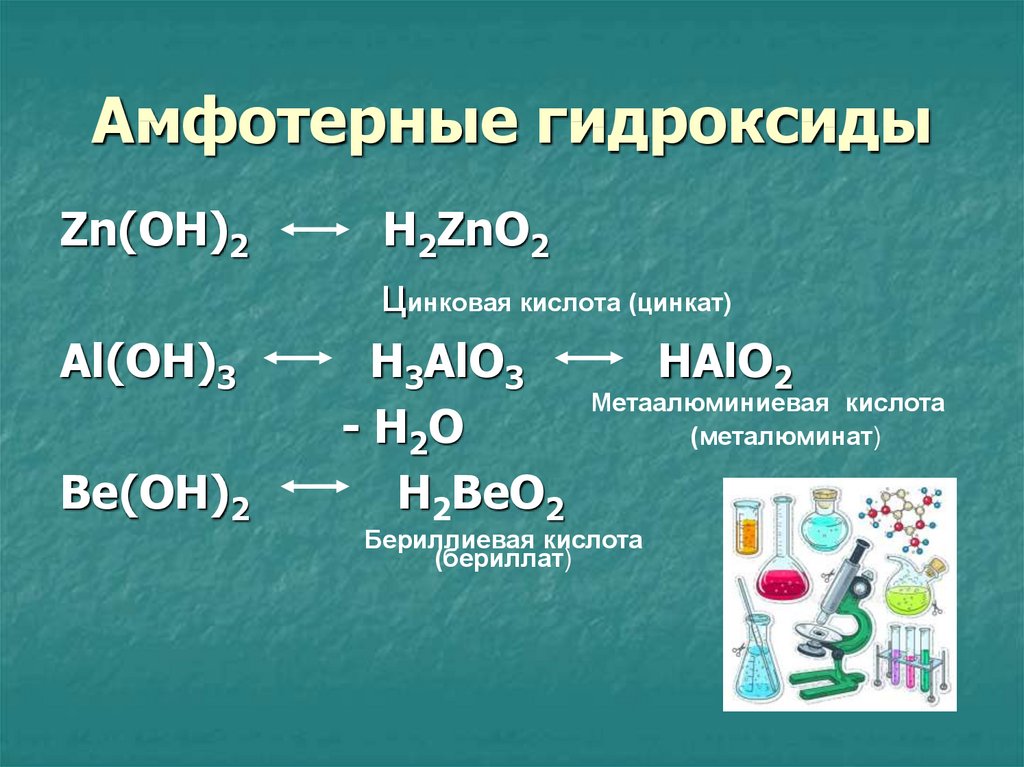
14. Амфотерные гидроксиды
Zn(OH)2Al(OH)3
Be(OH)2
H2ZnO2
цинковая кислота (цинкат)
H3AlO3
HAlO2
Метаалюминиевая кислота
- H2O
(металюминат)
H2BeO2
Бериллиевая кислота
(бериллат)
15. Соли
Нормальные (средние)NaCl, Na2SO4, Na3PO4
Кислые
NaHSO4, Na2HPO4, NaH2PO4
Основные
MgOHCl, Al(OH)2NO3
Двойные (смешанные)
KAl(SO4)2
Комплексные
Na2[Zn(OH)4], K3[Fe(CN)6]
16.
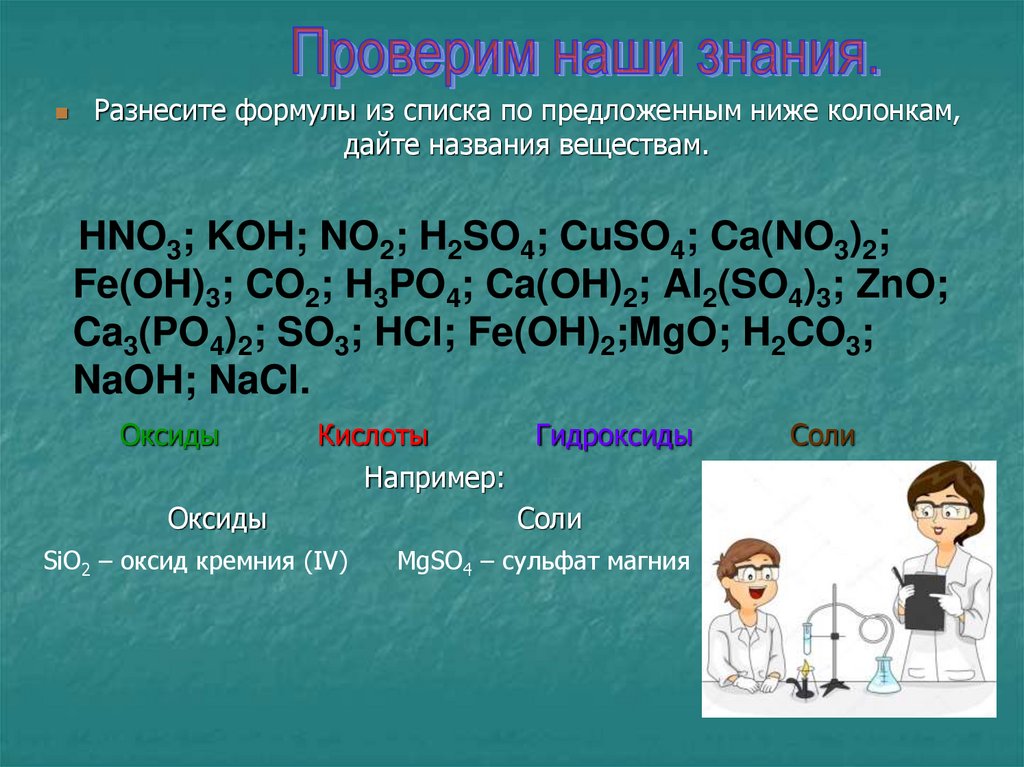
Разнесите формулы из списка по предложенным ниже колонкам,дайте названия веществам.
HNO3; KOH; NO2; H2SO4; CuSO4; Ca(NO3)2;
Fe(OH)3; CO2; H3PO4; Ca(OH)2; Al2(SO4)3; ZnO;
Ca3(PO4)2; SO3; HCl; Fe(OH)2;MgO; H2CO3;
NaOH; NaCl.
Оксиды
Кислоты
Например:
Оксиды
SiO2 – оксид кремния (IV)
Гидроксиды
Соли
MgSO4 – сульфат магния
Соли













 chemistry
chemistry








