Similar presentations:
Химическая термодинамика и кинетика
1.
Химическаятермодинамика
и кинетика
2.
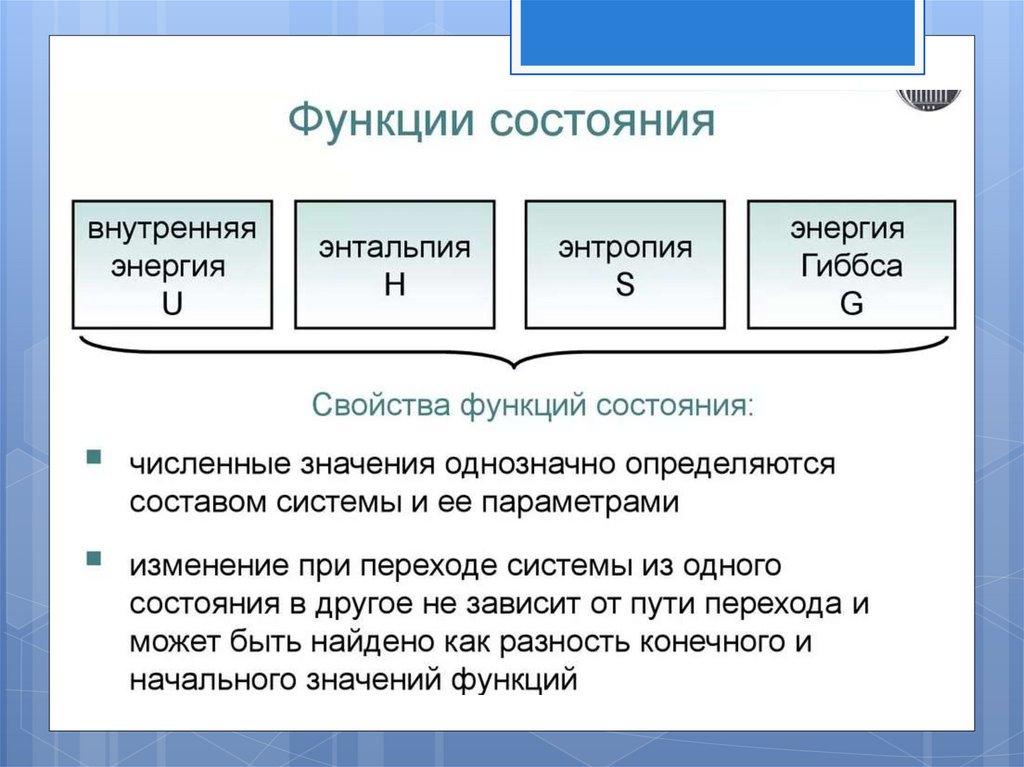
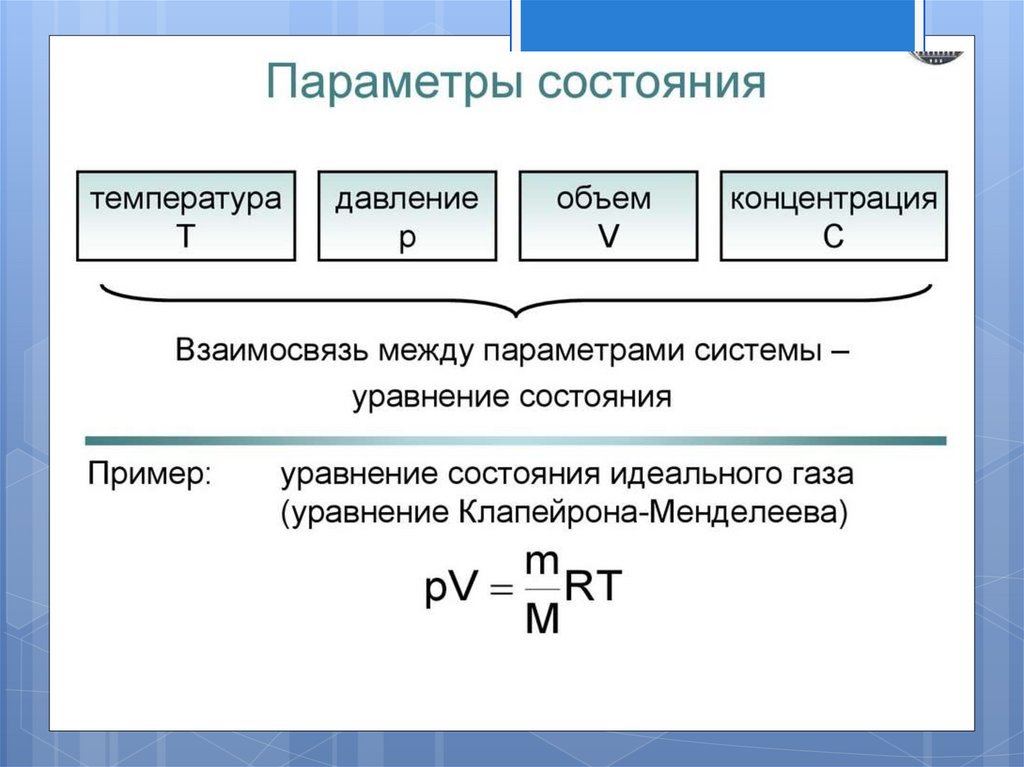
Основные понятия иопределения.
Внутренняя энергия и энтальпия вещества.
Первый закон термодинамики.
Тепловые эффекты химических реакций.
Экзо– и эндотермические реакции.
Термохимические уравнения.
Закон Гесса.
Движущие силы химического процесса.
Понятие об энтропии.
Направление
самопроизвольного
протекания
химических реакций.
Второй закон термодинамики. Энергия Гиббса.
3.
Термодинамика - наукао превращении
различных форм
энергии.
Та область
термодинамики, которая
занимается изучением
энергетических
изменений в
химических реакциях,
называется химической
термодинамикой.
Система - это часть
пространства,
заполненное веществом
и отделенное от
окружающей среды
поверхностью раздела.
Такой поверхностью
может быть стенки
сосуда.
4.
Различаюттри
вида
системы:
открытые
закрытые
изолированные
Открытая - такая система,
которая
обменивается
с
окружающей
средой
веществом и энергией.
Закрытая - система, которая
обменивается со средой только
энергией.
Изолированная
не
обменивается с окружающей
средой ни веществом, ни
энергией.
5.
6.
7.
8.
9.
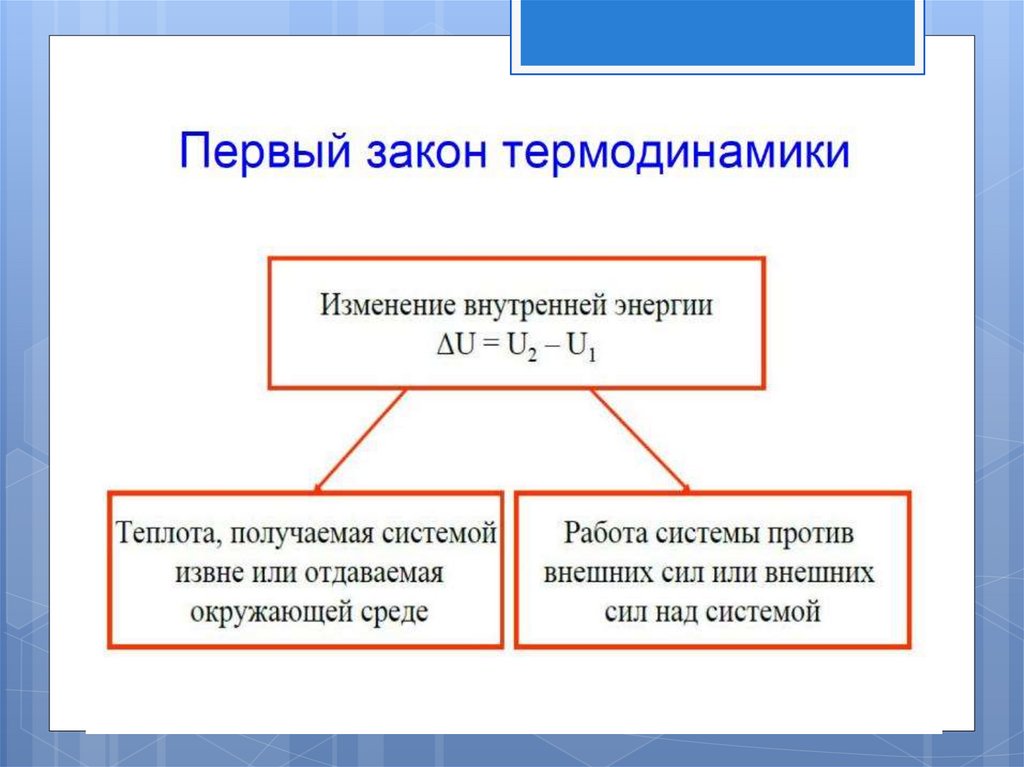
Первый законтермодинамики
В изолированной системе сумма всех видов энергии есть
величина постоянная. Если к системе подведено некоторое
количество теплоты Q, то оно может быть израсходовано на
изменение внутренней энергии системы
и на совершение
системой внешней работы А.
Под внутренней энергией системы U подразумевают ее общий
запас, обусловленный всеми видами движений и взаимодействий
состояний её молекул и атомов. В эту энергию включается
поступательное, колебательное и вращательное движение
молекул, атомов, ионов, энергии силового взаимодействия и все
другие виды энергии, кроме кинетической (перемещение всей
системы в целом) и потенциальной (взаимодействие с внешними
силовыми полями).
В любом процессе приращение внутренней энергии равно:
10.
11.
12.
13.
!Знак теплового эффекта определяется тем, с какой стороны
рассматриваем процесс: со стороны окружающей среды, или изнутри
химической системы. Если со стороны окружающей среды, то знак «+»
соответствует экзотермическому процессу, когда среда получает тепло
от химической системы. В дальнейшем мы будем пользоваться
термодинамической системой знаков, то есть рассматривать процесс с
точки зрения системы. Экзотермической реакции будет соответствовать
знак «–», поскольку система теряет энергию в виде тепла.
С помощью изменения характеризуется не только реакции, но и
отдельные соединения. Для этого применяется понятие о стандартной
энтальпии образования - это количество теплоты, которое выделяется
или поглощается при образовании 1 моля cложного соединения из
простых веществ ( элементов), причем и само соединение и элементы
находятся в том агрегатном состоянии, в котором они устойчивы, в так
называемых стандартных условиях.
14.
15.
16.
17.
18.
19.
Следствия из закона Гесса20.
Направление самопроизвольно протекающихпроцессов. Движущие силы химического
.
процесса. Понятие об энтропии
21.
22.
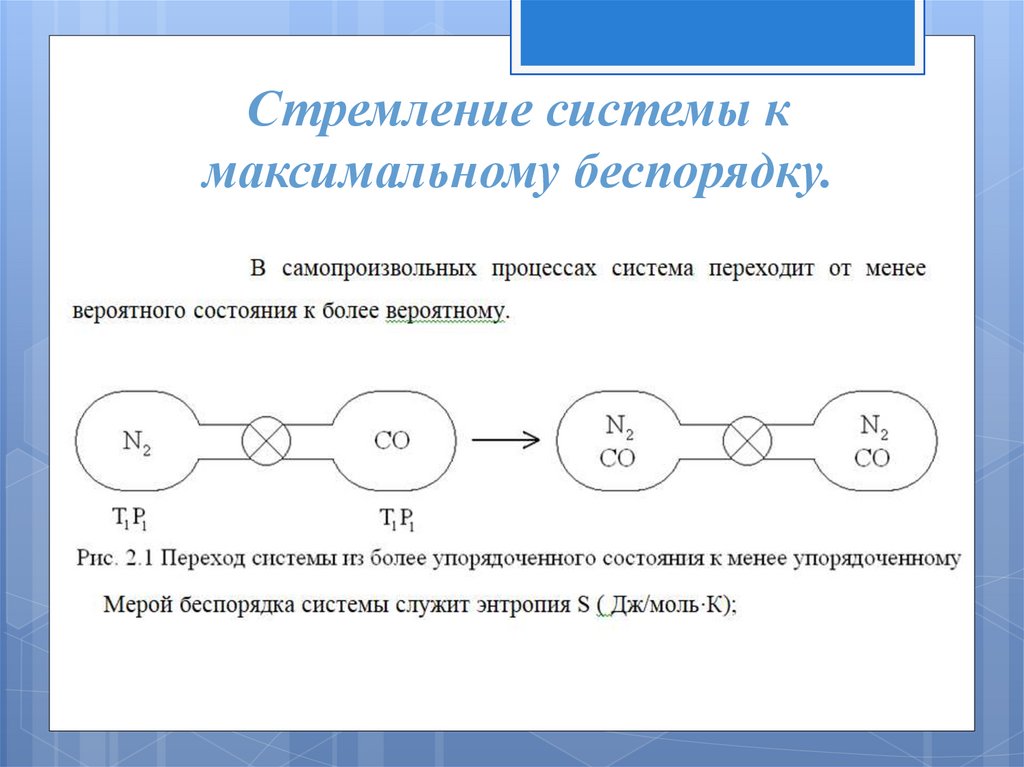
Стремление системы кмаксимальному беспорядку.
23.
Второй закон термодинамики.Самопроизвольный
процесс,
происходящий
без
изменения
энергетического
запаса
системы
совершается только в направлении,
при котором энтропия возрастает
(S>О);
Энтропия - это логарифмическое
выражение вероятности существования
системы.
R
универсальная
газовая
постоянная = 8,314 Дж/моль К;
Nа - постоянная Авогадро
( 6,02*1023);
Следовательно, чем большим числом
макрочастиц
представлена
рассматриваемая макросистема, тем
больше вариантов распределение этих
частиц, при которых может быть
достигнуто макросостояние, тем выше
значение энтропии.
24.
25.
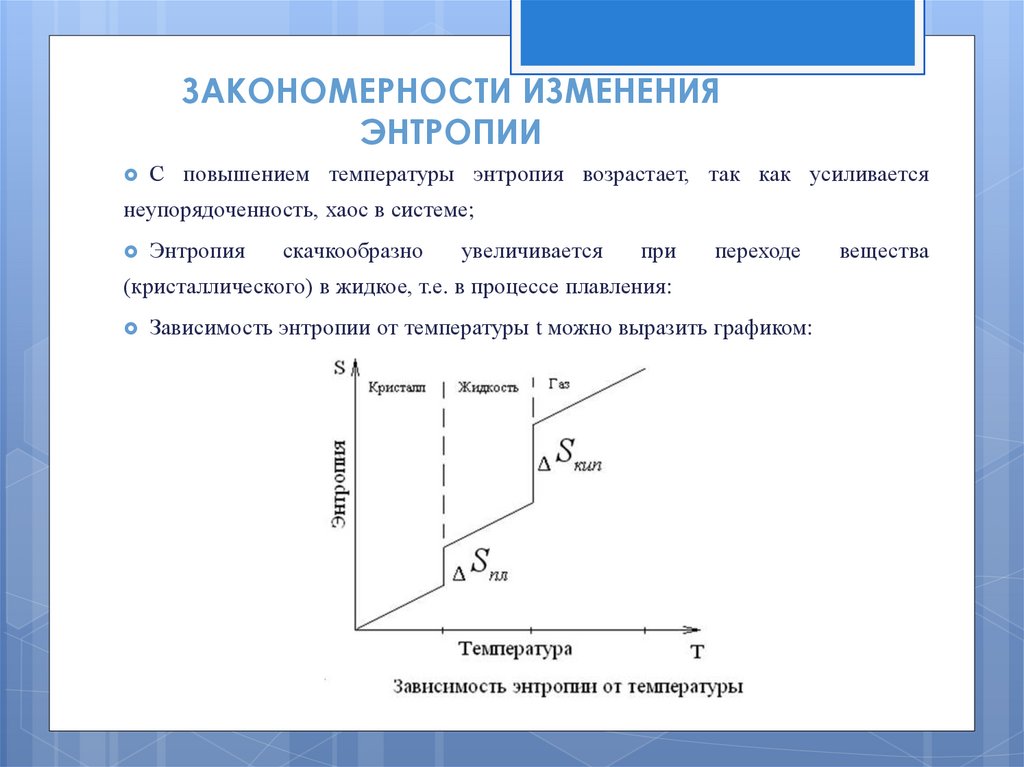
ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯЭНТРОПИИ
С повышением температуры энтропия возрастает, так как усиливается
неупорядоченность, хаос в системе;
Энтропия
скачкообразно
увеличивается
при
переходе
(кристаллического) в жидкое, т.е. в процессе плавления:
Зависимость энтропии от температуры t можно выразить графиком:
вещества
26.
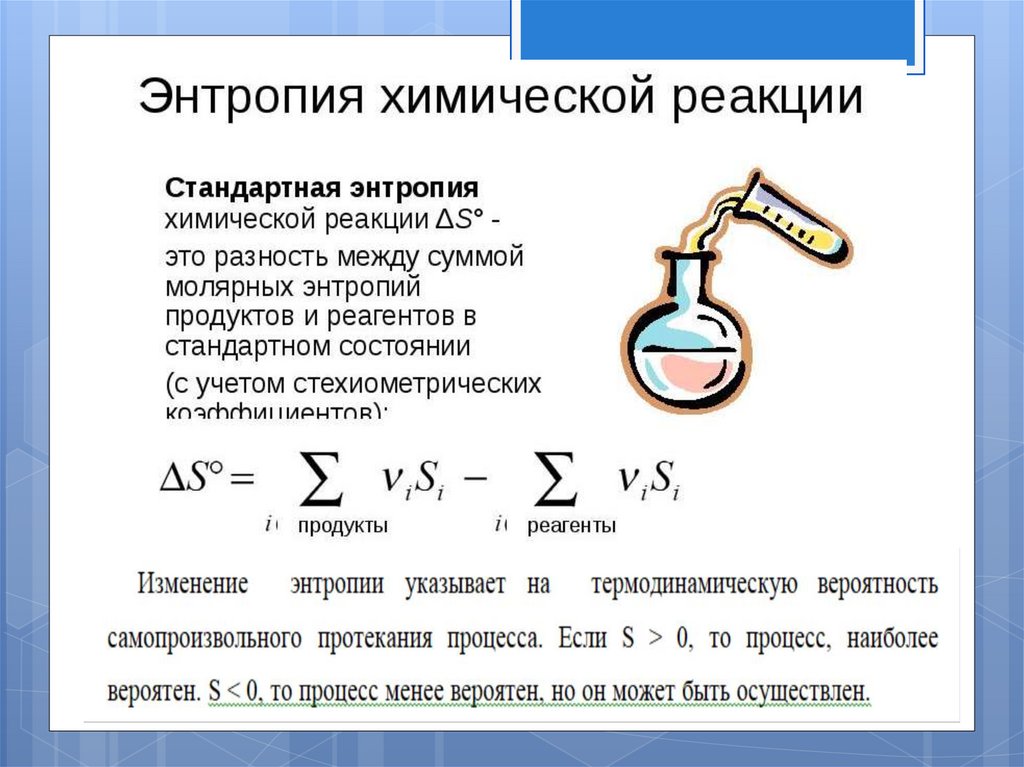
Процессы — нагревания, кипения, диссоциации, вызывающие увеличениебеспорядка сопровождаются увеличением энтропии.
Кристаллизация,
полимеризация
связана
с
уменьшением
объема,
сопровождаются уменьшением энтропии.
Чем тверже вещество, тем меньше его энтропия, чем мягче, тем энтропия
больше.
По группам сверху вниз наблюдается увеличение энтропии. В отличие от всех
других термодинамических функций энтропия имеет абсолютное значение.
Абсолютная энтропия идеального кристалла при ОК равна нулю.
В идеальном кристалле при О К все частицы находятся в одном энергетическом
состоянии, т.к. кристалл упорядочен, тепловое движение отсутствует, то для
идеального кристалла возможно только 1 состояние полной упорядоченности, т.е.
W=1


























 chemistry
chemistry








