Similar presentations:
Периодическая система
1.
Периодический закон — этофундаментальный закон, который
был сформулирован Д.И.
Менделеевым в 1869 году.
2.
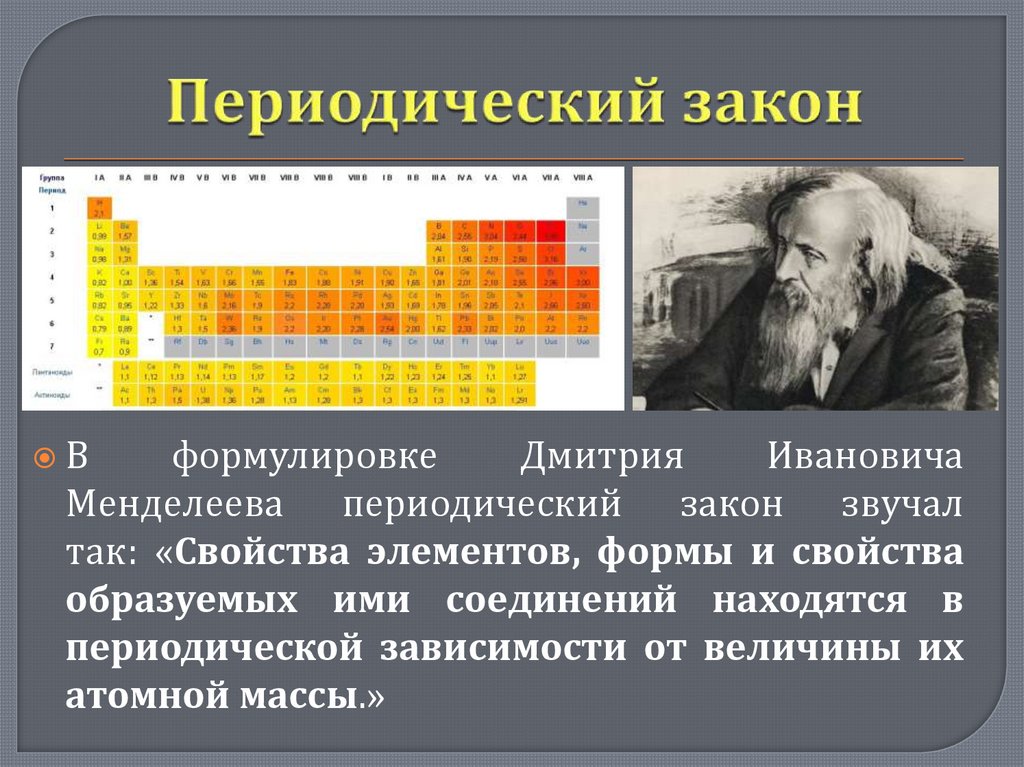
Вформулировке
Дмитрия
Ивановича
Менделеева периодический закон звучал
так: «Свойства элементов, формы и свойства
образуемых ими соединений находятся в
периодической зависимости от величины их
атомной массы.»
3.
Более поздние исследования показали,что свойства атомов и их соединений
зависят в первую очередь от
электронного строения атома. А
электронное строение определяется
свойствами атомного ядра. В
частности, зарядом ядра атома.
Поэтому современная формулировка периодического
закона звучит так: «Свойства элементов, форма и
свойства образованных ими соединений находятся
в периодической зависимости от величины заряда
ядер их атомов».
4.
Периоды – этогоризонтальные ряды
элементов с одинаковым
количеством заполняемых
электронных уровней.
Номер периода
обозначает число
энергетических уровней в
атоме элемента. Все
периоды (кроме первого)
начинаются щелочным
металлом (s-элементом), а
заканчиваются
благородным газом.
Группы – вертикальные
столбцы элементов с
одинаковым числом
валентных электронов,
равным номеру группы.
Различают главные и
побочные подгруппы.
Главные подгруппы
состоят из элементов
малых и больших
периодов, валентные
электроны которых
расположены на внешних
ns— и np— подуровнях.
5.
Каждыйпериод
(за
исключением
первого)
начинается атомами щелочных металлов (Li, Na, К, Rb,
Cs, Fr) и заканчивается благородными газами (Ne, Ar,
Kr, Xe, Rn), которым предшествуют типичные
неметаллы.
Шестой и седьмой периоды имеют двойные вставки
элементов. За элементом Ва расположены десять d–
элементов (от лантана La — до гадолиния Hg), а после
первого переходного элемента лантана La следуют14 f–
элементов — лантаноидов (Се — Lu). После ртути Hg
располагаются остальные 6 основных р-элементов
шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–
элементов- актиноидов (Th — Lr). В последнее время La
и Ас стали причислять соответственно к лантаноидам и
актиноидам. Лантаноиды и актиноиды помещены
отдельно внизу таблицы.
6.
В Периодической системе каждый элементрасположен в строго определенном месте, которое
соответствует его порядковому номерому.
Элементы в Периодической системе разделены
на восемь групп (I – VIII), которые в свою очередь
делятся на подгруппы — главные, или подгруппы
А и побочные, или подгруппы Б.
Подгруппа VIIIБ-особая, она содержит триады
элементов, составляющих семейства железа (Fе, Со,
Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют
похожие свойства и схожи по химическому
строению.
7.
Номер периода соответствует числу заполняемыхэнергетических уровней.
Номер группы, как правило, соответствует числу
валентных электронов в атоме (т.е. электроном,
способных к образованию химической связи).
Номер
группы, как правило, соответствует
высшей положительной степени окисления
атома.
Но есть исключения!
Периодически
зависят
от
заряда
ядра
такие
характеристики атомов, как орбитальный радиус,
энергия сродства к электрону, электроотрицательность,
энергия ионизации, степень окисления и др.






 chemistry
chemistry








