Similar presentations:
Периодический закон
1.
2.
Свойства элементов, а также свойстваобразованных ими простых и
сложных веществ находятся в
периодической зависимости от
атомной массы.
Дмитрий Иванович открыл фундаментальный
закон химии. В его время (середина XIX века)
было известно 63 сорта атомов – химических
элементов. И другие ученые пытались их
систематизировать, но почему же русскому
химику «улыбнулась удача?»
Самой первой попыткой систематизировать
сорта атомов наверняка была попытка
разделить их на металлы и неметаллы.
3.
МеталлыСеребро Ag
Натрий Na
Платина Pt
Марганец Mn
Золото Au
Медь Сu
По своим физическим свойствам металлы
довольно однообразны : имеют блеск, ковкие ,
пластичные, прекрасно проводят ток и тепло,
большинство серебристо – серые.
4.
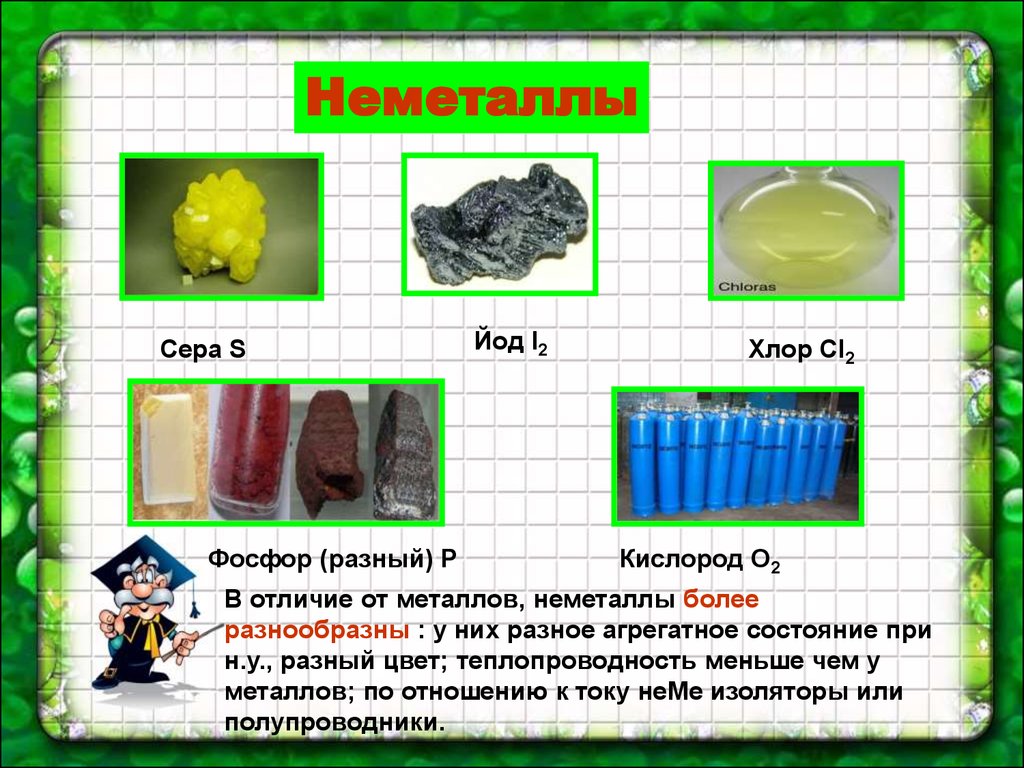
НеметаллыСера S
Фосфор (разный) Р
Йод I2
Хлор Cl2
Кислород О2
В отличие от металлов, неметаллы более
разнообразны : у них разное агрегатное состояние при
н.у., разный цвет; теплопроводность меньше чем у
металлов; по отношению к току неМе изоляторы или
полупроводники.
5.
Но этой систематизации явно не хватало, слишком онапримитивная. Тогда Менделеев задумался и решил
разложить карточки с выписанными свойствами элементов
просто в ряд по мере возрастания атомной массы:
И как же быть
–то ?
И он заметил, что
через каждые 7
элементов физические
и химические свойства
веществ повторяются!
6.
Литий LiНатрий Na
Литий и натрий – очень мягкие,
серебристые, чрезвычайно
активные металлы, мощные
восстановители. Оксиды и
гидроксиды – с основными
свойствами.
Углерод (графит) и кремний – серые
с металлическим блеском вещества полупроводники, слабые
окислители и сильные
восстановители. Оксиды и
гидроксиды с кислотными
Кремний Si
свойствами.
Алмаз С
Графит С
У алмаза
(разновидности
углерода) и у кремния
одинаковая
кристаллическая
решетка ( тетраэдр)
7.
Следующий важный вывод сделал Менделеев: начиная слития, падают металлические свойства, а также
восстановительные свойства элементов, а неметаллические
свойства , а также окислительные , наоборот, возрастают.
Когда в конце XIX века открыли благородные газы, ученый
интуитивно правильно поместил их вслед за активными
неметаллами-галогенами (фтором, хлором, бромом, йодом).
Таким образом, Менделеев открыл повторяемость элементов
через каждые 8 штук (другие ученые называли это «закон
октав»). Эту «химическую октаву» Дмитрий Иванович назвал
«периодом». Период должен был начинаться активным
щелочным металлом, а завершаться инертным благородным
газом.
Менделеев не был
педантом, он понимал,
что все тайны атома еще
не изучены,
следовательно из его
Калий К
Аргон Ar
закона могут быть
Ar=39
Ar=40
исключения
8.
Он совершенно справедливо поставил более тяжелый атомаргона перед более легким атомом калия, потому что
благородный газ аргон по сути должен был завершать 3
период, а щелочной металл калий – открывать период
четвертый.
После того как внутреннее строение атома было разгадано
(создана планетарная модель), правильный поступок
Менделеева да и вообще Периодический закон блестяще
подтвердились.
Свойства элементов, а также
свойства образованных ими простых
и сложных веществ находятся в
периодической зависимости от
заряда ядра атома.
Ребята, вам к Периодическому законы важная
ссылка на работу «Строение атома»
9.
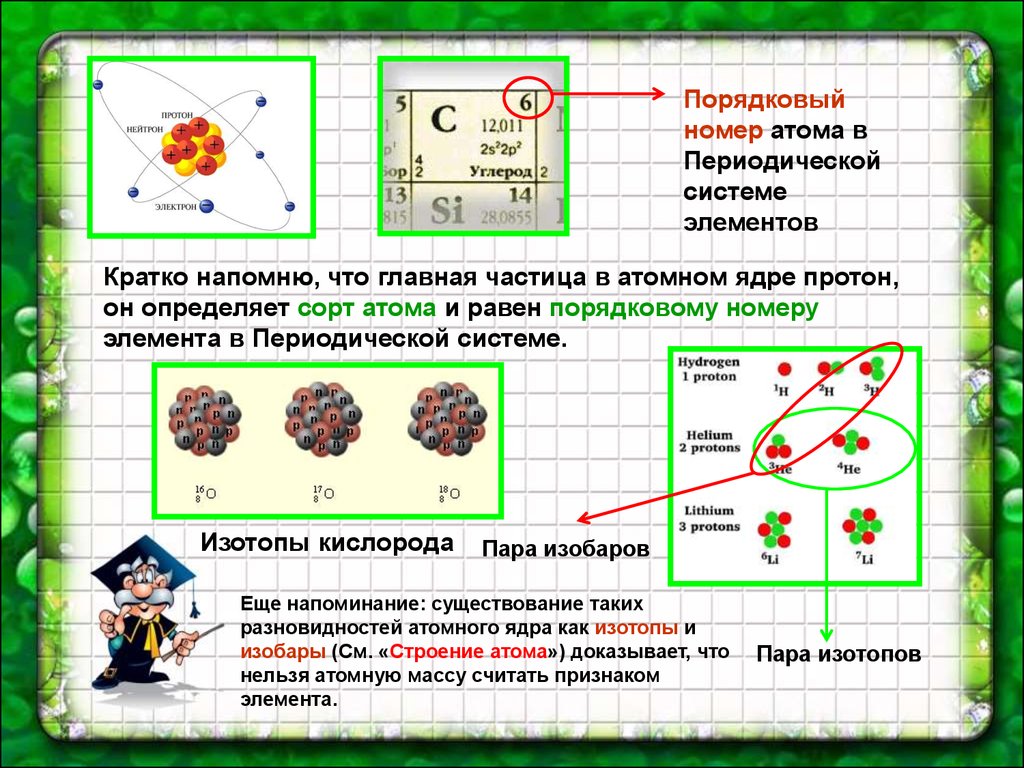
Порядковыйномер атома в
Периодической
системе
элементов
Кратко напомню, что главная частица в атомном ядре протон,
он определяет сорт атома и равен порядковому номеру
элемента в Периодической системе.
Изотопы кислорода
Пара изобаров
Еще напоминание: существование таких
разновидностей атомного ядра как изотопы и
изобары (См. «Строение атома») доказывает, что
нельзя атомную массу считать признаком
элемента.
Пара изотопов
10.
Это графическое подтверждение Периодического закона. Внастоящее время внутри нее нет «белых пятен», т.е. все
элементы открыты в природе или искусственно созданы
людьми. Но она все пополняется и пополняется с конца, так как
физики-ядерщики создают новые элементы в ходе ядерных
реакций.
Трудность ядерного
синтеза в том, что
тяжелые нуклиды
радиоактивны и живут
порой очень-очень мало.
11.
Современные разновидноститаблиц Менделеева
После триумфа Периодического закона на полном
серьезе было создано столько разновидностей и
интерпретаций таблицы элементов, что люди
откровенно путались. Поэтому международный
съезд химиков ИЮПАК (союз аналитической и
прикладной химии) постановил признать
официальными только 3 вида таблиц
Менделеева.
А вот это все «от лукавого»
12.
1 вид Периодической системы –длинная. Все периоды показаны
горизонтально. Она хоть и
каноническая, но используется
редко, так как весьма длинная и
громоздкая.
Тут для ребят
подсказка –
разными цветами
обозначены
различные
семейства
элементов
(вооружитесь
словариком)
2 вид Периодической системы –
полудлинная. Все периоды показаны
горизонтально, но лантаноиды и
актиноиды вынесены вниз. Такой тип ПС
принят в Америке и вообще на Западе.
Преимущества: более компактная,
хорошо видны подгруппы элементов.
13.
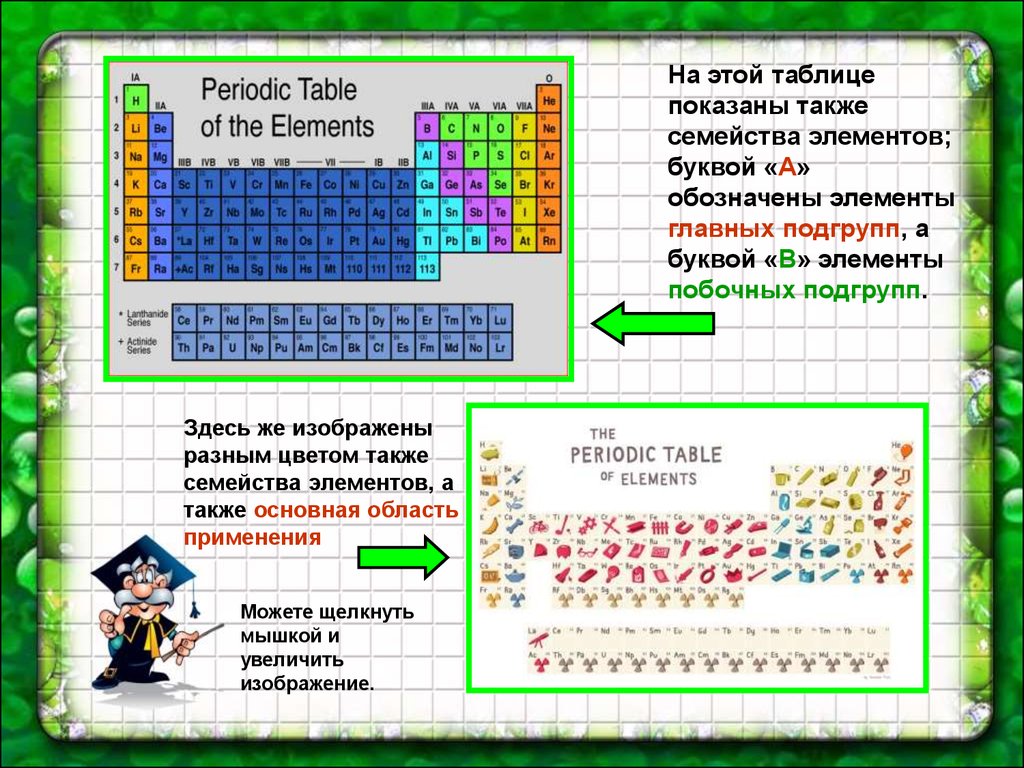
На этой таблицепоказаны также
семейства элементов;
буквой «А»
обозначены элементы
главных подгрупп, а
буквой «В» элементы
побочных подгрупп.
Здесь же изображены
разным цветом также
семейства элементов, а
также основная область
применения
Можете щелкнуть
мышкой и
увеличить
изображение.
14.
А эта таблица (вполне официальная) вызовет интерес уребят начальной школы, она красочная, и на ней также
показаны основные области применения элементов.
(Увеличьте ее и порассматривайте хорошенько).
15.
Еще красочная таблица для тех, кто интересуется химией икультурой готов. Здесь портреты тех ученых, в честь кого
названы элементы; гербы населенных пунктов, внешний
вид и назначение веществ.
16.
Периодическая система –источник вдохновения не
только для ученых, но и для
дизайнеров!
17.
И ,наконец, 3 канонический вариант ПС,принятый в России – краткая форма. Большие
периоды сложены «пополам», лантаноиды и
актиноиды внизу. Видны группы элементов и
их единство (это не показано в «западном»
варианте ПС). Вообще при такой форме
проще увязать строение атома и положение
элемента в ПС.
При таком дизайне
показаны
электронные
семейства атомов
(s-, p-, d-, fэлементы.)
18.
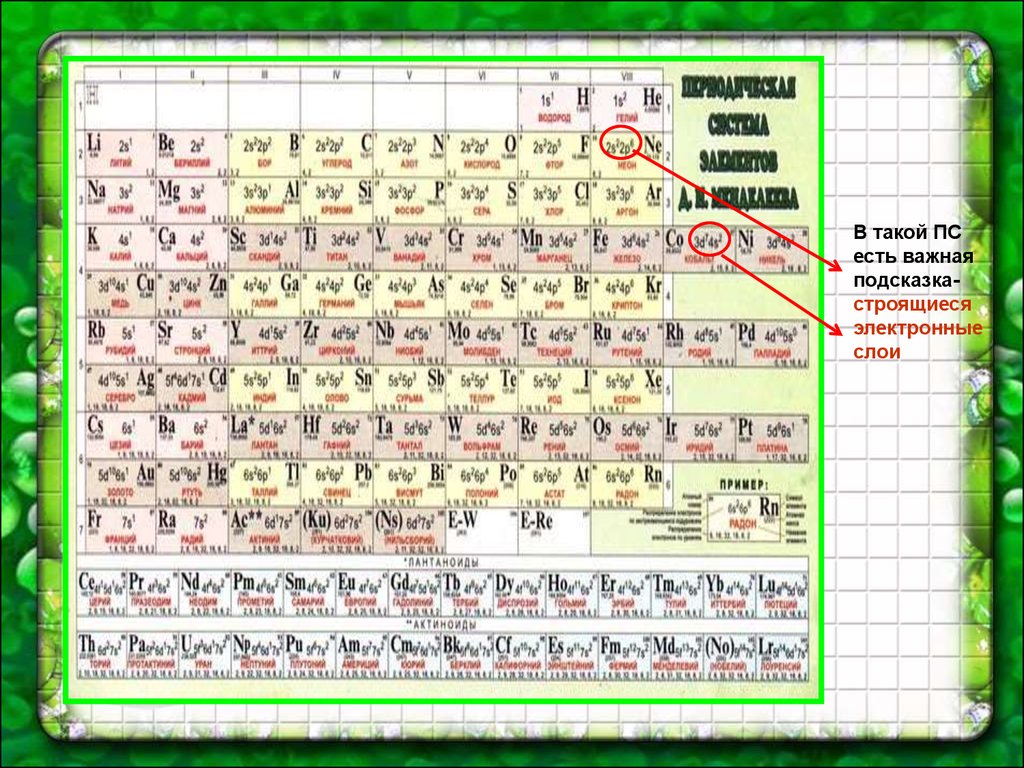
В такой ПСесть важная
подсказкастроящиеся
электронные
слои
19.
И такая ПС совершенно необходима , важная цветоваяинформация показана внизу таблицы (только тут нет fэлементов). Вообще при изучении химии можно и нужно иметь
под рукой ПС разных дизайнов и несущих разную полезную
информацию!
20.
Алкогольные элементыТаблица десертов
Шутка: пародии на
таблицу Менделеева
Таблица овощей
Криминальные элементы
21.
Строение таблицы Менделеева(короткий вариант)
Давайте для начала рассмотрим важную информацию, которая
есть в «клеточке-ячейке», предназначенной для каждого
отдельного сорта атома.
Порядковый №
Символ элемента
Национальное
название элемента
(Именно он
определяет заряд
ядра и сорт атома)
Атомная масса
(при расчетах она
округляется до
целого числа)
Строящиеся
электронные
слои
22.
Ребята порой путаются в таком вопросе: где элементы главныхи побочных подгрупп и как их различить в т.М.? Помогут здесь
символическая окраска «клеточки элемента» и расположение в
ней символа элемента.
Прежде всего, у элементов главных подгрупп символы в
клеточках чаще всего расположены слева; окраска ячеек
соответствует электронным семействам s- и р-элементов.
Тут показан участок Т.М. Неметаллы и
металлоиды показаны соответственно
зеленым и фиолетовым цветом. Они
всегда главным подгруппам.
23.
А у элементов побочных подгрупп символы в клеточкахчаще всего расположены справа; окраска ячеек
соответствует электронным семействам d- и f-элементов.
Еще важное правило : элементами
главных подгрупп могут быть
металлы и неметаллы, а
элементами побочных подгрупп –
только металлы.
24.
Период – горизонтальный ряд в т.М., который начинается активнымщелочным металлом и завершается благородным газом. Всего в ПС 7
периодов: 3 малых и 4 больших. Они включают в себя разные
электронные семейства.
1 период – 2 s-элемента;
2и 3 периоды – всего по 8
элементов, в них s- и рэлементы. У всех этих
атомов строится
внешний электронный
слой все они
главным подгруппам.
В 4 и 5 периодах по 18
элементов, есть s- и рэлементы, добавляются
d-элементы (вставные
декады)
В 6 периоде 32
элемента, есть s,p-,d-элементы +
лантаноиды
25.
7 период неполный, он включает в себя много сильнорадиоактивных элементов, созданных физиками, есть s-,d-,fэлементы (актиноиды) , р-элементы еще не синтезированы (но
все впереди!)
Группа – вертикальный столбец в
т.М., который объединяет элементы
с одинаковым числом валентных
электронов. Всего таких групп 8
штук.
26.
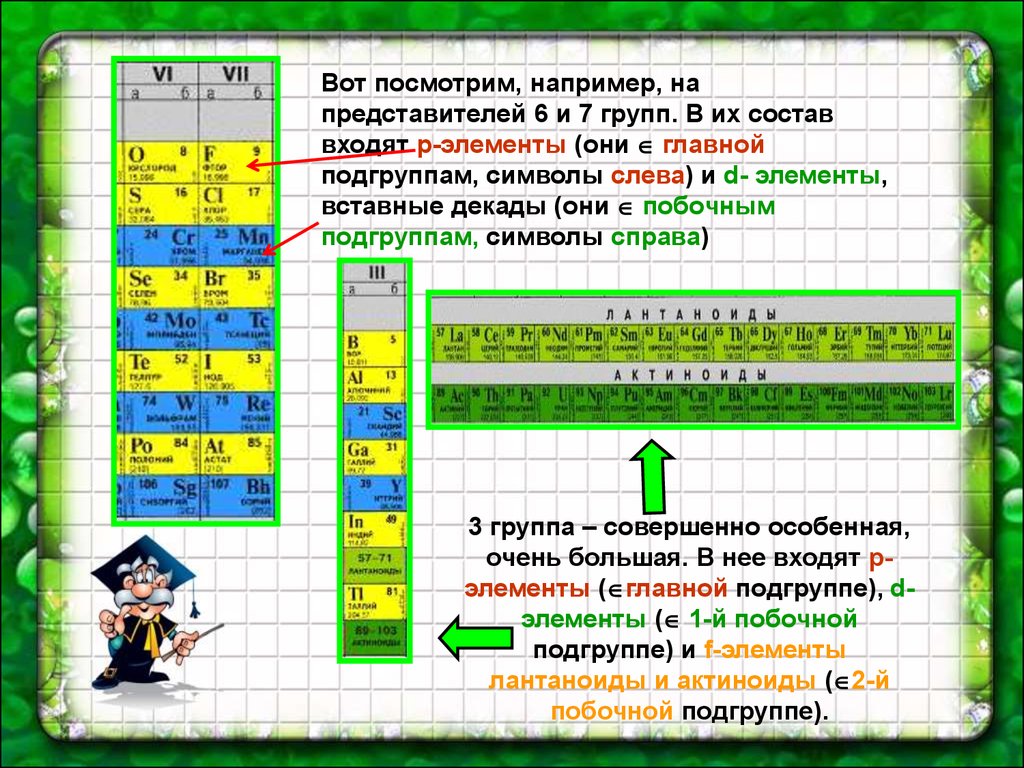
Вот посмотрим, например, напредставителей 6 и 7 групп. В их состав
входят р-элементы (они главной
подгруппам, символы слева) и d- элементы,
вставные декады (они побочным
подгруппам, символы справа)
3 группа – совершенно особенная,
очень большая. В нее входят рэлементы ( главной подгруппе), dэлементы ( 1-й побочной
подгруппе) и f-элементы
лантаноиды и актиноиды ( 2-й
побочной подгруппе).
27.
В «западных» ПС элементы однойгруппы пространственно разделены,
тут другая подсказка: римской
цифрой обозначен № группы, а
буквами «А» и «В» соответственно
главная и побочная подгруппы.
Кстати, в таких Т.М. положение
элементов в клеточках часто
одинаковое из-за того, что
главная и побочная подгруппы
разделены в пространстве.
Мы же будем работать с «русской»
версией Т.М. и должны уметь
понимать сходство и различие в
свойствах атомов и веществ,
объединенных в состав одной
группы.
28.
Сравним для начала представителей 7группы: фтор, хлор и марганец .
Фтор
хлор
марганец
Фтор и хлор похожи между собой: простые вещества
образуют двухатомные молекулы, это ядовитые
чрезвычайно химически активные газы, мощные
окислители. Температура плавления у них низкая,
твердые хлор и фтор хрупкие вещества, изоляторы.
Марганец же – типичный металл , ковкий, пластичный,
проводник, температура плавления высокая. Решетка
металлическая, проявляет лишь восстановительные
свойства. Что же у него-то общего с хлором и фтором?
29.
Разгадка сходства этих элементов кроется в строении ихатомов : у них у всех общее число валентных электронов, но
расположены они в атомах по-разному, отсюда и различие!
Фтор и хлор р- элементы
у них строятся внешний
s- и р-подуровни; у них по
7ē на внешнем слое
(Красный цвет квантовых
ячеек).
Марганец же d-элемент валентные
ē на внешнем 4s- и предвнешнем 3dподуровне. Но их тоже 7 штук!
30.
Забегая вперед скажу, что фтор не может распаривать свои внешниеэлектроны и образовывать катионы, а хлор может распарить все свои
валентные электроны и образовывать соединения с валентностью
=VII (хлорный ангидрид, хлорную кислоту и ее соли). Марганец тоже
имеет семивалентные соединения (соответственно марганцовый
ангидрид, марганцовую кислоту и ее соли).
Правило: № периода говорит о числе
электронных слоев в атоме, № группы говорит
о числе валентных электронов в атомах , а
также максимальной валентности элемента и
значении степени окисления (исключения:
валентность и СТОК < № группы: фтор,
кислород, азот (у него максимальная
валентность =IV), железо (max СТОК=+6),
кобальт (max СТОК=+3); max СТОК>№ группы: медь
(max СТОК=+2), золото (max СТОК=+3).
Теперь вот о чем: когда вы будете сравнивать свойства
элементов по группе, то сравнивайте только представителей
одной и той же подгруппы; а то уж больно велика разница в
строении и свойствах элементов разных подгрупп!
31.
Вот пример из биологии: ну что общего , скажем, между кошкой и мышкой? Обе животные,млекопитающие ( ну мышка пища для кошки).
Кошку лучше сравнить с тигром (оба
отряд хищники, семейство кошачьи).
А мышку лучше сравнить с хомяком ( отряд
грызуны).
Похожи
щелочные
металлы
sэлементы
Калий
К
Натрий Na
Похожи
малоактив
ные
металлы
dэлементы
Медь Сu
Серебро Ag
32.
Глядя на строение представителей одной и той же подгруппы всоставе одной группы напрашивается еще вывод: у них
совершенно сходное расположение валентных электронов
одинаковые валентные возможности, сходные физические и
химические свойства простых веществ и соединений!
Углерод и кремний главной
подгруппе 4 группы 4 ē на
внешнем слое
Элементы со сходным строением
электронных оболочек можно
назвать электронными аналогами
33.
У элементов одного и того же периода тоже есть сходство встроении атомов : у них одинаковое число электронных слоев
и одинаковый набор орбиталей (на модели – квантовых ячеек).
Представители II периода
34.
Первичная периодичность – закономерное изменение свойстватомов, простых и сложных веществ по периодам и по
подгруппам в составе одной группы.
Будем рассматривать следующие изменения у
химических элементов: радиус атома (r),
электроотрицательность (ЭО), металлические
св-ва (способность отдавать внешние ē),
восстановительные св-ва (Red св-ва),
неметаллические св-ва (способность
принимать ē), окислительные св-ва (Ох св-ва).
У сложных веществ сравним кислотноосновный характер оксидов и гидроксидов
Рассмотрим 3 период как наиболее типичный.
35.
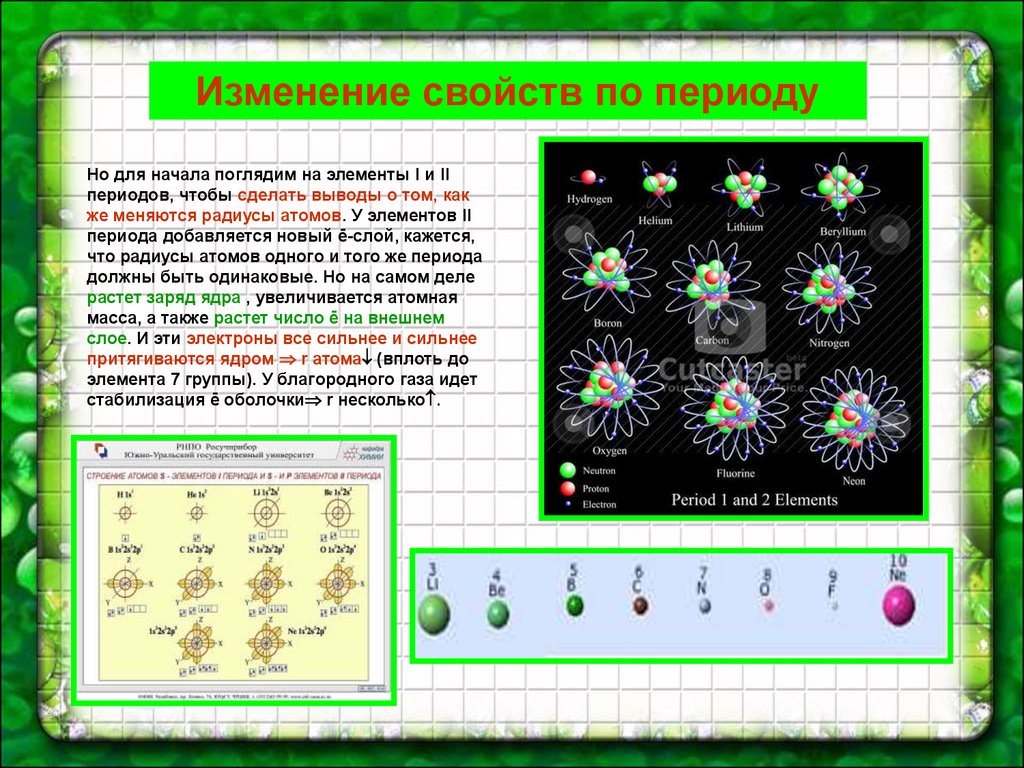
Изменение свойств по периодуНо для начала поглядим на элементы I и II
периодов, чтобы сделать выводы о том, как
же меняются радиусы атомов. У элементов II
периода добавляется новый ē-слой, кажется,
что радиусы атомов одного и того же периода
должны быть одинаковые. Но на самом деле
растет заряд ядра , увеличивается атомная
масса, а также растет число ē на внешнем
слое. И эти электроны все сильнее и сильнее
притягиваются ядром r атома (вплоть до
элемента 7 группы). У благородного газа идет
стабилизация ē оболочки r несколько .
36.
1 группа2 группа 3 группа 4 группа 5 группа 6 группа 7группа
8 группа
Изменение свойств атомов: r атома ; Ме св-ва ; Red св-ва ; неМе св-ва
(до хлора); Ох св-ва и ЭО (тоже до хлора). Изменение числа
электронов (от 1 до 8 на внешнем слое)-см. предыдущий слайд, оно очень
похоже на элементы II периода.
+
Оксиды Na 2O
Mg+2O
Основные
оксиды
Al2+3O3
Si+4O2
Амфотерный
оксид
P2+5O5 S+6O3
Cl2+7O7
Кислотные
оксиды
Ниже поглядим, какие будут соответствующие
гидроксиды, будьте внимательны! (для удобства и
наглядности формулы расположатся вертикально
37.
Na2O – NaOH (основание едкий натр)MgO – Mg(OH)2 (основание гидроксид
магния)
Mg
Al2O3 – Al(OH)3 (основание гидроксид
алюминия) и Н3AlO3 (алюминиевая кислота)
SiO2 – H2SiO3(кремниевая кислота)
P2O5 – H3PO4(фосфорная кислота)
SO3– H2SO4(серная кислота)
Сl2O7 – HClO4(хлорная кислота)
38.
Вывод: при движении по периоду свойства оксидов игидроксидов меняются так: основные свойства ослабевают,
потом идет(ут) амфотерное(ые) соединение(я), далее
возрастают кислотные свойства вплоть до галогена (элемента
главной подгруппы 7 группы). Но у тяжелых благородных газов
(ксенона и радона), замыкающих 5 и 6 периоды, есть уже
сложные соединения, они тоже кислотные, но более слабые,
чем соединения галогенов.
У элементов больших периодов не такое резкое
изменение атомных радиусов, да и вообще свойств
атомов и их соединений. У элементов вставных декад
строится предвнешний d-подуровень, поэтому радиусы
d-элементов почти одинаковые. Более резко меняются
св-ва р-элементов (как и в малых периодах).
39.
Изменения свойств по группам ( всоставе главной подгруппы).
Рассмотрим для примера главную
подгруппу 5 группы (азот, фосфор,
мышьяк, сурьму и висмут).
Свойства элементов меняются с №
так: r , Ме св-ва ; Red св-ва ; неМе
св-ва ; Ох св-ва ; ЭО . А число
валентных ē cоnst., оно = № группы
(здесь =5).
Изменение св-в соединений с № :
ослабление кислотных св-в и
усиление основных.
40.
Азот - бесцветный газ, изолятор; усоединений кислотные св-ва
Мышьяк – твердый серый,
полупроводник; у соединений
кислотные св-ва
Фосфор – разные твердые
аллотропные модификации, изолятор
(но черный «Р» полупроводник); у
соединений кислотные св-ва
Cурьма – серый металл, проводник; у
соединений амфотерные св-ва
41.
Висмут - своеобразный металл с голубоватым отливом,проводник; у соединений амфотерные и основные св-ва
Подгруппа азота выбрана не случайно :
велико разнообразие ее представителей.
Вы убедились, что они разные по
внешнему виду простых веществ и
свойствам соединений, но у них у всех
одинаковое строение внешней электронной
оболочки ns2np3.
42.
Вторичная периодичность.Это явление немонотонного изменения свойств атома или его
соединений в периоде или в группе. Короче, есть элементы,
которые можно назвать «белыми воронами», у них есть
особенности строения.
1-й пример: рассмотрим изменение
такой величины как энергия ионизации
во II и III периодах. Энергия ионизации –
та энергия, которую надо затратить на
то, чтобы оторвать от атома 1 электрон.
На рисунке видно, что в периоде Еион.
от щелочного металла к инертному
газу. Но у элементов главной подгруппы
2 группы (Be и Mg) и эл-тов главной
подгруппы 5 группы (N и P) она
несколько выше, чем у соседей.
Почему?
43.
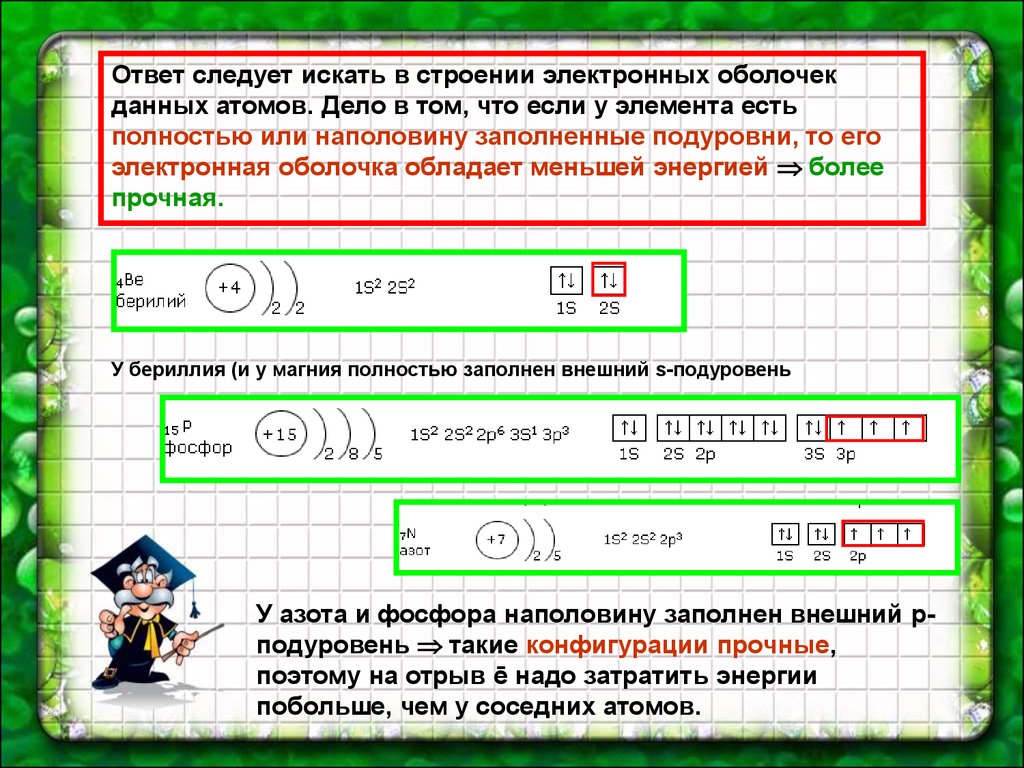
Ответ следует искать в строении электронных оболочекданных атомов. Дело в том, что если у элемента есть
полностью или наполовину заполненные подуровни, то его
электронная оболочка обладает меньшей энергией более
прочная.
У бериллия (и у магния полностью заполнен внешний s-подуровень
У азота и фосфора наполовину заполнен внешний рподуровень такие конфигурации прочные,
поэтому на отрыв ē надо затратить энергии
побольше, чем у соседних атомов.
44.
Вот пример вторичной периодичности у галогенов (гл.Подгр. 7 группы)Самый элекроотрицательный из элементов никогда не бывает
анионом; нет возбужденного атома валентность const=I; СТОК=0 или -1
Соединения брома со СТОК=+7 получили довольно поздно, в 1967
году.
Br 1s22s22p63s23p63d104s24p5
Исходя из электронного паспорта брома, мы видим, что его валентные ē-ны
находятся на орбиталях 4s и 4р-подуровней. У Br*** они распариваются на 4dподуровень. Но чтобы произошло распаривание ē-нов и вступление их в
химическую связь, надо этим ē-нам в момент химического взаимодействия
«быть дома» ( то есть находиться на своих орбиталях. А это не всегда имеет
место и вот почему. ē-ны стремятся из-за своего «-» заряда быть ближе к
атомному ядру. Из-за своей вещественно - волновой двойственности они
«могут это делать.»
У атома брома 3-й предвнешний ē-слой полностью заполнен. Заполнен
3d-подуровень. И вот под этот 3d10-экран и проникают стремящиеся быть
ближе к ядру валентные ē-ны брома. Чтобы их «вытащить» из-под 3d10экрана и «вернуть» на орбитали, применяют жесткие условия протекания
реакции (нагрев, давление, активные реагенты, селективные
катализаторы).Особенно тяжело «возвращается на орбитали» 4s-пара
валентных ē-нов отсюда и затруднительно было получить соединения
Br+7.
Здесь на примере брома был образно описан эффект проникновения
валентных ē-нов атома под предвнешний d10-экран.
45.
Дмитрий Иванович не только открыл фундаментальный закон,но и создал его подтверждение – Периодическую систему
элементов. И благодаря этой системе можно было с очень
большой долей вероятности описать свойства не только уже
известных атомов и веществ, но и еще не найденных
Вот первоначальная ПС на
доме, где жил и работал ученый
в Петербурге у метро
«Технологический институт».
Как вы думаете, сильно ли она
отличается от нынешней?
46.
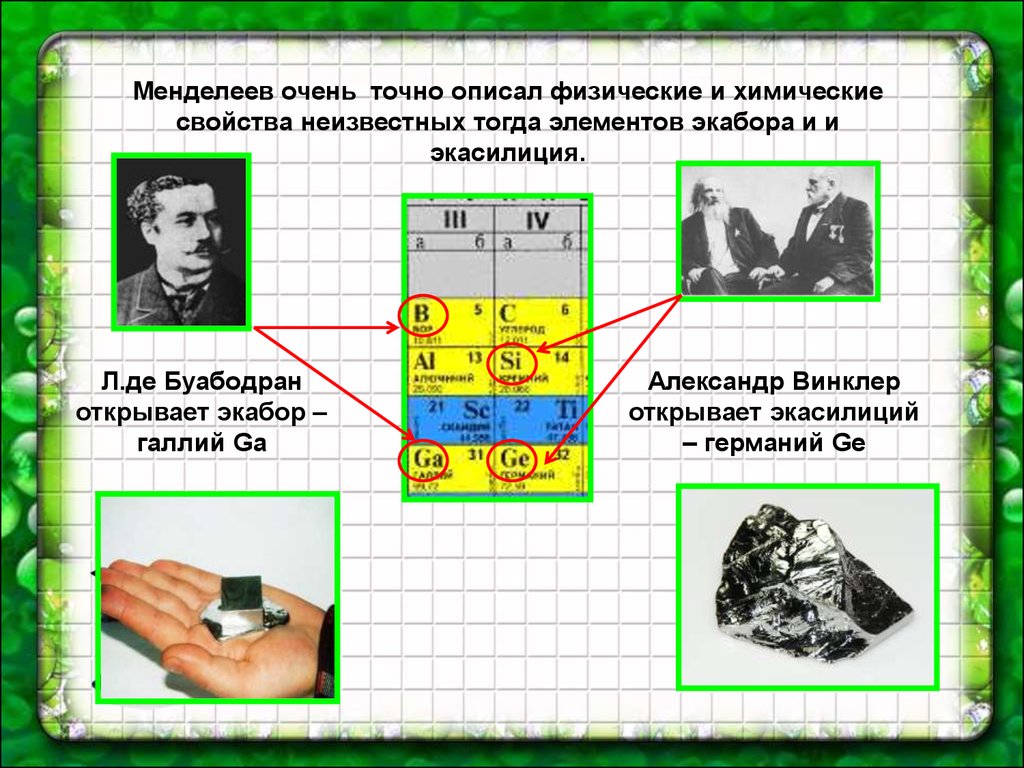
Менделеев очень точно описал физические и химическиесвойства неизвестных тогда элементов экабора и и
экасилиция.
Л.де Буабодран
открывает экабор –
галлий Ga
Александр Винклер
открывает экасилиций
– германий Ge
47.
В 1976 году команда американскихфизиков-ядерщиков во главе с Гленом
Сиборгом синтезировала 101 элемент.
Решено было назвать его в честь
Менделеева. Это был разгар
«холодной войны» между СССР и
США, поэтому желание назвать
элемент в честь русского было
довольно смелым поступком.
Советские ученые не
остались в долгу и
назвали открытый ими в
Дубне 106 элемент
сиборгием.








































 chemistry
chemistry








